需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
测量与建模干燥收缩人类角质层
摘要
本文介绍定量通过测量空间分辨粘附到弹性体基体的圆形组织样品的面内干燥位移动态干燥行为和角质层的机械性能的方法。这种技术可以用于测量化学处理如何不同改变干燥和组织的机械性能。
摘要
角质层(SC)是最表面的表层。其与外部环境接触装置,该组织层进行既清洁剂,并在环境水分日变化;这两者都可以改变组织中的水含量。在严重的屏障功能障碍或低湿度的环境中的水含量减少可以改变SC刚度和引起干燥应力的积聚。在极端情况下,这些因素可能会导致组织的机械破裂。我们已经建立了量化的SC的干燥时的力学性能动态变化的高通量方法。可以采用这种技术来量化在干燥行为和改变与化妆品的清洁剂和保湿处理的SC的机械性能。这是通过测量在粘附到弹性体基体的圆形的组织样本的空间分辨的面内干燥位移动态变化来实现的。在平面径向位移ACQ干燥期间uired被方位角平均,并装配有基于线性弹性收缩模型的轮廓。在干燥应力和SC弹性模量的动态变化可以被从拟合模型轮廓萃取。
引言
最外层的表皮,或角质层(SC)包括由富含脂质的基质1,2包围凝聚力角质细胞的细胞。 SC的组合物和结构的完整性对于维持正确屏障功能3,这将阻止微生物侵入和抗蚀剂既机械力和4损失过多的水是必不可少的。个人护理产品,以维持或降低皮肤屏障功能的能力是极大的兴趣,皮肤保健和化妆品行业5。的个人护理产品的日常应用是已知的,以改变SC 6,7,8的机械性能。例如,包含在化妆品清洁剂的表面活性剂可以导致弹性模量显著增加和积聚干燥应力SC,增加了组织的倾向破解7,9。包含在几乎所有的化妆品的保湿剂的甘油可以软化SC和减少干燥应力8,10,11,减少组织破裂的可能性的积聚。
在这篇文章中详细描述的方法是能够量化动态干燥行为和在控制的环境7个 SC干燥机械性能,8。以前,这种技术已被证明能够阐明关于在动态干燥行为变化和SC组织的力学性能的不同的化妆品产品的效果的。这是通过量化粘附到一个软的弹性体基板的人类SC组织的干燥引起的收缩来实现,用一个简单的嵌合干燥位移收缩模型,然后提取的弹性模量和从拟合轮廓干燥应力。当需要多个SC样品的测试,此方法提供了更快速的替代单轴tensometry,利用显著较少的组织并通过防止蒸发从样品底面提供了更多的生理学相关的干燥。
Access restricted. Please log in or start a trial to view this content.
研究方案
豁免核准(3002-13)使用依照卫生署去识别组织样本和人类服务条例开展调研,45 CFR 46.101(二)(4)获得了批准。全层皮肤从择期手术的好评。在这篇文章中,组织来源是66岁的白人女性的乳房。
1.弹性体覆盖盖玻片的制备
- 在20毫升玻璃小瓶中,用5.893克碱混合0.107克的Sylgard 184固化剂。总混合物的质量是6克与碱固化55剂:1的比例。
- 用玻璃棒混合以确保均匀后,将玻璃小瓶在真空室中脱气以除去所有的气泡。
- 放置在旋涂机的中心的玻璃盖玻片(55毫米×25毫米)。添加〜1毫升混合物,到盖玻片的中心。使用5000微升吸管到底用剪刀剪除。旋涂在2,000rpm的盖玻片60秒。
- 重复该process创建5-6基板。
- 固化在12小时的烘箱外盖单在60℃。
- 用剃刀刀片部分地由牺牲衬底取出弹性体膜。使用了不可磨灭的标记,以纪念弹性体膜和暴露的玻璃的上部。
- 安装在倒置显微镜的样品,并使用远程焦点附件以记录在两个标记的焦平面之间在z高度差。这对应于弹性体衬底厚度h。
2.角质层的制备
- 使用水浴或加热搅拌板上以加热玻璃烧杯中半充满去离子水(DW)至60℃。内的生物安全柜,浸泡在水中的充分厚度人类皮肤4分钟。
- 紧接皮肤样品转移到含有烧杯DW冷却至<10℃4分钟。半填充烧杯减少生物危险品溅。
- 从烧杯中取出,放置在培养皿中的皮肤上,并轻轻地隔离利用一对弯曲鼻组织镊子的表皮。
- 放置的分离的表皮基底侧向下在培养皿中,用纱布衬里。确保基底层完全与纱布接触。
- 浸泡的纱布在0.25%(重量/体积)型溶解于0.1M磷酸盐缓冲的盐水,在室温下6-8ħIX-S猪胰腺的胰蛋白酶溶液。添加只够胰蛋白酶在容器湿纱布。
- 提起与组织镊子纱布浮起来部分装有DW的容器。轻轻拉动SC把它从纱布中分离出来。
- 洗净角质层3-4倍DW以去除仍然连接到SC残留的表皮组织。
- 浮法孤立SC在0.4%,大豆(黄豆)的胰蛋白酶抑制剂的DW解决方案。用板振荡器来搅拌组织10分钟。
- 在培养皿中漂浮的SC部分充满了DW。用板振荡器来搅拌组织10分钟。
- 干上的超细塑料网的分离的SC纸,在室温下48小时(25℃,40%相对湿度(RH))。
- 从网格分开SC和切出用圆形打孔个人循环 - [R = 3毫米半径的样品。马克最外层的脸用了不可磨灭的标记的小螺旋痕迹的中心。这提供了用于识别SC的顶面视觉线索。
注:不可磨灭标记应在样本,其中,在干燥的变形将是最小的中心施加。这将最小化标记上记录,干燥位移轮廓的影响。
3.样品处理和沉积
- 搅动SC样品在含有90微升荧光标记珠15毫升DW 30分钟(515分之505纳米,直径为1微米,羧酸改性的)。这种存款珠到SC面
注意:当升沉积的在SC珠粒ARGE号码可以相对于样品略微慢干而不珠粒本12,将最大化可随后获得的面内变形场的空间分辨率。因此,珠体积增加的选择应作出临时性的 。 - 除去SC样品并将它们放置在培养皿中部分地填充有DW传递。
- 在15-30°的小角度部分浸泡在DW的衬底。
- 在基板和水界面之间的接触线脚浮动SC样品的边缘。垂直从水中取出衬底将顺利层压SC样品到衬底没有皱褶或夹带的空气气泡。
- 重复步骤3.4至放置最多6个SC样品到每个衬底。离开至少样本之间2-3毫米间隙,避免靠近衬底边缘样品层压。这可以防止的一个样本影响干燥位移干燥另一个。
- 干燥在实验室条件下安装的SC样品60分钟。这允许SC和基板之间残留的水蒸发,并确保完整组织粘连。
注:在这一时刻,SC样品可以用化学或化妆品配方7,8通过放置在基片倒置在一段必要的时间的所需溶液处理。重复步骤3.6一旦处理步骤进行。干燥后,SC样品到衬底的不完全粘附可使用透射光显微术来验证。在SC样品或脱层边缘被困气泡会形成良好定义的边缘样品中鲜明对比的变化。 - 通过将培养皿部分地填充有水进入密封容器中创建一个湿度室中。
- 地方基板进入室24小时平衡至99%的相对湿度。不要将基板到切赫我的菜。
4.显微镜环境控制
- 实现通过连接到显微镜安装灌注室中的湿度控制系统的环境条件的控制。在德语等设置在湿度调节装置的细节。 (2013年)7和刘和德国(2015年)8。
- 安装在基板上的显微镜,将灌注腔的衬底上,并使用真空润滑脂密封灌注腔的边缘与弹性体。
- 一旦安装之前,实验平衡内部空气到99%RH。这可以防止水分的蒸发前的实验。一旦在第5或7成像开始,减少内部的空气湿度期望值。
注:在本文中,SC样品干燥至25%RH
5.成像平面位移干燥
- 获得使用倒置microsco SC样本图像用1X物镜PE。利用激发光引擎与FITC滤光片(503-530 nm发射带通)荧光珠。多个样品可以按顺序在整个烘干使用自动化的xy阶段进行成像。
- 记录荧光灯和使用数码相机的CCD在1392点¯x1,040像素的分辨率透射光图像。的视图中的每个图像的场为8.98点¯x6.71毫米,允许单个图像来捕获完整的SC样品。取的图像为10分钟16小时的频率。
6.基板制备厚度测量
- 在化学通风橱中,放置1毫升硅烷(3-氨基丙基;≥98%)在一些小的塑料盖。放置弹性体基板从部分1和在密封的容器盖5小时。不允许基材以在与硅烷直接接触来。
- 在1.5mL管中;添加5毫克的EDC(≥99%的N -ethylcarbodiimide盐酸- N - (3-二甲基氨基丙基))。添加500微升DW到EDC。搅拌用涡旋混合器10秒的溶液。
- 添加0.076克四硼酸钠和0.1克硼酸,以20毫升DW传递。混合使用磁力搅拌器在70℃(1小时)。添加硼酸,直至pH为7.4。
- 添加20mL的硼酸缓冲液至50毫升离心管中。加1微米珠(五百七十五分之五百三十五纳米,羧化物修饰)60微升到硼酸盐缓冲液。最后,加入200μl的EDC解决方案瓶。摇管珠混合溶液中,然后倒入一个直径10厘米的培养皿。
- 从容器中取出硅烷化衬底并将它们弹性体膜侧向下进入珠溶液。这样做慢慢地防止气泡被困。两个基板将适合在每个培养皿。
- 离开基板在胎圈溶液漂浮45分钟。
- 使用镊子从珠溶液中除去基材,再在DW冲洗,除去未结合的珠子。
- 空气干燥该衬底。吹入压缩空气过弹性体膜表面减少水斑的形成。
- 密封基板在一个不透明的盒子,以防止珠粒光致漂白,直到SC样品沉积。
7. SC的成像厚度
- 关于使用部分3.但是在基板存款SC样本,执行步骤3.1无添加荧光珠到DW。此外,在完成步骤3.6之前申请未稀释的荧光标记物珠溶液(五百十五分之五百零五纳米,直径为0.1μm),以用移液管每次敷SC样品的表面的5微升下降。
- 建立使用具有40X物镜的显微镜的SC厚度的测量。使用远程焦点附件以记录在位于所述SC-衬底界面两个胎圈层焦平面和SC的顶侧之间z高度差测量SC样品随时间的厚度。
- 测量每个SC样品的3个地区的超过3小时的干燥期的厚度。厚度SC样品到达这个时间框架内8稳态值。
8.量化和建模组织变形
- 使用粒子图像测速13在每个记录的时间步骤,以获得从所述荧光图像空间分辨的面内干燥位移。
- 使用MATLAB从每个径向对称SC样品的位移场获得方位平均径向和方位角位移曲线。
注:示例数据集(题为"d.mat'),并且同时执行这一步和步8.3 MATLAB代码(题为"PIV-processing.m")已经在补充信息中提供。 - 适合径向位移轮廓到模型7,8,14,15,16,描述烘干SC作为收缩线状弹性circula变化的厚度,H SC,半径R,和弹性模量,E SC,附着于弹性模量的可变形的弹性基底,大肠杆菌假定的SC的时间R盘具有明确定义和恒定泊松比,νSC = 0.4 7 8。获得使用最小最小二乘法最适合。
注:用于拟合该模型描述了在修正贝塞尔函数方面的径向位移是: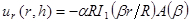 (1)
(1)
同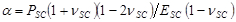 ,
,  和
和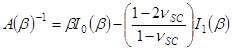
期限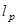 对应于由下式给出一个穿透深度,
对应于由下式给出一个穿透深度,  。
。 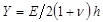 表示基底刚性参数;时有效的样本大小是比基板厚度大得多。这里,参数
表示基底刚性参数;时有效的样本大小是比基板厚度大得多。这里,参数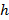 和
和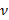 分别表示基板厚度泊松比。有机硅弹性体基片17的泊松比是ν= 0.5。
分别表示基板厚度泊松比。有机硅弹性体基片17的泊松比是ν= 0.5。 - 获得模型参数α和β在从向径向位移分布拟合等式(1)的最小二乘每个时间步。
- 聘请拟合参数β获得SC弹性模量E SC,使用表达式,
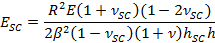
- 使用拟合参数α,以获得随时间变化的收缩的干燥STRESS,PSC,使用表达式,
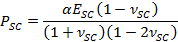
- 聘请拟合参数β获得SC弹性模量E SC,使用表达式,
Access restricted. Please log in or start a trial to view this content.
结果
图1(a)示出了涂覆有荧光珠(第3节)的SC样品的代表性荧光图像。样品的相应的透射光图像在图1(b)覆盖有后在25%RH下16小时干燥形成空间分辨干燥位移的颤动情节由于样品的圆形对称性所示,这些位移可方位角平均。 图1(c)所示的径向(U R,红色实线)和方位角(Uθ,蓝色虚线)位移曲线绘制了无量纲径向位?...
Access restricted. Please log in or start a trial to view this content.
讨论
在本文中,我们描述了可以用来测量动态干燥行为和人SC的机械性能的技术。以前的研究已经表明,这种技术可用于量化的化妆品清洁剂和保湿剂常用于SC 7,8的动态干燥行为的环境条件和化学品的影响。有许多在该协议的关键步骤。首先,SC含水量明显膨胀;因此,SC厚度的面内位移以及测量准确预测的弹性模量和干燥应力大小是至关重要的。其次,样品?...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
致谢
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Silicone elastomer base | Dow-Corning | 1064291 | |
| Silicone elastomer Curing Agent | Dow-Corning | 1015311 | |
| FluoSpheres Carboxylate 0.1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8803 | |
| FluoSpheres Carboxylate 1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8823 | |
| FluoSpheres Carboxylate 1 µm nile red fluorescent 535/575 | Thermo Fisher | F8819 | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T6567 | |
| Trypsin inhibitor type II-s | Sigma-Aldrich | T9128 | |
| (3-aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Boric acid | Sigma-Aldrich | B0294 | |
| Phosphate buffered saline | Sigma-Aldrich | P7059 | |
| N-(3-Dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride | Sigma-Aldrich | E7750 | |
| Vortexer mixer | VWR | 58816-123 | |
| 6 mm diameter hole punch | Sigma-Aldrich | Z708860 | |
| SOLA 6-LCR-SB | Lummencor light engine | No.3526 | |
| Cfi Plan Achro Uw 1X Objective | Nikon Plan UW | MRL00012 | |
| CFI Plan Fluor 40X Oil Objective 1.3 na - 0.20 mm wd | Nikon Plan Fluor | MRH01401 | |
| Nikon Eclipse Ti-U inverted microscope | Nikon | MEA53200 | |
| Clara-E Camera | Andor | DR-328G-C02-SIL | |
| Remote Focus Attachment E-RFA Ergo Design | Nikon | 99888 | |
| Ti-S-E Motorized Stage | Nikon | MEC56110 |
参考文献
- Van Hal, D., Jeremiasse, E., Junginger, H. E., Spies, F., Bouwstra, J. Structure of fully hydrated human stratum corneum: a freeze-fracture electron microscopy study. J. Invest. Dermatol. 106 (1), 89-95 (1996).
- Norlén, L., Al-Amoudi, A. Stratum corneum keratin structure, function, and formation: the cubic rod-packing and membrane templating model. J. Invest. Dermatol. 123 (4), 715-732 (2004).
- Liu, X., Cleary, J., German, G. K. The global mechanical properties and multi-scale failure mechanics of heterogeneous human stratum corneum. Acta Biomater. , (2016).
- Geerligs, M. Skin layer mechanics. , Technische Universiteit Eindhoven. (2010).
- Farage, M. S., Miller, K. W., Maibach, H. I. Textbook of Aging Skin. , (2010).
- Levi, K., Kwan, A., Rhines, A. S., Gorcea, M., Moore, D. J., Dauskardt, R. H. Emollient molecule effects on the drying stresses in human stratum corneum. Br. J. Dermatol. 163 (4), 695-703 (2010).
- German, G. K., Pashkovski, E., Dufresne, E. R. Surfactant treatments influence drying mechanics in human stratum corneum. J. Biomech. 46 (13), 2145-2151 (2013).
- Liu, X., German, G. K. The effects of barrier disruption and moisturization on the dynamic drying mechanics of human stratum corneum. J. Mech. Behav. Biomed. Mater. 49 (13), 80-89 (2015).
- Levi, K., Weber, R. J., Do, J. Q., Dauskardt, R. H. Drying stress and damage processes in human stratum corneum. Int. J. Cosmet. Sci. 32 (4), 276-293 (2010).
- Levi, K., et al. Effect of glycerin on drying stresses in human stratum corneum. J. Dermatol. Sci. 61, 129-131 (2011).
- Fluhr, J. W., Darlenski, R., Surber, C. Glycerol and the skin: holistic approach to its origin and functions. Br. J. Dermatol. 159 (1), 23-34 (2008).
- German, G. K., et al. Heterogeneous drying stresses in stratum corneum. Biophys. J. 102 (11), 2424-2432 (2012).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Exp. Fluids. 10 (4), 181-193 (1991).
- Mertz, A. F., et al. Scaling of traction forces with the size of cohesive cell colonies. Phys. Rev. Lett. 108 (19), 1-5 (2012).
- Banerjee, S., Marchetti, M. C. Substrate rigidity deforms and polarizes active gels. Euro Phys. Lett. 96 (2), 28003(2011).
- Edwards, C. M., Schwarz, U. S. Force localization in contracting cell layers. Phys. Rev. Lett. 107 (12), 128101(2011).
- Cesa, C., et al. Micropatterned silicone elastomer substrates for high resolution analysis of cellular force patterns. Rev. Sci. Instrum. 78 (3), 34301(2007).
- Wu, K. S., Van Osdol, W. W., Dauskardt, R. H. Mechanical And Microstructural Properties Of Stratum Corneum. Mater. Res. Soc. 724, 27-33 (2002).
- Yuan, Y., Verma, R. Measuring microelastic properties of stratum corneum. Colloids Surf. B. 48 (1), 6-12 (2006).
- Christensen, M. S., Hargens, C. W., Nacht, S., Gans, E. H. Viscoelastic properties of intact human skin: instrumentation, hydration effects, and the contribution of the stratum corneum. J Invest. Dermatol. 69 (3), (1977).
- Pailler-Mattei, C., Bec, S., Zahouani, H. In vivo measurements of the elastic mechanical properties of human skin by indentation tests. Med. Eng.Phys. 30 (5), 599-606 (2008).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。