É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição e Modelagem contrátil que secam no Estrato Córneo Humano
Neste Artigo
Resumo
Este artigo descreve um método para quantificar o comportamento dinâmico de secagem e propriedades mecânicas do estrato córneo através da medição espacialmente resolvida no plano deslocamentos de secagem de amostras circulares de tecido aderidas a um substrato de elastómero. Esta técnica pode ser utilizada para medir a forma como os diferentes tratamentos químicos Após a secagem dos tecidos e propriedades mecânicas.
Resumo
estrato córneo (SC) é a camada mais superficial da pele. O seu contacto com o ambiente externo significa que esta camada de tecido é sujeito a ambos os agentes de limpeza e variações diárias em humidade ambiente; ambos os quais podem alterar o conteúdo de água do tecido. Reduções do teor de água da disfunção da barreira grave ou ambientes de baixa umidade pode alterar SC rigidez e causar um acúmulo de tensões de secagem. Em condições extremas, estes factores podem causar a ruptura mecânica do tecido. Nós estabelecemos um método de alto rendimento de quantificar as alterações dinâmicas as propriedades mecânicas de SC aquando da secagem. Esta técnica pode ser utilizada para quantificar as mudanças no comportamento de secagem e propriedades mecânicas do SC com cosméticos limpador e hidratante tratamentos. Isto é conseguido medindo as variações dinâmicas da espacialmente resolvidas deslocamentos de secagem em plano de amostras circulares de tecido aderidas a um substrato de elastómero. In-Plane deslocamentos radiais ACQuired durante a secagem são azimutal média e equipado com um perfil baseado em um modelo contratilidade elástica linear. mudanças dinâmicas no estresse de secagem e SC módulo de elasticidade pode então ser extraído a partir dos perfis modelo ajustado.
Introdução
A camada mais externa da epiderme, ou estrato córneo (SC) é constituído por células corneócito coesivas rodeadas por um lípido rico matriz 1, 2. A composição estrutural e integridade do SC é essencial para manter a funcionalidade de barreira correct 3, que impede a invasão de microorganismos e resiste a ambas as forças mecânicas e perda excessiva de água 4. A capacidade dos produtos de cuidados pessoais para manter ou degradar a função de barreira da pele é de grande interesse para saúde da pele e da indústria cosmética 5. A aplicação diária de produtos de cuidado pessoal é conhecida para alterar as propriedades mecânicas do SC 6, 7, 8. Por exemplo, surfactantes contidos em produtos de limpeza cosméticos podem causar aumentos significativos no módulo de elasticidade e uma acumulação detensões de secagem em SC, aumentando a propensão do tecido de crack 7, 9. Glicerol contido em quase todos os hidratantes cosméticos pode suavizar SC e diminuir o acúmulo de tensões de secagem 8, 10, 11, reduzindo a probabilidade de ruptura do tecido.
O método descrito neste artigo é capaz de quantificar o comportamento de secagem dinâmico e propriedades mecânicas do SC de secagem em ambientes controlados 7, 8. Anteriormente, esta técnica tem sido demonstrada ser capaz de elucidar o efeito de diferentes produtos cosméticos em alterações do comportamento dinâmico de secagem e propriedades mecânicas do tecido SC. Isto é conseguido através da quantificação contracção induzida por secagem de tecido humano SC aderiu a um substrato de elastómero macio, encaixando deslocamentos de secagem com uma simplesmodelo de contratilidade, e depois extrair o módulo de elasticidade e secagem estresse a partir do perfil equipada. Quando são necessários ensaios de amostras múltiplas SC, este método oferece uma alternativa mais rápida para tensometry uniaxial, utiliza significativamente menos tecido e fornece mais fisiologicamente relevante de secagem, impedindo a evaporação a partir do lado de baixo da amostra.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Uma aprovação isentos (3002-13) para realizar a pesquisa utilizando amostras de tecido de-identificados em conformidade com o Departamento de Saúde e regulamentos Serviços Humanos, 45 CFR 46,101 (b) (4) foi concedido. pele de espessura total é recebido de uma cirurgia eletiva. Neste artigo, a fonte de tecido é de mama mulher caucasiana de 66 anos de idade.
1. Preparação de Lamelas Elastomer Revestido
- Num frasco de vidro de 20 mL, misturar 0,107 g de agente de Sylgard 184 cura com 5,893 g de base. A massa total da mistura é de 6 g de produto com uma base para a cura da proporção de agente de 55: 1.
- Após a mistura com uma vareta de vidro para assegurar a homogeneidade, colocar o frasco de vidro em uma câmara de vácuo e desgaseifica para remover todas as bolhas.
- Coloque uma lamela de vidro (55 mm x 25 mm) no centro de um revestidor de rotação. Adicionar ~ 1 ml da mistura sobre o centro da tampa-derrapante. Usar uma pipeta de 5000 uL com a extremidade cortada com uma tesoura. Spin revestimento da tampa-derrapante a 2.000 rpm durante 60 s.
- Repita este pROCESSO para criar 5-6 substratos.
- Curar as lamelas num forno durante 12 h a 60 ° C.
- Usar uma lâmina de barbear para remover parcialmente a película de elastómero a partir de um substrato de sacrifício. Use um marcador indelével para marcar o topside do filme elastômero eo vidro exposta.
- Monte a amostra em um microscópio invertido e usar um acessório de foco remoto para gravar a diferença de altura z entre os planos focais das duas marcas. Isto corresponde à espessura do substrato elastómero, h.
2. Preparação do Estrato Córneo
- Usar um banho de água ou placa de agitação aquecida para aquecer uma proveta de vidro de metade cheio com água desionizada (DW) a 60 ° C. Dentro de uma cabine de segurança biológica, mergulhe a plena pele humana de espessura na água durante 4 min.
- Imediatamente transferir a amostra de pele para uma proveta contendo DW arrefecida a <10 ° C durante 4 min. Metade enchendo o copo minimiza a projecção de salpicos de material de risco biológico.
- Retire a pele do copo, coloque em uma placa de Petri, e gentilmente isolar a epiderme usando um par de pinças de tecido nariz curvado.
- Coloque a epiderme isolado lado basal para baixo em uma placa de Petri forrada com gaze. Assegurar a camada basal está totalmente em contato com a gaze.
- Embeber o gaze em um 0,25% (peso / vol) de tipo IX-S solução de tripsina de pâncreas de suíno dissolvido em 0,1 M de fosfato de solução salina tamponada durante 6-8 h à temperatura ambiente. Adicionar apenas tripsina suficiente no recipiente para molhar a gaze.
- Levante a gaze com uma pinça de tecidos e bóia-lo em um recipiente parcialmente cheio com DW. Puxe cuidadosamente o SC para separá-lo da gaze.
- Lava-se a camada córnea 3-4 vezes em DW para remover o tecido epidérmico residual que permanece ligado ao SC.
- Flutuador da SC isolado numa solução de 0,4% de Glycine max (soja) de inibidor de tripsina em DW. Usar um agitador de placas para agitar o tecido durante 10 min.
- Flutuar SC numa placa de Petri parcialmentepreenchido com DW. Usar um agitador de placas para agitar o tecido durante 10 min.
- Seca-se a folha de SC isolado em uma malha de plástico ultra-fino durante 48 h à temperatura ambiente (25 ° C, 40% de humidade relativa (RH)).
- Separe o SC da malha e cortar amostras circular R = 3 mm de raio individuais usando um furador circular. Marcar o centro da face mais exterior com uma marca de espiral pequenos usando um marcador indelével. Isso proporciona uma sinalização visual para reconhecer a parte de cima do SC.
NOTA: A marca indelével deve ser aplicada no centro da amostra, onde as deformações de secagem será menor. Isto vai minimizar o impacto do marcador em perfis de deslocamento de secagem gravados.
3. Amostra Tratamento e Deposição
- Agitar amostras SC durante 30 minutos em 15 ml de DW contendo 90 uL grânulos marcador fluorescente (505/515 nm, 1 um de diâmetro, carboxilato-modificada). Este depósitos grânulos para a superfície de SC
NOTA: Durante a deposição de lnúmeros de Arge de contas sobre a SC pode marginalmente lenta a secagem em relação a amostras sem contas de presente 12, ele irá maximizar a resolução espacial dos campos de deformação no plano que podem ser posteriormente obtidos. A escolha do volume de talão adicionada deve, portanto, ser feita ad hoc. - Retirar amostras de SC e colocá-los em uma placa de Petri parcialmente preenchido com DW.
- Imergir um substrato parcialmente no DW a um ângulo raso de 15-30 °.
- Fixar um bordo da amostra SC flutuante na linha de contacto entre o substrato e a interface água. Verticalmente retirar o substrato da água vai laminar suavemente a amostra SC para o substrato, sem rugas ou bolhas de ar aprisionadas.
- Repita o passo 3.4 para colocar até 6 amostras de SC em cada substrato. Deixar pelo menos uma folga de 2-3 mm entre as amostras e evitar a laminação amostra perto da borda do substrato. Isso impede a secagem de uma amostra que influenciam deslocamentos de secagem em outro.
- Secam-se as amostras SC montados em condições de laboratório durante 60 min. Isso permite que a água residual entre o SC e substrato para evaporar e garante a adesão de tecidos completa.
NOTA: Nesta fase, as amostras de SC pode ser tratada com um produto químico ou formulações cosméticas 7, 8, colocando os substratos de cabeça para baixo em uma solução desejada por um período de tempo necessário. Repetir o passo 3.6 uma vez que o passo de tratamento é realizado. Após a secagem, a adesão incompleto de amostras de SC para o substrato pode ser verificado através de microscopia de luz transmitida. de bolhas de ar sob a amostra SC ou bordas desagregadas formarão variações claro contraste na amostra com bordas bem definidas. - Criar uma câmara de humidade por colocação de uma placa de Petri parcialmente preenchida com água para um recipiente hermeticamente selado.
- Coloque substratos para dentro da câmara durante 24 h, para equilibrar a humidade relativa de 99%. Não coloque os substratos para a Petri prato.
4. Controle Ambiental Microscópio
- Atingir o controlo das condições ambientais através de um sistema de controlo de humidade ligado a uma câmara de perfusão montável microscópio. Detalhes do sistema de controlo de humidade são fornecidos em alemão et ai. (2013) 7 e Liu e alemão (2015) 8.
- Montar o substrato sobre o microscópio, colocar a câmara de perfusão sobre o substrato e selar as bordas da câmara de perfusão para o elastómero usando graxa de vácuo.
- Uma vez montado, o ar interno equilibrar a 99% de humidade relativa antes da experimentação. Isto impede a evaporação de água antes da experimentação. Depois de imagem nas seções 5 ou 7 começou, reduzir a umidade do ar interno para o valor desejado.
NOTA: Neste artigo, as amostras de SC são secos a 25% RH
5. Criação de Imagens no plano de secagem Deslocamentos
- Adquirir imagens de amostras de SC usando um microsco invertidope com lente objetiva 1X. Excite partículas fluorescentes, utilizando um motor de luz com filtro FITC (503-530 nm de banda de emissão). amostras múltiplas podem ser visualizados sequencialmente ao longo de secagem usando um estágio xy automatizado.
- fluorescente registro e imagens de luz transmitida usando uma câmera CCD digital com uma resolução de 1.392 x 1.040 pixels. O campo de visão de cada imagem é 8,98 x 6,71 milímetros, permitindo que uma única imagem para capturar uma amostra SC completo. Captar imagens com uma frequência de 10 min por 16 h.
6. Preparação Substrato para medição de espessura
- Em uma Cobertura de vapores químicos, coloque 1 mL de silano (3-aminopropiltrietoxissilano; ≥98%) em alguma pequena tampa de plástico. Coloque substratos elastoméricos da seção 1 e a tampa num recipiente selado durante 5 h. Não permitir que substratos para vir directamente em contacto com o silano.
- Adicionam-se 5 mg de EDC (N - (3-dimetilaminopropil) - N-etilcarbodiimida; ≥99%) num tubo de 1,5 mL. Adicionar 500 ul de DW para a EDC. Agitar a solução durante 10 s com um misturador de vórtice.
- Adicionar 0,076 g de tetraborato de sódio e 0,1 g de ácido bórico para 20 ml de DW. Misturar utilizando um agitador magnético a 70 ° C (1 h). Adicionar ácido bórico, até que o pH é 7,4.
- Adicionar 20 ml de tampão de borato a um tubo de centrífuga de 50 mL. Adicionar 60 ul de 1 uM grânulos (535/575 nm, modificadas com carboxilato) para o tampão de borato. Finalmente, adicione 200 mL de solução de EDC a garrafa. Agite o tubo para misturar a solução de contas e, em seguida, despeje em um 10 cm de diâmetro placa de Petri.
- Remover os substratos silanizadas a partir do recipiente e colocá-los lado-elastômero filme para baixo para dentro da solução do grânulo. Fazê-lo lentamente para evitar bolhas de tornar-se preso. Dois substratos vai caber em cada placa de Petri.
- Deixar substratos para flutuar na solução talão durante 45 min.
- Use uma pinça para remover os substratos da solução talão, em seguida, enxaguar em DW para remover contas não ligadas.
- Ar secar os substratos. Soprando ar comprimido maisa superfície da película de elastómero reduz a formação de manchas de água.
- Selar os substratos em uma caixa opaca para evitar a foto-branqueamento das esferas até a deposição amostra SC.
7. Imagens Espessura de SC
- Amostras de depósito SC sobre a um substrato utilizando seção 3. No entanto, executar a etapa 3.1, sem adição de partículas fluorescentes à DW. Além disso, aplicam-se uma gota de 5 mL de uma solução não diluída marcador fluorescente talão (505/515 nm, de 0,1 um de diâmetro) na superfície de cada amostra SC depositado com uma pipeta antes de completar o passo 3.6.
- Estabelecer medidas de espessura SC usando o microscópio com 40X lente objetiva. Medir a espessura das amostras SC ao longo do tempo utilizando um acessório de focagem remoto para registar a diferença em altura z entre os dois planos focais camada friso localizado na interface substrato-SC e a parte de cima do SC.
- Medir a espessura de 3 regiões de cada amostra SC ao longo de um período de secagem de 3 horas. A espessurade amostras de SC atinge um valor estável dentro desse tempo 8.
8. Quantificação e modelagem Tissue Deformação
- Use velocimetria por imagem de partículas 13 para obter espacialmente resolvidas no plano deslocamentos de secagem a partir das imagens fluorescentes em cada passo de tempo gravado.
- Use MATLAB para obter perfis radiais e azimutais deslocamento azimutal em média a partir do campo de deslocamento de cada amostra SC radialmente simétrica.
NOTA: Um exemplo de conjunto de dados (intitulado «d.mat ') e um código MATLAB (intitulado« PIV-processing.m'), que realiza tanto este passo e passo 8.3 foi fornecida a informação suplementar. - Fit perfis de deslocamento radial para um modelo de 7, 8, 14, 15, 16 que descreve a secagem SC como circula elástica linear encolhendodisco r de tempo espessura variável, H SC, raio, R, e módulo de elasticidade, E SC, aderiu a um substrato elástico deformável, com o módulo de elasticidade, E. Suponha SC tem um coeficiente de Poisson bem definida e constante, ν SC = 0,4 7 , 8. Obter melhores ajustes usando um mínimo menos abordagem quadrados.
NOTA: O modelo utilizado para a montagem descreve deslocamentos radiais em termos de funções de Bessel modificadas são: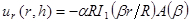 (1)
(1)
com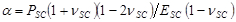 ,
,  e
e 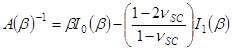
O termo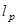 corresponde a uma profundidade de penetração determinada por,
corresponde a uma profundidade de penetração determinada por,  .
. 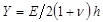 indica um parâmetro substrato rigidez; válido quando as amostras são muito maiores do que a espessura do substrato. Aqui, os parâmetros,
indica um parâmetro substrato rigidez; válido quando as amostras são muito maiores do que a espessura do substrato. Aqui, os parâmetros, 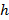 e
e 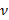 designam respectivamente a espessura do substrato coeficiente de Poisson. Razão entre o substrato de elastómero de silicone 17 de Poisson é ν = 0,5.
designam respectivamente a espessura do substrato coeficiente de Poisson. Razão entre o substrato de elastómero de silicone 17 de Poisson é ν = 0,5. - Obter os parâmetros do modelo a e β em cada intervalo de tempo a partir dos mínimos quadrados ajuste da equação (1) para o perfil de deslocamento radial.
- Empregar o β parâmetro de ajustamento para se obter SC módulo de elasticidade, E SC, utilizando a expressão:
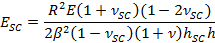
- Use α parâmetro de ajustamento para se obter o tempo de secagem varia contráctil stress, PSC, usando a expressão,
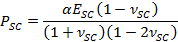
- Empregar o β parâmetro de ajustamento para se obter SC módulo de elasticidade, E SC, utilizando a expressão:
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 1 (a) mostra uma imagem fluorescente de uma amostra representativa de SC revestido com esferas fluorescentes (secção 3). A imagem da luz transmitida correspondente da amostra é mostrado na Figura 1 (b) revestida com uma trama tremor de deslocamentos de secagem espacialmente resolvidas que se formam após 16 horas de secagem a 25% de HR Devido à simetria circular das amostras, estes deslocamentos podem ser azimutais média. Figura 1 (...
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste artigo, descreve-se uma técnica que pode ser utilizada para medir o comportamento dinâmico de secagem e propriedades mecânicas de SC humano. Estudos anteriores demonstraram que esta técnica pode ser utilizada para quantificar os efeitos de condições ambientais e de produtos químicos normalmente utilizados em produtos de limpeza e cosméticos hidratantes no comportamento dinâmico de secagem SC 7, 8. Há uma série de passos-chave no protocolo. Em pr...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Silicone elastomer base | Dow-Corning | 1064291 | |
| Silicone elastomer Curing Agent | Dow-Corning | 1015311 | |
| FluoSpheres Carboxylate 0.1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8803 | |
| FluoSpheres Carboxylate 1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8823 | |
| FluoSpheres Carboxylate 1 µm nile red fluorescent 535/575 | Thermo Fisher | F8819 | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T6567 | |
| Trypsin inhibitor type II-s | Sigma-Aldrich | T9128 | |
| (3-aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Boric acid | Sigma-Aldrich | B0294 | |
| Phosphate buffered saline | Sigma-Aldrich | P7059 | |
| N-(3-Dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride | Sigma-Aldrich | E7750 | |
| Vortexer mixer | VWR | 58816-123 | |
| 6 mm diameter hole punch | Sigma-Aldrich | Z708860 | |
| SOLA 6-LCR-SB | Lummencor light engine | No.3526 | |
| Cfi Plan Achro Uw 1X Objective | Nikon Plan UW | MRL00012 | |
| CFI Plan Fluor 40X Oil Objective 1.3 na - 0.20 mm wd | Nikon Plan Fluor | MRH01401 | |
| Nikon Eclipse Ti-U inverted microscope | Nikon | MEA53200 | |
| Clara-E Camera | Andor | DR-328G-C02-SIL | |
| Remote Focus Attachment E-RFA Ergo Design | Nikon | 99888 | |
| Ti-S-E Motorized Stage | Nikon | MEC56110 |
Referências
- Van Hal, D., Jeremiasse, E., Junginger, H. E., Spies, F., Bouwstra, J. Structure of fully hydrated human stratum corneum: a freeze-fracture electron microscopy study. J. Invest. Dermatol. 106 (1), 89-95 (1996).
- Norlén, L., Al-Amoudi, A. Stratum corneum keratin structure, function, and formation: the cubic rod-packing and membrane templating model. J. Invest. Dermatol. 123 (4), 715-732 (2004).
- Liu, X., Cleary, J., German, G. K. The global mechanical properties and multi-scale failure mechanics of heterogeneous human stratum corneum. Acta Biomater. , (2016).
- Geerligs, M. Skin layer mechanics. , Technische Universiteit Eindhoven. (2010).
- Farage, M. S., Miller, K. W., Maibach, H. I. Textbook of Aging Skin. , (2010).
- Levi, K., Kwan, A., Rhines, A. S., Gorcea, M., Moore, D. J., Dauskardt, R. H. Emollient molecule effects on the drying stresses in human stratum corneum. Br. J. Dermatol. 163 (4), 695-703 (2010).
- German, G. K., Pashkovski, E., Dufresne, E. R. Surfactant treatments influence drying mechanics in human stratum corneum. J. Biomech. 46 (13), 2145-2151 (2013).
- Liu, X., German, G. K. The effects of barrier disruption and moisturization on the dynamic drying mechanics of human stratum corneum. J. Mech. Behav. Biomed. Mater. 49 (13), 80-89 (2015).
- Levi, K., Weber, R. J., Do, J. Q., Dauskardt, R. H. Drying stress and damage processes in human stratum corneum. Int. J. Cosmet. Sci. 32 (4), 276-293 (2010).
- Levi, K., et al. Effect of glycerin on drying stresses in human stratum corneum. J. Dermatol. Sci. 61, 129-131 (2011).
- Fluhr, J. W., Darlenski, R., Surber, C. Glycerol and the skin: holistic approach to its origin and functions. Br. J. Dermatol. 159 (1), 23-34 (2008).
- German, G. K., et al. Heterogeneous drying stresses in stratum corneum. Biophys. J. 102 (11), 2424-2432 (2012).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Exp. Fluids. 10 (4), 181-193 (1991).
- Mertz, A. F., et al. Scaling of traction forces with the size of cohesive cell colonies. Phys. Rev. Lett. 108 (19), 1-5 (2012).
- Banerjee, S., Marchetti, M. C. Substrate rigidity deforms and polarizes active gels. Euro Phys. Lett. 96 (2), 28003(2011).
- Edwards, C. M., Schwarz, U. S. Force localization in contracting cell layers. Phys. Rev. Lett. 107 (12), 128101(2011).
- Cesa, C., et al. Micropatterned silicone elastomer substrates for high resolution analysis of cellular force patterns. Rev. Sci. Instrum. 78 (3), 34301(2007).
- Wu, K. S., Van Osdol, W. W., Dauskardt, R. H. Mechanical And Microstructural Properties Of Stratum Corneum. Mater. Res. Soc. 724, 27-33 (2002).
- Yuan, Y., Verma, R. Measuring microelastic properties of stratum corneum. Colloids Surf. B. 48 (1), 6-12 (2006).
- Christensen, M. S., Hargens, C. W., Nacht, S., Gans, E. H. Viscoelastic properties of intact human skin: instrumentation, hydration effects, and the contribution of the stratum corneum. J Invest. Dermatol. 69 (3), (1977).
- Pailler-Mattei, C., Bec, S., Zahouani, H. In vivo measurements of the elastic mechanical properties of human skin by indentation tests. Med. Eng.Phys. 30 (5), 599-606 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados