Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La medición y Modelado contráctil que se secan en humano estrato córneo
En este artículo
Resumen
Este artículo describe un método para cuantificar el comportamiento de secado dinámica y las propiedades mecánicas del estrato córneo midiendo la resuelto espacialmente desplazamientos de secado en el plano de muestras de tejido circulares adheridas a un sustrato de elastómero. Esta técnica se puede utilizar para medir cómo los diferentes tratamientos químicos altera de secado y propiedades mecánicas del tejido.
Resumen
estrato córneo (SC) es la capa más superficial de la piel. Su contacto con el ambiente externo significa que esta capa de tejido se somete a ambos agentes de limpieza y las variaciones diarias en la humedad del ambiente; ambos de los cuales pueden alterar el contenido de agua del tejido. Las reducciones en el contenido de agua de la disfunción de la barrera grave o ambientes de baja humedad pueden alterar la rigidez SC y causar una acumulación de tensiones de secado. En condiciones extremas, estos factores pueden causar la ruptura mecánica del tejido. Hemos establecido un método de alto rendimiento de la cuantificación de los cambios dinámicos en las propiedades mecánicas de SC tras el secado. Esta técnica puede emplearse para cuantificar los cambios en el comportamiento de secado y propiedades mecánicas de SC con tratamientos limpiador y humectante cosméticos. Esto se logra midiendo las variaciones dinámicas en resolución espacial desplazamientos de secado en el plano de muestras de tejido circulares adheridas a un sustrato de elastómero. En el plano de desplazamientos radiales ACQpedirá otra durante el secado se promediaron azimutal y está equipada con un perfil basado en un modelo de la contractilidad elástico lineal. Los cambios dinámicos en el estrés de secado y SC módulo elástico a continuación se pueden extraer de los perfiles de modelo ajustado.
Introducción
La capa más externa de la epidermis, o estrato córneo (SC) se compone de células de corneocitos cohesivos rodeadas por una matriz rica en lípidos 1, 2. La composición y la integridad estructural de SC es esencial para mantener la funcionalidad de barrera correcta 3, lo que impide la invasión de microorganismos y resiste tanto a las fuerzas mecánicas y la pérdida excesiva de agua 4. La capacidad de los productos de cuidado personal para mantener o degradar la función de barrera de la piel es de gran interés para la salud de la piel y la industria cosmética 5. La aplicación diaria de productos de cuidado personal se sabe que altera las propiedades mecánicas de la SC 6, 7, 8. Por ejemplo, tensioactivos contenidos en productos de limpieza cosméticos pueden causar incrementos significativos en el módulo elástico y una acumulación detensiones de secado en Carolina del Sur, el aumento de la propensión de que el tejido se agrietan 7, 9. El glicerol contenido en casi todas las cremas hidratantes cosméticos puede suavizar SC y disminuir la acumulación de tensiones de secado 8, 10, 11, reduciendo la probabilidad de ruptura del tejido.
El método detallado en este artículo es capaz de cuantificar el comportamiento de secado dinámica y las propiedades mecánicas de SC secado en ambientes controlados 7, 8. Anteriormente, esta técnica se ha demostrado que es capaz de elucidar el efecto de diferentes productos cosméticos en los cambios en el comportamiento de secado dinámica y las propiedades mecánicas del tejido SC. Esto se logra mediante la cuantificación de la contracción por secado inducida de tejido humano SC adherido a un sustrato de elastómero blando, encajando desplazamientos de secado con un simplemodelo de contractilidad y, a continuación, extraer el módulo elástico y el secado de la tensión del perfil equipada. Cuando se requiere una prueba de múltiples muestras SC, este método ofrece una alternativa más rápida a tensometry uniaxial, utiliza significativamente menos tejido y proporciona más fisiológicamente relevante de secado mediante la prevención de la evaporación de la parte inferior de la muestra.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Una aprobación exentos (3002-13) para llevar a cabo la investigación con muestras de tejido sin identificación de conformidad con el Departamento de Salud y Servicios Humanos de los reglamentos, 45 CFR 46.101 (b) (4) se le concedió. grosor de la piel se recibe de la cirugía electiva. En este artículo, la fuente de tejido es de 66 años de edad, de raza caucásica mama femenina.
1. Preparación de cubreobjetos revestidos de elastómeros
- En un vial de vidrio de 20 ml, mezclar 0,107 g de Sylgard 184 agente de curado con 5,893 g de base. La masa total es mezcla 6 g con una base para la curación de relación de agente de 55: 1.
- Después de la mezcla con una varilla de vidrio para asegurar la homogeneidad, colocar el vial de vidrio en una cámara de vacío y desgasificar para eliminar todas las burbujas.
- Colocar un cubre de vidrio (55 mm x 25 mm) en el centro de una recubridora de rotación. Añadir ~ 1 ml de la mezcla en el centro de la tapa deslizante. Utilice una pipeta de 5.000 l con el extremo cortado con las tijeras. abrigo de giro del cubre a 2.000 rpm durante 60 s.
- Repita este process para crear 5-6 sustratos.
- Curar los cubres en un horno durante 12 horas a 60 ° C.
- Utilice una hoja de afeitar para eliminar parcialmente la película de elastómero de un sustrato de sacrificio. Utilice un marcador indeleble para marcar el lado superior de la película de elastómero y el vidrio expuesta.
- Montar la muestra en un microscopio invertido y el uso de un accesorio de enfoque remoto para registrar la diferencia de altura z entre los planos focales de las dos marcas. Esto se corresponde con el espesor del sustrato elastómero, h.
2. Preparación del estrato córneo
- Use un baño de agua o placa de agitación con calefacción para calentar un vaso de vidrio lleno hasta la mitad con agua desionizada (DW) a 60 ° C. Dentro de una cabina de seguridad biológica, sumergir la piel humana en todo su espesor en el agua durante 4 min.
- Inmediatamente transferir la muestra de piel en un vaso de precipitados que contiene DW enfrió a <10 ° C durante 4 min. La mitad de llenar el vaso de precipitados minimiza las salpicaduras de material de riesgo biológico.
- Quitar la piel del vaso de precipitados, colocar en una placa de Petri, y suavemente aislar la epidermis utilizando un par de pinzas de tejido de nariz dobladas.
- Coloque la epidermis aislados parte basal en una placa de Petri forrada con una gasa. Asegúrese de que la capa basal está plenamente en contacto con la tela.
- Remojar la gasa en un 0,25% (peso / vol) de tipo IX-S páncreas porcino solución de tripsina disuelto en 0,1 M tampón fosfato salino para 6-8 h a temperatura ambiente. Añadir tripsina sólo lo suficiente en el recipiente para humedecer la gasa.
- Levante la gasa con pinzas de tejido y flotar en un recipiente parcialmente lleno de DW. Tire suavemente de la SC para separarlo de la gasa.
- Se lava la capa córnea de 3-4 veces en DW para eliminar el tejido epidérmico residual que permanece unido a la SC.
- Flotador la SC aislado en una solución de 0,4% de glicina max (soja) inhibidor de la tripsina en DW. Utilice un agitador de placas para agitar el tejido durante 10 min.
- SC flotar en una placa de Petri parcialmentelleno de DW. Utilice un agitador de placas para agitar el tejido durante 10 min.
- Se seca la hoja SC aislado en una malla de plástico ultra-fino durante 48 h a temperatura ambiente (25 ° C, 40% de humedad relativa (RH)).
- Se separa la SC de la malla y cortar muestras circulares R = 3 mm de radio individuales utilizando una perforadora circular. Marcar el centro de la cara más exterior con una pequeña marca en espiral utilizando un marcador indeleble. Esto proporciona una indicación visual para el reconocimiento de la parte superior del SC.
NOTA: La marca indeleble debe ser aplicado en el centro de la muestra, donde las deformaciones de secado será más pequeño. Esto minimizará el impacto del marcador en los perfiles de desplazamiento de secado grabados.
3. Muestra de Tratamiento y Deposición
- Agitar muestras SC 30 min en 15 ml DW contiene 90 mu l perlas de marcador fluorescente (505/515 nm, 1 m de diámetro, carboxilato-modificado). Este tipo de depósitos sobre la superficie de perlas de Carolina del Sur
NOTA: Si bien la deposición de large números de cuentas en el SC pueden marginalmente secado lento con relación a las muestras sin perlas presentes 12, que maximizarán la resolución espacial de los campos de deformación en el plano que se pueden obtener posteriormente. Por lo tanto, la elección del volumen del grano agregado debe hacerse ad hoc. - Extraer muestras de SC y colocarlos en una placa de Petri parcialmente lleno de DW.
- Parcialmente sumergir un sustrato en el DW con un ángulo pequeño de 15-30 °.
- Pin un borde de la muestra de SC flotante en la línea de contacto entre el sustrato y la interfaz de agua. Verticalmente retirar el sustrato del agua sin problemas laminar la muestra de SC al sustrato sin arrugas o burbujas de aire atrapadas.
- Repita el paso 3.4 para colocar hasta 6 muestras SC en cada sustrato. Deje al menos un espacio de 2-3 mm entre las muestras y evitar la estratificación de la muestra cerca del borde del sustrato. Esto evita el secado de una muestra que influyen en los desplazamientos de secado en otro.
- Secar las muestras SC montados en condiciones de laboratorio durante 60 minutos. Esto permite que el agua residual entre el SC y el sustrato se evapore y que garantiza una adhesión completa del tejido.
NOTA: En esta coyuntura, las muestras SC puede ser tratada con un producto químico o formulaciones cosméticas 7, 8 mediante la colocación de los sustratos al revés en una solución deseada durante un periodo de tiempo requerido. Repita el paso 3.6 una vez que la etapa de tratamiento se lleva a cabo. Después del secado, adherencia incompleta de muestras SC al sustrato puede ser verificada mediante microscopía de luz transmitida. burbujas atrapadas bajo la muestra SC o bordes delaminados formarán variaciones de contraste claras en la muestra con bordes bien definidos. - Crear una cámara de humedad mediante la colocación de una placa de Petri parcialmente lleno de agua en un recipiente herméticamente cerrado.
- Coloque los sustratos en la cámara durante 24 h a equilibren a una humedad relativa de 99%. No coloque los sustratos en el Petri plato.
4. Microscopio Control Ambiental
- Lograr control de las condiciones ambientales a través de un sistema de control de humedad conectado a una cámara de perfusión montable microscopio. Los detalles del sistema de control de humedad se proporcionan en alemán y otros. (2013) 7 y Liu y alemán (2015) 8.
- Montar el sustrato en el microscopio, coloque la cámara de perfusión sobre el sustrato y sellar los bordes de la cámara de perfusión al elastómero usando grasa de vacío.
- Una vez montado, se equilibre de aire interno a 99% de humedad relativa antes de la experimentación. Esto evita la evaporación del agua antes de la experimentación. Una vez que las imágenes en las secciones 5 o 7 ha comenzado, reducir la humedad del aire interno al valor deseado.
NOTA: En este artículo, las muestras SC se secan a 25% de humedad relativa
5. Imaging en el plano de secado Desplazamientos
- Adquirir imágenes de las muestras de SC utilizando un microsco invertidaPE con lente objetivo 1X. Excite perlas fluorescentes que utilizan un motor de luz con filtro FITC (503-530 nm de paso de banda de emisión). Múltiples muestras se pueden obtener imágenes de forma secuencial a lo largo de secado usando una etapa xy automatizado.
- fluorescente de grabación y transmisión de las imágenes de luz usando una cámara digital CCD con una resolución de 1.392 x 1.040 píxeles. El campo de visión de cada imagen es 8,98 x 6,71 mm, lo que permite una sola imagen para capturar una muestra SC completo. Tomar imágenes con una frecuencia de 10 min durante 16 h.
6. Preparación del soporte para la medición de espesores
- En una campana de humos químicos, colocar 1 ml de silano (3-aminopropiltrietoxisilano; ≥98%) de alguna tapa de plástico pequeña. Coloque sustratos elastómeros de la sección 1 y la tapa en un recipiente sellado durante 5 h. No permita que los sustratos que entran directamente en contacto con el silano.
- Añadir 5 mg de EDC (N - (3-dimetilaminopropil) - N hidrocloruro de etilcarbodiimida; ≥99%) en un tubo de 1,5 ml. Añadir 500 l de DW a la EDC. Se agita la solución durante 10 s con un mezclador de vórtice.
- Añadir 0,076 g de tetraborato de sodio y 0,1 g de ácido bórico a 20 ml DW. Mezclar utilizando un agitador magnético a 70 ° C (1 h). Añadir ácido bórico hasta que el pH es 7,4.
- Añadir 20 ml de tampón de borato a un tubo de centrífuga de 50 ml. Añadir 60 l de 1 m perlas (535/575 nm, carboxilato-modificado) al tampón de borato. Por último, añadir 200 l de solución de EDC a la botella. Agitar el tubo para mezclar solución de bolas y luego verter en una placa de 10 cm de diámetro Petri.
- Eliminar los sustratos silanizada del recipiente y los colocan elastómero lado de la película hacia abajo en la solución de perlas. Hacerlo lentamente para evitar burbujas queden atrapados. Dos sustratos caben en cada placa de Petri.
- Deja sustratos para flotar en la solución de microesferas durante 45 min.
- Utilizar pinzas para quitar los sustratos de la solución de bolas, luego enjuague con DW para eliminar las perlas no unidas.
- Secar al aire los sustratos. Soplado de aire comprimido sobrela superficie de la película de elastómero reduce la formación de manchas de agua.
- Sellar los sustratos en una caja opaca para evitar la foto-blanqueamiento de los talones hasta la deposición de la muestra SC.
7. Espesor de imagen de SC
- SC muestras de depósito sobre un sustrato utilizando la sección 3. Sin embargo, realizar el paso 3.1 sin añadir perlas fluorescentes a la DW. Además, se aplica una gota 5 l de solución sin diluir fluorescente marcador talón (505/515 nm, 0,1 m de diámetro) a la superficie de cada muestra SC depositado con una pipeta antes de completar el paso 3.6.
- Establecer mediciones del espesor del SC utilizando el microscopio 40X con la lente del objetivo. Medir el espesor de las muestras de SC en el tiempo utilizando un accesorio de enfoque remoto para registrar la diferencia en z-altura entre los dos planos focales de la capa del grano situadas en la interfaz SC-sustrato y la parte superior del SC.
- Medir el espesor de 3 regiones de cada muestra SC durante un período de secado 3 h. El grosorde las muestras SC alcanza un valor estable en este marco de tiempo 8.
8. Cuantificación y la deformación del tejido Modelado
- Utilice velocimetría de imágenes de partículas 13 para obtener resolución espacial de secado desplazamientos en el plano de las imágenes fluorescentes en cada paso de tiempo registrado.
- Utilice MATLAB para obtener perfiles de desplazamiento radial y azimutal azimutal promediados desde el campo de desplazamiento de cada muestra SC radialmente simétrica.
NOTA: Un conjunto de datos de ejemplo (titulado 'd.mat') y el código de MATLAB (titulado 'PIV-processing.m') que realiza tanto este paso y el paso 8.3 se ha proporcionado de la información suplementaria. - Montar los perfiles de desplazamiento radial a un modelo de 7, 8, 14, 15, 16 que describe el secado SC como una circula elástico lineal contracciónr disco de tiempo que varía de espesor, h SC, el radio, R, y módulo de elasticidad, E SC, adherida a un sustrato elástico deformable con el módulo de elasticidad, E. Supongamos SC tiene una relación de Poisson bien definido y constante, ν SC = 0.4 7 , 8. Obtener mejores ajustes utilizando un enfoque mínimo de los mínimos cuadrados.
NOTA: El modelo utilizado para el montaje describe desplazamientos radiales en términos de funciones de Bessel modificadas son: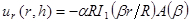 (1)
(1)
con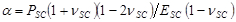 ,
,  y
y 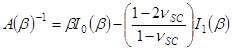
El termino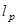 corresponde a una profundidad de penetración dada por,
corresponde a una profundidad de penetración dada por,  .
. 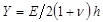 denota un parámetro sustrato rigidez; válida cuando los tamaños de muestra son mucho mayores que el grosor del sustrato. Aquí, los parámetros,
denota un parámetro sustrato rigidez; válida cuando los tamaños de muestra son mucho mayores que el grosor del sustrato. Aquí, los parámetros, 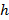 y
y 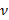 denotan, respectivamente, el espesor del sustrato coeficiente de Poisson. Relación del sustrato de elastómero de silicona 17 de la Poisson es ν = 0,5.
denotan, respectivamente, el espesor del sustrato coeficiente de Poisson. Relación del sustrato de elastómero de silicona 17 de la Poisson es ν = 0,5. - Obtener los parámetros del modelo alpha y β en cada paso de tiempo a partir de los mínimos cuadrados de la ecuación (1) en el perfil de desplazamiento radial.
- Emplear el parámetro de ajuste β obtener SC módulo de elasticidad, E SC, utilizando la expresión,
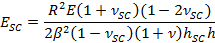
- Utilice los parámetros α de ajuste para obtener el tiempo de secado varía stre contráctilss, PSC, usando la expresión,
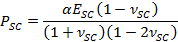
- Emplear el parámetro de ajuste β obtener SC módulo de elasticidad, E SC, utilizando la expresión,
Access restricted. Please log in or start a trial to view this content.
Resultados
La Figura 1 (a) muestra una imagen fluorescente de una muestra representativa SC recubierto con perlas fluorescentes (sección 3). La correspondiente imagen de luz transmitida de la muestra se muestra en la Figura 1 (b) superpone con una trama carcaj de desplazamientos de secado espacialmente resueltos que se forman después de 16 h de secado a 25% RH Debido a la simetría circular de las muestras, estos desplazamientos pueden ser azimutal promediado.
Access restricted. Please log in or start a trial to view this content.
Discusión
En este artículo, se describe una técnica que puede utilizarse para medir el comportamiento de secado dinámica y las propiedades mecánicas de SC humano. Estudios previos han demostrado que esta técnica se puede utilizar para cuantificar los efectos de las condiciones ambientales y de los productos químicos utilizados comúnmente en productos de limpieza cosméticos y humectantes en el comportamiento de secado dinámica de SC 7, 8. Hay una serie de pasos cl...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Silicone elastomer base | Dow-Corning | 1064291 | |
| Silicone elastomer Curing Agent | Dow-Corning | 1015311 | |
| FluoSpheres Carboxylate 0.1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8803 | |
| FluoSpheres Carboxylate 1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8823 | |
| FluoSpheres Carboxylate 1 µm nile red fluorescent 535/575 | Thermo Fisher | F8819 | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T6567 | |
| Trypsin inhibitor type II-s | Sigma-Aldrich | T9128 | |
| (3-aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Boric acid | Sigma-Aldrich | B0294 | |
| Phosphate buffered saline | Sigma-Aldrich | P7059 | |
| N-(3-Dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride | Sigma-Aldrich | E7750 | |
| Vortexer mixer | VWR | 58816-123 | |
| 6 mm diameter hole punch | Sigma-Aldrich | Z708860 | |
| SOLA 6-LCR-SB | Lummencor light engine | No.3526 | |
| Cfi Plan Achro Uw 1X Objective | Nikon Plan UW | MRL00012 | |
| CFI Plan Fluor 40X Oil Objective 1.3 na - 0.20 mm wd | Nikon Plan Fluor | MRH01401 | |
| Nikon Eclipse Ti-U inverted microscope | Nikon | MEA53200 | |
| Clara-E Camera | Andor | DR-328G-C02-SIL | |
| Remote Focus Attachment E-RFA Ergo Design | Nikon | 99888 | |
| Ti-S-E Motorized Stage | Nikon | MEC56110 |
Referencias
- Van Hal, D., Jeremiasse, E., Junginger, H. E., Spies, F., Bouwstra, J. Structure of fully hydrated human stratum corneum: a freeze-fracture electron microscopy study. J. Invest. Dermatol. 106 (1), 89-95 (1996).
- Norlén, L., Al-Amoudi, A. Stratum corneum keratin structure, function, and formation: the cubic rod-packing and membrane templating model. J. Invest. Dermatol. 123 (4), 715-732 (2004).
- Liu, X., Cleary, J., German, G. K. The global mechanical properties and multi-scale failure mechanics of heterogeneous human stratum corneum. Acta Biomater. , (2016).
- Geerligs, M. Skin layer mechanics. , Technische Universiteit Eindhoven. (2010).
- Farage, M. S., Miller, K. W., Maibach, H. I. Textbook of Aging Skin. , (2010).
- Levi, K., Kwan, A., Rhines, A. S., Gorcea, M., Moore, D. J., Dauskardt, R. H. Emollient molecule effects on the drying stresses in human stratum corneum. Br. J. Dermatol. 163 (4), 695-703 (2010).
- German, G. K., Pashkovski, E., Dufresne, E. R. Surfactant treatments influence drying mechanics in human stratum corneum. J. Biomech. 46 (13), 2145-2151 (2013).
- Liu, X., German, G. K. The effects of barrier disruption and moisturization on the dynamic drying mechanics of human stratum corneum. J. Mech. Behav. Biomed. Mater. 49 (13), 80-89 (2015).
- Levi, K., Weber, R. J., Do, J. Q., Dauskardt, R. H. Drying stress and damage processes in human stratum corneum. Int. J. Cosmet. Sci. 32 (4), 276-293 (2010).
- Levi, K., et al. Effect of glycerin on drying stresses in human stratum corneum. J. Dermatol. Sci. 61, 129-131 (2011).
- Fluhr, J. W., Darlenski, R., Surber, C. Glycerol and the skin: holistic approach to its origin and functions. Br. J. Dermatol. 159 (1), 23-34 (2008).
- German, G. K., et al. Heterogeneous drying stresses in stratum corneum. Biophys. J. 102 (11), 2424-2432 (2012).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Exp. Fluids. 10 (4), 181-193 (1991).
- Mertz, A. F., et al. Scaling of traction forces with the size of cohesive cell colonies. Phys. Rev. Lett. 108 (19), 1-5 (2012).
- Banerjee, S., Marchetti, M. C. Substrate rigidity deforms and polarizes active gels. Euro Phys. Lett. 96 (2), 28003(2011).
- Edwards, C. M., Schwarz, U. S. Force localization in contracting cell layers. Phys. Rev. Lett. 107 (12), 128101(2011).
- Cesa, C., et al. Micropatterned silicone elastomer substrates for high resolution analysis of cellular force patterns. Rev. Sci. Instrum. 78 (3), 34301(2007).
- Wu, K. S., Van Osdol, W. W., Dauskardt, R. H. Mechanical And Microstructural Properties Of Stratum Corneum. Mater. Res. Soc. 724, 27-33 (2002).
- Yuan, Y., Verma, R. Measuring microelastic properties of stratum corneum. Colloids Surf. B. 48 (1), 6-12 (2006).
- Christensen, M. S., Hargens, C. W., Nacht, S., Gans, E. H. Viscoelastic properties of intact human skin: instrumentation, hydration effects, and the contribution of the stratum corneum. J Invest. Dermatol. 69 (3), (1977).
- Pailler-Mattei, C., Bec, S., Zahouani, H. In vivo measurements of the elastic mechanical properties of human skin by indentation tests. Med. Eng.Phys. 30 (5), 599-606 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados