Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung und Modellierung Kontraktile Trocknung im Bereich Human Stratum corneum
In diesem Artikel
Zusammenfassung
in der Ebene räumlich aufgelösten Trocknungs Verschiebungen von kreisförmigen Gewebeproben geklebt auf ein Elastomersubstrat Dieser Artikel beschreibt ein Verfahren zur dynamischen Trocknungsverhalten und die mechanischen Eigenschaften des Stratum corneum Quantifizierung durch Messung. Diese Technik kann verwendet werden, um zu messen, wie verschiedene chemische Behandlungen Trocknen und Gewebe mechanischen Eigenschaften verändern.
Zusammenfassung
Stratum corneum (SC) ist die oberflächliche Hautschicht. Dessen Kontakt mit der äußeren Umgebung bedeutet, daß diese Gewebeschicht auf beide Reinigungsmittel und täglichen Schwankungen in der Umgebungsfeuchtigkeit ausgesetzt wird; beide können den Wassergehalt des Gewebes zu verändern. Kürzungen in Wassergehalt von schweren Barrierestörung oder niedriger Luftfeuchtigkeit Umgebungen kann SC Steifigkeit verändern und einen Aufbau von Trocknungsspannungen verursachen. Unter extremen Bedingungen können diese Faktoren mechanischen Bruch des Gewebes verursachen. Wir haben eine hohe Durchsatzverfahren zur Quantifizierung von dynamischen Veränderungen in den mechanischen Eigenschaften von SC nach dem Trocknen hergestellt. Diese Technik kann verwendet werden, um Änderungen in der Trocknungsverhalten und mechanische Eigenschaften von SC mit kosmetischen Reinigungsmittel und Feuchthaltemittel-Behandlungen zu quantifizieren. Dies wird durch Messen dynamischen Variationen in ortsaufgelöste in-plane Trocknungs Verschiebungen von kreisförmigen Gewebeproben geklebt auf ein Elastomersubstrat erreicht. In-plane radiale Verschiebungen acquired während der Trocknung azimutal gemittelt und mit einem Profil versehen basierend auf einem linearen elastischen Kontraktionsmodell. Dynamische Änderungen in Trockenstress und SC Elastizitätsmodul kann dann aus den angepassten Modells Profilen entnommen werden.
Einleitung
Die äußere Schicht der Epidermis oder Stratum corneum (SC) aus bindigen Korneozyt von einer Lipid - reichen Matrix umgeben Zellen 1, 2. Die Zusammensetzung und die strukturelle Integrität des SC ist von wesentlicher Bedeutung für die korrekte Barriere Funktionalität beibehalten 3, die Invasion von Mikroorganismen verhindert und widersteht sowohl mechanische Kräfte und übermäßigen Wasserverlust 4. Die Kapazität von Körperpflegeprodukten zu erhalten oder Hautbarrierefunktion verschlechtern ist von großem Interesse für die Haut im Gesundheitswesen und der Kosmetikindustrie 5. Die tägliche Anwendung von Körperpflegeprodukten ist bekannt , die mechanischen Eigenschaften des SC 6, 7, 8 zu verändern. Beispielsweise Tenside in kosmetischen Reinigungsmitteln enthalten sind, können deutliche Steigerungen der Elastizitätsmodul verursachen und einen Aufbau vonTrocknungsspannungen in SC, das Gewebe des Neigung zu erhöhen 7 zu knacken, 9. Glycerin in fast allen kosmetischen Moisturizer enthalten ist, kann SC erweichen und verringern die Bildung von Trocknungsspannungen 8, 10, 11, um die Wahrscheinlichkeit von Gewebebruch zu reduzieren.
Das Verfahren in diesem Artikel beschrieben ist in der Lage , die dynamischen Trocknungsverhalten und mechanische Eigenschaften von SC Trocknung in kontrollierten Umgebungen 7, 8 zu quantifizieren. Bisher hat diese Technik wurde der Erläuterung der Auswirkung verschiedener kosmetischer Produkte auf Veränderungen in der dynamischen Trocknungsverhalten und mechanische Eigenschaften von SC Gewebe fähig zu sein demonstriert. Dies wird durch Quantifizieren Trocknungsinduzierte Schrumpfung von menschlichen SC Gewebe zu einem weichen Elastomersubstrat geklebt erreicht, passend Trocknungs Verschiebungen mit einer einfachenKontraktilität des Modells und anschließend den Elastizitätsmodul zu extrahieren und von der angepassten Profil Stress zu trocknen. Beim Testen mehrerer Proben SC erforderlich ist, bietet dieses Verfahren eine schnellere Alternative zu uniaxial tensometry nutzt deutlich weniger Gewebe und bietet mehrere physiologisch relevant Trocknung durch Verdampfung von der Probenunterseite verhindert wird.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Eine befreit Zulassung (3002-13) Proben Forschung mit de-identifizierte Gewebe an das Department of Health gemäß durchführen und Human Services Vorschriften, 45 CFR 46,101 (b) (4) gewährt wurde. Volle Dicke Haut ist von einer geplanten Operation erhalten. In diesem Artikel ist die Gewebequelle 66-jährigen kaukasischen weiblichen Brust.
1. Herstellung von Elastomer beschichtete Deckgläser
- 0,107 g Sylgard 184 Härter mit 5,893 g Base in einem 20 Glasfläschchen ml, mischen. Die Gesamtmischung Masse beträgt 6 g mit einem Basismittel-Verhältnis von 55 bis Härtung: 1.
- Nach dem Mischen mit einem Glasstab um Homogenität zu gewährleisten, legen Sie das Glasfläschchen in einer Vakuumkammer und Entgasen alle Luftblasen zu entfernen.
- Ein Glasdeckglas (55 mm x 25 mm) in der Mitte eines Spin-Coater. In ~ 1 ml der Mischung auf die Mitte des Deckglas. Verwenden Sie eine 5000 ul Pipette mit dem Ende mit einer Schere abgeschnitten. Schleuderbeschichtung der Deckglas bei 2000 Umdrehungen pro Minute für 60 s.
- Wiederholen Sie diesen process 5-6 Substrate zu schaffen.
- Härten die Deckgläschen in einem Ofen 12 Stunden lang bei 60 ° C.
- Verwenden Sie eine Rasierklinge, um teilweise die Elastomerfolie aus einem Opfersubstrat zu entfernen. Verwenden Sie einen unauslöschlichen Markierung, um die Oberseite des Elastomerfilms und der exponierten Glas zu markieren.
- Montieren Sie die Probe auf einem inversen Mikroskop und mit einem Fernfokus als Zubehör den Unterschied in der z-Höhe zwischen den Brennebenen der beiden Marken zu erfassen. Dies entspricht dem Elastomersubstratdicke, h.
2. Herstellung des Stratum Corneum
- Verwenden Sie ein Wasserbad oder beheizte Rührplatte ein halbes Glas Becher mit VE-Wasser (DW) bis 60 ° C gefüllt zu erhitzen. In einem biologischen Sicherheitsschrank, tauchen die volle Dicke der menschlichen Haut im Wasser für 4 min.
- Unmittelbar übertragen die Hautprobe in ein Becherglas mit DW gekühlt auf <10 ° C für 4 min. Die Hälfte der Becher Füllung minimiert Verspritzen von infektiöses Material.
- Entfernen Sie die Haut aus dem Becher, in einer Petrischale, und zu isolieren, sanft in die Epidermis ein Paar gebogene Nase Gewebe mit einer Pinzette.
- Legen Sie die isolierten Epidermis basale Seite nach unten in einer Petrischale mit Gaze ausgekleidet. Sicherstellen, dass die basalen Schicht vollständig in Kontakt mit der Gaze ist.
- Genießen Sie die Gaze in einer 0,25% (wt / vol) Typ IX-S Schweinepankreas gelöst Trypsinlösung in 0,1 M phosphatgepufferter Kochsalzlösung für 6-8 h bei Raumtemperatur. Fügen Sie nur genug Trypsin in dem Behälter die Gaze zu benetzen.
- Heben Sie die Gaze mit Gewebe Pinzette und schweben sie teilweise in einem Behälter mit DW gefüllt. Ziehen Sie das SC sie von der Gaze zu trennen.
- Waschen Sie das Stratum corneum 3-4 mal in DW Rest epidermale Gewebe zu entfernen, die an den SC gebunden bleibt.
- Schwimmer, die isoliert SC in einer Lösung von 0,4% Glycin max (Soja) Trypsin-Inhibitor in DW. Verwenden Schüttler eine Platte in das Gewebe für 10 Minuten zu rühren.
- Float SC in einer Petrischale teilweisemit DW gefüllt. Verwenden Schüttler eine Platte in das Gewebe für 10 Minuten zu rühren.
- Trocknen Sie die isolierte SC Blatt auf einer ultrafeinen Kunststoffnetz für 48 Stunden bei Raumtemperatur (25 ° C, 40% relative Luftfeuchtigkeit (RH)).
- Trennen Sie die SC aus dem Netz und ausgeschnitten Proben einzelnen Kreis R = 3 mm Radius eine kreisförmige Lochung mit. Markieren Sie die Mitte der äußersten Fläche mit einer kleinen Spirale Marke einen unauslöschlichen Marker. Dies liefert einen visuellen Hinweis der Oberseite der SC für die Erkennung.
HINWEIS: Die unauslöschliche Spuren sollte in der Mitte der Probe aufgebracht werden, wobei die Trocknungs Verformungen kleinste sein. Dadurch wird die Wirkung der Markierung auf aufgezeichnet Trocknungsverschiebungsprofile minimieren.
3. Proben Behandlung und Ablagerung
- Agitieren SC Proben für 30 min in 15 ml DW, enthaltend 90 & mgr; l Fluoreszenzmarker Wülste (505/515 nm, 1 & mgr; m Durchmesser, Carboxylat-modifiziert). Diese Ablagerungen Perlen auf die SC Oberfläche
HINWEIS: Während der Abscheidung von large Zahlen von Perlen auf dem SC vorhanden 12 geringfügig relativ langsames Trocknen an Proben ohne Perlen, wird die räumliche Auflösung der in der gleichen Ebene Deformationsfelder zu maximieren , die anschließend erhalten werden können. Die Wahl des Bead - Volumens zugegeben wird, sollte daher ad hoc erfolgen. - Entfernen SC Proben und legen Sie sie in einer Petrischale teilweise mit DW gefüllt.
- Teilweise eintauchen in einem flachen Winkel von 15-30 ° ein Substrat in der DW.
- Pin eine Kante des schwebenden SC Probe an der Kontaktlinie zwischen dem Substrat und Wasser-Grenzfläche. Vertikal Herausziehen des Substrats aus dem Wasser gleichmäßig laminieren die SC Probe an das Substrat, ohne Falten oder eingeschlossenen Luftblasen.
- Wiederholen Sie Schritt 3.4 zu platzieren bis zu 6 SC Proben auf jedem Substrat. Lassen Sie mindestens eine 2-3 mm Abstand zwischen den Proben und vermeiden Probe Laminierung nahe an der Substratkante. Dies verhindert Trocknen einer Probe beeinflussen Trocknungs Verschiebungen in einem anderen.
- Trocknen Sie die montierten SC Proben unter Laborbedingungen für 60 min. Auf diese Weise können Restwasser zwischen dem SC und dem Substrat zu verdampfen und sorgt für eine vollständige Gewebehaftung.
HINWEIS: An dieser Stelle SC Proben können mit einem chemischen oder kosmetischen Formulierungen 7, 8 , indem die Substrate den Kopf in einer gewünschten Lösung für eine erforderliche Zeitdauer behandelt werden. Wiederholen Sie Schritt 3.6, sobald die Behandlungsschritt durchgeführt wird. Nach dem Trocknen kann unvollständige Adhäsion von SC-Proben auf das Substrat überprüft unter Verwendung von Durchlichtmikroskopie werden. Gefangen Blasen unter dem SC Probe oder abgelöste Kanten wird in der Probe mit gut definierten Kanten klare Kontrastvariationen bilden. - Erstellen Sie eine Feuchtigkeitskammer durch eine Petrischale platzieren teilweise mit Wasser in einem hermetisch verschlossenen Behälter gefüllt.
- Ort Substrate in die Kammer für 24 h einer relativen Feuchtigkeit von 99% äquilibrieren. Legen Sie nicht die Substrate in die Petri Gericht.
4. Mikroskop Umweltkontrolle
- Erreichen Kontrolle der Umweltbedingungen durch ein Feuchtigkeitsregelungssystem an ein Mikroskop montierbar Perfusionskammer verbunden. Einzelheiten des Feuchtigkeitskontrollsystem sind in der deutschen et al. (2013) 7 und Liu und Deutsch (2015) 8.
- Montieren Sie das Substrat, auf dem Mikroskop, legen Sie die Perfusionskammer über das Substrat und dichten Kanten der Perfusionskammer mit dem Elastomer mit Vakuumfett.
- Einmal montiert, ins Gleichgewicht Innenluft auf 99% RH vor dem Experiment. Dies verhindert, dass das Verdampfen von Wasser vor dem Experiment. Sobald Bildgebung in den Abschnitten 5 oder 7 begonnen hat, reduzieren interne Luftfeuchte auf den gewünschten Wert.
HINWEIS: In diesem Artikel werden SC-Proben auf 25% RH getrocknet
5. Imaging in Flugzeug Trocknung Verlagerungen
- Erwerben Sie Bilder von SC-Proben eines invertierten microsco mitpe mit 1X Objektivlinse. Excite fluoreszierende Kügelchen eine Lichtmaschine mit FITC-Filter (503-530 nm Emissionsbandpass). Mehrere Proben können nacheinander im gesamten Trocknungs abzubildenden eine automatisierte xy-Ebene verwendet wird.
- Nehmen Sie Leuchtstoff- und Durchlichtbilder einer digitalen CCD-Kamera mit einer Auflösung von 1.392 x 1.040 Pixeln. Das Sichtfeld jedes Bildes ist 8,98 x 6,71 mm, um ein einzelnes Bild ermöglicht eine vollständige SC Probe zu erfassen. Nehmen Bilder mit einer Frequenz von 10 min für 16 Stunden.
6. Untergrundvorbereitung für Dickenmessung
- In einem Laborabzug platzieren 1 ml Silan (3-Aminopropyltriethoxysilan; ≥98%) in einigen kleinen Plastikkappe. Platzieren Elastomersubstrate aus dem Abschnitt 1 und der Kappe in einem verschlossenen Behälter für 5 h. Substrate dürfen nicht direkt in Kontakt mit dem Silan zu kommen.
- Zugabe von 5 mg EDC (N - (3-Dimethylaminopropyl) - N -ethylcarbodiimide Hydrochlorid; ≥99%) in einem 1,5 ml - Röhrchen. In 500 & mgr; l von DW an die EDC. Rühre die Lösung für 10 s mit einem Wirbelmischer.
- Hinzufügen, 0,076 g Natriumtetraborat und 0,1 g Borsäure zu 20 ml DW. Mischen mit einem Magnetrührer bei 70 ° C (1 h). In Borsäure, bis der pH-Wert 7,4 ist.
- 20 ml Boratpuffer in ein 50 ml Zentrifugenröhrchen. Werden 60 & mgr; l von 1 & mgr; m-Kügelchen (535/575 nm Carboxylat-modifizierter) mit dem Boratpuffer. Schließlich fügen 200 ul EDC-Lösung in die Flasche. Das Röhrchen Wulst Lösung zu mischen und gießen Sie dann in einen 10 cm Durchmesser Petrischale.
- Entfernen Sie die silanisierte Substrate aus dem Behälter und legen Sie sie filmseitige Elastomer nach unten in die Beadlösung. Tun Sie dies langsam Blasen von Einklemmen zu verhindern. Zwei Substrate werden in jeder Petrischale passen.
- Lassen Substrate für 45 Minuten in der Beadlösung zu schweben.
- Verwenden einer Pinzette, die Substrate von der Perle Lösung zu entfernen, spülen Sie dann in DW ungebundenen Perlen zu entfernen.
- Luft trocknen die Substrate. Einblasen von Druckluft überdie Elastomerfolienoberfläche vermindert die Bildung von Wasserflecken.
- Verschließen Sie die Substrate in einer undurchsichtigen Box zu verhindern Photobleichens der Kügelchen bis SC Probenablage.
7. Imaging Dicke von SC
- Kaution SC Proben auf einen Substratabschnitt unter Verwendung 3. Allerdings führen Sie Schritt 3.1, ohne auf die DW fluoreszierende Kügelchen hinzugefügt wird. Zusätzlich wenden eine 5 & mgr; l Tropfen unverdünntes Fluoreszenzmarker bead-Lösung (505/515 nm, 0,1 um Durchmesser) auf der Oberfläche jeder abgelagerten SC Probe mit einer Pipette vor dem Schritt 3.6 abgeschlossen.
- Stellen Messungen von SC Dicke das Mikroskop mit 40-facher Objektivlinse verwendet wird. Messen der Dicke von SC-Proben über die Zeit eine Fernfokus Zubehör unter Verwendung der Differenz in z-Höhe zwischen den beiden Perlenschicht Brennebenen auf der SC-Substrat-Grenzfläche und der Oberseite des SC angeordnet aufzuzeichnen.
- Messen Sie die Dicke von 3 Regionen jeder SC Probe über einen 3 h Trocknungszeit. Die Dickevon SC - Proben erreicht innerhalb dieses Zeitrahmens 8 einen stationären Wert.
8. Quantifizierung und Modellierung Gewebe Deformation
- Verwenden Sie Particle Image Velocimetry 13 zu erhalten , räumlich aufgelöste in der Ebene liegende Trocknungs Verschiebungen von den fluoreszierenden Bildern bei jedem aufgezeichneten Zeitschritt.
- Verwenden MATLAB azimutal gemittelte radiale und azimutale Verschiebungsprofile aus dem Verschiebungsfeld jedes radial symmetrischen SC Probe zu erhalten.
Hinweis: Ein Beispiel-Datensatz (mit dem Titel 'd.mat') und MATLAB-Code (mit dem Titel "PIV-processing.m '), die 8.3 sowohl diesen Schritt und Schritt durchführt wurde, in dem ergänzende Informationen zur Verfügung gestellt. - Fit radialen Verschiebung Profile auf ein Modell 7, 8, 14, 15, 16 beschreibt Trocknen SC als schrumpf linearen elastischen circular Platte zeitveränderliche Dicke h SC, Radius, R, und der Elastizitätsmodul, SC E, geklebt auf ein verformbares elastisches Substrat mit einem Elastizitätsmodul, E. SC Angenommen hat eine gut definierte und konstante Poissonzahl, ν SC = 0,4 7 8. Erhalten Sie am besten passt ein Minimum der kleinsten Quadrate-Ansatz.
HINWEIS: Das Modell für den Einbau verwendet wird, beschreibt radiale Verschiebungen in Bezug auf die modifizierte Bessel-Funktionen sind: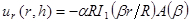 (1)
(1)
mit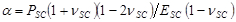 .
.  und
und 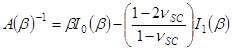
Der Begriff entspricht einer Eindringtiefe gegeben durch
entspricht einer Eindringtiefe gegeben durch  .
. 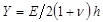 bezeichnet ein Substrat Steifigkeit Parameter; gilt, wenn die Probengrößen viel größer sind als die Substratdicke. Hierbei sind die Parameter,
bezeichnet ein Substrat Steifigkeit Parameter; gilt, wenn die Probengrößen viel größer sind als die Substratdicke. Hierbei sind die Parameter, 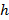 und
und 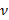 Das Poisson-Verhältnis bezeichnen jeweils die Substratdicke. Das Poisson-Verhältnis des Siliconelastomer - Substrat 17 ist ν = 0,5 auf .
Das Poisson-Verhältnis bezeichnen jeweils die Substratdicke. Das Poisson-Verhältnis des Siliconelastomer - Substrat 17 ist ν = 0,5 auf . - Erhalten Modellparameter a und β in jedem Zeitschritt der kleinsten Quadrate der Gleichung (1) zu der radialen Verschiebungsprofil.
- Setzen Sie dafür die Anpassungsparameter β zu SC Elastizitätsmodul, E SC zu erhalten, unter Verwendung des Ausdrucks,
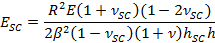
- Verwenden Sie Anpassungsparameter α die Zeit zu erhalten unterschiedlichen Kontraktions Trocknen stress, PSC, unter Verwendung des Ausdrucks,
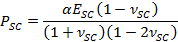
- Setzen Sie dafür die Anpassungsparameter β zu SC Elastizitätsmodul, E SC zu erhalten, unter Verwendung des Ausdrucks,
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
1 (a) zeigt eine repräsentative Fluoreszenzbild eines SC - Probe beschichtet mit fluoreszierenden Kügelchen (Abschnitt 3). Die entsprechende Durchlichtbild der Probe in 1 gezeigt ist (b) mit einem Köcher Grundstück von räumlich aufgelösten Trocknungs Verschiebungen überlagert , dass aufgrund der Kreissymmetrie der Proben bei 25% relativer Luftfeuchtigkeit nach 16 h Trocknen bilden, können diese Verschiebungen sein azimutal gemitt...
Access restricted. Please log in or start a trial to view this content.
Diskussion
In diesem Artikel beschreiben wir eine Technik, die verwendet werden können, die dynamische Trocknungsverhalten und die mechanischen Eigenschaften des menschlichen SC zu messen. Frühere Studien haben gezeigt , dass diese Technik verwendet werden kann , um die Auswirkungen von Umgebungsbedingungen und chemischen Produkten üblicherweise in kosmetischen Reinigungsmittel und Feuchthaltemittel auf der dynamischen Trocknungsverhalten von SC 7, 8 verwendet , zu quan...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Silicone elastomer base | Dow-Corning | 1064291 | |
| Silicone elastomer Curing Agent | Dow-Corning | 1015311 | |
| FluoSpheres Carboxylate 0.1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8803 | |
| FluoSpheres Carboxylate 1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8823 | |
| FluoSpheres Carboxylate 1 µm nile red fluorescent 535/575 | Thermo Fisher | F8819 | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T6567 | |
| Trypsin inhibitor type II-s | Sigma-Aldrich | T9128 | |
| (3-aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Boric acid | Sigma-Aldrich | B0294 | |
| Phosphate buffered saline | Sigma-Aldrich | P7059 | |
| N-(3-Dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride | Sigma-Aldrich | E7750 | |
| Vortexer mixer | VWR | 58816-123 | |
| 6 mm diameter hole punch | Sigma-Aldrich | Z708860 | |
| SOLA 6-LCR-SB | Lummencor light engine | No.3526 | |
| Cfi Plan Achro Uw 1X Objective | Nikon Plan UW | MRL00012 | |
| CFI Plan Fluor 40X Oil Objective 1.3 na - 0.20 mm wd | Nikon Plan Fluor | MRH01401 | |
| Nikon Eclipse Ti-U inverted microscope | Nikon | MEA53200 | |
| Clara-E Camera | Andor | DR-328G-C02-SIL | |
| Remote Focus Attachment E-RFA Ergo Design | Nikon | 99888 | |
| Ti-S-E Motorized Stage | Nikon | MEC56110 |
Referenzen
- Van Hal, D., Jeremiasse, E., Junginger, H. E., Spies, F., Bouwstra, J. Structure of fully hydrated human stratum corneum: a freeze-fracture electron microscopy study. J. Invest. Dermatol. 106 (1), 89-95 (1996).
- Norlén, L., Al-Amoudi, A. Stratum corneum keratin structure, function, and formation: the cubic rod-packing and membrane templating model. J. Invest. Dermatol. 123 (4), 715-732 (2004).
- Liu, X., Cleary, J., German, G. K. The global mechanical properties and multi-scale failure mechanics of heterogeneous human stratum corneum. Acta Biomater. , (2016).
- Geerligs, M. Skin layer mechanics. , Technische Universiteit Eindhoven. (2010).
- Farage, M. S., Miller, K. W., Maibach, H. I. Textbook of Aging Skin. , (2010).
- Levi, K., Kwan, A., Rhines, A. S., Gorcea, M., Moore, D. J., Dauskardt, R. H. Emollient molecule effects on the drying stresses in human stratum corneum. Br. J. Dermatol. 163 (4), 695-703 (2010).
- German, G. K., Pashkovski, E., Dufresne, E. R. Surfactant treatments influence drying mechanics in human stratum corneum. J. Biomech. 46 (13), 2145-2151 (2013).
- Liu, X., German, G. K. The effects of barrier disruption and moisturization on the dynamic drying mechanics of human stratum corneum. J. Mech. Behav. Biomed. Mater. 49 (13), 80-89 (2015).
- Levi, K., Weber, R. J., Do, J. Q., Dauskardt, R. H. Drying stress and damage processes in human stratum corneum. Int. J. Cosmet. Sci. 32 (4), 276-293 (2010).
- Levi, K., et al. Effect of glycerin on drying stresses in human stratum corneum. J. Dermatol. Sci. 61, 129-131 (2011).
- Fluhr, J. W., Darlenski, R., Surber, C. Glycerol and the skin: holistic approach to its origin and functions. Br. J. Dermatol. 159 (1), 23-34 (2008).
- German, G. K., et al. Heterogeneous drying stresses in stratum corneum. Biophys. J. 102 (11), 2424-2432 (2012).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Exp. Fluids. 10 (4), 181-193 (1991).
- Mertz, A. F., et al. Scaling of traction forces with the size of cohesive cell colonies. Phys. Rev. Lett. 108 (19), 1-5 (2012).
- Banerjee, S., Marchetti, M. C. Substrate rigidity deforms and polarizes active gels. Euro Phys. Lett. 96 (2), 28003(2011).
- Edwards, C. M., Schwarz, U. S. Force localization in contracting cell layers. Phys. Rev. Lett. 107 (12), 128101(2011).
- Cesa, C., et al. Micropatterned silicone elastomer substrates for high resolution analysis of cellular force patterns. Rev. Sci. Instrum. 78 (3), 34301(2007).
- Wu, K. S., Van Osdol, W. W., Dauskardt, R. H. Mechanical And Microstructural Properties Of Stratum Corneum. Mater. Res. Soc. 724, 27-33 (2002).
- Yuan, Y., Verma, R. Measuring microelastic properties of stratum corneum. Colloids Surf. B. 48 (1), 6-12 (2006).
- Christensen, M. S., Hargens, C. W., Nacht, S., Gans, E. H. Viscoelastic properties of intact human skin: instrumentation, hydration effects, and the contribution of the stratum corneum. J Invest. Dermatol. 69 (3), (1977).
- Pailler-Mattei, C., Bec, S., Zahouani, H. In vivo measurements of the elastic mechanical properties of human skin by indentation tests. Med. Eng.Phys. 30 (5), 599-606 (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten