Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure et modélisation contractile séchage dans Human stratum corneum
Dans cet article
Résumé
Cet article décrit une méthode de quantification du comportement dynamique de séchage et les propriétés mécaniques de la couche cornée par la mesure à résolution spatiale des déplacements d'échantillons de tissus circulaires adhérant à un substrat en élastomère de séchage dans le plan. Cette technique peut être utilisée pour mesurer la façon dont les différents traitements chimiques modifient séchage et de tissus propriétés mécaniques.
Résumé
Stratum corneum (SC) est la couche de la peau la plus superficielle. Son contact avec l'environnement extérieur signifie que cette couche de tissu est soumis à la fois des agents de nettoyage et des variations quotidiennes de l'humidité ambiante; les deux pouvant modifier la teneur en eau du tissu. La réduction de la teneur en eau du dysfonctionnement de la barrière sévère ou des environnements de faible humidité peuvent altérer la rigidité de SC et provoquer une accumulation de contraintes de séchage. Dans des conditions extrêmes, ces facteurs peuvent provoquer une rupture mécanique du tissu. Nous avons établi une méthode à haut débit de quantifier les changements dynamiques dans les propriétés mécaniques du SC lors du séchage. Cette technique peut être utilisée pour quantifier les changements dans le comportement de séchage et les propriétés mécaniques du SC avec un nettoyant et hydratant traitements cosmétiques. Ceci est réalisé en mesurant les variations dynamiques de la résolution spatiale des déplacements d'échantillons de tissus circulaires adhérant à un substrat en élastomère de séchage dans le plan. Dans le plan des déplacements radiaux acquired au cours du séchage sont azimutale moyenne et muni d'un profil basé sur un modèle de contractilité élastique linéaire. Les changements dynamiques dans le stress de séchage et SC module d'élasticité peuvent ensuite être extraits à partir des profils de modèles ajustés.
Introduction
La couche la plus externe de l'épiderme ou la couche cornée (SC) est constituée de cellules de cornéocytes cohésives entourées par une matrice riche en lipides 1, 2. L'intégrité de la composition et la structure de SC est essentielle pour maintenir la fonctionnalité de barrière correcte 3, ce qui empêche l' invasion de micro - organismes et résiste à la fois des forces mécaniques et perte excessive d'eau 4. La capacité des produits de soins personnels pour maintenir ou dégrader la fonction barrière de la peau est d' un grand intérêt pour la santé de la peau et l'industrie cosmétique 5. L'application quotidienne des produits de soins personnels est connue pour modifier les propriétés mécaniques du SC 6, 7, 8. Par exemple, agents de surface contenus dans les nettoyants cosmétiques peuvent provoquer une augmentation significative du module d'élasticité et une accumulation decontraintes de séchage dans SC, l' augmentation de la propension du tissu à craquer 7, 9. La glycérine contenue dans presque tous les agents hydratants cosmétiques peut adoucir SC et de diminuer l'accumulation de contraintes de séchage 8, 10, 11, ce qui réduit la probabilité d' une rupture du tissu.
La méthode détaillée dans cet article est capable de quantifier le comportement de séchage dynamique et les propriétés mécaniques de séchage SC dans des environnements contrôlés 7, 8. Auparavant, cette technique a été démontrée pour être capable d'élucider l'effet de différents produits cosmétiques sur les changements dans le comportement dynamique de séchage et les propriétés mécaniques du tissu SC. Ce résultat est obtenu en quantifiant le rétrécissement induit par séchage du tissu humain SC adhérant à un substrat en élastomère souple, les déplacements de montage par un simple séchagemodèle de contractilité, puis extraire le module d'élasticité et séchage contrainte du profil équipée. Lorsque le test de plusieurs échantillons de SC est nécessaire, cette méthode offre une alternative plus rapide à tensometry uniaxial, utilise nettement moins de tissu et fournit plus physiologiquement séchage pertinent en empêchant l'évaporation de l'échantillon inférieure.
Access restricted. Please log in or start a trial to view this content.
Protocole
Une approbation exonéré (3002-13) d'effectuer des recherches en utilisant des échantillons de tissus de-identifiés en vertu du ministère de la Santé et de la réglementation des services à la personne, 45 CFR 46,101 (b) (4) a été accordée. peau pleine épaisseur est reçue d'une chirurgie élective. Dans cet article, la source de tissu est de 66 ans, sein chez la femme de race blanche.
1. Préparation de Lamelles Elastomer Coated
- Dans un flacon de 20 ml en verre, mélanger 0,107 g de Sylgard 184 agents de durcissement avec 5,893 g de base. La masse totale du mélange est de 6 g avec une base pour durcir le rapport de l'agent de 55: 1.
- Après mélange avec une baguette de verre pour assurer l'homogénéité, placer le flacon en verre dans une chambre à vide et dégazer pour éliminer toutes les bulles.
- Placez une lamelle de verre (55 mm x 25 mm) dans le centre de la tournette. Ajouter ~ 1 mL du mélange sur le centre de la lamelle. Utiliser une pipette de 5000 pi avec l'extrémité coupée avec des ciseaux. manteau de Spin la lamelle à 2000 rpm pendant 60 s.
- Répétez cette process pour créer 5-6 substrats.
- Cure les lamelles dans un four pendant 12 h à 60 ° C.
- Utilisez une lame de rasoir pour enlever partiellement le film d'élastomère à partir d'un substrat sacrificiel. Utilisez un marqueur indélébile pour marquer la face supérieure du film d'élastomère et le verre exposé.
- Monter l'échantillon sur un microscope inversé et utiliser un accessoire de mise au point à distance pour enregistrer la différence de hauteur z entre les plans focaux des deux marques. Ceci correspond à l'épaisseur du substrat en élastomère, h.
2. Préparation du stratum corneum
- Utilisez un bain d'eau ou d'une plaque d'agitation chauffée pour chauffer un récipient en verre à moitié rempli d'eau déminéralisée (DW) à 60 ° C. A l'intérieur d'une enceinte de sécurité biologique, immerger la peau humaine pleine épaisseur dans l'eau pendant 4 min.
- transférer immédiatement l'échantillon de peau dans un bécher contenant DW refroidi à <10 ° C pendant 4 min. La moitié de remplir le bécher minimise les éclaboussures de matières infectieuses.
- Retirer la peau du bêcher, dans une boîte de Pétri, et doucement isoler l'épiderme en utilisant une paire de pinces de tissus nez courbées.
- Placez l'épiderme isolé côté basale dans une boîte de Pétri bordée de gaze. Assurez-vous de la couche basale est entièrement en contact avec la gaze.
- Faire tremper la gaze dans 0,25% (poids / volume) de type pancréas de porc solution IX-S trypsine dissous dans 0,1 M de tampon phosphate salin pendant 6-8 h à température ambiante. Ajouter seulement assez de la trypsine dans le récipient pour mouiller la gaze.
- Soulevez la gaze avec des pincettes de tissus et de flotter dans un récipient partiellement rempli de DW. Tirez doucement sur le SC pour le séparer de la gaze.
- Laver la couche cornée 3-4 fois dans DW pour enlever le tissu épidermique résiduel qui reste attaché à la SC.
- Laisser flotter le SC isolé dans une solution de 0,4% Glycine max (soja), inhibiteur de la trypsine dans le DW. Utiliser un agitateur de plaque pour agiter le tissu pendant 10 min.
- Float SC dans une boîte de Pétri partiellementrempli de DW. Utiliser un agitateur de plaque pour agiter le tissu pendant 10 min.
- Sécher la feuille de SC isolé sur un maillage en plastique ultra-fine pendant 48 h à température ambiante (25 ° C, humidité relative de 40% (HR)).
- Séparez le SC de la maille et découper des échantillons circulaires de rayon R = 3 mm individuels à l'aide d'un poinçon de trou circulaire. Marquer le centre de la face outmost avec une petite marque spirale en utilisant un marqueur indélébile. Cela fournit un repère visuel pour la reconnaissance de la face supérieure de la SC.
NOTE: La marque indélébile doit être appliqué dans le centre de l'échantillon, où les déformations de séchage seront plus petits. Cela permettrait de minimiser l'impact du marqueur sur les profils de déplacement de séchage enregistrés.
3. Exemple de traitement et de dépôt
- Agiter échantillons SC pendant 30 min dans 15 ml DW contenant 90 ul de perles de marqueur fluorescent (505/515 nm, 1 um de diamètre, carboxylate modifié). Ce dépôts perles sur la surface de SC
NOTE: Bien que le dépôt de lnuméros arge de perles sur le SC peuvent sécher légèrement lente par rapport à des échantillons sans perles présente 12, il permettra de maximiser la résolution spatiale des champs de déformation dans le plan que l' on peut obtenir par la suite. Le choix du volume de perles ajouté devrait donc être faite ad hoc. - Retirer les échantillons de SC et les placer dans une boîte de Pétri partiellement rempli de DW.
- immerger partiellement dans un substrat DW à un angle faible de 15 à 30 °.
- Épingler un bord de l'échantillon SC flottant à la ligne de contact entre le substrat et l'interface de l'eau. retirer le substrat verticalement de l'eau sera facilement plastifier l'échantillon SC sur le substrat sans rides ou les bulles d'air piégées.
- Répétez l'étape 3.4 de placer jusqu'à 6 échantillons de SC sur chaque substrat. Laissez au moins un écart de 2-3 mm entre les échantillons et éviter échantillon lamination près du bord du substrat. Cela empêche le séchage d'un échantillon influençant les déplacements de séchage dans un autre.
- Sécher les échantillons de SC montés dans des conditions de laboratoire pendant 60 min. Cela permet à l'eau résiduelle entre le SC et le substrat à évaporer et assure une adhérence tissulaire complète.
Remarque: À ce stade, les échantillons SC peut être traité avec un des formulations cosmétiques 7 chimique ou 8 en plaçant les substrats à l' envers dans une solution souhaitée pendant une période de temps requise. Répétez l'étape 3.6, une fois l'étape de traitement est effectuée. Après séchage, l'adhérence incomplète des échantillons SC sur le substrat peut être vérifiée en utilisant la microscopie lumière transmise. bulles piégées sous l'échantillon de SC ou les bords délaminées formeront des variations de contraste claires dans l'échantillon avec des bords bien définis. - Créer une chambre d'humidité en plaçant une boîte de Petri partiellement rempli d'eau dans un récipient hermétiquement fermé.
- Placer les substrats dans la chambre pendant 24 heures pour atteindre l'équilibre à une humidité relative de 99%. Ne pas placer les substrats dans le Petri plat.
4. Microscope contrôle de l'environnement
- Réaliser le contrôle des conditions environnementales grâce à un système de contrôle d'humidité relié à une chambre de perfusion pouvant être monté de microscope. Les détails du système de régulation d'humidité sont fournies en allemand et al. (2013) 7 et Liu et l' allemand (2015) 8.
- Monter le substrat sur le microscope, placer la chambre de perfusion sur le substrat et sceller les bords de la chambre de perfusion à l'élastomère à l'aide de graisse à vide.
- Une fois monté, équilibrer air interne à 99% d'humidité relative avant l'expérimentation. Ceci permet d'éviter l'évaporation de l'eau avant l'expérimentation. Une fois l'imagerie dans les sections 5 ou 7 a commencé, de réduire l'humidité de l'air interne à la valeur souhaitée.
NOTE: Dans cet article, les échantillons SC sont séchés à 25% HR
5. Imagerie en avion Séchage Désalignements
- Acquérir les images d'échantillons SC en utilisant un microsco inversépe avec 1X objectif. Excite billes fluorescentes en utilisant un moteur de lumière avec filtre FITC (émission passe-bande 503-530 nm). Plusieurs échantillons peuvent être visualisés successivement tout au long de séchage en utilisant une étape de xy automatisé.
- fluorescent d'enregistrement et des images lumineuses transmises à l'aide d'une caméra CCD numérique à une résolution de 1.392 x 1.040 pixels. Le champ de vision de chaque image est 8,98 x 6,71 mm, ce qui permet une seule image pour capturer un échantillon de SC complète. Prendre des images à une fréquence de 10 minutes pendant 16 heures.
6. Préparation du support pour la mesure d'épaisseur
- Dans une hotte chimique, placer 1 ml de silane (3-aminopropyltriéthoxysilane; ≥98%) dans un petit bouchon en plastique. Placez des substrats en élastomère de la section 1 et le bouchon dans un récipient fermé pendant 5 h. Ne pas laisser les substrats à venir directement en contact avec le silane.
- Ajouter 5 mg d'EDC (N - (3-diméthylaminopropyl) - N chlorhydrate -ethylcarbodiimide; ≥99%) dans un tube de 1,5 ml. Ajouter 500 ul de DW à EDC. Agiter la solution pendant 10 secondes avec un mélangeur à vortex.
- Ajouter 0,076 g de tétraborate de sodium et 0,1 g d'acide borique dans 20 ml DW. Mélanger à l'aide d'un agitateur magnétique à 70 ° C (1 h). Ajouter de l'acide borique jusqu'à ce que le pH est de 7,4.
- Ajouter 20 ml de tampon borate à un tube de 50 ml de la centrifugeuse. Ajouter 60 pi de billes de 1 um (535/575 nm, carboxylate modifié) dans le tampon borate. Enfin, ajouter 200 pi de solution EDC à la bouteille. Agiter le tube pour mélanger la solution de talon, puis verser dans un diamètre boîte de Pétri de 10 cm.
- Retirez les substrats silanée du récipient et placez-les élastomère côté film vers le bas dans la solution de talon. Faites-le lentement pour éviter que des bulles se coincent. Deux substrats conviendront dans chaque boîte de Pétri.
- Laisser flotter substrats dans la solution de talon pendant 45 min.
- Utilisez des pinces pour enlever les substrats de la solution de talon, puis rincer à DW pour éliminer les billes non liées.
- Air sécher les substrats. Souffler de l'air comprimé surla surface du film d'élastomère réduit la formation de taches d'eau.
- Sceller les substrats dans une boîte opaque pour empêcher la photo-blanchiment des perles jusqu'à ce que le dépôt de l'échantillon de SC.
7. Imaging Epaisseur de SC
- échantillons de dépôt de SC sur un substrat en utilisant la section 3. Cependant, effectuer l'étape 3.1 sans ajouter des perles fluorescentes à la DW. En outre, appliquer une goutte de 5 pi de solution non diluée marqueur fluorescent de talon (505/515 nm à 0,1 um de diamètre) sur la surface de chaque échantillon SC déposé à la pipette avant la fin de l'étape 3.6.
- Mettre en place des mesures d'épaisseur SC à l'aide du microscope avec 40X objectif. Mesurer l'épaisseur des échantillons SC au fil du temps en utilisant un accessoire de mise au point à distance pour enregistrer la différence de hauteur z entre les deux plans focaux de la couche de perles situés à l'interface SC-substrat et la face supérieure du SC.
- Mesurer l'épaisseur des 3 régions de chaque échantillon SC au cours d'une période de séchage 3 h. L'épaisseurdes échantillons SC atteint une valeur d'état stable dans ce laps de temps 8.
8. Quantifier et Déformation Tissue Modélisation
- Utiliser l' image particules velocimetry 13 pour obtenir résolus spatialement déplacements de séchage dans le plan des images fluorescentes à chaque étape de temps enregistré.
- Utilisez MATLAB pour obtenir des profils de déplacement radial et azimutal azimutale moyennées à partir du champ de chaque échantillon de SC à symétrie radiale de déplacement.
NOTE: Un exemple ensemble de données (intitulée 'd.mat') et le code MATLAB (intitulé «PIV-processing.m ') qui assure à la fois cette étape et l'étape 8.3 a été fourni dans les informations supplémentaires. - Monter les profils de déplacement radial à un modèle 7, 8, 14, 15, 16 décrivant le séchage SC comme un circula élastique linéaire rétrécissementr disque de temps épaisseur h SC, le rayon R et le module d' élasticité, E , SC, adhérant à un substrat déformable élastiquement avec un module d' élasticité variant E. On suppose SC a un ratio de Poisson bien définie et constante, ν SC = 0,4 7 , 8. Obtenir convient le mieux en utilisant une approche des moindres carrés minimum.
NOTE: Le modèle utilisé pour le montage décrit des déplacements radiaux en termes de fonctions de Bessel modifiées sont: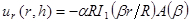 (1)
(1)
avec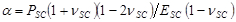 ,
,  et
et 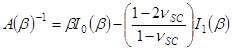
Le terme correspond à une profondeur de pénétration donnée par,
correspond à une profondeur de pénétration donnée par,  .
. 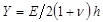 désigne un paramètre substrat de rigidité; valides lorsque les échantillons sont beaucoup plus grande que l'épaisseur du substrat. Ici, les paramètres,
désigne un paramètre substrat de rigidité; valides lorsque les échantillons sont beaucoup plus grande que l'épaisseur du substrat. Ici, les paramètres, 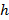 et
et 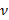 désignent respectivement l'épaisseur du substrat du rapport de Poisson. Le coefficient de Poisson du substrat en élastomère de silicone 17 est ν = 0,5.
désignent respectivement l'épaisseur du substrat du rapport de Poisson. Le coefficient de Poisson du substrat en élastomère de silicone 17 est ν = 0,5. - Obtenir les paramètres du modèle a et β à chaque pas de temps à partir des moindres carrés de l'équation (1) au profil de déplacement radial.
- Employez le paramètre β approprié pour obtenir SC module d' élasticité, E SC, en utilisant l'expression,
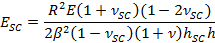
- Utiliser les paramètres d'ajustement α pour obtenir le temps de séchage variant contractile stress, PSC, en utilisant l'expression,
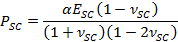
- Employez le paramètre β approprié pour obtenir SC module d' élasticité, E SC, en utilisant l'expression,
Access restricted. Please log in or start a trial to view this content.
Résultats
Figure 1 (a) montre une image fluorescente représentant d'un échantillon de SC revêtu de billes fluorescentes (section 3). L'image de lumière correspondant transmis de l'échantillon est représenté sur la figure 1 (b) recouvert d'un terrain de carquois des déplacements de séchage spatialement résolus qui se forment après 16 h de séchage à 25% HR En raison de la symétrie circulaire des échantillons, ces déplacements peuvent ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans cet article, nous décrivons une technique qui peut être utilisée pour mesurer le comportement de séchage dynamique et les propriétés mécaniques de SC humaine. Des études antérieures ont démontré que cette technique peut être utilisée pour quantifier les effets des conditions environnementales et des produits chimiques couramment utilisés dans les nettoyants et hydratants cosmétiques sur le comportement de séchage dynamique SC 7, 8. Il y a un...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Silicone elastomer base | Dow-Corning | 1064291 | |
| Silicone elastomer Curing Agent | Dow-Corning | 1015311 | |
| FluoSpheres Carboxylate 0.1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8803 | |
| FluoSpheres Carboxylate 1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8823 | |
| FluoSpheres Carboxylate 1 µm nile red fluorescent 535/575 | Thermo Fisher | F8819 | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T6567 | |
| Trypsin inhibitor type II-s | Sigma-Aldrich | T9128 | |
| (3-aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Boric acid | Sigma-Aldrich | B0294 | |
| Phosphate buffered saline | Sigma-Aldrich | P7059 | |
| N-(3-Dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride | Sigma-Aldrich | E7750 | |
| Vortexer mixer | VWR | 58816-123 | |
| 6 mm diameter hole punch | Sigma-Aldrich | Z708860 | |
| SOLA 6-LCR-SB | Lummencor light engine | No.3526 | |
| Cfi Plan Achro Uw 1X Objective | Nikon Plan UW | MRL00012 | |
| CFI Plan Fluor 40X Oil Objective 1.3 na - 0.20 mm wd | Nikon Plan Fluor | MRH01401 | |
| Nikon Eclipse Ti-U inverted microscope | Nikon | MEA53200 | |
| Clara-E Camera | Andor | DR-328G-C02-SIL | |
| Remote Focus Attachment E-RFA Ergo Design | Nikon | 99888 | |
| Ti-S-E Motorized Stage | Nikon | MEC56110 |
Références
- Van Hal, D., Jeremiasse, E., Junginger, H. E., Spies, F., Bouwstra, J. Structure of fully hydrated human stratum corneum: a freeze-fracture electron microscopy study. J. Invest. Dermatol. 106 (1), 89-95 (1996).
- Norlén, L., Al-Amoudi, A. Stratum corneum keratin structure, function, and formation: the cubic rod-packing and membrane templating model. J. Invest. Dermatol. 123 (4), 715-732 (2004).
- Liu, X., Cleary, J., German, G. K. The global mechanical properties and multi-scale failure mechanics of heterogeneous human stratum corneum. Acta Biomater. , (2016).
- Geerligs, M. Skin layer mechanics. , Technische Universiteit Eindhoven. (2010).
- Farage, M. S., Miller, K. W., Maibach, H. I. Textbook of Aging Skin. , (2010).
- Levi, K., Kwan, A., Rhines, A. S., Gorcea, M., Moore, D. J., Dauskardt, R. H. Emollient molecule effects on the drying stresses in human stratum corneum. Br. J. Dermatol. 163 (4), 695-703 (2010).
- German, G. K., Pashkovski, E., Dufresne, E. R. Surfactant treatments influence drying mechanics in human stratum corneum. J. Biomech. 46 (13), 2145-2151 (2013).
- Liu, X., German, G. K. The effects of barrier disruption and moisturization on the dynamic drying mechanics of human stratum corneum. J. Mech. Behav. Biomed. Mater. 49 (13), 80-89 (2015).
- Levi, K., Weber, R. J., Do, J. Q., Dauskardt, R. H. Drying stress and damage processes in human stratum corneum. Int. J. Cosmet. Sci. 32 (4), 276-293 (2010).
- Levi, K., et al. Effect of glycerin on drying stresses in human stratum corneum. J. Dermatol. Sci. 61, 129-131 (2011).
- Fluhr, J. W., Darlenski, R., Surber, C. Glycerol and the skin: holistic approach to its origin and functions. Br. J. Dermatol. 159 (1), 23-34 (2008).
- German, G. K., et al. Heterogeneous drying stresses in stratum corneum. Biophys. J. 102 (11), 2424-2432 (2012).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Exp. Fluids. 10 (4), 181-193 (1991).
- Mertz, A. F., et al. Scaling of traction forces with the size of cohesive cell colonies. Phys. Rev. Lett. 108 (19), 1-5 (2012).
- Banerjee, S., Marchetti, M. C. Substrate rigidity deforms and polarizes active gels. Euro Phys. Lett. 96 (2), 28003(2011).
- Edwards, C. M., Schwarz, U. S. Force localization in contracting cell layers. Phys. Rev. Lett. 107 (12), 128101(2011).
- Cesa, C., et al. Micropatterned silicone elastomer substrates for high resolution analysis of cellular force patterns. Rev. Sci. Instrum. 78 (3), 34301(2007).
- Wu, K. S., Van Osdol, W. W., Dauskardt, R. H. Mechanical And Microstructural Properties Of Stratum Corneum. Mater. Res. Soc. 724, 27-33 (2002).
- Yuan, Y., Verma, R. Measuring microelastic properties of stratum corneum. Colloids Surf. B. 48 (1), 6-12 (2006).
- Christensen, M. S., Hargens, C. W., Nacht, S., Gans, E. H. Viscoelastic properties of intact human skin: instrumentation, hydration effects, and the contribution of the stratum corneum. J Invest. Dermatol. 69 (3), (1977).
- Pailler-Mattei, C., Bec, S., Zahouani, H. In vivo measurements of the elastic mechanical properties of human skin by indentation tests. Med. Eng.Phys. 30 (5), 599-606 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon