È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione e modellazione contrattile asciugatura in Human strato corneo
In questo articolo
Riepilogo
Questo articolo descrive un metodo per quantificare il comportamento dinamico di essiccazione e le proprietà meccaniche dello strato corneo misurando spazialmente risolta nel piano spostamenti di essiccazione dei campioni di tessuto circolari aderito ad un substrato elastomero. Questa tecnica può essere usata per misurare la diversa trattamenti chimici altera essiccazione e tissutali proprietà meccaniche.
Abstract
Strato corneo (SC) è lo strato più superficiale della pelle. Il suo contatto con l'ambiente esterno significa che questo strato di tessuto è sottoposto ad entrambe detergenti e variazioni giornaliere umidità ambientale; entrambi i quali possono alterare il contenuto di acqua del tessuto. Riduzione del contenuto di acqua da una grave disfunzione barriera o ambienti di bassa umidità possono alterare SC rigidità e causare un accumulo di tensioni di essiccazione. In condizioni estreme, questi fattori possono causare la rottura meccanica del tessuto. Abbiamo stabilito un metodo ad alta produttività per quantificare cambiamenti dinamici delle proprietà meccaniche del SC su essiccamento. Questa tecnica può essere impiegata per quantificare i cambiamenti nel comportamento di asciugatura e le proprietà meccaniche di SC con trattamenti detergente e idratante cosmetici. Questo risultato è ottenuto misurando le variazioni dinamiche spazialmente risolte nel piano spostamenti di essiccazione dei campioni di tessuto circolari aderito ad un substrato elastomero. In-Plane spostamenti radiali ACQuired durante l'essiccazione sono azimutalmente in media e dotati di un profilo basato su un modello contrattilità elastico lineare. cambiamenti dinamici nella sollecitazione di essiccazione e SC modulo elastico possono essere estratte dai profili modello adattato.
Introduzione
Il strato più esterno dell'epidermide o strato corneo (SC) comprende cellule corneociti coesive circondate da una ricca matrice lipidica 1, 2. L'integrità strutturale composizione e di SC è essenziale per mantenere la funzionalità di barriera corretta 3, che impedisce l'invasione da microrganismi e resiste sia le forze meccaniche e eccessiva perdita di acqua 4. La capacità dei prodotti di cura personale per mantenere o degradare la funzione di barriera della pelle è di grande interesse per l'assistenza sanitaria della pelle e l'industria cosmetica 5. L'applicazione quotidiana di prodotti per la cura personale è noto per alterare le proprietà meccaniche del SC 6, 7, 8. Per esempio, tensioattivi contenuti nei detergenti cosmetici possono provocare aumenti significativi del modulo elastico e un accumulo disollecitazioni di essiccazione in SC, aumentando la propensione del tessuto per rompere 7, 9. Glicerolo contenuta in quasi tutti idratanti cosmetici può ammorbidire SC e diminuire l'accumulo di sollecitazioni asciugatura 8, 10, 11, riducendo il rischio di rottura del tessuto.
Il metodo descritto in questo articolo è in grado di quantificare il comportamento di essiccazione dinamica e le proprietà meccaniche di SC essiccazione in ambienti controllati 7, 8. In precedenza, questa tecnica è stata dimostrata per essere in grado di chiarire l'effetto di diversi prodotti cosmetici sui cambiamenti nel comportamento dinamico di essiccazione e le proprietà meccaniche del tessuto SC. Ciò si ottiene quantificazione ritiro essiccamento indotta del tessuto SC umana aderito a un substrato elastomero morbido, sagomata spostamenti essiccazione con un semplicemodello di contrattilità, e poi estrarre il modulo elastico e l'essiccazione lo stress dal profilo montato. Quando è richiesta la sperimentazione di campioni multipli SC, questo metodo offre una più rapida alternativa tensometry monoassiale, utilizza significativamente meno tessuto e fornisce più fisiologicamente rilevanti asciugatura impedendo l'evaporazione dal lato inferiore del campione.
Access restricted. Please log in or start a trial to view this content.
Protocollo
L'approvazione esenti (3002-13) a fini di ricerca utilizzando campioni di tessuto de-identificato ai sensi del Dipartimento della Salute e dei regolamenti Servizi Umani, 45 CFR 46,101 (b) (4) è stato concesso. pelle tutto spessore viene ricevuto da un intervento chirurgico elettivo. In questo articolo, l'origine del tessuto è 66-year-old seno femminile caucasica.
1. Preparazione di vetrini elastomero rivestite
- In un ml Fiala 20 di vetro, mescolare 0,107 g di Sylgard agente 184 indurimento con 5,893 g di base. La massa totale della miscela è di 6 g di una base per curare rapporto agente di 55: 1.
- Dopo la miscelazione con una bacchetta di vetro per garantire omogeneità, posizionare la fiala di vetro in una camera a vuoto e degassamento per rimuovere tutte le bolle.
- Posizionare un vetro di copertura antiscivolo (55 mm x 25 mm) al centro di un coater rotazione. Aggiungere ~ 1 ml della miscela sul centro del coperchio antiscivolo. Utilizzare una pipetta 5000 microlitri con l'estremità tagliata con le forbici. cappotto Spin la copertura antiscivolo a 2.000 rpm per 60 s.
- Ripetere questo process per creare 5-6 substrati.
- Curare il cover-scivola in un forno per 12 ore a 60 ° C.
- Utilizzare una lama di rasoio per rimuovere parzialmente la pellicola di elastomero da un substrato sacrificale. Utilizzare un pennarello indelebile per segnare la parte superiore del film elastomero e il vetro esposto.
- Montare il campione su un microscopio invertito e utilizzare un accessorio di messa a fuoco remota per registrare la differenza di z-altezza tra i piani focali dei due marchi. Ciò corrisponde allo spessore del substrato elastomero, h.
2. Preparazione del strato corneo
- Usare un bagno d'acqua o piatto mescolare riscaldato per riscaldare un bicchiere di vetro mezzo riempito con acqua deionizzata (DW) a 60 ° C. All'interno di una cappa di sicurezza biologica, immergere l'intero spessore della pelle umana in acqua per 4 min.
- Trasferire immediatamente il campione di pelle in un bicchiere contenente DW raffreddata a <10 ° C per 4 min. Metà riempire il bicchiere riduce al minimo gli spruzzi di materiale a rischio biologico.
- Togliere la pelle dal bicchiere, posto in una capsula di Petri, e delicatamente isolare l'epidermide con un paio di pinzette tessuto naso piegate.
- Posizionare l'epidermide isolati lato basale verso il basso in una capsula di Petri rivestito con una garza. Assicurarsi che il livello basale è completamente a contatto con la garza.
- Immergere la garza in un 0,25% (peso / volume) di tipo IX-S pancreas suino soluzione tripsina disciolti in 0,1 M tampone fosfato per 6-8 ore a temperatura ambiente. Aggiungere solo abbastanza tripsina nel contenitore per bagnare la garza.
- Sollevare la garza con una pinzetta tessuti e galleggiare in un contenitore parzialmente riempito con DW. Tirare delicatamente la SC per separarlo dalla garza.
- Lavare lo strato corneo 3-4 volte in DW per rimuovere il tessuto epidermico residuo che rimane attaccato alla SC.
- Float la SC isolato in una soluzione di 0,4% glycine max (soia) inibitore della tripsina in DW. Utilizzare un agitatore per agitare il tessuto per 10 min.
- Float SC in una capsula di Petri parzialmentepieno di DW. Utilizzare un agitatore per agitare il tessuto per 10 min.
- Essiccare il foglio isolato SC in una rete di plastica ultra-fine per 48 ore a temperatura ambiente (25 ° C, 40% umidità relativa (RH)).
- Separare il SC dalla rete e tagliare singoli campioni circolare R = 3 mm raggio utilizzando una foratura circolare. Segnare il centro del viso più esterno con un piccolo segno a spirale con un pennarello indelebile. Ciò fornisce un segnale visivo per riconoscere la parte superiore della SC.
NOTA: Il segno indelebile dovrebbe essere applicata nel centro del campione, in cui le deformazioni essiccazione sarà più piccola. Questo ridurrà al minimo l'impatto del marcatore su profili di spostamento di essiccazione registrati.
3. Il campione Trattamento e Deposizione
- Agitare campioni SC per 30 minuti in 15 ml DW contenente 90 microlitri perline marcatore fluorescente (505/515 nm, 1 micron di diametro, carbossilato-modificato). Questa depositi perline sulla superficie SC
NOTA: Durante la deposizione di lNumeri arge di perline sul SC possono marginalmente asciugatura lenta rispetto a campioni senza perline presenti 12, sarà massimizzare la risoluzione spaziale dei campi di deformazione nel piano che può essere successivamente ottenuti. La scelta del volume di perline aggiunto deve pertanto essere fatta ad hoc. - Rimuovere campioni SC e metterli in una capsula di Petri parzialmente riempito con DW.
- Parzialmente immergere un substrato nel DW con un angolo basso di 15-30 °.
- Pin un bordo del campione SC galleggiante al linea di contatto tra il substrato e l'interfaccia acqua. Verticalmente ritirare il substrato dall'acqua sarà uniformemente laminare campione SC al substrato senza grinze o bolle d'aria intrappolate.
- Ripetere il punto 3.4 per inserire fino a 6 campioni SC su ogni substrato. Lasciare almeno una distanza di 2-3 mm tra i campioni ed evitare campione laminazione vicino al bordo del substrato. Questo impedisce l'essiccazione di un campione che influenzano spostamenti di essiccazione in un altro.
- Asciugare i campioni SC montati in condizioni di laboratorio per 60 min. Questo permette di acqua residua tra la SC e il substrato di evaporare e garantisce l'adesione del tessuto completo.
NOTA: A questo punto, i campioni SC può essere trattato con una sostanza chimica o formulazioni cosmetiche 7, 8 posizionando i substrati a testa in giù in una soluzione desiderata per un periodo di tempo necessario. Ripetere il punto 3.6 una volta che la fase di trattamento viene eseguito. Dopo l'essiccazione, completa aderenza SC campioni al substrato può essere verificata mediante microscopia a luce trasmessa. la formazione di bolle sotto il campione SC o bordi delaminate formeranno variazioni di contrasto chiare nel campione con bordi ben definiti. - Creare una camera umida ponendo una piastra di Petri parzialmente riempito con acqua in un contenitore ermeticamente sigillato.
- Inserire substrati nella camera per 24 h equilibrare a un'umidità relativa del 99%. Non posizionare i substrati nel PetrI piatto.
4. Controllo Ambientale microscopio
- Ottenere controllo delle condizioni ambientali attraverso un sistema di controllo dell'umidità collegato ad un microscopio camera di perfusione montabile. Dettagli del sistema di controllo dell'umidità sono forniti in tedesco et al. (2013) 7 e Liu e tedesca (2015) 8.
- Montare il substrato sul microscopio, posizionare la camera di perfusione di sopra del substrato e sigillare bordi della camera di perfusione all'elastomero usando grasso per vuoto.
- Una volta montato, equilibrare aria interna al 99% di umidità relativa prima sperimentazione. Questo impedisce l'evaporazione di acqua prima sperimentazione. Una volta che l'imaging nelle sezioni 5 o 7 ha iniziato, ridurre l'umidità dell'aria interna al valore desiderato.
NOTA: In questo articolo, i campioni SC vengono essiccati al 25% di umidità relativa
5. Imaging in aereo essiccazione Spostamenti
- Acquisire le immagini dei campioni SC usando un microsco invertitaPE con lente obiettivo 1X. Excite perline fluorescenti che utilizzano un motore leggero con filtro FITC (503-530 nm banda passante di emissione). campioni multipli possono essere esposte in sequenza durante l'asciugatura utilizzando una fase xy automatizzato.
- Record fluorescenti e immagini luce trasmessa utilizzando una fotocamera digitale CCD con una risoluzione di 1.392 x 1.040 pixel. Il campo di vista di ogni immagine è 8,98 x 6,71 millimetri, permettendo una singola immagine per catturare un intero campione SC. Prendere immagini con una frequenza di 10 min per 16 h.
6. Preparazione del supporto per la misurazione spessore
- In una cappa, mettere 1 mL silano (3 amminopropiltrietossisilano; ≥98%) in qualche piccolo cappuccio di plastica. Posizionare substrati elastomerici dalla sezione 1 e il tappo in un contenitore sigillato per 5 h. Non permettere substrati vengono direttamente in contatto con il silano.
- Aggiungere 5 mg di EDC (N - (3-dimetilamminopropil) - N cloridrato -ethylcarbodiimide; ≥99%) in una provetta da 1,5 ml. Aggiungere 500 ml di DW al EDC. Agitare la soluzione per 10 s con un vortex.
- Aggiungere 0.076 g tetraborato di sodio e acido borico 0,1 g per 20 ml DW. Mescolare con un agitatore magnetico a 70 ° C (1 h). Aggiungere acido borico finché il pH è 7,4.
- Aggiungere 20 ml di tampone borato a un tubo da 50 ml centrifuga. Aggiungere 60 ml di 1 micron perline (535/575 nm, carbossilato modificato) al tampone borato. Infine, aggiungere 200 ml di soluzione EDC alla bottiglia. Agitare la provetta per miscelare soluzione tallone e poi versare in un diametro di 10 cm Petri.
- Rimuovere i substrati silanizzati dal contenitore e piazzale elastomero pellicola rivolto verso il basso nella soluzione tallone. Farlo lentamente per evitare le bolle di diventare intrappolati. Due substrati si inserisce in ogni piatto di Petri.
- Lasciare substrati a galleggiare nella soluzione tallone per 45 min.
- Utilizzare le pinzette per rimuovere i substrati dalla soluzione tallone, poi sciacquare in DW per rimuovere perline non legati.
- Far asciugare i substrati. Soffiando aria compressa sula superficie della pellicola di elastomero riduce la formazione di macchie d'acqua.
- Sigillare i substrati in una scatola opaca per impedire fotometabolismo delle perline fino deposizione del campione SC.
7. Imaging Spessore del SC
- depositare campioni SC su di un substrato utilizzando la sezione 3. Tuttavia, eseguire il passaggio 3.1 senza l'aggiunta di perline fluorescenti al DW. Inoltre, applicare una goccia 5 ml di soluzione non diluita fluorescente marcatore tallone (505/515 nm, 0,1 micron di diametro) alla superficie di ciascun campione SC depositato con una pipetta prima di completare passo 3.6.
- Stabilire misurazioni dello spessore SC utilizzando il microscopio con lente obiettivo 40X. Misurare lo spessore dei campioni SC nel tempo utilizzando un accessorio fuoco a distanza per registrare la differenza di z-altezza tra i due strati piani focali branello situati all'interfaccia SC-substrato e la parte superiore del SC.
- Misurare lo spessore di 3 regioni di ciascun campione SC su un periodo di asciugatura 3 h. Lo spessoredei campioni SC raggiunge un valore di stato stazionario entro questo lasso di tempo 8.
8. Quantificare e modellazione del tessuto Deformazione
- Utilizzare Particle Image Velocimetry 13 per ottenere risolta spazialmente nel piano spostamenti asciugatura dalle immagini fluorescenti ad ogni passo tempo registrato.
- Utilizzare MATLAB per ottenere profili radiali e spostamento azimutale azimutalmente mediati dal campo di spostamento di ciascun campione SC radialmente simmetrica.
NOTA: Un esempio di dati (titolo 'd.mat') e il codice MATLAB (intitolato 'PIV-processing.m') che esegue sia questo passo e passo 8.3 è stata fornita nelle informazioni supplementari. - Montare profili spostamento radiale ad un modello 7, 8, 14, 15, 16 descrivendo essiccamento SC come restringimento circula elastico linearer disco di tempo vario spessore, h SC, raggio, R, e modulo elastico, E SC, aderito a un substrato elastico deformabile con modulo elastico, E. assumere SC ha un rapporto di Poisson ben definita e costante, ν SC = 0,4 7 , 8. Ottenere meglio si adatta con un minimo di almeno approccio quadrati.
NOTA: Il modello utilizzato per il montaggio descrive spostamenti radiali in termini di funzioni di Bessel modificate sono: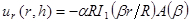 (1)
(1)
con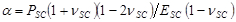 ,
,  e
e 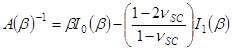
Il termine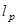 corrisponde a una profondità di penetrazione in,
corrisponde a una profondità di penetrazione in,  .
. 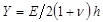 denota un parametro substrato rigidità; valido quando le dimensioni del campione sono molto maggiore dello spessore del substrato. Qui, i parametri,
denota un parametro substrato rigidità; valido quando le dimensioni del campione sono molto maggiore dello spessore del substrato. Qui, i parametri, 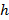 e
e 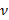 rispettivamente indicare lo spessore del substrato rapporto di Poisson. Il rapporto di Poisson del silicone elastomero substrato 17 è ν = 0,5.
rispettivamente indicare lo spessore del substrato rapporto di Poisson. Il rapporto di Poisson del silicone elastomero substrato 17 è ν = 0,5. - Ottenere parametri del modello alfa e β ad ogni passo volta dai minimi quadrati dell'equazione (1) al profilo spostamento radiale.
- Impiegare il parametro β raccordo per ottenere SC modulo elastico, e SC, utilizzando l'espressione,
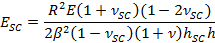
- Utilizzare montaggio α parametri per ottenere il tempo variabile contrattile asciugatura stress, PSC, utilizzando l'espressione,
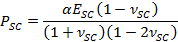
- Impiegare il parametro β raccordo per ottenere SC modulo elastico, e SC, utilizzando l'espressione,
Access restricted. Please log in or start a trial to view this content.
Risultati
Figura 1 (a) mostra un'immagine rappresentativa fluorescenza di un campione SC rivestito con perline fluorescenti (punto 3). La corrispondente luce trasmessa immagine del campione è mostrato nella Figura 1 (b) rivestito con una trama faretra di spostamenti essiccazione spazialmente risolti che formano dopo 16 h di essiccazione a 25% RH A causa della simmetria circolare dei campioni, tali spostamenti possono essere azimutalmente media. Figura...
Access restricted. Please log in or start a trial to view this content.
Discussione
In questo articolo, si descrive una tecnica che può essere usata per misurare il comportamento dinamico di essiccazione e le proprietà meccaniche del SC umana. Studi precedenti hanno dimostrato che questa tecnica può essere usata per quantificare gli effetti delle condizioni ambientali e prodotti chimici comunemente utilizzati in detergenti cosmetici e creme idratanti sul comportamento dinamico di essiccazione di SC 7, 8. Ci sono un certo numero di passaggi c...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Silicone elastomer base | Dow-Corning | 1064291 | |
| Silicone elastomer Curing Agent | Dow-Corning | 1015311 | |
| FluoSpheres Carboxylate 0.1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8803 | |
| FluoSpheres Carboxylate 1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8823 | |
| FluoSpheres Carboxylate 1 µm nile red fluorescent 535/575 | Thermo Fisher | F8819 | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T6567 | |
| Trypsin inhibitor type II-s | Sigma-Aldrich | T9128 | |
| (3-aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Boric acid | Sigma-Aldrich | B0294 | |
| Phosphate buffered saline | Sigma-Aldrich | P7059 | |
| N-(3-Dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride | Sigma-Aldrich | E7750 | |
| Vortexer mixer | VWR | 58816-123 | |
| 6 mm diameter hole punch | Sigma-Aldrich | Z708860 | |
| SOLA 6-LCR-SB | Lummencor light engine | No.3526 | |
| Cfi Plan Achro Uw 1X Objective | Nikon Plan UW | MRL00012 | |
| CFI Plan Fluor 40X Oil Objective 1.3 na - 0.20 mm wd | Nikon Plan Fluor | MRH01401 | |
| Nikon Eclipse Ti-U inverted microscope | Nikon | MEA53200 | |
| Clara-E Camera | Andor | DR-328G-C02-SIL | |
| Remote Focus Attachment E-RFA Ergo Design | Nikon | 99888 | |
| Ti-S-E Motorized Stage | Nikon | MEC56110 |
Riferimenti
- Van Hal, D., Jeremiasse, E., Junginger, H. E., Spies, F., Bouwstra, J. Structure of fully hydrated human stratum corneum: a freeze-fracture electron microscopy study. J. Invest. Dermatol. 106 (1), 89-95 (1996).
- Norlén, L., Al-Amoudi, A. Stratum corneum keratin structure, function, and formation: the cubic rod-packing and membrane templating model. J. Invest. Dermatol. 123 (4), 715-732 (2004).
- Liu, X., Cleary, J., German, G. K. The global mechanical properties and multi-scale failure mechanics of heterogeneous human stratum corneum. Acta Biomater. , (2016).
- Geerligs, M. Skin layer mechanics. , Technische Universiteit Eindhoven. (2010).
- Farage, M. S., Miller, K. W., Maibach, H. I. Textbook of Aging Skin. , (2010).
- Levi, K., Kwan, A., Rhines, A. S., Gorcea, M., Moore, D. J., Dauskardt, R. H. Emollient molecule effects on the drying stresses in human stratum corneum. Br. J. Dermatol. 163 (4), 695-703 (2010).
- German, G. K., Pashkovski, E., Dufresne, E. R. Surfactant treatments influence drying mechanics in human stratum corneum. J. Biomech. 46 (13), 2145-2151 (2013).
- Liu, X., German, G. K. The effects of barrier disruption and moisturization on the dynamic drying mechanics of human stratum corneum. J. Mech. Behav. Biomed. Mater. 49 (13), 80-89 (2015).
- Levi, K., Weber, R. J., Do, J. Q., Dauskardt, R. H. Drying stress and damage processes in human stratum corneum. Int. J. Cosmet. Sci. 32 (4), 276-293 (2010).
- Levi, K., et al. Effect of glycerin on drying stresses in human stratum corneum. J. Dermatol. Sci. 61, 129-131 (2011).
- Fluhr, J. W., Darlenski, R., Surber, C. Glycerol and the skin: holistic approach to its origin and functions. Br. J. Dermatol. 159 (1), 23-34 (2008).
- German, G. K., et al. Heterogeneous drying stresses in stratum corneum. Biophys. J. 102 (11), 2424-2432 (2012).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Exp. Fluids. 10 (4), 181-193 (1991).
- Mertz, A. F., et al. Scaling of traction forces with the size of cohesive cell colonies. Phys. Rev. Lett. 108 (19), 1-5 (2012).
- Banerjee, S., Marchetti, M. C. Substrate rigidity deforms and polarizes active gels. Euro Phys. Lett. 96 (2), 28003(2011).
- Edwards, C. M., Schwarz, U. S. Force localization in contracting cell layers. Phys. Rev. Lett. 107 (12), 128101(2011).
- Cesa, C., et al. Micropatterned silicone elastomer substrates for high resolution analysis of cellular force patterns. Rev. Sci. Instrum. 78 (3), 34301(2007).
- Wu, K. S., Van Osdol, W. W., Dauskardt, R. H. Mechanical And Microstructural Properties Of Stratum Corneum. Mater. Res. Soc. 724, 27-33 (2002).
- Yuan, Y., Verma, R. Measuring microelastic properties of stratum corneum. Colloids Surf. B. 48 (1), 6-12 (2006).
- Christensen, M. S., Hargens, C. W., Nacht, S., Gans, E. H. Viscoelastic properties of intact human skin: instrumentation, hydration effects, and the contribution of the stratum corneum. J Invest. Dermatol. 69 (3), (1977).
- Pailler-Mattei, C., Bec, S., Zahouani, H. In vivo measurements of the elastic mechanical properties of human skin by indentation tests. Med. Eng.Phys. 30 (5), 599-606 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon