Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение и моделирование Сократительная Сушка в роговом слое кожи человека
В этой статье
Резюме
В данной статье описывается метод количественной оценки динамических характеристик сушки и механические свойства рогового слоя путем измерения с пространственным разрешением в плоскости сушки перемещения образцов ткани круговыми привязанных к эластомерной подложке. Этот метод может быть использован для измерения, как различные виды химической обработки изменяют высыхание и ткани механические свойства.
Аннотация
Роговой (SC) является наиболее поверхностный слой кожи. Его контакт с внешней средой означает, что этот слой ткани подвергается обоим очистительных средств и суточных колебаний в окружающей влажности; оба из которых могут изменить содержание воды в ткани. Снижение содержания воды от тяжелой барьерной дисфункции или низкой влажности может изменять жесткость SC и вызвать накопление сушильных напряжений. В экстремальных условиях, эти факторы могут привести к механическому разрыву ткани. Мы создали метод с высокой пропускной способностью количественной оценки динамических изменений в механических свойствах SC при сушке. Этот метод может быть использован для количественной оценки изменений в поведении сушки и механические свойства SC с косметическим моющим средством и увлажняющее средство лечения. Это достигается путем измерения динамических изменений в пространственно решенных плоскостных сушильных перемещений образцов круговых тканей, прилипших к эластомерным субстратом. В плоскости радиальных перемещений ПОЛУЧuired во время сушки азимутально усредненные и оснащены профилем на основе линейной упругой модели сократимости. Динамические изменения в сушильном стресса и SC модуля упругости можно извлечь из профилей подобранной модели.
Введение
Наружный самый слой эпидермиса, или роговой слой (SC) , состоит из липких клеток корнеоцитов , окруженных богатой липидами матрицей 1, 2. Состав и структурная целостность СК имеет важное значение для поддержания правильного функционирования барьера 3, который предотвращает вторжение от микроорганизмов и противостоит как механические силы и чрезмерную потерю воды 4. Способность продуктов личной гигиены для поддержания или ухудшать функцию барьера кожи представляет большой интерес для кожи здравоохранения и косметической промышленности 5. Ежедневное применение средств личной гигиены , как известно, изменяют механические свойства SC 6, 7, 8. Например, поверхностно-активные вещества, содержащиеся в косметических моющих средств может привести к значительному увеличению модуля упругости и наращиваниесушильные напряжения в СК, увеличение склонности ткани к треснуть 7, 9. Глицерин содержится почти во всех косметических увлажняющих средств может смягчить SC и уменьшить накопление сушильных напряжений 8, 10, 11, уменьшая вероятность разрыва ткани.
Подробно описано в данной статье метод позволяет количественной оценки динамических характеристик сушки и механические свойства SC сушки в контролируемых средах 7, 8. Ранее эта техника была продемонстрирована быть способным выяснении влияния различных косметических продуктов на изменения в динамическом режиме сушки и механические свойства SC ткани. Это достигается с помощью количественного анализа сушильно-индуцированной усадки ткани SC человека приклеена к подложке из мягкого эластомера, подгонка сушильных смещениях с простымсократимость модель, а затем извлечения модуля упругости и сушки напряжение от подогнанной профиля. Когда требуется тестирование нескольких образцов SC, этот способ предлагает более быстрый альтернативой одноосного тензометрии, использует значительно меньше тканей и обеспечивает более физиологически соответствующую сушку путем предотвращения испарения с образца нижней стороны.
протокол
Освобожденные утверждение (3002-13) для проведения исследований с использованием образцов обезличенной ткани в соответствии с Департаментом здравоохранения и социальных служб США правила, 45 CFR 46,101 (б) (4) была удовлетворена. Полная толщина кожи получена от плановой операции. В этой статье источник ткани 66-летний кавказских женской груди.
1. Получение Эластомер с нанесенным покровные
- В стеклянную пробирку емкостью 20 мл, смесь 0,107 г Sylgard 184 отвердителем с 5.893 г основания. Общая масса смеси составляет 6 г основанием с отверждением отношение агента в 55: 1.
- После смешивания стеклянной палочкой для обеспечения однородности, поместите флакон стекла в вакуумной камере и Дега, чтобы удалить все пузырьки.
- Поместите стеклянную крышку скольжения (55 мм х 25 мм) в центре спин для нанесения покрытий. Добавить ~ 1 мл смеси на центр крышки скольжения. Используйте 5000 мкл пипетки с конца отрезать ножницами. Спин пальто покрытие скольжению при 2000 оборотах в минуту в течение 60 сек.
- Повторите этот рrocess для создания 5-6 субстратов.
- Лечение Сокрытие промахов в печи в течение 12 ч при температуре 60 ° C.
- Используйте лезвие, чтобы частично удалить эластомерной пленки из жертвенного подложки. Используйте несмываемый маркер, чтобы отметить Topside эластомерного пленки и облученной стекла.
- Установите образец на инвертированный микроскоп и использовать удаленный фокус аксессуар для записи разницу в г высоты между координационными плоскостями двух марок. Это соответствует толщине эластомера подложки, ч.
2. Получение рогового слоя
- С помощью водяной бани или подогретой мешалка для нагревания стеклянный стакан, наполовину заполненный деионизованной водой (DW) до 60 ° C. Внутри бокса биологической безопасности, погрузить всю толщину кожи человека в воде в течение 4 мин.
- Немедленно перенести образец кожи в химический стакан, содержащий DW охлаждают до <10 ° С в течение 4 мин. Половина наполнения стакана минимизирует разбрызгивание биологически опасными материалами,
- Удалить кожу из стакана, место в чашке Петри, и аккуратно изолировать эпидермис с помощью пары изогнутых пинцетов обнюханными ткани.
- Поместите изолированном эпидермисе базальной стороной вниз в чашку Петри выложены марлю. Убедитесь, что базальный слой полностью контактирует с марлей.
- Замачивание марлю в 0,25% (вес / объем) типа IX-S поджелудочной железы свиньи раствора трипсина, растворенного в 0,1 М фосфатном буферном солевом растворе в течение 6-8 ч при комнатной температуре. Добавьте только достаточное количество трипсина в контейнере, чтобы смочить марлю.
- Поднимите марлю с помощью пинцета ткани и плавать его в контейнере, частично заполненной DW. Осторожно потяните SC, чтобы отделить его от марли.
- Вымойте рогового слоя 3-4 раза в DW для удаления остаточного эпидермальный ткань, которая остается прикрепленной к SC.
- Поплавок обособленное SC в растворе 0,4% глицин макс (соя) ингибитор трипсина в DW. Используйте планшетном шейкере для перемешивания ткани в течение 10 мин.
- Поплавок SC в чашке Петри частичнозаполнена DW. Используйте планшетном шейкере для перемешивания ткани в течение 10 мин.
- Сушат изолированный SC лист на ультра-тонкой пластиковой сетки в течение 48 часов при комнатной температуре (25 ° C, 40% относительной влажности (RH)).
- Отделить SC от сетки и вырезать отдельные образцы круговой радиус R = 3 мм, используя круглую дырокола. Отметьте центр наиболее удаленном от центра лица с небольшим спиральным метки с использованием несмываемым маркером. Это обеспечивает визуальный сигнал для распознавания TopSide КА.
Примечание: Неизгладимое отметка должна быть применена в центре образца, где сушка деформации будет наименьшим. Это позволит свести к минимуму влияние маркера на записанных профилей сушки смещения.
3. Образец Лечение и Отложение
- Перемешивайте образцы SC в течение 30 мин в 15 мл DW, содержащей 90 мкл флуоресцентный маркер бусин (505/515 нм, диаметр 1 мкм, карбоксилат-модифицированный). Эти отложения бусин на поверхность SC
Примечание: В то время как осаждение лАРГЕ количество бисера на КА может незначительно медленной сушке относительно образцов без бусинок присутствуют 12, он будет максимизировать пространственное разрешение полей деформации в плоскости , которые можно получить в дальнейшем. Поэтому выбор объема шарика добавлен должны быть сделаны специальные. - Удалить образцы SC и поместить их в чашку Петри, частично заполненном DW.
- Частично погружать подложку в ДГ под небольшим углом 15-30 °.
- Чтобы закрепить края образца плавающего SC на линии контакта между подложкой и интерфейсом воды. Вертикально снятия подложки из воды будет плавно ламинировать образец SC на подложку без складок и вовлеченного воздуха пузырьки.
- Повторите шаг 3.4, чтобы разместить до 6 образцов SC на каждой подложке. Оставьте по крайней мере, зазор 2-3 мм между образцами и избежать образца ламинирование близко к краю подложки. Это предотвращает высыхание одного образца, влияющих на сушильных перемещений в другой.
- Сухие смонтированные образцы SC в лабораторных условиях в течение 60 мин. Это позволяет остаточную воду между SC и субстратом для испарения и обеспечивает полную адгезию тканей.
Примечание: На этом этапе образцы SC можно лечить с помощью химических или косметических составов 7, 8 путем размещения подложки вверх дном в желаемом раствором в течение необходимого периода времени. Повторите шаг 3,6 раз этап обработки выполняется. После сушки, неполное сцепление SC образцов с подложкой можно проверить с помощью микроскопии в проходящем свете. Захваченные пузырьки под образцом SC или расслаиваться края будет формировать четкие вариации контраста в образце с четко определенными краями. - Создание влажной камере путем размещения чашки Петри, частично заполненной жидкостью в герметично закрытом контейнере.
- Место субстратов в камере в течение 24 ч до уравновешивания до относительной влажности 99%. Не ставьте подложки в Petrя блюдо.
4. Контроль окружающей среды микроскоп
- Обеспечение контроля за состоянием окружающей среды через систему контроля влажности, подключенного к микроскопу монтируемый перфузионной камеры. Детали системы контроля влажности предоставляются на немецком языке и др. (2013) 7 и Лю и немецком языках (2015) 8.
- Устанавливать подложку на микроскопе, поместите перфузии камеры над подложкой и запечатать края перфузионной камеры с эластомером с помощью вакуумной смазки.
- После того, как установлен, уравновешивания внутреннего воздуха до 99% RH до эксперимента. Это предотвращает испарение воды до эксперимента. После того, как изображения в разделах 5 или 7 началось, уменьшить внутреннюю влажность воздуха до требуемого значения.
Примечание: В данной статье SC образцы высушивают до 25% относительной влажности
5. визуализации в самолет Сушильные перемещениях
- Получение изображений образцов SC с использованием инвертированного microscoре с 1X объективом. Excite флуоресцентные шарики, используя легкий двигатель с FITC фильтром (503-530 нм излучение полосовой). Несколько образцов могут быть отображены последовательно во время сушки с использованием автоматизированного этап XY.
- Запись флуоресцентные и прошедшего света изображения с помощью цифровой ПЗС-камерой с разрешением 1392 х 1040 пикселей. Поле зрения каждого изображения 8.98 х 6.71 мм, что позволяет единое изображение, чтобы захватить полный образец SC. Возьмем изображения с частотой 10 мин в течение 16 часов.
6. Подготовка основания для измерения толщины
- В химическом вытяжном шкафу, поместите 1 мл силана (3-аминопропилтриэтоксисилан; ≥98%) в какой-то небольшой пластиковой крышкой. Поместите эластомерные субстраты из секции 1 и крышкой в герметичном контейнере в течение 5 часов. Не допускать субстраты прийти непосредственно в контакт с силаном.
- Добавить 5 мг EDC (N - (3-диметиламинопропил) - N -ethylcarbodiimide гидрохлорид; ≥99%) в 1,5 мл трубки. Добавить 500 мкл DW к EDC. Перемешивать раствор в течение 10 с с вихревым смесителем.
- Добавить 0,076 г тетрабората натрия и 0,1 г борной кислоты в 20 мл DW. Смешать с помощью магнитной мешалки при 70 ° С (1 час). Добавить борную кислоту до тех пор, пока рН не является 7,4.
- Добавьте 20 мл боратного буфера в 50 мл центрифужную пробирку. Добавить 60 мкл 1 мкм шариков (535/575 нм, карбоксилат-модифицированного) в буфер борат. Наконец, добавьте 200 мкл раствора EDC в бутылку. Встряхните пробирку, чтобы смешать шарик раствора, а затем вылить в 10 см диаметром чашки Петри.
- Удалите силанизировать субстраты из контейнера и поместите их эластомер пленки стороной вниз в раствор гранулы. Делайте это медленно, чтобы предотвратить пузыри от попадания в ловушку. Две основы будет вписываться в каждой чашке Петри.
- Оставьте субстраты, чтобы плавать в растворе шарик в течение 45 мин.
- Используйте пинцет, чтобы удалить подложки из раствора шарик, затем промыть в DW для удаления несвязанных бусы.
- Воздух сухой подложки. Продувка сжатым воздухом надповерхность эластомер пленка уменьшает образование пятен от воды.
- Уплотнение субстратов в непрозрачном ящике, чтобы предотвратить фото-отбеливание гранул до осаждения SC образца.
7. визуализации Толщина SC
- Образцы вкладов SC на подложку с использованием раздела 3. Однако выполнить шаг 3.1 без добавления флуоресцентных бусины в DW. Кроме того, наносить каплю 5 мкл неразбавленного раствора флуоресцентного маркера шарик (505/515 нм, диаметр 0,1 мкм) до поверхности каждого осажденного образца SC с пипеткой до выполнения шага 3.6.
- Установить измерения толщины SC с помощью микроскопа с 40Х объективом. Измерить толщину образцов СУ с течением времени с использованием удаленного фокуса аксессуар для записи разности г высоты между двумя бортовыми фокальные плоскости слоя, расположенного на границе раздела SC-подложка, так и надводной части КА.
- Измерить толщину 3 областей каждого образца SC в течение периода сушки 3 ч. ТолщинаSC образцов достигает установившегося значения в течение этого времени 8.
8. Количественная и моделирование тканей Деформация
- Использование частиц изображения велосиметрии 13 для получения пространственно решена в плоскости сушки смещения от флуоресцентных изображений на каждом шаге по времени записанного.
- Использование MATLAB для получения азимутально усредненных радиальных и азимутального смещения профилей из поля смещений каждого радиально-симметричного образца SC.
Примечание: Пример набора данных (под названием 'd.mat') и MATLAB код (под названием 'PIV-processing.m »), который выполняет как этот шаг и шаг 8.3 была представлена в справочной информации. - Установить профили радиального смещения к модели 7, 8, 14, 15, 16 , описывающего сушки SC в качестве сокращающейся линейной упругой циркуляциейг диск времени различной толщины, H SC, радиус R, и модуль упругости, E SC, приклеенный к деформируемой упругой подложке с модулем упругости, Е. Предположим , SC имеет отношение четко определенной и постоянной Пуассона, ν SC = 0,4 7 , 8. Получите лучшие припадки с использованием минимального подхода наименьших квадратов.
Примечание: Модель, используемая для подгонки описывает радиальных перемещений в терминах модифицированных функций Бесселя являются: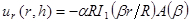 (1)
(1)
с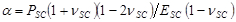 ,
,  а также
а также 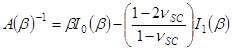
Срок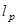 соответствует глубине проникновения заданной,
соответствует глубине проникновения заданной,  .
. 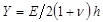 обозначает параметр субстрат жесткости; действительный, когда размеры выборки намного больше толщины подложки. Здесь параметры,
обозначает параметр субстрат жесткости; действительный, когда размеры выборки намного больше толщины подложки. Здесь параметры, 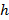 а также
а также 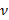 соответственно обозначают толщину подложки коэффициент Пуассона. Коэффициент Пуассона эластомерного подложки 17 силикон ν = 0,5.
соответственно обозначают толщину подложки коэффициент Пуассона. Коэффициент Пуассона эластомерного подложки 17 силикон ν = 0,5. - Получить параметры модели а и β на каждом временном шаге от наименьших квадратов уравнения (1) для радиального профиля смещения.
- Наймите фитинга параметр & beta ; получить SC модуль упругости, E SC, используя выражение,
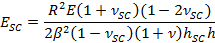
- Используйте подходящие параметр а для получения времени изменения сократительной сушки STREсс, PSC, используя выражение,
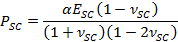
- Наймите фитинга параметр & beta ; получить SC модуль упругости, E SC, используя выражение,
Результаты
На рисунке 1 (а) показывает характерный флуоресцентное изображение образца , покрытого SC флуоресцентных бусин (раздел 3). Соответствующий передаваемый свет изображение образца показана на рисунке 1 (б) , обложенных с колчаном участком пространственно ...
Обсуждение
В этой статье мы опишем метод, который может быть использован для измерения динамических характеристик сушки и механические свойства человеческого SC. Предыдущие исследования показали , что этот метод может быть использован для количественной оценки последствий условий окружающей ср...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors have no acknowledgements.
Материалы
| Name | Company | Catalog Number | Comments |
| Silicone elastomer base | Dow-Corning | 1064291 | |
| Silicone elastomer Curing Agent | Dow-Corning | 1015311 | |
| FluoSpheres Carboxylate 0.1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8803 | |
| FluoSpheres Carboxylate 1 µm yellow green fluorescent 505/515 | Thermo Fisher | F8823 | |
| FluoSpheres Carboxylate 1 µm nile red fluorescent 535/575 | Thermo Fisher | F8819 | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T6567 | |
| Trypsin inhibitor type II-s | Sigma-Aldrich | T9128 | |
| (3-aminopropyl)triethoxysilane | Sigma-Aldrich | 440140 | |
| Sodium tetraborate | Sigma-Aldrich | 221732 | |
| Boric acid | Sigma-Aldrich | B0294 | |
| Phosphate buffered saline | Sigma-Aldrich | P7059 | |
| N-(3-Dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride | Sigma-Aldrich | E7750 | |
| Vortexer mixer | VWR | 58816-123 | |
| 6mm diameter hole punch | Sigma-Aldrich | Z708860 | |
| SOLA 6-LCR-SB | Lummencor light engine | No.3526 | |
| Cfi Plan Achro Uw 1x Objective | Nikon Plan UW | MRL00012 | |
| CFI Plan Fluor 40x Oil Objective 1.3 na - 0.20mm wd | Nikon Plan Fluor | MRH01401 | |
| Nikon Eclipse Ti-U inverted microscope | Nikon | MEA53200 | |
| Clara-E Camera | Andor | DR-328G-C02-SIL | |
| Remote Focus Attachment E-RFA Ergo Design | Nikon | 99888 | |
| Ti-S-E Motorized Stage | Nikon | MEC56110 |
Ссылки
- Van Hal, D., Jeremiasse, E., Junginger, H. E., Spies, F., Bouwstra, J. Structure of fully hydrated human stratum corneum: a freeze-fracture electron microscopy study. J. Invest. Dermatol. 106 (1), 89-95 (1996).
- Norlén, L., Al-Amoudi, A. Stratum corneum keratin structure, function, and formation: the cubic rod-packing and membrane templating model. J. Invest. Dermatol. 123 (4), 715-732 (2004).
- Liu, X., Cleary, J., German, G. K. The global mechanical properties and multi-scale failure mechanics of heterogeneous human stratum corneum. Acta Biomater. , (2016).
- Geerligs, M. . Skin layer mechanics. , (2010).
- Farage, M. S., Miller, K. W., Maibach, H. I. . Textbook of Aging Skin. , (2010).
- Levi, K., Kwan, A., Rhines, A. S., Gorcea, M., Moore, D. J., Dauskardt, R. H. Emollient molecule effects on the drying stresses in human stratum corneum. Br. J. Dermatol. 163 (4), 695-703 (2010).
- German, G. K., Pashkovski, E., Dufresne, E. R. Surfactant treatments influence drying mechanics in human stratum corneum. J. Biomech. 46 (13), 2145-2151 (2013).
- Liu, X., German, G. K. The effects of barrier disruption and moisturization on the dynamic drying mechanics of human stratum corneum. J. Mech. Behav. Biomed. Mater. 49 (13), 80-89 (2015).
- Levi, K., Weber, R. J., Do, J. Q., Dauskardt, R. H. Drying stress and damage processes in human stratum corneum. Int. J. Cosmet. Sci. 32 (4), 276-293 (2010).
- Levi, K., et al. Effect of glycerin on drying stresses in human stratum corneum. J. Dermatol. Sci. 61, 129-131 (2011).
- Fluhr, J. W., Darlenski, R., Surber, C. Glycerol and the skin: holistic approach to its origin and functions. Br. J. Dermatol. 159 (1), 23-34 (2008).
- German, G. K., et al. Heterogeneous drying stresses in stratum corneum. Biophys. J. 102 (11), 2424-2432 (2012).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Exp. Fluids. 10 (4), 181-193 (1991).
- Mertz, A. F., et al. Scaling of traction forces with the size of cohesive cell colonies. Phys. Rev. Lett. 108 (19), 1-5 (2012).
- Banerjee, S., Marchetti, M. C. Substrate rigidity deforms and polarizes active gels. Euro Phys. Lett. 96 (2), 28003 (2011).
- Edwards, C. M., Schwarz, U. S. Force localization in contracting cell layers. Phys. Rev. Lett. 107 (12), 128101 (2011).
- Cesa, C., et al. Micropatterned silicone elastomer substrates for high resolution analysis of cellular force patterns. Rev. Sci. Instrum. 78 (3), 34301 (2007).
- Wu, K. S., Van Osdol, W. W., Dauskardt, R. H. Mechanical And Microstructural Properties Of Stratum Corneum. Mater. Res. Soc. 724, 27-33 (2002).
- Yuan, Y., Verma, R. Measuring microelastic properties of stratum corneum. Colloids Surf. B. 48 (1), 6-12 (2006).
- Christensen, M. S., Hargens, C. W., Nacht, S., Gans, E. H. Viscoelastic properties of intact human skin: instrumentation, hydration effects, and the contribution of the stratum corneum. J Invest. Dermatol. 69 (3), (1977).
- Pailler-Mattei, C., Bec, S., Zahouani, H. In vivo measurements of the elastic mechanical properties of human skin by indentation tests. Med. Eng.Phys. 30 (5), 599-606 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены