需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鱼肾注射液循环系统中微粒的简易有效管理与可视化
摘要
本文阐述了快速、微创荧光微粒注入小鱼循环系统的原理和鱼血中微粒的体内可视化。
摘要
将微粒径粒子系统地管理到生物体中, 可用于血管可视化、药物和疫苗的提供、转基因细胞的植入和微小的光学传感器。然而, 静脉注射 microinjections 的小动物, 主要用于生物和兽医实验室, 是非常困难的, 需要训练有素的人员。在此, 我们展示了一种健壮和有效的方法, 引入微粒进入成年斑马鱼 (斑马斑马) 的循环系统, 注入到鱼肾。为了对微血管中引入的微粒进行可视化, 我们提出了一种简单的鱼鳃活体成像技术。在体内监测斑马鱼的血液 pH 值是使用注射微胶囊荧光探针, SNARF-1, 以证明其中一个可能的应用的描述技术。本文详细介绍了 pH 敏感染料的封装, 并说明了该微胶囊在荧光信号活体记录中快速注射和可视化的原理。所提出的注射方法的特点是低死亡率 (0-20%) 和高效率 (70-90% 成功), 并易于使用常用设备。所有被描述的规程可以执行对其他小鱼种类, 例如孔雀鱼和鳉。
引言
在药物和疫苗的提供1、血管可视化2、转基因细胞植入3和微型光学传感器植入等领域, 微粒径颗粒的管理是一项重要任务。4,5. 然而, 微型微粒进入小实验动物的血管系统的植入程序是困难的, 特别是对于微妙的水生生物。对于像斑马鱼这样的热门研究标本, 建议使用视频协议来澄清这些程序。
心内和毛细血管 microinjections 需要训练有素的人员和独特的显微外科设施, 以提供 microobjects 到斑马鱼的血液。此前,3是一种简便有效的全细胞管理方法。然而, 在我们的经验中, 由于眼毛管网络的面积很小, 这项技术需要大量的实践才能达到预期的效果。
在此, 我们描述了一种方法, 通过手动注射直接注入到富含毛细血管和肾血管的成年斑马鱼的肾脏组织中, 以强力有效的微粒注入循环系统。该技术是基于视频协议的细胞移植到斑马鱼肾脏6, 但创伤和耗时的显微手术步骤被淘汰。该方法具有低死亡率 (0-20%) 和高效率 (70-90% 成功) 的特点, 易于使用常用设备。
建议的协议的一个重要部分是可视化的植入微粒 (如果它们是荧光或彩色) 在鳃毛细血管, 这允许验证注射质量, 一个粗略的相对评估的数量注入粒子, 并检测光谱信号的生理测量直接从循环血液。作为描述技术的可能应用的一个例子, 我们展示了在活体测量斑马鱼血液 pH 值使用微胶囊化荧光探针, SNARF-1, 最初建议在 Borvinskaya 等.20175。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验程序都是按照欧盟 2010/63/欧盟关于动物实验的指令进行的, 并经伊尔库茨克州立大学生物研究所动物学科研究委员会批准。
1. 微胶囊的制备
注: 携带荧光染料的微胶囊采用相反带电聚电解质7、8的逐层组装制备。所有的程序都是在室温下进行的。
- 为了合成多孔碳酸钙3 microcores 包围荧光染料, 混合2毫升的 SNARF-1-dextran 溶液 (大多数聚合物绑定荧光染料, 如 FITC-BSA 可以使用) 在2毫克/毫升浓度约0.6 毫升每1摩尔/L 溶液 CaCl2和 Na2CO3下快速搅拌。
注意: 注意荧光染料对漂白的不同敏感性;如果使用光敏荧光探针 (如 SNARF-1), 则必须以尽可能少的光来执行微粒的操作和储存。 - 经过5-10 秒的搅拌, 将悬浮液转移到2毫升离心管和离心机, 十五年代在1000万克碳酸钙3 microcores。
- 丢弃上清, 用〜2毫升的去离子水洗涤芯, 并通过摇动并用重悬颗粒。
- 重复离心洗涤程序总共三次。最后一次离心后, 丢弃上清。
- 在超声波浴中孵化 microcores 1 分钟以减少它们的聚集。
注意: 不要忘记用耳机保护耳朵。 - 为了将第一个聚合物层存放在模板上, 并用重悬在1摩尔/升氯化钠中, 将4毫克/毫升溶液中的2毫升的核 (烯丙胺盐酸盐) (多环芳烃)。
- 在溶液中保持 microcores 5 分钟, 持续晃动。
- 十五年代离心后, 用未结环芳烃丢弃上清液。通过多次离心和洗涤步骤, 将覆盖的 microcores 用去离子水清洗至少3次。最后一次离心后, 丢弃上清。
- 在超声波浴中孵化 microcores 1 分钟以减少它们的聚集。
注: 如果应用的荧光染料是阳离子, 从聚 (4-苯乙烯) (PSS) 开始在1摩尔/升氯化钠 (见步骤 1.7)。
- 重复步骤 1.6, 用2毫升4毫克/毫升的 PSS 溶液 (也含有1摩尔/升氯化钠) 将第二个聚合物层存入模板。
- 重复步骤1.6 和1.7 六次, 以存入12聚合物层。
注意: 建议不要在程序中进行长时间的休息 (12 小时或以上), 直到3-5 层沉积, 因为碳酸钙3 microcores 没有覆盖可能会结晶。请注意, PSS 覆盖率会导致 microcores 的更高聚合, 只有当用聚乙二醇 (PLL) 接枝的多环芳烃或聚 l-赖氨酸是外层层时, 才可取长时间停顿。 - 孵化的覆盖 microcores 2 毫克/毫升锁相环-g PEG (1 毫升每微细) 至少2小时。
- 通过顺序离心和泥沙步骤冲洗 microcores 水。最后一次离心后, 丢弃上清。
- 要获得中空微囊, 通过加入2毫升0.1 摩尔/升乙二胺四乙酸 (EDTA) 溶液 (经调整为 pH 7.1 和氢氧化钠), 将碳酸钙3模板分解为覆盖的 microcores。
- 经过5分钟的孵化, 离心的微囊四十五年代, 并放弃上清与 EDTA。
- 重复步骤 1.10-1. 10.1 两次。
- 在四十五年代内通过多次离心步骤清洗微囊, 0.9% 氯化钠三次, 然后洗涤步骤。最后的离心步骤后, 丢弃上清。
注: 注射用的最终微胶囊溶液必须保持不育 (例如, 加入氨苄西林, 0.1 毫克/毫升), 介质应与调查对象进行生物相容性 (与中性 pH 值的等渗介质)。 - 在荧光显微镜下估计 hemocytometer 中制备的微囊的浓度。采用 ImageJ9或等效软件, 对微囊进行了一系列的图像测量, 测定了约100微囊的直径, 并利用直方图对尺寸分布进行了研究。
- 在黑暗中存储得到的封装探针。
注: 在不育0.9% 氯化钠的几次洗涤后, 微胶囊可以储存数月到4摄氏度。不推荐在贮存期间完全干燥微胶囊。
2. 微胶囊化 SNARF-1 的光学设置和标定方法的制备
注: 微胶囊化 SNARF-1 的粗糙 pH 值可以使用荧光显微镜7的两个通道中的图像进行, 但在本协议中应用了连接到光纤光谱仪的单通道荧光显微镜。
- 根据所应用的荧光染料的特点, 将所需的荧光过滤器放在荧光显微镜上, 并打开荧光灯。
- 把杠杆拉出目镜。
注意: 过量的光线会破坏光谱仪矩阵。因此, 在不使用光谱仪的情况下, 请确保杠杆处于 "目镜" 模式。 - 将光纤的一端连接到光谱仪, 另一端与准直器相连。使用适配器, 将准直器放在照相机管或荧光显微镜的其他可用端口的焦点上。
- 打开光谱仪。运行光谱仪控制程序, 并准备光谱仪测量。
- 把杠杆拉出目镜。
- 对于微胶囊批次的校准, 在显微镜滑动处放置5µL 的微胶囊悬浮液 (每µL 10 000 微胶囊), 并在一个黑暗的地方干掉 (例如, 在恒温器35摄氏度)。
- 为了校准微胶囊化 SNARF-1 的光谱特性, 在6-9 范围内使用一系列不同 pH 值的缓冲器。将10µL 的缓冲液放到干燥的微胶囊上, 用 SNARF-1-dextran 盖上盖玻片。
- 将玻璃滑梯放在显微镜台上。使用×40目标定位微胶囊。
- 将显微镜拉杆转向相机端口。用光谱仪注册它们的荧光。把杠杆转回到目镜。
注: 确保光谱信号远超过背景水平, 并确保在视图领域的微胶囊不在气泡 (如果需要切换到较低的放大倍数)。避免同一微胶囊的长时间光照。SNARF-1 对漂白敏感。 - 重复步骤2.2.3 不同的微囊10-15 次。
- 计算所有已注册光谱的荧光峰值比值 (例如, 使用 R 或 Scilab), 并使用以下公式确定中值比值 (每个缓冲区) 和中 pH 值之间的回归线:
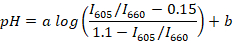
注: SNARF-1 具有与质子和 deprotonated 染料的发射相对应的两个峰值的光谱, 峰值之间的比值响应介质的 pH 值。本研究采用605和 660 nm 荧光强度的比值。根据所使用的筛选器集选择这些波长。a和b是由非线性回归 (例如, 使用 R) 确定的系数。值0.15 和1.1 分别是在校准期间观察到的605/i660 的最小和最大值。 - 从大约5只成年动物身上收集大约10µL 的鱼血。将鱼放入培养皿中, 用1µL/毫升水悬浮丁香油进行麻醉, 等到动物转向它的一侧, 停止对鳍的捏 (通常是2-3 分钟) 的反应。把鱼转移到玻璃滑梯上。用柳叶刀切断鱼尾, 从尾静脉收集大约2µL 的鱼血。
注: 为防止血液凝固, 用肝素 (5000 U/毫升) 治疗切口, 使用血气玻璃毛细血管和离心管收集血液。- 用吸管将10µL 的血液滴在微电极的尖端上, 用 ph 表确定 ph 值。
- 将血液滴到带有干微胶囊的滑梯上, 并按照校准缓冲器 (步骤 2.2-2.3) 的说明, 注册荧光强度的比值。
- 调整校准曲线的线性系数, 使曲线与鱼血中的测量相匹配 (详情见 Borvinskaya等20175)。
3. 注射准备
- 用锋利的柳叶刀除去塑料, 从胰岛素笔 (或注射器) 的尖端释放出钢针。
注: 任何细针 (Ø0.33 毫米或更小) 或玻璃毛细管 (通常Ø1毫米) 可以为显微注射10,11准备。 - 将针插入玻璃 microcapillary 的一半;使用气体火炬快速和轻轻地焊料。
- 将玻璃 microcapillary 连接至 microinjector, 用无菌水冲洗三次。确保液体流经针头。
- 用蒸馏水填满系统。
注意: 确保系统中没有气泡。
4. 注塑
- 并用重悬微囊的准备悬浮 (在无菌0.9% 氯化钠, 或任何其他用于注射的培养基上, 浓度为0.5 到600万微胶囊每微升) 使用超声波浴1分钟。
注: 由于微囊倾向于沉淀, 在以下注射过程中, 用微胶囊机械 (使用转子) 摇动瓶子, 或手动每隔几分钟并用重悬, 防止它们聚集。 - 将鱼放入带有麻醉剂的培养皿中 (在水中悬浮的丁香油0.1 毫升/升) 为 ~ 2-3 分钟. 等待, 直到鱼转向它的一侧, 停止响应的鳍轻捏。
- 使用勺子, 把鱼从麻醉剂中转移出来, 轻轻地将它放在一个侧向的潮湿的海绵上, 头部向左 (右撇子) 或向右 (左手的人)。
- 就在注射前, 吸1-2 毫米空气进入玻璃毛细管与 microinjector 连接。然后, 加载它与大约2µL 分散微囊。
注: 在注射前, 微胶囊溶液必须调整到保存鱼的温度。 - 用非显性手轻轻地将鱼的身体稳定在海绵上。
- 找到鱼的侧线。心理上选择从笼盖延伸到腹腔末端的一段。找到这段的中间部分。把针1毫米低的腹部方向。
- 用刮擦动作, 轻轻地将鱼鳞放在一旁, 然后进行穿刺。用45°的角度将针头插入到工作台表面。
- 把针头推到脊椎上, 直到它仔细地对着它。
- 释放大约1µL 的微囊悬浮入肾脏, 慢慢地提取针。
注意: 为了更容易找到合适的穿刺部位, 用底部的光线透照鱼来寻找躯干肾脏是有用的, 如图 2A 和 2B所示。
- 将鱼从头到尾用一条水冲洗, 以除去注射部位溢出的微囊。
5.在体内可视化
- 使用解剖剪刀去除鱼头上的鳃盖, 掀鱼鳃。用清水冲洗鳃。
- 使用勺子, 把鱼转移到显微镜幻灯片, 并把它放在荧光显微镜的舞台上。
注意: 确保鱼鳃在连续的过程中不干燥。为了避免这种情况, 用巴斯德吸管定期用水 (大约每1-2 分钟) 滋润它们。 - 使房间变暗, 使用低放大倍数 (x10 目标) 检查鳃以找到荧光微囊。
注: 当该程序用于将某些荧光微粒引入鱼类循环系统时, 建议在注射前检查几个人的鳃, 以检测意外的荧光微粒。野生斑马鱼的鳃没有自体荧光, 但在某些情况下, 有零星的荧光微粒 (如食物片断或单细胞共生) 可能存在于鳃上。如有必要, 这些粒子可以根据其特定的形状来识别 (例如, 食品件的形状不规则, 不像球形微囊) 或荧光光谱 (即颜色)。- 将透镜切换到更高的幅度 (×40目标), 并将微囊或一组微胶囊放置在视野中心。
- 用连接的光谱仪将拉杆转向端口。记录光谱信号。
- 把杠杆转回到目镜上。
- 对不同的微胶囊重复测量几次。
- 把鱼转到水族馆, 用适当的通气进行恢复。
注意: 使用最少的练习, 可以以每条鱼的大约2-3 分钟的速度进行注射和信号记录。该测量可以重复一个人多次使用重复低, 无害剂量的麻醉或另一种固定方法。对于长期观察, 使用连续麻醉的系统12。
Access restricted. Please log in or start a trial to view this content.
结果
得到的结果来自三个主要类别的协议: 荧光染料的封装形成荧光微粒 (图 1), 肾脏注射微囊的进一步可视化鳃毛细血管 (图 2 和 3), 最后,在体内光谱记录 SNARF-1 荧光监测血液 pH 值 (图 4)。
逐层方法使用模板碳酸钙3芯的涂?...
Access restricted. Please log in or start a trial to view this content.
讨论
为了证明微粒注入斑马鱼肾脏, 我们使用了半渗透性微胶囊加载的指示染料。因此, 该协议包含使用相反带电聚电解质7、8、15、16、17 的逐层组装制备微囊的指示 ,18 (图 1A)。这项技术的优点是它易于使用现有的实验室设备。根?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
作者非常感谢伯登 Osadchiy 和叶甫 Protasov (伊尔库茨克州立大学) 在编写视频协议方面的帮助。这项研究得到了俄罗斯科学基金会 (#15 14-10008) 和俄罗斯基础研究基金会 (#15-29-01003) 的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
参考文献
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。