Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Einfache und effektive Verwaltung und Visualisierung von Mikropartikeln im Herz-Kreislauf-System von kleinen Fischen mit Niere Injektion
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt die Grundsätze der eine schnelle, minimal-invasive Injektion von fluoreszierenden Mikropartikel in der Circulatory system von kleinen Fischen und in Vivo Visualisierung von Mikropartikeln Fisch im Blut.
Zusammenfassung
Die systemische Gabe von Mikro-Größe Partikel in einem lebenden Organismus kann zur Gefäßsystem Visualisierung, Drogen und Impfung, Implantation von transgenen Zellen und kleine optische Sensoren eingesetzt werden. Jedoch intravenöse Mikroinjektionen in kleine Tiere, die meist in biologischen und veterinärmedizinischen Laboratorien verwendet werden, sind sehr schwer und erfordert geschultes Personal. Hier zeigen wir eine robuste und effiziente Methode für die Einführung von Mikropartikeln in das Kreislaufsystem der Erwachsenen Zebrafisch (Danio Rerio) durch Injektion in die Fisch-Niere. Um die eingeführten Mikropartikel in das Gefäßsystem zu visualisieren, schlagen wir eine einfache intravitalen bildgebende Verfahren in Kiemen. Überwachung von Zebrafisch-Blut-pH in Vivo wurde erreicht mit einem injizierten mikroverkapselte Leuchtstofflampen Sonde, SNARF-1, eine der möglichen Anwendungen von der beschriebenen Technik demonstrieren. Dieser Artikel enthält eine ausführliche Beschreibung der Kapselung des pH-sensitiven Farbstoffs und zeigt die Grundsätze der schnelle Injektion und Visualisierung der erhaltenen Mikrokapseln für in Vivo Aufnahme das Fluoreszenzsignal. Die vorgeschlagene Methode der Injektion zeichnet sich durch eine niedrige Sterblichkeitsrate (0-20 %) und hohe Effizienz (70-90 % Erfolg), und es ist leicht, Institut, mit handelsüblichen Geräten. Alle beschriebene Verfahren können auf anderen kleinen Fischarten wie Guppys und Medaka durchgeführt werden.
Einleitung
Die Verwaltung der Mikro-Größe Partikel in den tierischen Organismus ist eine wichtige Aufgabe in Bereichen wie Drogen und Impfstoff Lieferung1, Gefäßsystem Visualisierung2, transgenen Zelle Implantation3und winzigen optischen Sensor implantation 4 , 5. der Implantation für Microscale Partikel in das Gefäßsystem von kleinen Labortieren ist jedoch schwierig, vor allem für empfindliche Wasserorganismen. Für populäre Forschung Exemplare wie Zebrafisch, ist es ratsam, die diese Verfahren mit Videoprotokolle geklärt werden.
Intrakardialen und Kapillare Mikroinjektionen erfordert geschultes Personal und einzigartige Mikrochirurgie Einrichtungen für die Lieferung von Microobjects in Zebrafisch Blut. Zuvor wurde ein Retro-Orbital manuelle Injektion3 als eine einfache und effektive Methode für die Verwaltung ganzer Zellen vorgeschlagen. Aber nach unserer Erfahrung dauert wegen der kleinen Fläche des Auges Kapillaren Netzes, es viel Übung, um das gewünschte Ergebnis von dieser Technik zu erreichen.
Hier beschreiben wir eine Methode für die robuste und effiziente Mikropartikel Implantation in das Herz-Kreislauf-System durch manuelle Injektion direkt in das nierengewebe Erwachsenen Zebrafisch, die ist reich an Kapillaren und renaler Gefäße. Diese Technik basiert auf dem video-Protokoll für Stammzelltransplantation in der Zebrafisch Niere6, aber die traumatischen und zeitraubende mikrochirurgische Schritte wurden beseitigt. Die vorgeschlagene Methode zeichnet sich durch geringe Mortalität (0-20 %) und hohe Effizienz (70-90 % Erfolg), und es ist leicht, Institut, mit handelsüblichen Geräten.
Ein wichtiger Teil des vorgeschlagenen Protokolls ist die Visualisierung der implantierten Mikropartikel (wenn sie fluoreszierende oder eingefärbte) in den Kapillaren der Kieme, ermöglicht eine Überprüfung der Injektion Qualität, eine grobe relative Bewertung der Anzahl der injizierten Partikel und die Erkennung des spektralen Signals für physiologische Messungen direkt aus dem zirkulierenden Blut. Als ein Beispiel für die Einsatzmöglichkeiten von der beschriebenen Technik demonstrieren wir das Protokoll für in Vivo Messungen von Zebrafisch-Blut-pH mittels mikroverkapselte fluoreszierende Sonde, SNARF-1, ursprünglich vorgeschlagenen in Borvinskaya Et Al. 2017-5.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle experimentelle Verfahren wurden im Einklang mit der EU-Richtlinie 2010/63/EU für Tierversuche und die Tier Themen Forschung Ausschusses des Instituts für Biologie an Irkutsk Landesuniversität genehmigt worden.
1. Herstellung von Mikrokapseln
Hinweis: Mikrokapseln mit einem Fluoreszenzfarbstoff werden mit einer Schicht für Schicht Versammlung entgegengesetzt geladenen Polyelektrolyten7,8zubereitet. Alle Verfahren wurden bei Raumtemperatur durchgeführt.
- Um poröse CaCO3 Microcores umschließt den Fluoreszenzfarbstoff zu synthetisieren, mischen Sie 2 mL der SNARF-1-Dextran-Lösung (die meisten Polymer gebundener Fluoreszenzfarbstoff wie FITC-BSA kann verwendet werden) in einer Konzentration von etwa 2 mg/mL mit 0,6 mL jeweils 1 Mol/L-Lösungen von CaCl2 und Na2CO3 unter schnell rühren.
Hinweis: Achten Sie auf die unterschiedlichen Empfindlichkeiten von Fluoreszenzfarbstoffen, Immunofluoreszenz; Wenn eine lichtempfindliche fluoreszierende Sonde (wie SNARF-1) verwendet wird, müssen die Manipulation und Lagerung der Mikropartikel mit so wenig Licht wie möglich durchgeführt werden. - Nach ca. 5-10 s Agitation, übertragen die Aussetzung auf 2 mL Mikrozentrifugenröhrchen und Zentrifuge für 15 s bei 10.000-12.000 g zu CaCO3 Microcores Pellets.
- Den überstand verwerfen, die Kerne mit ~ 2 mL entionisiertem Wasser waschen und Aufschwemmen der Pellets durch Schütteln.
- Wiederholen Sie die Zentrifugation Waschvorgang in insgesamt drei Mal. Nach der letzten Zentrifugation verwerfen des Überstands.
- Inkubieren Sie die Microcores für 1 min in ein Ultraschallbad, deren Aggregation zu reduzieren.
Achtung: Vergessen Sie nicht, Ohren mit Kopfhörern zu schützen. - Um die erste Polymerschicht auf die Vorlagen einzuzahlen, Aufschwemmen der Kerne in ~ 2 mL einer 4 mg/mL Lösung von Poly(allylamine hydrochloride) (PAK) in 1 Mol/L NaCl.
- Halten Sie die Microcores in der Lösung für ~ 5 min mit konstanter schütteln.
- Nach 15 s der Zentrifugation, verwerfen den Überstand mit dem ungebundenen PAH. Waschen Sie die überdachte Microcores mit entionisiertem Wasser mindestens 3 Mal durch mehrere Zentrifugation und Waschschritte. Nach der letzten Zentrifugation verwerfen des Überstands.
- Inkubieren Sie die Microcores für 1 min in ein Ultraschallbad, deren Aggregation zu reduzieren.
Hinweis: Wenn die angewandte Fluoreszenzfarbstoff kationischen ist, starten von Poly (Natrium-4-Styrenesulfonate) (PSS) in 1 Mol/L NaCl (siehe Schritt 1,7).
- Wiederholen Sie Schritt 1.6 mit ~ 2 mL einer 4 mg/mL Lösung von PSS (auch mit 1 Mol/L NaCl) die zweite Polymerschicht auf die Vorlagen zu hinterlegen.
- Wiederholen Sie die Schritte 1.6 und 1.7 sechs mal 12 Polymere Schichten zu hinterlegen.
Hinweis: Es empfiehlt sich nicht für eine lange Pause (~ 12 h oder mehr) in der Prozedur bis ~ 3-5 Schichten weil CaCO3 Microcores ohne Abdeckung kann tendenziell recrystallize hinterlegt worden. Beachten Sie, dass PSS Abdeckung eine höhere Ansammlung von den Microcores bewirkt und die lange Pause empfiehlt sich nur dann, wenn PAH oder Poly-L-Lysin mit Polyethylenglykol veredelt (PLL-g-PEG) ist die äußerste Schicht. - Inkubieren Sie die überdachte Microcores in 2 mg/mL PLL-g-PEG (~ 1 mL pro reaktionscup) für mindestens 2 h.
- Waschen Sie die Microcores mit Wasser über sequentielle Zentrifugation und Wiederfreisetzung Schritte. Nach der letzten Zentrifugation verwerfen des Überstands.
- Um hohle Mikrokapseln zu erhalten, Auflösen der CaCO3 Vorlagen durch Zugabe von 2 mL 0,1 Mol/L Ethylenediaminetetraacetic (EDTA) Säurelösung (eingestellt auf 7,1 pH mit NaOH) auf die überdachten Microcores.
- Nach ca. 5 min Inkubation, Zentrifugieren die Mikrokapseln für 45 s und entsorgen des Überstands mit EDTA.
- Wiederholen Sie die Schritte 1.10-1.10.1 zweimal.
- Waschen Sie die Mikrokapseln mit 0,9 % NaCl dreimal durch mehrere Zentrifugation innerhalb 45 Schritte s gefolgt von Waschschritten. Nach dem letzten Zentrifugationsschritt verwerfen des Überstands.
Hinweis: Die endgültige Mikrokapsel Injektionslösung muss gehalten werden steril (z. B. durch Hinzufügen von Ampicillin, 0,1 mg/mL), und die Medien sollen biokompatible mit dem Ziel, Untersuchung (isotonische Medien mit neutralem pH-Wert). - Schätzen Sie die Konzentration der vorbereiteten Mikrokapseln in einer Hemocytometer unter dem Fluoreszenzmikroskop. Nehmen Sie eine Reihe von Bildern der Mikrokapseln, Messen Sie den Durchmesser von über hundert Mikrokapseln mit ImageJ9 oder gleichwertige Software und untersuchen Sie die Größenverteilung mit ein Histogramm.
- Shop der erhaltenen gekapselt Sonde im Dunkeln.
Hinweis: nach mehrmaligem Waschen in steriler 0,9 % NaCl, die Mikrokapseln können Monate bei 4 ° c gelagert Vollständige Trocknung der Mikrokapseln während der Lagerung wird nicht empfohlen.
2. Vorbereitung des optischen Aufbau und Kalibrierung von mikroverkapselte SNARF-1
Hinweis: Grobe pH-Messung mit mikroverkapselte SNARF-1 kann mit Bildern in zwei Kanälen eines fluoreszierenden Mikroskop7erfolgen, aber in diesem Protokoll eine einkanalige fluoreszierende Mikroskop mit einem Glasfaser-Spektrometer verbunden angewendet wurde.
- Die erforderlichen Satz von Fluoreszenz-Filter an das fluoreszierende Mikroskop nach den Merkmalen der angewandten Fluoreszenzfarbstoff und schalten Sie der Leuchtstofflampe ein.
- Ziehen Sie den Hebel in die Okulare.
Achtung: Überschüssige Licht kann die Spektrometer-Matrix Schäden. So stellen Sie sicher, dass der Hebel in der "Okular" Modus ist, wenn das Spektrometer nicht verwendet wird. - Schließen Sie ein Ende des Lichtleiters das Spektrometer und das andere Ende an einen Kollimator. Verwendung von Adaptern, legen Sie den Kollimator in den Fokus der Kamera Röhre oder anderen verfügbaren Port des fluoreszierenden Mikroskops.
- Schalten Sie das Spektrometer. Führen Sie das Spektrometer-Steuerprogramm und bereiten Sie das Spektrometer für Messungen.
- Ziehen Sie den Hebel in die Okulare.
- Platzieren Sie für die Kalibrierung der Mikrokapsel-Charge ~ 5 µL der Mikrokapsel Suspension (~ 10 000 Mikrokapseln pro Mikroliter in entionisiertem Wasser) auf einen Objektträger zu und trocknen Sie den Tropfen an einem dunklen Ort (z.B. in einem Thermostat bei 35 ° C).
- Um die spektralen Eigenschaften der mikroverkapselte SNARF-1 zu kalibrieren, verwenden Sie eine Reihe von Puffern mit unterschiedlichen pH-Werten im Bereich von ~ 6-9. Drop ~ 10 µL eines Puffers auf die getrockneten Mikrokapseln mit SNARF 1 Dextran und mit einem Deckglas abgedeckt.
- Legen Sie den Objektträger auf den Mikroskoptisch. Suchen Sie die Mikrokapseln mit einem × 40 Ziel.
- Durch Drehen des Hebels Mikroskop an den Kamera-Anschluss. Registrieren Sie ihre Fluoreszenz mit dem Spektrometer. Drehen Sie den Verschluss wieder in die Okulare.
Hinweis: Sicherstellen Sie, dass die spektrale Signal weit jenseits der Hintergrund-Ebene ist, und sicherstellen Sie, dass die Mikrokapseln in das Sichtfeld nicht in einer Blase (durch die Umstellung auf eine geringere Vergrößerung bei Bedarf). Vermeiden Sie längere Beleuchtung der gleichen Mikrokapseln. SNARF-1 reagiert empfindlich auf Immunofluoreszenz. - Wiederholen Sie Schritt 2.2.3 für unterschiedliche Mikrokapseln 10 - 15 Mal.
- Berechnen Sie die Fluoreszenz-Peak-Verhältnisse (z. B. Verwendung von R oder Scilab) für alle registrierten Spektren und bestimmen Sie die Regressionsgerade zwischen dem Median Verhältnis (für jeden Puffer) und mittlerer pH-Wert mit Hilfe der folgenden Formel:
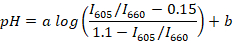
Hinweis: SNARF-1 hat ein Spektrum mit zwei Spitzen, die Emission des protonierten und deprotonierten Farbstoffs entspricht und das Verhältnis zwischen den Gipfeln reagiert auf den pH-Wert des Mediums. In dieser Studie wird das Verhältnis zwischen der Fluoreszenzintensität für 605 und 660 nm verwendet. Diese Wellenlängen sind je nach eingestellter Filter verwendet gewählt. a und b sind Koeffizienten durch nicht-lineare Regression (z. B. Verwendung von R) bestimmt werden. Werte 0,15 bis 1.1 sind, bzw. die minimalen und maximalen Werte der ich605/i660 beobachtet während der Kalibrierung. - Sammeln Sie etwa 10 µL Blut Fisch von ca. 5 Erwachsene Tiere. Statt Fisch in eine Petrischale mit 1 µL/mL Wasser-Suspension von Nelkenöl für Anästhesie und warten, bis das Tier dreht sich auf der Seite und nicht mehr reagiert, drückt der Flosse (in der Regel ~ 2-3 min). Übertragen Sie die Fische auf einen Objektträger. Die Schwanzflosse mit einer Lanzette abgeschnitten und ca. 2 µL Blut der Fische von der Rute Vene zu sammeln.
Hinweis: Um zu verhindern, Blutgerinnung, behandeln Sie den Schnitt mit Heparin (5000 U/mL) zu und verwenden Sie heparinisierten Glaskapillaren und Mikrozentrifugenröhrchen, um das Blut zu sammeln.- Drip ca. 10 µL Blut mit einer Pipette auf die Spitze der Mikroelektrode und bestimmen den pH-Wert mit einem pH-Meter.
- Tropfen Sie Blut auf eine Folie mit getrockneten Mikrokapseln und registrieren Sie das Verhältnis von der Fluoreszenzintensität wie für die Kalibrierung Puffer (Schritte 2.2-2.3) beschrieben.
- Anpassen der lineare Koeffizient der Eichkurve die Kurve die Messungen in der Fisch-Blut (für weitere Details siehe Borvinskaya Et Al. 20175) entsprechen.
3. Vorbereitung für die Injektion
- Lassen Sie die Stahl-Nadel von der Spitze des Insulin-Pen (oder Spritze) durch Entfernen des Kunststoffs mit einer scharfen Lanzette.
Hinweis: Eine dünne Nadel (Ø0.33 mm oder weniger) oder Glas-Kapillare (in der Regel Ø1 mm) für die Mikroinjektion10,11zubereitet werden. - Stechen Sie die Nadel auf halbem Weg in die Glas-Microcapillary; Verlöten Sie schnell und schonend mit einem Gasbrenner.
- Schließen Sie die Glas-Microcapillary an die Microinjector an und spülen Sie es mit sterilem Wasser dreimal. Stellen Sie sicher, dass die Nadel die Flüssigkeit durchströmt.
- Füllen Sie das System mit destilliertem Wasser.
Hinweis: Stellen Sie sicher, dass es gibt keine Luftblasen im System.
4. Injektion
- Die vorbereitete Aussetzung der Mikrokapseln Aufschwemmen (in steriler 0,9 % NaCl oder ein anderes Medium die Injektionen verwendet, mit einer Konzentration von 0,5 bis 6 Millionen Mikrokapseln pro Mikroliter) mit Ultraschallbad für 1 min.
Hinweis: Da die Mikrokapseln Niederschlag tendenziell, während der folgenden Injektion, schütteln Sie das Fläschchen mit der Mikrokapseln mechanisch (mit einem Rotor) oder manuell alle paar Minuten sie aufschwemmen und verhindern deren Aggregation. - Legen Sie den Fisch in eine Petrischale mit Betäubung (0,1 mL/L von Nelkenöl in Wasser suspendiert) für ~ 2 – 3 min. warten, bis der Fisch stellt sich auf seiner Seite und reagiert auf eine leichte Prise die Flosse.
- Mit einem Löffel, übertragen Sie den Fisch aus der Narkose zu und legen Sie sie vorsichtig mit einem feuchten Schwamm in einer seitlichen Position mit dem Kopf nach links (für Rechtshänder) oder nach rechts (für Linkshänder).
- Kurz vor der Injektion saugen Sie 1-2 mm Luft in das Glas-Kapillare mit Microinjector verbunden. Laden Sie es anschließend mit ca. 2 µL der dispergierten Mikrokapseln.
Hinweis: Vor der Injektion muss die Mikrokapsel-Lösung auf die Temperatur eingestellt werden an dem die Fische gehalten werden. - Stabilisieren Sie sanft den Körper des Fisches auf den Schwamm mit der nichtdominanten Hand.
- Die Seitenlinie des Fisches zu finden. Geistig markieren Sie ein Segment, das erstreckt sich von der Kiemendeckel bis zum Ende der Bauchhöhle. Die Mitte dieses Segments zu finden. Legen Sie die Nadel 1 mm niedriger ventralen.
- Bewegen Sie mit einer Schaben Bewegung sanft die Fische Skalen beiseite und machen einen Reifenschaden. Stechen Sie die Nadel in den Körper in einem Winkel von 45° auf der Tischoberfläche.
- Schieben Sie die Nadel in Richtung der Wirbelsäule, bis es sorgfältig anliegt.
- Lassen Sie etwa 1 µL der Mikrokapseln Suspension in der Niere und langsam zurückziehen der Nadelöhrs.
Hinweis: Um die richtige Einstichstelle zu finden ist leichter, es sinnvoll zu üben, die Suche nach der Stamm Niere durch transilluminating die Fische mit einem unteren Licht, wie in Abbildung 2A und 2 bdargestellt.
- Spülen Sie den Fisch von Kopf zu Endstück mit einem Strom des Wassers, eine verschütteten Mikrokapseln an der Injektionsstelle zu entfernen.
5. in Vivo Visualisierung
- Verwenden Sie die Dissektion Schere die Kiemendeckel aus den Fischkopf entfernen und entblößen die Kiemen. Spülen Sie die Kiemen mit Wasser.
- Mit einem Löffel, übertragen Sie den Fisch auf einen Objektträger, und legen Sie es auf der Bühne des fluoreszierenden Mikroskops.
Hinweis: Stellen Sie sicher, dass die Kiemen der Fische während der nachfolgenden Verfahren nicht austrocknen. Um dies zu vermeiden, Befeuchten Sie sie regelmäßig mit Wasser und einer Pasteurpipette (etwa alle 1-2 min). - Verdunkeln den Raum und mit geringer Vergrößerung (x 10 Ziel) untersuchen die Kiemen, die fluoreszierenden Mikrokapseln zu finden.
Hinweis: Wenn das Verfahren für die Einführung von einigen fluoreszierenden Partikeln in Fisch-Kreislauf-System verwendet wird, empfiehlt es Kiemen mehrerer Personen für unerwartete fluoreszierenden Partikeln vor Injektionen zu inspizieren. Kiemen von Wildtyp Zebrafisch haben keine Autofluoreszenz, aber in einigen Fällen können sporadische fluoreszierende Partikeln (z. B. Lebensmittel Stücke oder einzelligen Symbionten) auf Kiemen vorhanden sein. Wenn nötig, solche Partikel können basierend auf ihre spezifische Form erkannt werden (z. B. Lebensmittel Stücke haben unregelmäßigen Form, im Gegensatz zu kugelförmig Mikrokapseln) oder Fluoreszenz-Spektrum (z.B. Farbe).- Wechseln Sie das Objektiv in eine höhere Größenordnung (× 40 Ziel) und positionieren Sie eine Mikrokapsel oder eine Gruppe von Mikrokapseln in der Mitte des Sichtfeldes.
- Durch Drehen des Hebels zum Hafen mit einem angeschlossenen Spektrometer. Die spektrale Signal aufzeichnen.
- Drehen Sie den Verschluss wieder in das Okular.
- Wiederholen Sie die Messungen für unterschiedliche Mikrokapseln mehrmals.
- Übertragen Sie die Fische in das Aquarium mit der richtigen Belüftung für die Wiederherstellung.
Hinweis: Mit minimalen Praxis ist es möglich zur Durchführung der Injektion und Signal Aufnahme mit einer ungefähren Geschwindigkeit von 2 bis 3 min pro Fisch. Für eine individuelle mehrmals mit dem Einsatz von wiederholten niedrig, harmlosen Dosen der Narkose oder eine andere Methode der Fixierung kann die Messung wiederholt werden. Verwenden Sie für Langzeit-Beobachtung ein System mit kontinuierlicher Narkose12.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die erzielten Ergebnisse stammen aus einer der drei Hauptkategorien des Protokolls präsentiert: die Bildung von fluoreszierenden Mikropartikel durch Verkapselung von einem Fluoreszenzfarbstoff (Abbildung 1), die Niere Injektion von Mikrokapseln mit weiteren Visualisierung in Gill Kapillaren (Abbildung 2 und 3) und schließlich die in Vivo spektrale Aufnahme SNARF-1 Fluoreszenz zu über...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Um die Injektion von Mikropartikeln in der Zebrafisch-Niere zu demonstrieren, haben wir semipermeable Mikrokapseln mit einem indikatorfarbstoff geladen. Das Protokoll enthält Anweisungen für die Herstellung der Mikrokapseln mit der Schicht für Schicht Versammlung von entgegengesetzt geladenen Polyelektrolyten7,8,15,16,17 ,18
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Autoren erkennen stark Hilfe von Bogdan Osadchiy und Evgenii Protasov (staatliche Universität Irkutsk, Russland) in Vorbereitung des video-Protokolls. Diese Forschung wurde von der russischen Science Foundation (#15-14-10008) und der Russischen Stiftung für Grundlagenforschung (#15-29-01003) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
Referenzen
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten