Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Простое и эффективное управление и визуализация микрочастиц в системе кровообращения малых рыб с помощью инъекций почек
В этой статье
Резюме
Эта статья демонстрирует принципы быстро, миниинвазивная инъекции флуоресцентные микрочастиц в circulatory system рыбки и визуализации в vivo микрочастиц в крови рыб.
Аннотация
Системного администрирования микро размера частиц в живой организм может применяться для визуализации сосудистую, наркотиков и вакцинации, имплантации крошечные оптических датчиков и трансгенных клеток. Однако внутривенного введения микроинъекций в мелких животных, которые в основном используются в биологических и ветеринарных лабораторий, очень сложны и требуют квалифицированного персонала. Здесь мы демонстрируем надежный и эффективный метод для введения микрочастиц в кровеносную систему взрослых рыбок данио (Danio рерио) путем инъекций в рыбы почек. Чтобы визуализировать введено микрочастиц в сосудистую, мы предлагаем простой метод прижизненной визуализации в жабры рыбы. В естественных условиях мониторинг pH крови данио рерио была выполнена с использованием вводят Микрокапсулированный флуоресцентный зонд, SNARF-1, чтобы продемонстрировать один из возможных применений описанные методики. Эта статья содержит подробное описание инкапсуляции рН чувствительных красителя и демонстрирует принципы быстрой инъекции и визуализации полученных микрокапсулы для записи в vivo флуоресцентного сигнала. Предложенный метод впрыска характеризуется низкой смертности (0-20%) и высокая эффективность (70-90% успеха) и это легко институт с помощью обычно доступных оборудования. Все описанные процедуры можно выполнять на других мелких рыб, таких как гуппи и оризии.
Введение
Администрация микро размера частиц в организм животных является одной из важных задач в таких областях, как наркотиков и доставки вакцины1, сосудистую визуализации2, трансгенными ячейку имплантации3и имплантации крошечные оптический датчик 4 , 5. Однако, трудно процедура имплантации микромасштабной частиц в сосудистой системе мелких лабораторных животных, особенно для деликатной водных организмов. Для популярных исследований образцов как данио рерио, он сообщил, что эти процедуры необходимо уточнить с помощью видео протоколов.
Внутрисердечной и капиллярной микроинъекций требуют квалифицированного персонала и уникальных микрохирургии зал для доставки microobjects в zebrafish кровь. Ранее ретро орбиталь ручной инъекций3 было предложено как простой и эффективный метод для управления всей клетки. Однако по нашему опыту, из-за небольшой площади глаз капиллярной сети, это занимает много практики для достижения желаемых результатов от этого метода.
Здесь мы описываем метод для надежной и эффективной микрочастица имплантации в кровеносную систему путем ручной инъекции непосредственно в ткани почек взрослых рыбок данио, который богат капилляров и почечных сосудов. Эта техника основана на протоколе видео для трансплантации клеток в zebrafish почек6, но болезненным и длительным микрохирургическое шаги были ликвидированы. Предложенный метод характеризуется низкой смертности (0-20%) и высокая эффективность (70-90% успеха) и это легко институт с помощью обычно доступных оборудования.
Важной частью предлагаемого протокола является визуализация имплантированных микрочастиц (если они флуоресцентные или раскрашенная) в капиллярах Гилл, который позволяет для проверки качества инъекции, грубый относительной оценки числа вводят частицы и обнаружение спектрального сигнала для физиологических измерений непосредственно из циркулирующей крови. В качестве примера возможных применений описаны методики, мы демонстрируем протокол для измерений в vivo данио рерио рН крови с помощью Микрокапсулированный флуоресцентного зонда, SNARF-1, первоначально предложенных в Borvinskaya и др. 20175.
протокол
Все экспериментальные процедуры были проведены в соответствии с директивой ЕС 2010/63/ЕС для экспериментов на животных и были одобрены животное темам исследований Комитета из Института биологии Иркутского государственного университета.
1. Изготовление микрокапсулы
Примечание: Микрокапсулы, ношение флуоресцентные краски готовятся с использованием слой за слоем Ассамблеи противоположно заряженных полиэлектролитов7,8. Все процедуры были выполнены при комнатной температуре.
- Для синтеза пористых СаСО3 microcores, включающего Люминесцентную краску, смешайте 2 мл раствора SNARF-1-декстрана (большинство полимер прыгните Люминесцентную краску например FITC-BSA могут использоваться) в концентрации ~ 2 мг/мл с 0,6 мл каждого из решений CaCl2 1 моль/Л и Na2CO3 под быстро помешивая.
Примечание: Обратить внимание на различные чувства флуоресцентных красителей в Фотообесцвечивание; Если используется светочувствительные флуоресцентного зонда (как SNARF-1), манипулирования и хранения микрочастиц должны выполняться с как мало света как можно скорее. - После 5-10 s агитации, передать подвеска 2 мл microcentrifuge трубы и центрифуги для 15 s на 10000-12000 g для пеллет СаСО3 microcores.
- Отменить супернатанта, мыть ядер с ~ 2 мл деионизированной воды и Ресуспензируйте гранулы путем встряхивания.
- Повторите процедуру центрифугирования промывание три раза в общей сложности. После последнего центрифугирования удалить супернатант.
- Инкубируйте microcores за 1 мин в ультразвуковой ванне для уменьшения их агрегирования.
Предупреждение: Не забудьте защитить уши с наушниками. - Внести первый полимерный слой на шаблоны, Ресуспензируйте ядер в ~ 2 мл 4 мг/мл раствора poly(allylamine hydrochloride) (ПАУ) в 1 моль/Л NaCl.
- Держите microcores в растворе для ~ 5 мин при постоянном встряхивании.
- После 15 s центрифугирования, удалить супернатант с несвязанных ПАУ. Вымойте покрыты microcores с дейонизированной водой по крайней мере 3 раза через несколько центрифугирования и мытье шаги. После последнего центрифугирования удалить супернатант.
- Инкубируйте microcores за 1 мин в ультразвуковой ванне для уменьшения их агрегирования.
Примечание: Если прикладной флуоресцентного красителя катионного, начните с поли (натрия 4-styrenesulfonate) (PSS) в 1 моль/Л NaCl (см. шаг 1.7).
- Повторите шаг 1.6 с ~ 2 мл 4 мг/мл раствора PSS (также содержащие 1 моль/Л NaCl) для депозита второй полимерный слой на шаблоны.
- Повторите шаги 1.6 и 1.7 шесть раз депозита 12 полимерные слои.
Примечание: Не рекомендуется сделать длинный перерыв (~ 12 ч или больше) в процедуре до ~ 3-5 слоев сдали потому что СаСО3 microcores без покрытия могут, как правило, recrystallize. Обратите внимание, что PSS покрытие вызывает выше агрегации microcores, и долгой паузы рекомендуется только тогда, когда ПАУ или поли L-лизин привитый с полиэтиленгликоля (PLL-g-PEG) является исключительно слой. - Проинкубируйте покрыты microcores в 2 мг/мл PLL-g ПЭГ (~ 1 мл микропробирок) для по крайней мере 2 ч.
- Мыть microcores с водой через последовательные центрифугирования и ресуспендирования шаги. После последнего центрифугирования удалить супернатант.
- Чтобы получить полые микрокапсулы, Растворите СаСО3 шаблоны, добавив 2 мл раствора 0,1 моль/Л Этилендиаминтетрауксусная кислота (ЭДТА) (с учетом рН 7,1 с NaOH) покрыты microcores.
- После ~ 5 минут инкубации, центрифуга микрокапсулы для 45 s и удалить супернатант с ЭДТА.
- Повторите шаги 1.10-1.10.1 дважды.
- Вымойте микрокапсулы с 0,9% NaCl три раза через несколько центрифугирования шаги в пределах 45 s следуют мытья шаги. После последнего шага центрифугирования удалить супернатант.
Примечание: Окончательный микрокапсульная раствор для инъекций должны храниться стерильные (например, путем добавления ампициллин, 0,1 мг/мл), и средства массовой информации должны быть биологически совместимого с целью расследования (изотонические СМИ с нейтральным pH). - Оценки концентрации подготовленных микрокапсулы в Горяева под флуоресцентным микроскопом. Сделать серию фотографий микрокапсулы, измерить диаметр о ста микрокапсулы, используя ImageJ9 или эквивалент программного обеспечения и исследовать распределение по размерам, с помощью гистограммы.
- Хранилища, полученные инкапсулированные зонд в темноте.
Примечание: после нескольких стирок в стерильного 0,9% NaCl, микрокапсулы могут храниться месяцами при 4 ° C. Полного высыхания микрокапсулы во время хранения не рекомендуется.
2. Подготовка оптические установки и калибровки Микрокапсулированный SNARF-1
Примечание: Грубая рН измерения с микрокапсулами SNARF-1 могут быть сделаны с использованием изображений в двух каналах флуоресцентный Микроскоп7, но в настоящем Протоколе, один одноканальной флуоресцентный Микроскоп связаны волоконно-спектрометр был применен.
- Установите необходимый набор фильтров флуоресценции флуоресцентный Микроскоп согласно характеристикам применяемых Люминесцентную краску и включите люминесцентных ламп.
- Вытяните рычаг окуляры.
Предупреждение: Избыток света может повредить спектрометр матрицы. Таким образом убедитесь, что рычаг находится в режиме «окуляр», когда не используется спектрометр. - Подключите один конец волоконно-оптических спектрометр и другой конец к коллиматора. С помощью адаптеров, место коллиматор в фокус камеры трубки или другой доступный порт флуоресцентный Микроскоп.
- Включите спектрометр. Запустите программу управления спектрометр и подготовить спектрометр для измерений.
- Вытяните рычаг окуляры.
- Для калибровки микрокапсульная партии место ~ 5 мкл микрокапсульная подвески (~ 10 000 микрокапсулы за мкл в деионизированной воде) на слайде микроскопа и сухой капли в темном месте (например, в термостат при температуре 35 ° C).
- Для калибровки спектральные характеристики Микрокапсулированный SNARF-1, используйте серию буферов с различными pH в диапазоне ~ 6-9. Падение ~ 10 мкл буфера на сушеные микрокапсулы с SNARF-1-декстран и покрывают его с coverslip.
- Место стеклянное скольжение на микроскопа. Найдите микрокапсулы, используя × 40 цель.
- Поверните рычаг Микроскоп к порту камеры. Зарегистрируйте их флуоресценции с помощью спектрометра. Поверните рычаг обратно в окуляры.
Примечание: Убедитесь, что спектральная сигнал выходит далеко за рамки фонового уровня и убедитесь что микрокапсулы в поле зрения не в пузырь (путем переключения на нижней увеличение при необходимости). Избегайте длительного освещения же микрокапсулы. SNARF-1 чувствителен к Фотообесцвечивание. - Повторите шаг 2.2.3 для различных микрокапсулы 10 - 15 раз.
- Рассчитать коэффициенты пика флуоресценции (например, с помощью R или Scilab) для всех зарегистрированных спектров и определить линии регрессии между средний коэффициент (для каждого буфера) и Средний рН, по следующей формуле:
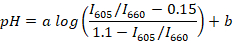
Примечание: SNARF-1 имеет спектр с двумя пиками, соответствующих выбросов протонированных и депротонированная красителя, и соотношение между пиками реагировать рН среды. В этом исследовании используется соотношение между интенсивностью флуоресценции для 605 и 660 нм. Эти длины волн выбираются в зависимости от используемых набор фильтров. и b являются коэффициенты определяются нелинейной регрессии (например, с помощью R). Значения, 0,15 и 1.1 являются, соответственно, минимальное и максимальное значения я605/iий660 наблюдается во время калибровки. - Соберите около 10 мкл крови рыб от приблизительно 5 взрослых животных. Место рыбы в чашке Петри с 1 мкл/мл воды подвеска гвоздичное масло для анестезии и подождать до тех пор, пока животное оказывается на его стороне и перестает отвечать на щепотки плавника (обычно ~ 2-3 мин). Передача рыбы на стеклянное скольжение. Отрезать хвост рыбы с стрельчатые и собирать примерно 2 мкл крови рыб из Вены хвост.
Примечание: Для предотвращения свертывания крови, лечить разрез с гепарином (5000 ед/мл) и использовать гепаринизированным стеклянные капилляры и microcentrifuge трубки для сбора крови.- Капельного около 10 мкл крови с пипеткой на кончик микроэлектродные и определить с помощью рН метр pH.
- Капля крови на слайд с микрокапсулами сушеные и зарегистрировать отношение интенсивности флуоресценции, как описано для калибровки буферов (шаги 2.2-2.3).
- Отрегулируйте коэффициент линейной калибровочной кривой сделать кривой соответствуют измерениям в крови рыбы (для более подробную информацию см. Borvinskaya et al. 20175).
3. подготовка для инъекций
- Выпуск стальной иглой от кончика инсулина пера (или шприц), удалив пластиковые с острым Ланцет.
Примечание: Любой тонкой иглой (Ø0.33 мм или меньше) или стеклянные капиллярные (обычно Ø1 мм) могут быть подготовлены для микроинъекции10,11. - Вставьте иглу на полпути в микрокапиллярной стекла; быстро и аккуратно спаять его с помощью газовой горелки.
- Подключите микрокапиллярной стекла к microinjector и промыть стерильной водой три раза. Убедитесь, что жидкость течет через иглу.
- Заполните систему с дистиллированной водой.
Примечание: Убедитесь, что в системе существует никаких пузырей.
4. инъекции
- Ресуспензируйте подготовленный подвеска микрокапсулы (стерильного 0,9% NaCl, или любые другие средства массовой информации используются для инъекций, с концентрацией 0,5 до 6 миллионов микрокапсулы в микролитр) с помощью Ультразвуковая ванна на 1 мин.
Примечание: Поскольку микрокапсулы, как правило, осадок, во время следующей инъекции, встряхните флакон с микрокапсулами механически (с помощью ротора) или вручную каждые несколько минут, чтобы Ресуспензируйте их и предотвращать их агрегирования. - Место рыбы в чашке Петри с анестетиком (0,1 мл/Л масла гвоздики, взвешенных в воде) ~ 2-3 минут ждать пока рыба превращается на его стороне и перестает отвечать на легкий Пинч плавника.
- С помощью ложки, передача рыбы из анестетиков и осторожно поместите его на влажной губкой в боковой позиции с головой влево (для правша) или вправо (для левшей человека).
- Как раз перед инъекцией сосать 1-2 мм воздуха в стеклянный капилляр связаны с microinjector. Затем загрузите его с приблизительно 2 мкл дисперсной микрокапсулы.
Примечание: Перед инъекцией, микрокапсульная решения должны быть скорректированы до температуры, на котором хранятся рыбы. - Аккуратно стабилизируйте тело рыбы на губку с недоминирующей руки.
- Найти боковой линии рыб. Мысленно выделите сегмент, который простирается от крышечки до конца брюшной полости. Найти в середине этого сегмента. Положите иглы 1 мм ниже в вентральной направлении.
- Соскоб движением аккуратно переместите Рыба весы в сторону и сделать прокол. Вставьте иглу в тело под углом 45° к поверхности стола.
- Вставьте иглу к позвоночника до тех пор, пока он тщательно лежит против него.
- Выпуск примерно 1 мкл суспензии микрокапсулы в почках и медленно снять иглу.
Примечание: Чтобы найти надлежащее прокол сайт более легко, полезно практике найти ствол почек, к рыб, используя свет снизу, как показано на рис. 2A и 2B.
- Промывайте рыбу от головы до хвоста с потоком воды, чтобы удалить любые пролитой микрокапсулы в месте инъекции.
5. Визуализация в естественных условиях
- Используйте ножницы рассечение, чтобы удалить жаберной крышки из головы рыбы и оголять жабры рыбы. Промывайте жабры с водой.
- С помощью ложки, передача рыбы для микроскопа и поместите его на сцене флуоресцентный Микроскоп.
Примечание: Убедитесь, что жабры рыбы не высохнуть в течение последовательных процедур. Чтобы избежать этого, периодически смачивают их водой с помощью пипетки Пастера (примерно каждые 1-2 мин). - Затемнить номер и используя низкий масштаб (x 10 цель) осмотрите жабры найти флуоресцентные микрокапсулы.
Примечание: При процедуре используется для внедрения некоторых флуоресцентные частицы в рыбы сердечно-сосудистой системы, рекомендуется проверять жабры нескольких лиц для неожиданных флуоресцентные частицы до инъекции. Жабры данио рерио одичал типа не имеют аутофлюоресценция, но в некоторых случаях отдельные флуоресцентные частицы (как куски пищи или одноклеточные симбионтами) могут присутствовать на жабры. При необходимости, такие частицы могут быть признаны на основании их определенной формы (например, куски пищи имеют неправильную форму, в отличие от сферического микрокапсулы) или спектр флуоресценции (то есть, цвет).- Переключитесь выше величины (цель × 40) объектив и положение микрокапсульная или группы микрокапсулы в центре поля зрения.
- Поверните рычаг в порт с подключенного спектрометр. Запись спектрального сигнала.
- Поверните рычаг обратно в окуляр.
- Повторите измерения для различных микрокапсулы несколько раз.
- Трансфер рыбы в аквариуме с надлежащей аэрации для восстановления.
Примечание: С минимальной практике, это возможно для выполнения инъекций и сигнал записи с приблизительной скоростью 2-3 мин на рыбу. Измерение может быть повторен для отдельных несколько раз с использованием повторных доз низкой, безвредные анестезии или другой метод фиксации. Для долгосрочного наблюдения используйте систему с непрерывной анестезии12.
Результаты
Полученные результаты приходят от одного из трех основных категорий представленных протокола: формирование флуоресцентный микрочастиц путем инкапсуляции флуоресцентные краски (рис. 1), почки инъекции микрокапсулы с дальнейшей визуализации в Джилл к?...
Обсуждение
Чтобы продемонстрировать инъекции микрочастиц в почках данио рерио, мы использовали полупроницаемой микрокапсулы, загружен с красителем индикатора. Таким образом в протоколе содержатся инструкции для изготовления микрокапсулы, используя слой за слоем Ассамблея противоположно заря?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы признают значительно помощью Богдан Осадчий и Евгений Протасов (Иркутский государственный университет, Россия) в рамках подготовки видео протокола. Это исследование было поддержано Российского научного фонда (#15-14-10008) и российского фонда фундаментальных исследований (#15-29-01003).
Материалы
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
Ссылки
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645 (2009).
- Gurkov, A., Shchapova, &. #. 1. 0. 4. 5. ;., Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427 (2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725 (2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. . ImageJ User Guide - Version 1.44. , (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018 (2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960 (2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065 (2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839 (2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены