A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניהול פשוטה ויעילה והדמיה של Microparticles במערכת הדם של דגים קטנים באמצעות הזרקת כליות
In This Article
Summary
מאמר זה מדגים את העקרונות של זריקה מהירה, פולשנית של פלורסנט microparticles את circulatory system של דגים קטנים, הפריט החזותי ויוו של microparticles בדם דגים.
Abstract
המינהל מערכתית של חלקיקים בגודל מיקרו לתוך אורגניזם יכול להיות מיושם להערכת ויזואליזציה, סמים, משלוח חיסון, ההשתלה של תאים הטרנסגניים וחיישנים אופטי זעיר. עם זאת, microinjections תוך ורידי לתוך חיות קטנות, אשר משמשים בעיקר במעבדות ביולוגי, וטרינרית, קשה מאוד, דורשת צוות מיומן. במסמך זה, נדגים שיטה חזקה ויעילה המבוא של microparticles לתוך מערכת הדם של דג זברה למבוגרים (רזבורה rerio) על ידי זריקה לתוך הכליה דגים. כדי להמחיש את microparticles הציג ב להערכת, אנו מציעים טכניקה פשוטה הדמיה intravital ב זימים של דג. In vivo ניטור pH הדם דג זברה הושג באמצעות פלורסנט microencapsulated מוזרק בדיקה, SNARF-1, כדי להדגים את אחד היישומים האפשריים של הטכניקה המתוארת. מאמר זה מספק תיאור מפורט העטיפה של pH רגיש צבע ומדגים את עקרונות הזריקה מהירה והדמיה של מהמיקרו קפסולות שהושג ויוו הקלטה של האות פלורסנט. השיטה המוצעת של הזרקת מאופיין על ידי שיעור התמותה נמוכה (0-20%) ואת יעילות גבוהה (70-90% הצלחה), וזה קל של מכון התקנים באמצעות ציוד זמין נפוץ. ניתן לבצע בכל ההליכים המתוארים במינים אחרים של דגים קטנים, כגון דגים ו- medaka.
Introduction
המינהל של חלקיקים בגודל מיקרו לתוך אורגניזם בעל חיים הינה משימה חשובה בתחומים כמו סמים, חיסון משלוח1, להערכת ויזואליזציה2, תא הטרנסגניים השרשה3וחיישן אופטי זעיר השרשה 4 , 5. עם זאת, הליך ההשתלה microscale חלקיקים לתוך מערכת כלי הדם של חיות מעבדה קטנה קשה, במיוחד עבור אורגניזמים ימיים עדין. עבור דגימות מחקר פופולרי כמו דג זברה, מומלץ כי הליכים אלה מובהר, שימוש בפרוטוקולי הוידאו.
Microinjections intracardiac, נימי דורשים צוות מיומן ומתקני למיקרו ייחודי למסירה של microobjects לדם דג זברה. בעבר, הזרקת ידנית רטרו-מסלולית3 הוצע כמו שיטת קלה ויעילה לניהול התוכן של תאים שלמים. עם זאת, מניסיוננו, בגלל שטח קטן של הרשת נימי העין, זה לוקח הרבה ניסיון כדי להשיג את התוצאה הרצויה של טכניקה זו.
במסמך זה, אנו מתארים שיטה חזקה ויעילה microparticle השרשה לתוך מערכת הדם על ידי זריקה ידנית ישירות לתוך רקמת הכליה של דג זברה בוגרת, אשר הוא עשיר נימים וכלי כליות. טכניקה זו מבוססת על פרוטוקול וידאו עבור השתלת תא לתוך הכליה דג זברה6, אך השלבים המיקרוכירורגית טראומטי ולגזול חוסלו. השיטה המוצעת מאופיין התמותה נמוכה (0-20%) ואת יעילות גבוהה (70-90% הצלחה), וזה קל של מכון התקנים באמצעות ציוד זמין נפוץ.
חלק חשוב של הפרוטוקול המוצע הוא החזיית מושתל microparticles (אם הם נמצאים פלורסנט או ולצבוע אותם) הנימים גיל, מה שמאפשר עבור האימות של איכות הזרקה, הערכה יחסית קשה של מספר חלקיקים מוזרק, זיהוי האות ספקטרלי מדידות פיזיולוגיות ישירות מתוך במחזור הדם. כדוגמה היישומים האפשריים של הטכניקה המתוארת, נדגים את פרוטוקול ויוו מדידות של דג זברה החומציות בדם באמצעות בדיקה פלורסנט microencapsulated, SNARF-1, Borvinskaya שהוצע במקור ב et al. 20175.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ההליכים ניסיוני נערכו בהתאם להנחיית האיחוד האירופי 2010/63/האיחוד האירופי על ניסויים בבעלי חיים, אושרו על ידי החיה נושאים מחקר הוועדה של המכון לביולוגיה באוניברסיטת אירקוטסק.
1. ייצור של מהמיקרו קפסולות
הערה: נושא של הפלורסנט מהמיקרו קפסולות מוכנות תוך שימוש אסיפה שכבה אחרי שכבה של הפוך טעונה polyelectrolytes7,8. כל ההליכים בוצעו בטמפרטורת החדר.
- לסנתז נקבובי microcores3 של קאקו, תוחמת את הפלורסנט, מערבבים 2 מ"ל של הפתרון SNARF-1-לתוספי (רוב פולימר מכורך הפלורסנט כגון FITC-BSA יכול לשמש)-ריכוז של ~ 2 מ"ג/מ"ל עם 0.6 מ"ל כל אחד הפתרונות 1 מול/ליטר של CaCl2 ו-2CO נה3 תחת ערבוב מהיר.
הערה: שימו לב שהיא התכוונה שונים של צבעי פלורסנט כדי photobleaching; אם בדיקה פלורסנט רגישים לאור (כמו SNARF-1), מניפולציה ואת אחסון של microparticles חייב להתבצע עם כמו אור קטן ככל האפשר. - לאחר 5-10 s של עצבנות, להעביר את המתלים צינורות microcentrifuge 2 מ"ל, צנטריפוגה 15 s ב 10,000-12,000 g כדי הצניפה קאקו3 microcores.
- למחוק את תגובת שיקוע, לשטוף את הליבות עם ~ 2 מ ל מים יונים, resuspend בגדר ע י ניעור.
- חזור על הפעולות צנטריפוגה-כביסה שלוש פעמים בסך הכל. לאחר צנטריפוגה אחרון, להשליך את תגובת שיקוע.
- דגירה של microcores עבור 1 דקות באמבט אולטראסוני כדי להפחית את מצבור שלהם.
התראה: אל תשכחו להגן על האוזניים עם אוזניות. - להפקיד את השכבה הראשונה פולימריים על התבניות, resuspend הליבות ב ~ 2 מ"ל של פתרון 4 מ"ג/מ"ל של poly(allylamine hydrochloride) (הפה) 1 מול/ליטר NaCl.
- שמור microcores את הפתרון עבור ~ 5 דקות עם טלטול מתמיד.
- לאחר 15 s של צנטריפוגה, למחוק את תגובת שיקוע עם הפה לא מאוגד. לשטוף את microcores מכוסה עם מים יונים לפחות 3 פעמים באמצעות צנטריפוגה מרובים ושטיפת צעדים. לאחר צנטריפוגה אחרון, להשליך את תגובת שיקוע.
- דגירה של microcores עבור 1 דקות באמבט אולטראסוני כדי להפחית את מצבור שלהם.
הערה: אם יישומי הפלורסנט cationic, להתחיל פוליפוני (נתרן 4-styrenesulfonate) (PSS) 1 מול/ליטר NaCl (ראה שלב 1.7).
- חזור על שלב 1.6 עם ~ 2 מ"ל של פתרון 4 מ"ג/מ"ל של PSS (גם המכיל mol 1/L NaCl) להפקיד את השכבה השנייה פולימריים על התבניות.
- חזור על שלבים 6 פעמים 1.6 ל- 1.7 להפקיד 12 שכבות פולימריים.
הערה: לא מומלץ לקחת הפסקה ארוכה (~ 12 שעות או יותר) במסגרת ההליך עד ~ 3-5 שכבות נצברים קאקו microcores3 ללא כיסוי עשוי נוטים recrystallize. שים לב PSS כיסוי גורם צבירה גבוה יותר של microcores, הפסקה ארוכה, מומלץ שרק כאשר הפה או פולי-L-ליזין הושתל עם פוליאתילן גליקול (PLL-g-PEG) היא השכבה החיצוני ביותר. - דגירה של microcores מקורה ב- 2 מ"ג/מ"ל של PLL-g-יתד (~ 1 מ"ל לכל microtube) כבר לפחות שעתיים.
- לשטוף את microcores עם מים בעזרת צנטריפוגה רציפים והשלבים resuspension. לאחר צנטריפוגה אחרון, להשליך את תגובת שיקוע.
- כדי להשיג מהמיקרו קפסולות חלול, מתמוסס התבניות3 קאקו על-ידי הוספת 2 מ של 0.1 מול/ליטר ethylenediaminetetraacetic חומצה (EDTA) פתרון (מותאם pH 7.1 עם NaOH) microcores מקורה.
- לאחר ~ 5 דקות של דגירה, centrifuge מהמיקרו קפסולות עבור 45 s ו להשליך תגובת שיקוע עם EDTA.
- חזור על שלבים 1.10-1.10.1 פעמיים.
- לשטוף מהמיקרו קפסולות עם 0.9% NaCl 3 פעמים באמצעות צנטריפוגה מספר צעדים בתוך 45 s ולאחריה שטיפה צעדים. לאחר השלב האחרון צנטריפוגה, למחוק את תגובת שיקוע.
הערה: הפתרון הסופי microcapsule להזרקה חייב להישמר סטרילי (לדוגמה על-ידי הוספת אמפיצילין, 0.1 מ"ג/מ"ל), התקשורת. לא מסתיימים מושא החקירה (מול מדיה עם חומציות ניטראלית). - מעריכים את ריכוז מהמיקרו קפסולות מוכן ב hemocytometer תחת מיקרוסקופ זריחה. בסדרת תמונות של מהמיקרו קפסולות, למדוד את הקוטר על מאה מהמיקרו קפסולות באמצעות תוכנה9 או שווה ערך ImageJ, ולחקור את התפלגות גודל באמצעות היסטוגרמה.
- חנות שהושג אנקפסולציה בדיקה בחושך.
הערה: לאחר מספר כביסות סטרילי 0.9% NaCl, מהמיקרו קפסולות ניתן לאחסן במשך חודשים-4 מעלות צלזיוס. לא מומלץ ייבוש מוחלט של מהמיקרו קפסולות במהלך האחסון.
2. הכנת ההתקנה אופטי וכיול של SNARF Microencapsulated-1
הערה: מדידות pH קשה עם SNARF microencapsulated-1 יכול להתבצע באמצעות תמונות בשני ערוצים של מיקרוסקופ פלואורסצנטי7, אך ב פרוטוקול זה מיקרוסקופ פלואורסצנטי ערוץ אחד מחובר ספקטרומטר סיבים היה מוחל.
- מקום קבוצת זריחה מסננים כדי מיקרוסקופ פלואורסצנטי לפי מאפייני הפלורסנט להחיל הנדרש והפעל את נורה פלואורסצנטית.
- למשוך את הידית עיניות.
התראה: עודף אור יכול להזיק המטריקס ספקטרומטר. לפיכך, ודא כי המנוף הוא במצב "עינית" כאשר ספקטרומטר אינו בשימוש. - חבר קצה אחד של סיבים אופטיים של ספקטרומטר ואת הקצה השני קולימטור. באמצעות מתאמי, מקם את קולימטור המוקד של הצינור מצלמה או אחרים היציאות הזמינות של מיקרוסקופ פלואורסצנטי.
- הפעל את ספקטרומטר. הפעל את תוכנית בקרה ספקטרומטר ולהתכונן ספקטרומטר את המידות.
- למשוך את הידית עיניות.
- לצורך כיול של אצוות microcapsule, מקום ~ 5 µL של ההשעיה microcapsule (~ 10 000 מהמיקרו קפסולות לכל µL במים יונים) בשקופית מיקרוסקופ, יבש הירידה במקום חשוך (לדוגמה, בתרמוסטט-35 ° C).
- כדי לכייל את מאפייני ספקטרלי של microencapsulated SNARF-1, השתמש סדרה של מאגרי בערכי pH שונים בטווח ~ 6-9. זרוק ~ 10 µL של מאגר על גבי מהמיקרו קפסולות מיובשים עם SNARF-1-לתוספי, לכסות את זה עם coverslip.
- מקם את השקופית זכוכית על הבמה מיקרוסקופ. אתר מהמיקרו קפסולות באמצעות יעד 40 ×.
- לפנות את ידית מיקרוסקופ יציאת המצלמה. הירשם פלורסצנטיות שלהם עם ספקטרומטר. להפוך את הידית בחזרה אל עיניות.
הערה: ודא כי האות ספקטרלי הוא הרבה מעבר לרמת הרקע ולהבטיח כי מהמיקרו קפסולות של שדה הראייה אינם בבועה (על-ידי המעבר הגדלה נמוכה במידת הצורך). הימנע תאורה ממושך של אותו מהמיקרו קפסולות. SNARF-1 הוא רגיש photobleaching. - חזור על צעד 2.2.3 10 - 15 פעמים מהמיקרו קפסולות שונות.
- לחשב את יחס שיא קרינה פלואורסצנטית (לדוגמה, שימוש R או Scilab) עבור כל ספקטרום רשום ולקבוע קו הרגרסיה בין יחס החציוני (עבור כל מאגר) בינוני pH באמצעות הנוסחה הבאה:
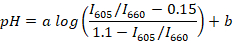
הערה: SNARF-1 יש קשת עם שתי הפסגות התואם פליטת לצבוע protonated ו- deprotonated, היחס בין הפסגות מגיבים ה-pH של המדיום. במחקר זה, משמש היחס בין עוצמת קרינה פלואורסצנטית עבור 605, 660 ננומטר. אורכי גל אלה נבחרו בהתאם לקבוצת מסנן בשימוש. ו- b הם המקדמים שייקבעו ע י רגרסיה ליניארי (לדוגמה, שימוש R). הערכים 0.15 ו- 1.1 הם, בהתאמה, ערכי המינימום והמקסימום של אני605/I660 נצפתה במהלך הכיול. - לאסוף 10 µL של דם דגים כ 5 חיות למבוגרים. המקום דגים לתוך צלחת פטרי עם µL 1/מ"ל מים השעיה של שמן ציפורן על הרדמה ולחכות עד החיה מסתובב על צידה, מפסיק להגיב קמצוצים הסנפיר (בדרך כלל ~ 2-3 דקות). להעביר את הדג על משטח זכוכית. לנתק את הזנב דגים עם אזמל מנתחים ולאסוף כ 2 µL של דם דגים מן הווריד של הזנב.
הערה: כדי למנוע קרישת הדם, לטיפול החתך עם הפרין (5000 U/mL) ולהשתמש נימים זכוכית heparinized וצינורות microcentrifuge כדי לאסוף את הדם.- לטפטף בערך 10 µL של דם עם פיפטה אל קצה microelectrode ולקבוע את ה-pH באמצעות מד pH.
- זרוק את הדם לשקופית עם מהמיקרו קפסולות מיובשים ולרשום את היחס של עוצמת קרינה פלואורסצנטית כמתואר על המאגרים כיול (שלבים 2.2-2.3).
- התאם את מקדם ליניארי של עקומת כיול כדי להפוך את עקומת להתאים את המידות בדם דגים (עבור פרטים נוספים ראה Borvinskaya et al. . 20175).
3. הכנה הזרקה
- שחרר את המחט פלדה מהקצה של עט אינסולין (או מזרק) על-ידי הסרת הפלסטיק עם אזמל מנתחים חדה.
הערה: כל מחט דקה (Ø0.33 מ מ או פחות) או יכול להיות מוכנים נימי זכוכית (בדרך כלל Ø1 מ"מ) microinjection10,11. - להכניס את המחט בחצי הדרך microcapillary זכוכית; במהירות ובעדינות הלחמה אותו באמצעות מבער גז.
- לחבר את microcapillary זכוכית microinjector ולא לשטוף את זה עם מים סטריליים שלוש פעמים. ודא כי הנוזל זורם דרך המחט.
- למלא את המערכת עם מים מזוקקים.
הערה: ודא כי קיימים אין בועות בתוך המערכת.
4. הזרקה
- Resuspend על השעיית מהמיקרו קפסולות מוכן (סטרילי 0.9% NaCl או לכל מדיה אחרת המשמשים הזריקות, עם ריכוז של 0.5 ל 6 מיליון פרצת לכל microliter) באמצעות האמבט קולי עבור 1 דקות.
הערה: מאז מהמיקרו קפסולות נוטים לזרז, במהלך הזריקה הבאה, לנער את המבחנה עם מהמיקרו קפסולות מכנית (באמצעות רוטור) או באופן ידני כל כמה דקות כדי resuspend אותם ולמנוע צבירת שלהם. - מניחים את הדג לתוך צלחת פטרי עם הרדמה (0.1 מ"ל/ליטר של שמן ציפורן מושעה במים) עבור ~ 2-3 דק. חכה עד הדגים מסתובב על צידה, מפסיק להגיב קמצוץ אור של הסנפיר.
- בעזרת כפית, להעביר את הדג מהאגף ההרדמה ומניחים בעדינות אותו על ספוג לח במצב לרוחב עם הראש לכיוון השמאל (עבור אדם ימני) או לכיוון ימין (לאדם שמאלי).
- לפני הזריקה, למצוץ 1-2 מ מ של אוויר לתוך כוס נימי קשור microinjector. אז, לעזאזל עם µL כ- 2 של מהמיקרו קפסולות התפזרו.
הערה: לפני הזריקה, הפתרון microcapsule חייב להיות מותאם לטמפרטורה שבה נשמרים הדג. - בעדינות לייצב את הגוף של הדג על הספוג ביד האחרת.
- למצוא את קו הצד של הדג. נפשית בחר מקטע המרחיבה operculum לסופו של חלל הבטן. למצוא את האמצע של קטע זה. לשים את המחט 1 מ מ נמוך יותר כיוון הגחון.
- עם תנועה מגרד, להניע בעדינות הדג קשקשים הצידה, וגם לעשות נקב. הכנס את המחט לתוך הגוף בזווית של 45 מעלות על פני השטח בטבלה.
- דחוף את המחט לכיוון עמוד השדרה עד שתוצב בקפידה נגד זה.
- שחרור כ 1 µL של ההשעיה של מהמיקרו קפסולות לתוך הכליה, לאט לאט למשוך את המחט.
הערה: כדי למצוא את החדירה נכונה בקלות רבה יותר, שימושי לאימון מציאת עורק הכליה על ידי transilluminating הדגים באמצעות אור למטה, כפי שמוצג 2A ו- 2B.
- לשטוף את הדג מהראש אל הזנב עם זרם מים כדי להסיר כל מהמיקרו קפסולות שנשפך באתר הזרקת.
5. להדמיה in Vivo
- להשתמש את המספריים לנתיחה כדי להסיר את מכסה הזימים ראש דג, מערטל את הזימים של דג. שטוף הזימים עם מים.
- בעזרת כפית, להעביר את הדג על שקופית מיקרוסקופ, ומניחים אותו על השלב של מיקרוסקופ פלואורסצנטי.
הערה: ודא כי הגג של הדג לא יתייבש במהלך הליכי רצופים. כדי למנוע זאת, מדי פעם להרטיב אותן עם מים באמצעות פיפטה של פסטר (כ כל דקה 1-2). - להכהות את החדר, באמצעות הגדלה נמוכה (x 10 המטרה) לבדוק הזימים למצוא מהמיקרו קפסולות פלורסנט.
הערה: כאשר ההליך משמשת היכרות ראשונית של כמה חלקיקים פלורסנט לתוך מערכת הדם דגים, מומלץ לבחון זימים של כמה אנשים עבור חלקיקים פלורסנט לא צפוי לפני זריקות. זימים של פראי-סוג דג זברה autofluorescence, אך במקרים מסוימים חלקיקים פלורסנט ספורדי (כמו חתיכות אוכל או אנחנו חיים איתם בסמביוזה חד־תאיות) עשוי להיות נוכח על הזימים. אם יש צורך, חלקיקים כאלה ניתן לזהות המבוססת על צורתם ספציפי (לדוגמה, חתיכות אוכל יש צורה לא סדירה, בניגוד מהמיקרו קפסולות כדורית) או ספקטרום קרינה פלואורסצנטית (קרי, צבע).- לעבור את העדשה גבוה יותר בסולם ריכטר (המטרה × 40), והצב את microcapsule או קבוצת מהמיקרו קפסולות במרכז שדה הראייה.
- לפנות את הידית היציאה עם ספקטרומטר מחוברים. להקליט את האות ספקטרלי.
- להפוך את הידית בחזרה אל העינית.
- חזור על המדידות מספר פעמים מהמיקרו קפסולות שונות.
- להעביר את הדגים באקווריום עם אוורור נאות להתאוששות.
הערה: עם אימון מינימלי, זה אפשרי לבצע את ההזרקה ושידור הקלטת בשיעור מקורב של 2-3 דקות לכל דג. ניתן לחזור על המדידה עבור אחד מספר פעמים בודדות עם השימוש במינון נמוך, לא מזיק חוזרות ונשנות של הרדמה או שיטה אחרת של קיבעון. להשגחה לטווח ארוך, להשתמש במערכת עם הרדמה רציפה12.
Access restricted. Please log in or start a trial to view this content.
תוצאות
התוצאות שהושג בא מאחד לשלוש קטגוריות עיקריות של פרוטוקול שהוצגו: היווצרות של פלורסנט microparticles על ידי ומגעים צבע פלורסנט (איור 1), הזרקה כליות של מהמיקרו קפסולות עם עוד יותר את הפריט החזותי גיל נימים (איור 2 ו 3) וההקלטה, בסו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
כדי להדגים את הזריקה של microparticles לתוך הכליה דג זברה, השתמשנו חדיר למחצה מהמיקרו קפסולות עמוסה של אינדקטור. כך, הפרוטוקול מכיל הוראות להרכבת מהמיקרו קפסולות באמצעות מכלול שכבה אחרי שכבה טעונה הפוך polyelectrolytes7,8,15,16,
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אין לחשוף.
Acknowledgements
מחברים מאוד להכיר את העזרה של בוגדן Osadchiy, ייבגני Protasov (אוניברסיטת המדינה של אירקוטסק, רוסיה) בהכנה של פרוטוקול וידאו. מחקר זה נתמך על ידי קרן המדע הרוסי (#15-14-10008) וקרן רוסי למחקר בסיסי (#15-29-01003).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
References
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved