Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Basit ve etkili yönetim ve küçük balıklar böbrek enjeksiyon kullanarak dolaşım sistemi içinde Microparticles görselleştirme
Bu Makalede
Özet
Bu makalede, floresan microparticles hızlı, minimal invaziv enjeksiyon circulatory system küçük balıklar ve balık kan microparticles in vivo görselleştirme içine prensipleri gösterilir.
Özet
Canlı bir organizma içine mikro büyüklükteki parçacıkların yönetim sistemik damarlara görselleştirme, ilaç ve aşı teslim, transgenik hücreleri ve küçük optik sensörler implantasyonu için uygulanabilir. Ancak, biyolojik ve veteriner laboratuvarları çoğunlukla kullanılan, küçük hayvanların içine intravenöz microinjections çok zor ve eğitimli personel gerektirir. Burada, biz balık böbrek içine enjeksiyon tarafından microparticles giriş yetişkin zebra balığı (Danio rerio) dolaşım sistemi içine için sağlam ve verimli bir yöntem göstermek. Damarlara tanıtılan microparticles görselleştirmek için balık solungaçları basit bir intravital görüntüleme tekniği öneriyorum. Vivo zebra balığı kan pH kontrolü başarılı bir enjekte microencapsulated floresan kullanarak sonda, SNARF-1, açıklanan tekniği mümkün uygulamalarından birini göstermek için. Bu makalede pH duyarlı boya encapsulation ayrıntılı bir açıklamasını ve hızlı enjeksiyon prensipleri ve görselleştirme floresan sinyali VIVO içinde kayıt için elde edilen microcapsules gösterir. Enjeksiyon önerilen yöntemi düşük mortalite oranı ile karakterizedir (0-%20) ve yüksek verimlilik (% 70-90 başarı) ve yaygın olarak bulunan cihazlar kullanılıyor Enstitü kolaydır. Tüm açıklanan yordamları süs balıkları ve medaka gibi diğer küçük balık türleri üzerinde gerçekleştirilebilir.
Giriş
Mikro büyüklükteki parçacıklar yönetim hayvan bir organizma içine ilaç ve aşı teslim1, damarlara görselleştirme2, transgenik hücre implantasyonu3ve küçük optik sensör implantasyon gibi alanlarda önemli bir görevdir 4 , 5. ancak, implantasyon yordam microscale parçacıklar halinde küçük Laboratuvar hayvanlarının damar sistemi için özellikle hassas Sucul organizmalar için zordur. Zebra balığı gibi popüler araştırma numuneler için bu tavsiye edilir bu yordamları açıklık video protokollerini kullanarak.
İntrakardiyak ve kapiller microinjections'microobjects dır zebra balığı kana eğitimli personel ve benzersiz mikrocerrahi özellikleri gerektirir. Daha önce bir retro-orbital el ile enjeksiyon3 tüm hücreleri yönetim için kolay ve etkili bir yöntem olarak önerilmiştir. Ancak, deneyim, göz kılcal ağ küçük alanı nedeniyle bu teknik üzerinden istenilen sonucu elde etmek için çok pratik alır.
Burada, biz güçlü ve verimli microparticle implantasyon dolaşım sistemi içine için bir yöntem yetişkin zebra balığı, böbrek dokusunun içine doğrudan el ile enjeksiyonla kılcal damar ve böbrek damarlarının açısından zengin olduğu açıklanmaktadır. Bu teknik zebra balığı böbrek6içine hücre transplantasyonu için video protokolünü dayanır ama travmatik ve zaman alıcı mikrocerrahi adımları elendi. Önerilen yöntem tarafından düşük mortalite ile karakterizedir (0-%20) ve yüksek verimlilik (% 70-90 başarı) ve yaygın olarak bulunan cihazlar kullanılıyor Enstitü kolaydır.
Hangi enjeksiyon kalite, sayısı bir kaba göreli değerlendirme doğrulanmasına izin verir (floresan veya renkli olmaları durumunda) implant microparticles gill kılcal damarlar içinde görselleştirme önerilen protokol önemli bir parçası olduğunu enjekte parçacıklar ve dolaşımdaki kandan doğrudan fizyolojik ölçümler için spektral sinyal algılama. Açıklanan tekniği olası uygulamaları bir örnek olarak, biz SNARF-1, ilk olarak önerilen Borvinskaya bir microencapsulated floresan sonda kullanarak zebra balığı kan pH vivo ölçümleri için protokol göstermek ve ark. 20175.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm deneysel yordamlar AB Direktifi 2010/63/AB hayvan deneyleri için uygun olarak yapılmıştır ve hayvan konularda araştırma komitesi, Enstitüsü biyoloji Irkutsk State Üniversitesi tarafından onaylanmıştır.
1. Microcapsules imalatı
Not: bir floresan boya taşıyan Microcapsules ters şarj edilmiş polyelectrolytes7,8katman katman Meclisi kullanarak hazırlanır. Tüm yordamları oda sıcaklığında yapıldı.
- Gözenekli CaCO3 microcores floresan boya kapsayan sentezlemek için 2 mL (çoğu polimer bağlı floresan boya FITC-BSA gibi kullanılabilir) SNARF-1-dextran çözeltisi ~ 2 mg/mL konsantrasyonu 0.6 mL ile her biri 1 mol/L çözümleri CaCl2, mix ve Na2CO3 hızlı karıştırma altında.
Not: floresan boyalar farklı hassasiyetleri photobleaching için dikkat; bir ışığa duyarlı floresan sonda (gibi SNARF-1) kullandıysanız, işleme ve depolama microparticles ile mümkün olduğunca az ışık olarak gerçekleştirilmelidir. - Sonra 5-10 s ajitasyon, süspansiyon 2 mL microcentrifuge tüpler ve santrifüj 15 transfer 10.000-12.000 CaCO3 microcores cips için g, s.
- Süpernatant atmak, çekirdek ~ 2 mL deiyonize su ile yıkayın ve Pelet sallayarak resuspend.
- Toplamda üç kez Santrifüjü yıkama yordamı yineleyin. Son Santrifüjü sonra süpernatant atmak.
- Microcores onların toplama azaltmak için bir ultrasonik banyo 1 dk. için kuluçkaya.
Dikkat: kulak kulaklık ile korumak unutmayın. - İlk polimer katman şablonlar yatırmak için ~ 2 mL bir 4 mg/mL lik poly(allylamine hydrochloride) (PAH) 1 mol/L NaCl içinde çekirdek resuspend.
- Microcores ~ 5 dakika sürekli sallayarak ile çözüm unutmayın.
- 15 sonra Santrifüjü, s süpernatant ilişkisiz PAH ile atmak. Kapalı microcores en az 3 kez aracılığıyla birden çok Santrifüjü ve adımları yıkama deiyonize su ile yıkayın. Son Santrifüjü sonra süpernatant atmak.
- Microcores onların toplama azaltmak için bir ultrasonik banyo 1 dk. için kuluçkaya.
Not: Uygulamalı floresan boya katyonik ise, poli (sodyum 4-styrenesulfonate) başlatma (PSS) ın 1 mol/L NaCl (bkz. Adım 1.7).
- 1.6 ~ 2 mL bir 4 mg/mL lik (Ayrıca 1 mol/L NaCl içeren) PSS ile ikinci polimer tabaka şablonlar yatırmak için adımları yineleyin.
- 12 polimer kat yatırmak için 1,6 ve 1.7 altı kez adımları yineleyin.
Not: Bu uzun bir aradan (~ 12 saat veya daha fazla) almak için tavsiye edilmez çünkü CaCO3 microcores kapsama olmadan Li2 eğilimi ~ 3-5 kadar yordamdaki katmanları yatırılan. Not PSS kapsama microcores daha yüksek bir toplama neden olur ve uzun sessizlik (PLL-g-PEG) sadece PAH veya poli-L-lizin Polietilen glikol ile aşılı dıştaki katman olduğunda önerilir. - Kapalı microcores 2 mg/ml PLL-g-PEG (~ 1 mL microtube başına) en az 2 h için kuluçkaya.
- Microcores sıralı Santrifüjü ve resuspension adımları üzerinden su ile yıkayın. Son Santrifüjü sonra süpernatant atmak.
- İçi boş microcapsules elde etmek için CaCO3 şablonlar 2 mL (pH 7.1 NaOH ile düzeltilmiş) 0,1 mol/L ethylenediaminetetraacetic asit (EDTA) çözeltisi ekleyerek kapalı microcores geçiyoruz.
- Microcapsules 45 s ve atma, kuluçka ~ 5 dk sonra santrifüj kapasitesi süpernatant EDTA ile.
- 1.10-1.10.1 adımları iki kez tekrarlayın.
- Microcapsules % 0,9 NaCl üç kez aracılığıyla birden çok Santrifüjü adımlar içinde 45 ile yıkayın s takip adımlar yıkayarak. Son Santrifüjü adımdan sonra süpernatant atmak.
Not: Son microcapsule çözüm enjeksiyon için (örneğin ampisilin, 0.1 mg/mL ekleyerek) steril tutulmalıdır ve medya araştırma (izotonik ortam nötr pH ile) ile biyouyumlu olmalıdır. - Bir hemasitometre bir floresan mikroskop altında hazırlanan microcapsules konsantrasyonu tahmin ediyoruz. Microcapsules resimleri bir dizi, çapı yüz microcapsules ImageJ9 veya eşdeğer yazılım kullanma hakkında ölçmek ve bir çubuk grafik kullanarak boyutu dağıtım araştırmak.
- Mağaza elde edilen karanlıkta prob kapsüllenir.
Not: sonra birkaç yıkama steril % 0,9 NaCl, microcapsules ay 4 ° C'de depolanan Tam microcapsules depolama sırasında kurutma tavsiye edilmez.
2. Optik Kurulum ve kalibrasyon mikroenkapsüle SNARF-1'in hazırlanması
Not: Kaba pH ölçümleri mikroenkapsüle SNARF-1 ile floresan mikroskop7iki kanallarında görüntüleri kullanılarak yapılabilir, ancak tek kanallı floresan mikroskop fiber spektrometre için bağlı bu protokolü uygulandı.
- Floresan filtre uygulanan floresan boya özelliklerine göre floresan mikroskop için gerekli kümesi yerleştirin ve floresan lamba açmak.
- Kolu göz mercekleri için çekin.
Uyarı: Aşırı ışık Spektrometre matris zarar verebilir. Böylece, spektrometre kullanılmadığında kolu "mercek" modunda olduğundan emin olun. - Fiber optik bir ucunu Spektrometre ve bir kolimatör diğer ucunu bağlayın. Bağdaştırıcıları kullanarak, Kolimatör kamera tüpü odak veya floresan mikroskop diğer kullanılabilir bağlantı noktası ekleyin.
- Spektrometre üzerinde açın. Spektrometre denetim programını çalıştırıp Spektrometre ölçümleri için hazırlamak.
- Kolu göz mercekleri için çekin.
- Microcapsule toplu kalibrasyonunun ~ 5 µL microcapsule süspansiyon (~ 10 000 microcapsules µL deiyonize su başına), mikroskop slaytta yer ve karanlık bir yere (örneğin, bir termostat 35 ° c) içinde belgili tanımlık damla kuru.
- Microencapsulated SNARF-1 spektral özellikleri ayarlamak için bir dizi arabellekleri ~ 6-9 aralığındaki farklı pH değerleri kullanın. ~ 10 µL SNARF-1-dextran ile kurutulmuş microcapsules üzerine bir arabellek bırak ve bir coverslip ile kaplayın.
- Cam slayt mikroskop sahnesinde yerini. × 40 amacı istimal microcapsules bulun.
- Mikroskop kolu kamera bağlantı noktasına çevirin. Onların Floresans Spektrometre ile kayıt. Göz mercekleri başa kolu çevirin.
Not: spektral sinyal çok arka plan düzeyinin sağlayın ve görüş alanı içinde microcapsules bir balonun içinde (daha düşük bir boyuta gerekirse geçiş yaparak) olmadığından emin olun. Aynı microcapsules uzun süreli aydınlatma kaçının. SNARF-1 için photobleaching duyarlıdır. - 2.2.3 farklı microcapsules için 10 - 15 kez yineleyin.
- Floresan en yüksek oranları (örneğin, R veya Scilab kullanarak) hesaplamak için tüm kayıtlı spectra ve medyan oranı (için her arabellek) ve aşağıdaki formülü kullanarak orta pH arasındaki regresyon çizgisini belirler:
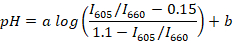
Not: SNARF-1 ile iki doruklarına protonated ve deprotonated boya emisyon için karşılık gelen bir spektrum vardır ve tepeler arasındaki oran orta pH cevap veriyor. Bu çalışmada, 605 ve 660 nm floresan yoğunluğu arasındaki oranı kullanılır. Bu dalga boyu kullanılan filtre kümesini bağlı olarak seçilir. a ve b (örneğin, R kullanarak) doğrusal olmayan regresyon belirlenecek katsayıları vardır. 0,15 ve 1.1 değerlerdir, sırasıyla, minimum ve maksimum değerlerini ben605/i660 kalibrasyon sırasında gözlenen. - Balık kan yaklaşık 10 µL yaklaşık 5 Yetişkin hayvanlardan toplamak. Yer balık Petri kabına 1 µL/mL ile içine su karanfil yağı anestezi için süspansiyon ve hayvan yan döner ve fin pinch için yanıt vermiyor kadar bekleyin (genellikle ~ 2-3 dk). Balık bir cam slayt üzerinde aktarın. Balık kuyruğu lanset ile kesti ve kuyruk damar yaklaşık 2 µL balık kan toplamak.
Not: kan pıhtılaşma önlemek için heparin (5000 U/mL) ile belgili tanımlık kesme tedavi ve heparinized cam kılcal damarlar ve microcentrifuge tüpler kan toplamak için kullanın.- Yaklaşık 10 µL kan elektrot ucunu üzerine bir pipet ile damla ve pH pH-metre kullanarak belirleyebilirsiniz.
- Kan kurutulmuş microcapsules ile bir slayt üzerine bırakın ve kalibrasyon arabelleklerini (adım 2.2 2.3) açıklandığı gibi floresan yoğunluğu oranı kayıt.
- Eğri (için daha fazla ayrıntı bkz: Borvinskaya ve ark. 20175) balık kanı ölçümlerde maç yapmak için kalibrasyon eğrisi doğrusal katsayısı ayarlayın.
3. hazırlık enjeksiyon için
- Çelik iğne ucu keskin lanset ile plastik kaldırarak insülin kalem (veya şırınga) yayın.
Not: Herhangi bir ince iğne (Ø0.33 mm veya daha az) veya cam kılcal (genellikle Ø1 mm) mikroenjeksiyon10,11için hazırlıklı ol. - İğneyi yarıya kadar cam microcapillary yerleştirin; hızlı ve yavaş bir gaz meşale kullanarak lehim.
- Cam microcapillary için microinjector bağlamak ve üç kez steril su ile yıkayın. Sıvı iğne akar emin olun.
- Sistem distile su ile doldurun.
Not: sistemde hava kabarcığı yok olduğundan emin olun.
4. enjeksiyon
- Microcapsules hazırlanan süspansiyon resuspend (steril % 0.9 NaCl veya diğer medya kullanılan 0.5 ila 6 milyon microcapsules microliter başına bir konsantrasyon ile enjeksiyonlar için) için 1 dk ultrasonik banyo kullanarak.
Not: microcapsules, aşağıdaki enjeksiyon sırasında çökelti eğilimindedir bu yana şişeyi microcapsules ile mekanik sallamak (bir rotor kullanarak) veya el ile her birkaç dakikada onları resuspend ve onların toplama önlemek için. - ~ 2-3 için bir petri anestezi (0.1 mL/L karanfil yağı suya askıya) ile içine balık yer dk. kadar bekleyin balık yan döner ve fin hafif bir tutam yanıt vermiyor.
- Bir kaşık kullanarak, anestezi çıkmış balık aktarmak ve yavaşça (sağ elini kullanan kişi için) sola doğru veya (sol elli kişi için) sağa doğru kafa ile yanal bir konumda nemli bir sünger üzerine yerleştirin.
- Sadece enjeksiyon önce 1-2 mm cam kılcal damar içine hava microinjector ile bağlı emmek. O zaman, dağınık microcapsules yaklaşık 2 µL ile yük.
Not: enjeksiyon önce microcapsule çözüm hangi balık tutulur sıcaklık ayarlanması gerekir. - Yavaşça sigara dominant el ile sünger balık gövdesini stabilize etmek.
- Sonradan içini kaplamak balık bulmak. Zihinsel genişleten bir kesimi operculum karın boşluğu sonuna kadar seçer. Bu segmentteki ortasını bulmak. İğne 1 mm daha düşük ventral yönde koymak.
- Kazıma bir hareketi, yavaşça balık bir kenara ölçekler ve bir delik yapmak hareket. Tablo yüzeye 45 ° açılı ve vücuda iğne yerleştirin.
- Dikkatli bir şekilde buna karşı aittir kadar iğne omurga doğru itin.
- Microcapsules süspansiyon yaklaşık 1 µL böbrek bırakın ve yavaş yavaş iğne tutar.
Not: uygun delik site bulmak için daha kolay, pratik Şekil 2A ve 2B'yigösterildiği gibi bir alt ışık kullanarak balıklar transilluminating tarafından gövde böbrek bulmak için yararlıdır.
- Enjeksiyon yerinde dökülmüş herhangi bir microcapsules kaldırmak için su akışı ile kuyruk başından balık durulayın.
5. içinde Vivo görselleştirme
- Balık baştan gill kapağını çıkarın ve balık solungaçları denude için diseksiyon makası kullanın. Solungaçları su ile durulayın.
- Bir kaşık kullanarak, balık mikroskop slayda aktarmak ve floresan mikroskop sahnesinde yerini.
Not: balık solungaçları ardışık işlemler sırasında kurumasına olduğunu emin olun. Bunu önlemek için düzenli olarak onları nemlendirin su Pasteur pipet (yaklaşık her 1-2 dk) kullanarak. - Odayı karartmak ve düşük büyütme (x 10 amaç) kullanarak floresan microcapsules bulmak için solungaçları inceleyin.
Not: balık dolaşım sistemi içine bazı floresan parçacıkların giriş için yordam kullanıldığında, solungaçları, birkaç bireylerin enjeksiyonları önce beklenmedik floresan parçacıklar için incelemek için önerilir. Vahşi-türü zebra balığı solungaçları autofluorescence yok ama bazı durumlarda sporadik floresan parçacıklar (gıda parçaları veya tek hücreli simbiont) solungaçları üzerinde mevcut olabilir. Gerekli, bu tür parçacıklar belirli şekilleri göre kabul edilebilir eğer (örneğin, gıda adet düzensiz şekli, küresel microcapsules aksine var) veya floresan spektrum (Yani, renk).- Objektifin daha yüksek bir büyüklük (× 40 amaç) geçin ve bir microcapsule veya microcapsules bir grup görüş alanı ortasına yerleştirin.
- Yandaki bağlantı noktasına bağlı bir Spektrometre ile açmak. Spektral sinyal kaydedebilir.
- Mercek için geri kolu çevirin.
- Ölçümler için farklı microcapsules birkaç kere tekrar edin.
- Balık akvaryum kurtarma için uygun havalandırma ile aktarın.
Not: en az uygulama ile enjeksiyon ve 2-3 dk balık başına yaklaşık bir oranda kayıt sinyal yapmak mümkündür. Ölçüm bir bireysel birkaç kez anestezi tekrarlanan zararsız, düşük doz veya başka bir yöntemi fiksasyon kullanımı ile tekrar edilebilir. Uzun vadeli gözlem için bir sistem ile sürekli anestezi12kullanın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Elde edilen sonuçları sunulan Protokolü üç ana kategoride birinden gelir: bir floresan boya (Şekil 1), microcapsules daha fazla görselleştirme ile böbrek enjeksiyon encapsulation tarafından floresan microparticles oluşumu Gill kılcal damarlar (Şekil 2 ve 3) ve pH seviyeleri (Şekil 4) kan son olarak, in vivo spektral kayıt SNARF-1 floresans iz...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Microparticles enjeksiyon zebra balığı böbrek içine göstermek için yarı geçirgen microcapsules bir göstergesi boya ile yüklenen kullanılmıştır. Böylece, iletişim kuralı kullanarak katman katman derleme ters şarj edilmiş polyelectrolytes7,8,15,16,17 microcapsules imalatı için yönergeler içerir ,18 (
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar büyük ölçüde Bogdan Osadchiy ve Evgenii Protasov (Irkutsk State University, Rusya) yardımıyla video Protokolü hazırlanmasında kabul etmiş oluyorsunuz. Bu araştırma için temel araştırma (#15-29-01003) Rus Bilim Vakfı (#15-14-10008) ve Rus Vakfı tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
Referanslar
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır