È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Amministrazione semplice ed efficace e la visualizzazione di microparticelle nell'apparato circolatorio di piccoli pesci mediante l'inserimento di rene
In questo articolo
Riepilogo
Questo articolo illustra i principi di un'iniezione rapida, come minimo dilagante di microparticelle fluorescenti in circulatory system di piccoli pesci e la visualizzazione in vivo delle microparticelle in sangue di pesce.
Abstract
La somministrazione sistemica di particelle micro-dimensione in un organismo vivente può essere applicata per la visualizzazione del sistema vascolare, droga e distribuzione del vaccino, l'impianto di cellule transgeniche e piccoli sensori ottici. Tuttavia, microiniezioni endovenosa in piccoli animali, che sono principalmente utilizzati nei laboratori biologici e veterinari, sono molto difficili e richiedono personale qualificato. Qui, dimostriamo un metodo robusto ed efficiente per l'introduzione di microparticelle nell'apparato circolatorio di adulto zebrafish (Danio rerio) tramite l'iniezione nel rene pesce. Per visualizzare le microparticelle introdotte nel sistema vascolare, vi proponiamo una semplice tecnica di imaging videomicroscopia nelle branchie di pesce. In vivo monitoraggio del pH del sangue di zebrafish è stato compiuto usando un fluorescente microincapsulati iniettato sonda, SNARF-1, per dimostrare una delle possibili applicazioni della tecnica descritta. Questo articolo fornisce una descrizione dettagliata di incapsulamento di pH sensibili colorante e dimostra i principi dell'iniezione rapida e la visualizzazione di microcapsule ottenute per registrazione in vivo del segnale fluorescente. Il metodo proposto di iniezione è caratterizzato da un tasso di mortalità basso (0-20%) e ad alta efficienza (70-90% di successo) ed è facile da Istituto utilizzando attrezzature comunemente disponibili. Tutte le procedure descritte possono essere eseguite su altre specie di piccoli pesci, come i guppies e medaka.
Introduzione
La somministrazione di particelle micro-dimensione in un organismo animale è un compito importante in tali zone come droga e vaccino consegna1, sistema vascolare visualizzazione2, cellula transgenica impianto3e l'impianto piccolo sensore ottico 4 , 5. Tuttavia, la procedura di impianto per le particelle di Microscala nel sistema vascolare di piccoli animali da laboratorio è difficile, soprattutto per gli organismi acquatici delicati. Per campioni di ricerca popolari come zebrafish, è consigliabile che queste procedure essere chiarita mediante protocolli dei video.
Microiniezioni intracardiache e capillare richiedono personale qualificato e servizi di microchirurgia unico per la consegna dei microobjects nel sangue di zebrafish. In precedenza, un' iniezione manuale retro-orbitale3 è stato suggerito come un metodo facile ed efficace per la somministrazione di cellule intere. Tuttavia, nella nostra esperienza, a causa della piccola zona della rete capillare occhio, ci vuole molta pratica per ottenere il risultato desiderato da questa tecnica.
Qui, descriviamo un metodo per l'impianto di microparticelle solide ed efficienti nell'apparato circolatorio di iniezione manuale direttamente nel tessuto del rene di zebrafish adulto, che è ricca di vasi capillari e vasi renali. Questa tecnica si basa sul protocollo dei video per trapianto di cellule in zebrafish rene6, ma sono stati eliminati i passaggi di microsurgical traumatici e che richiede tempo. Il metodo proposto è caratterizzato da bassa mortalità (0-20%) e ad alta efficienza (70-90% di successo) ed è facile da Istituto utilizzando attrezzature comunemente disponibili.
Una parte importante del protocollo proposto è la visualizzazione delle impiantato microparticelle (se sono fluorescenti o colorato) nei capillari gill, che permette di verificare la qualità di iniezione, una valutazione relativa approssimativa del numero di particelle iniettate e la rilevazione del segnale spettrale per misurazioni fisiologiche direttamente dal sangue circolante. Come esempio delle possibili applicazioni della tecnica descritta, dimostriamo il protocollo per in vivo misure di pH del sangue di zebrafish usando una sonda fluorescente microincapsulata, SNARF-1, originariamente suggerito nel Borvinskaya et al. 20175.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure sperimentali sono stati condotti in conformità con la direttiva europea 2010/63/UE per gli esperimenti sugli animali e sono state approvate da animale soggetti ricerca comitato di Istituto di biologia all'Università statale di Irkutsk.
1. fabbricazione di microcapsule
Nota: Microcapsule che trasportano una tintura fluorescente sono preparati utilizzando un assembly di strato dopo strato di carica opposta polielettroliti7,8. Tutte le procedure sono state effettuate a temperatura ambiente.
- Per sintetizzare poroso CaCO3 microcarote che racchiude il colorante fluorescente, mescolare 2 mL della soluzione di SNARF-1-destrano (può essere usato più associato a polimero colorante fluorescente come FITC-BSA) ad una concentrazione di ~ 2 mg/mL con 0,6 mL ciascuna delle soluzioni di 1 mol/L di CaCl2 e Na2CO3 sotto veloce agitazione.
Nota: Prestare attenzione alle diverse sensibilità di coloranti fluorescenti per photobleaching; Se viene utilizzata una sonda fluorescente sensibile alla luce (come SNARF-1), la manipolazione e lo stoccaggio delle microparticelle deve essere eseguite con come poca luce possibile. - Dopo 5-10 s di agitazione, trasferire la sospensione alle provette microcentrifuga da 2 mL e centrifugare per 15 s a 10.000-12.000 g a pellet CaCO3 microcarote.
- Eliminare il supernatante, lavare i nuclei con ~ 2 mL di acqua deionizzata e risospendere il pellet agitando.
- Ripetere la procedura di centrifugazione-lavaggio tre volte in totale. Dopo l'ultima centrifugazione, scartare il surnatante.
- Incubare la microcarote per 1 min in un bagno ad ultrasuoni per ridurre la loro aggregazione.
Attenzione: Non dimenticate di proteggere le orecchie con le cuffie. - Per depositare il primo strato polimerico sui modelli, risospendere i nuclei in ~ 2 mL di una soluzione di 4 mg/mL di poly(allylamine hydrochloride) (PAH) in 1 mol/L NaCl.
- Tenere il microcarote soluzione per ~ 5 minuti con agitazione costante.
- Dopo 15 s di centrifugazione, scartare il surnatante con la PAH non associato. Lavare il microcarote coperto con acqua deionizzata, almeno 3 volte attraverso centrifugazione più e fasi di lavaggio. Dopo l'ultima centrifugazione, scartare il surnatante.
- Incubare la microcarote per 1 min in un bagno ad ultrasuoni per ridurre la loro aggregazione.
Nota: Se il colorante fluorescente applicato è cationico, a partire da poli (4-Stirensolfonato di sodio) (PSS) in 1 mol/L NaCl (Vedi punto 1.7).
- Ripetere il passaggio 1.6 ~ 2 ml di una soluzione di 4 mg/mL di PSS (contenente anche 1 mol/L NaCl) per depositare il secondo strato polimerico sui modelli.
- Ripetere i passaggi da 1.6 e 1.7 sei volte a depositare 12 strati polimerici.
Nota: Non è consigliabile prendere una lunga pausa (~ 12 h o più) nella procedura fino a ~ 3-5 strati sono stati depositati perché CaCO3 microcarote senza copertura tendono a cristallizzare. Si noti che copertura PSS provoca una maggiore aggregazione della microcarote, e la lunga pausa è consigliabile che solo quando PAH o poli-L-lisina innestato con polietilenglicole (PLL-g-PEG) è lo strato più esterno. - Incubare il microcarote coperto a 2 mg/mL PLL-g-PEG (~ 1 mL ogni microprovetta) per almeno 2 h.
- Lavare il microcarote con acqua tramite centrifugazione sequenziale e passaggi di risospensione. Dopo l'ultima centrifugazione, scartare il surnatante.
- Per ottenere cavità microcapsule, sciogliere i CaCO3 modelli con l'aggiunta di 2 mL di 0,1 mol/L acido etilendiamminotetraacetico (EDTA) soluzione acida (regolata a pH 7,1 con NaOH) per il microcarote coperto.
- Dopo ~ 5 min di incubazione, centrifugare le microcapsule per 45 s e scartare il surnatante con l'EDTA.
- Ripetere i passaggi da 1.10-1.10.1 due volte.
- Lavare le microcapsule con 0,9% NaCl tre volte attraverso centrifugazione più passi entro 45 s seguita da fasi di lavaggio. Dopo l'ultimo passo di centrifugazione, scartare il surnatante.
Nota: La soluzione finale microcapsule iniettabile deve essere mantenuta sterile (ad esempio con l'aggiunta di ampicillina, 0,1 mg/mL), e i media dovrebbero essere biocompatibili con l'oggetto di indagine (isotonica media con pH neutro). - Stimare la concentrazione di microcapsule preparate in un emocitometro sotto un microscopio a fluorescenza. Prendere una serie di immagini di microcapsule, misurare il diametro di circa un centinaio di microcapsule usando ImageJ9 o equivalente software e indagare la distribuzione di dimensione utilizzando un istogramma.
- Archivio ottenuto incapsulato sonda al buio.
Nota: dopo diversi lavaggi in sterile 0,9% NaCl, le microcapsule possono essere conservate per mesi a 4 ° C. Si consiglia di non completa essiccazione delle microcapsule durante la conservazione.
2. preparazione del Setup ottico e calibrazione di microincapsulati SNARF-1
Nota: Misure di pH ruvido con microincapsulati SNARF-1 può essere fatta utilizzando immagini in due canali di un microscopio a fluorescenza7, ma in questo protocollo un microscopio a fluorescenza un canale collegato ad uno spettrometro di fibra è stato applicato.
- Inserire il corretto set di filtri di fluorescenza al microscopio fluorescente secondo le caratteristiche del colorante fluorescente applicata e accendere la lampada fluorescente.
- Estrarre la leva per gli oculari.
Attenzione: Luce in eccesso può danneggiare la matrice di spettrometro. Così, assicurarsi che la leva sia in modalità "oculare", quando non viene utilizzato lo spettrometro. - Collegare un'estremità della fibra ottica per lo spettrometro e l'altra estremità a un collimatore. Utilizzando adattatori, posizionare il collimatore nella messa a fuoco del tubo fotocamera o altra porta disponibile del microscopio fluorescente.
- Accendere lo spettrometro. Eseguire il programma di controllo di spettrometro e tarare lo spettrofotometro per misure.
- Estrarre la leva per gli oculari.
- Per la calibrazione del batch microcapsule, mettere ~ 5 µ l della sospensione di microcapsule (microcapsule ~ 10 000 per µ l in acqua deionizzata) su un vetrino da microscopio e asciugare la goccia in un luogo buio (ad esempio, in un termostato a 35 ° C).
- Per calibrare le caratteristiche spettrali del microincapsulati SNARF-1, è possibile utilizzare una serie di buffer con diversi gradi di pH nell'intervallo ~ 6-9. Goccia ~ 10 µ l di un tampone sulle microcapsule secche con SNARF-1-destrano e coprire con un vetrino coprioggetti.
- Porre il vetrino di vetro sulla fase di microscopio. Individuare le microcapsule usando un obiettivo di 40 ×.
- Ruotare la leva di microscopio alla porta macchina fotografica. Registrare loro fluorescenza con lo spettrometro. Ruotare la leva indietro verso gli oculari.
Nota: Assicurarsi che il segnale spettrale è ben oltre il livello di sfondo e garantire che le microcapsule nel campo di vista non sono in una bolla (passando ad un ingrandimento minore se necessario). Evitare illuminazione prolungata di microcapsule stesse. SNARF-1 è sensibile al photobleaching. - Ripetere il passaggio 2.2.3 per diversi microcapsule 10 - 15 volte.
- Calcolare i rapporti di picchi di fluorescenza (ad esempio, utilizzando R o Scilab) per tutti gli spettri registrati e determinare la retta di regressione tra il rapporto mediano (per ogni buffer) e pH medio utilizzando la seguente formula:
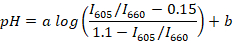
Nota: SNARF-1 ha uno spettro con due picchi corrispondenti all'emissione della tintura protonata e deprotonato, e il rapporto tra le cime è sensibile al pH del mezzo. In questo studio, il rapporto tra l'intensità di fluorescenza per 605 e 660 nm viene utilizzato. Queste lunghezze d'onda vengono scelti a seconda del filtro utilizzato. a e b sono coefficienti da determinarsi di regressione non lineare (ad esempio, utilizzando R). Valori 0,15 e 1.1 sono, rispettivamente, i valori minimi e massimo di ho605/I660 osservati durante la calibrazione. - Raccogliere circa 10 µ l di sangue di pesce da circa 5 animali adulti. Pesce posto in una capsula di Petri con 1 µ l/mL sospensione di olio di chiodi di garofano per anestesia di acqua e attendere che l'animale si trasforma sul suo lato e si blocca a pizzichi della pinna (solitamente ~ 2-3 min). Trasferire il pesce su un vetrino. Tagliare la coda di pesce con un bisturi e raccogliere circa 2 µ l di sangue di pesce da vena caudale.
Nota: Per evitare la coagulazione del sangue, trattare l'incisione con l'eparina (5000 U/mL) e utilizzare tubi capillari in vetro eparinizzata e tubi per microcentrifuga per raccogliere il sangue.- Circa 10 µ l di sangue con una pipetta sulla punta del microelettrodo a goccia e determinare il pH utilizzando un pH-metro.
- Goccia di sangue su un vetrino con microcapsule secchi e registrare il rapporto tra l'intensità della fluorescenza come descritto per i buffer di calibrazione (punti 2.2-2.3).
- Regolare il coefficiente lineare della curva di calibrazione per rendere la curva corrispondono le misurazioni nel sangue di pesce (per maggiori dettagli vedere Borvinskaya et al 20175).
3. preparazione iniettabile
- Rilasciare l'ago in acciaio dalla punta della penna dell'insulina (o siringa) rimuovendo la plastica con un bisturi affilato.
Nota: Qualsiasi ago sottile (Ø0.33 mm o meno) o capillare di vetro (solitamente Ø1 mm) può essere preparato per microiniezione10,11. - Inserire l'ago a metà del vetro microcapillary; rapidamente e delicatamente solder utilizzando un cannello a gas.
- Collegare il vetro microcapillary per la microinjector e sciacquarlo con acqua sterile tre volte. Assicurarsi che il liquido fluisce attraverso l'ago.
- Riempire l'impianto con acqua distillata.
Nota: Assicurarsi che non ci siano bolle nel sistema.
4. iniezione
- Risospendere la soluzione ricostituita di microcapsule (in sterile 0,9% NaCl, o qualsiasi altro supporto utilizzato per le iniezioni, con una concentrazione di 0,5 a 6 milioni di microcapsule per microlitro) utilizzando il bagno a ultrasuoni per 1 min.
Nota: Poiché le microcapsule tendono a precipitare, durante l'iniezione seguente, agitare il flaconcino con le microcapsule meccanicamente (tramite un rotore) o manualmente ogni pochi minuti per risospendere li e prevenire la loro aggregazione. - Mettere il pesce in una capsula di Petri con anestetico (0,1 mL/L di olio di chiodi di garofano sospesa in acqua) per ~ 2-3 min. attendere che il pesce gira su un fianco e si blocca a un leggero pizzico della pinna.
- Usando un cucchiaio, trasferire il pesce fuori l'anestetico e inserirlo delicatamente su una spugna umida in posizione laterale con la testa verso sinistra (per destri) o verso destra (per persona di sinistra).
- Appena prima dell'iniezione, succhiare 1-2 mm di aria nel vetro capillare collegato con microinjector. Poi, caricarlo con circa 2 µ l di microcapsule dispersione.
Nota: Prima dell'iniezione, la soluzione di microcapsule deve essere regolata alla temperatura a cui sono tenuti i pesci. - Delicatamente e stabilizzare il corpo del pesce sulla spugna con mano non dominante.
- Trovare la linea laterale dei pesci. Selezionare mentalmente un segmento che si estende dall'opercolo fino alla fine della cavità addominale. Trovare la metà di questo segmento. Mettere l'ago 1 mm inferiore in direzione ventrale.
- Con un movimento di raschiatura, muovete delicatamente il pesce scale da parte e fare una puntura. Inserire l'ago nel corpo ad un angolo di 45° verso la superficie del tavolo.
- Spingere l'ago verso la spina dorsale fino a posizionarla con attenzione contro di esso.
- Circa 1 µ l di sospensione delle microcapsule di rilascio nel rene e ritirare lentamente l'ago.
Nota: Per trovare il sito di puntura corretto più facilmente, è utile alla pratica trovando il rene di tronco di transilluminating i pesci usando una luce di fondo, come mostrato in Figura 2A e 2B.
- Sciacquare il pesce dalla testa alla coda con un flusso di acqua per rimuovere qualsiasi microcapsule versati al sito di iniezione.
5. visualizzazione in Vivo
- Utilizzare le forbici di dissezione per rimuovere il coperchio di gill dalla testa del pesce e denudare le branchie di pesce. Sciacquare le branchie con acqua.
- Usando un cucchiaio, trasferire il pesce a un vetrino da microscopio e posizionarlo sul palco del microscopio fluorescente.
Nota: Assicurarsi che le branchie dei pesci non asciugarsi durante le procedure successive. Per evitare questo problema, periodicamente di bagnarli con acqua usando una pipetta di Pasteur (circa ogni 1-2 min). - Oscurare la stanza e utilizzando basso ingrandimento (x 10 obiettivo) ispezionare le branchie per trovare le microcapsule fluorescente.
Nota: Quando la procedura viene utilizzata per l'introduzione di alcune particelle fluorescenti nel sistema circolatorio di pesce, si consiglia di ispezionare le branchie di parecchi individui per particelle fluorescenti impreviste prima iniezioni. Branchie di selvaggio-tipo zebrafish non hanno autofluorescenza, ma in alcuni casi sporadiche particelle fluorescenti (come pezzi di cibo o simbionti unicellulari) possono essere presenti sulle branchie. Se necessario, tali particelle possono essere riconosciute sulla loro forma specifica base (ad esempio, pezzi di cibo hanno forma irregolare, a differenza di microcapsule sferiche) o dello spettro di fluorescenza (cioè, colori).- Passare la lente di una magnitudo superiore (obiettivo × 40) e posizionare un microcapsule o un gruppo di microcapsule al centro del campo visivo.
- Ruotare la leva alla porta con uno spettrometro connesso. Registrare il segnale spettrale.
- Ruotare la leva indietro verso l'oculare.
- Ripetere le misurazioni per diversi microcapsule diverse volte.
- Trasferire i pesci nell'acquario con adeguata aerazione per il recupero.
Nota: Con la minima pratica, è possibile effettuare l'iniezione e il segnale di registrazione a un ritmo approssimativo di 2-3 min per pesce. La misura può essere ripetuta per una individuale più volte con l'uso di dosi ripetute di basse, innocue di anestesia o un altro metodo di fissazione. Per l'osservazione a lungo termine, è necessario utilizzare un sistema con anestesia continua12.
Access restricted. Please log in or start a trial to view this content.
Risultati
I risultati ottenuti provengono da una delle tre principali categorie del protocollo presentato: la formazione di microparticelle fluorescenti di incapsulamento di un colorante fluorescente (Figura 1), l'iniezione di rene di microcapsule con ulteriore visualizzazione in Gill capillari (Figura 2 e 3) e, infine, la in vivo spettrale registrazione della fluorescenza di SNARF-1 per il monit...
Access restricted. Please log in or start a trial to view this content.
Discussione
Per dimostrare l'iniezione di microparticelle in zebrafish rene, abbiamo usato semipermeabile microcapsule caricati con un colorante indicatore. Così, il protocollo contiene le istruzioni per la fabbricazione di microcapsule usando l'Assemblea strato dopo strato di carica opposta polielettroliti7,8,15,16,17 ,18 (
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Autori riconoscono notevolmente l'aiuto di Bogdan Osadchiy ed Evgenii Protasov (Università statale di Irkutsk, Russia) in preparazione del protocollo dei video. Questa ricerca è stata sostenuta dalla Fondazione scienza russa (n. 15-14-10008) e dalla Fondazione russa per la ricerca di base (n. 15-29-01003).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
Riferimenti
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon