Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Simple y eficaz administración y visualización de micropartículas en el sistema circulatorio de peces pequeños con inyección de riñón
En este artículo
Resumen
Este artículo demuestra los principios de una inyección rápida, mínimamente invasiva de micropartículas fluorescentes en el circulatory system de peces pequeños y la visualización en vivo de las micropartículas en sangre de peces.
Resumen
La administración sistémica de tamaño de micro partículas en un organismo vivo puede aplicarse para la visualización de la vasculatura, drogas y vacunas entrega, implantación de células transgénicas y diminutos sensores ópticos. Sin embargo, microinyecciones intravenosa en animales pequeños, que se utilizan principalmente en laboratorios biológicos y veterinarios, son muy difíciles y requieren de personal capacitado. Aquí, demostramos un método robusto y eficiente para la introducción de micropartículas en el sistema circulatorio del adulto pez cebra (Danio rerio) por inyección en el riñón de peces. Para visualizar las micropartículas introducidas en la vasculatura, proponemos una simple técnica de imagen intravital en branquias de peces. En vivo monitoreo del pH de sangre del pez cebra se logró mediante un fluorescente microencapsulado inyectado sonda, SNARF-1, para demostrar una de las posibles aplicaciones de la técnica descrita. Este artículo proporciona una descripción detallada de la encapsulación de tinte pH-sensible y demuestra los principios de la inyección rápida y visualización de las microcápsulas obtenidas para la grabación en vivo de la señal fluorescente. El método de inyección propuesto se caracteriza por una tasa de mortalidad baja (0-20%) y alta eficiencia (70-90% de éxito) y es fácil de Instituto con equipamiento disponible comúnmente. Pueden realizarse todos los procedimientos descritos en otras especies de peces pequeños, como lebistes y medaka.
Introducción
La administración de partículas micro-tamaño en un organismo animal es una tarea importante en áreas tales como drogas y vacunas entrega1, vasculatura visualización2, célula transgénica implantación3e implantación minúsculo sensor óptico 4 , 5. sin embargo, el procedimiento de implantación para las partículas de la microescala en el sistema vascular de los animales de laboratorio pequeños es difícil, especialmente para los organismos acuáticos delicados. Para muestras de investigación populares como el pez cebra, se recomienda que estos procedimientos aclararse utilizando protocolos de videos.
Intracardiacos y capilares microinjertos requieren microcirugía únicas instalaciones y personal capacitado para la entrega de microobjects en sangre de pez cebra. Previamente, una inyección manual retro orbital3 fue sugerido como un método fácil y eficaz para la administración de células enteras. Sin embargo, en nuestra experiencia, debido a la pequeña área de la red capilar del ojo, toma mucha práctica para lograr el resultado deseado de esta técnica.
Adjunto, describimos un método para la implantación de micropartículas sólidas y eficientes en el sistema circulatorio por inyección manual directamente en el tejido del riñón del pez cebra adulto, que es rico en capilares y los vasos renales. Esta técnica se basa en el protocolo de video para la célula en el pez cebra riñón6, pero fueron eliminados los pasos microcirugía traumáticos y requiere mucho tiempo. El método propuesto se caracteriza por la baja mortalidad (0-20%) y alta eficiencia (70-90% de éxito) y es fácil de Instituto con equipamiento disponible comúnmente.
Una parte importante del protocolo propuesto es la visualización de las implantados micropartículas (si son fluorescentes o coloreada) en los capilares branquiales, que permite la verificación de la calidad de la inyección, una evaluación relativa aproximada del número de las partículas inyectadas y la detección de la señal espectral para medidas fisiológicas de la sangre circulante. Como ejemplo de las posibles aplicaciones de la técnica descrita, demostramos el protocolo para la medición en vivo de pH de la sangre del pez cebra con una sonda fluorescente microencapsulada, SNARF-1, originalmente sugerido en Borvinskaya et al. 20175.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los procedimientos experimentales se llevaron a cabo con arreglo a la Directiva 2010/63/UE para experimentos con animales y han sido aprobados por Animal temas investigación Comité del Instituto de biología en la Universidad Estatal de Irkutsk.
1. fabricación de microcápsulas
Nota: Microcápsulas con un colorante fluorescente se preparan con un conjunto de capa por capa de polielectrolitos cargados opuestamente7,8. Todos los procedimientos fueron realizados a temperatura ambiente.
- Para sintetizar poroso CaCO3 microcores adjuntando el tinte fluorescente, mezclar 2 mL de la solución de SNARF-1-dextrano (se puede utilizar más tinte fluorescente polímero enlazado como FITC-BSA) a una concentración de 2 mg/mL con 0.6 mL cada una de las soluciones de CaCl2 1 mol/L y Na2CO3 bajo rápida agitación.
Nota: Preste atención a las diferentes sensibilidades de los tintes fluorescentes fotoblanqueo; Si se utiliza una sonda fluorescente sensible a la luz (como SNARF-1), la manipulación y el almacenamiento de las micropartículas deben realizarse con poca luz como sea posible. - Después de 5-10 s de agitación, transferir la suspensión a tubos de microcentrífuga de 2 mL y centrifugar durante 15 s a 10.000-12.000 g de CaCO3 microcores de pellets.
- Desechar el sobrenadante y lavar los corazones con 2 mL de agua desionizada, Resuspender el precipitado agitando.
- Repita el procedimiento de centrifugado-lavado tres veces en total. Después de la última centrifugación, descartar el sobrenadante.
- Incubar microcores durante 1 min en un baño ultrasónico para reducir su agregación.
PRECAUCIÓN: No olvide proteger oídos con los auriculares. - Para depositar la primera capa polímero en las plantillas, resuspender los corazones en 2 mL de una solución de 4 mg/mL de poly(allylamine hydrochloride) (PAH) en NaCl 1 mol/L.
- Mantener la microcores en la solución durante ~ 5 min con agitación constante.
- Después de 15 s de centrifugación, descartar el sobrenadante con la PAH no consolidado. Lave el microcores cubierto con agua desionizada por lo menos 3 veces por centrifugación múltiples y pasos de lavado. Después de la última centrifugación, descartar el sobrenadante.
- Incubar microcores durante 1 min en un baño ultrasónico para reducir su agregación.
Nota: Si el colorante fluorescente aplicado es catiónico, partir de poli (4-styrenesulfonate de sodio) (PSS) en NaCl 1 mol/L (véase el paso 1.7).
- Repita el paso 1.6 con 2 mL de una solución de 4 mg/mL de PSS (también contiene 1 mol/L NaCl) para depositar la segunda capa polímero en las plantillas.
- Repita los pasos seis veces de 1,6 y 1,7 para depositar capas poliméricas 12.
Nota: Se recomienda no tomar un descanso largo (~ 12 h o más) en el procedimiento hasta ~ 3-5 se han depositado capas porque CaCO3 microcores sin cobertura puede tender a recristalizan. Cuenta que la cobertura PSS causa una mayor agregación de las microcores, y la pausa larga es recomendable que sólo cuando la PAH o poli-l-lisina injertadas con polietilenglicol (PLL-g-PEG) es la capa mayor. - Incubar la cubierta microcores en PLL-g-PEG (~ 1 mL por microtubo) 2 mg/mL durante al menos 2 h.
- Lave microcores con agua a través de pasos de resuspensión y centrifugación secuencial. Después de la última centrifugación, descartar el sobrenadante.
- Para obtener microcápsulas hueco, disolver el CaCO3 plantillas, añadir 2 mL de 0.1 mol/L etilendiaminotetracético (EDTA) solución ácida (ajustado a pH 7.1 con NaOH) a la cubierta microcores.
- Después de ~ 5 min de incubación, centrifugar las microcápsulas para 45 s y descartar el sobrenadante con el EDTA.
- Repita los pasos 1.10 1.10.1 dos veces.
- Lavar las microcápsulas con 0.9% NaCl tres veces mediante centrifugación múltiples pasos en 45 s seguido de pasos de lavado. Después el último paso de centrifugación, descartar el sobrenadante.
Nota: La solución final de la microcápsula inyectable debe conservarse estéril (por ejemplo añadiendo ampicilina, 0,1 mg/mL), y los medios de comunicación deben ser biocompatibles con el objeto de investigación (isotónicos medios con pH neutro). - Calcular la concentración de las microcápsulas preparadas en un hemocitómetro bajo un microscopio de fluorescencia. Tomar una serie de fotos de las microcápsulas, medir el diámetro de cerca de cien microcápsulas con ImageJ9 o equivalente software e investigar la distribución mediante un histograma.
- Tienda los obtenidos había encapsulado sonda en la oscuridad.
Nota: después de varios lavados en estéril 0,9% NaCl, las microcápsulas pueden guardarse durante meses a 4 ° C. No se recomienda el secado completo de las microcápsulas durante el almacenamiento.
2. preparación de óptica configuración y calibración de microencapsulado SNARF-1
Nota: Las mediciones pH áspero con microencapsulado SNARF-1 se puede hacer uso de imágenes en dos canales de un microscopio de fluorescencia7, pero en el presente Protocolo un microscopio de fluorescencia de un canal conectado a un espectrómetro de fibra se aplicó.
- Coloque el conjunto requiere de filtros de fluorescencia para el microscopio de fluorescencia según las características del tinte fluorescente aplicada y encender la lámpara fluorescente.
- Tire la palanca de los oculares.
PRECAUCIÓN: Exceso luz puede dañar la matriz del espectrómetro. Por lo tanto, asegúrese de que la palanca esté en el modo de "ocular" cuando no se utiliza el espectrómetro. - Conecte un extremo de la fibra óptica en el espectrómetro y el otro extremo a un colimador. Uso de adaptadores, colocar el colimador en el foco del tubo de cámara u otro puerto disponible del microscopio fluorescente.
- Encienda el espectrómetro. Ejecute el programa de control del espectrómetro y preparar el espectrómetro para la medición.
- Tire la palanca de los oculares.
- Para la calibración del lote de microcápsula, colocar ~ 5 μl de la suspensión de la microcápsula (microcápsulas de ~ 10 000 por μl de agua desionizada) en un portaobjetos de microscopio y secar la gota en un lugar oscuro (por ejemplo, en un termostato a 35 ° C).
- Para calibrar las características espectrales de los microencapsulados SNARF-1, utilice una serie de buffers con valores diferentes de pH en el rango ~ 6-9. Caer ~ 10 μl de un buffer a las microcápsulas secos con SNARF-1-dextran y cubrir con un cubreobjetos.
- Coloque el portaobjetos de cristal de la platina del microscopio. Localizar las microcápsulas con un objetivo 40 ×.
- Gire la palanca del microscopio para el puerto de la cámara. Registrar la fluorescencia con el espectrómetro. Gire la palanca hacia los oculares.
Nota: Asegúrese de que la señal espectral está más allá del nivel de fondo y asegurar que las microcápsulas en el campo de visión no están en una burbuja (cambiando a una ampliación más baja si es necesario). Evitar iluminación prolongada de las microcápsulas de la misma. SNARF-1 es sensible al fotoblanqueo. - Repita el paso 2.2.3 microcápsulas diferentes 10 - 15 veces.
- Calcular los cocientes del pico de fluorescencia (por ejemplo, con R o Scilab) para todos los espectros registrados y determinar la recta de regresión entre la ratio mediana (para cada búfer) y pH del medio mediante la fórmula siguiente:
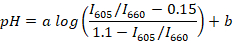
Nota: SNARF-1 tiene un espectro con dos picos correspondientes a la emisión del colorante protonada y deprotonated y la relación entre los picos es sensible a lo pH del medio. En este estudio, se utiliza la relación entre la intensidad de fluorescencia para 605 y 660 nm. Estas longitudes de onda son elegidos según el sistema de filtro utilizado. a y b son coeficientes a determinar por regresión no lineal (por ejemplo, usando R). Son valores de 0.15 y 1.1, respectivamente, los valores mínimos y máximos de I605/I660 observadas durante la calibración. - Recoger alrededor de 10 μl de sangre de pescado de aproximadamente 5 animales adultos. Coloque el pescado en una placa Petri con 1 μl/mL suspensión de aceite de clavo para la anestesia del agua y esperar hasta que el animal se convierte en su lado y deja de responder a pellizcos de la aleta (generalmente 2-3 min). Transferencia de los peces en un portaobjetos de vidrio. Cortar la cola de pez con una lanceta y recoger aproximadamente 2 μl de sangre de peces de la vena de la cola.
Nota: Para evitar la coagulación de la sangre, tratar la incisión con heparina (5000 U/mL) y utilice capilares de vidrio heparinizado de microtitular y tubos para recoger la sangre.- Goteo 10 μl de sangre con una pipeta en la punta del microelectrodo y determinar el pH con un medidor de pH.
- Dejar caer la sangre sobre una diapositiva con microcápsulas secos y registrar el cociente de la intensidad de fluorescencia que se describen para los buffers de calibración (pasos 2.2-2.3).
- Ajustar el coeficiente lineal de la curva de calibración para la curva coincida con las mediciones en la sangre de peces (para más detalles vea Borvinskaya et al. 20175).
3. preparación para la inyección
- Suelte la aguja desde la punta de la pluma de insulina (o jeringa) quitando el plástico con una lanceta afilada de acero.
Nota: Cualquier aguja delgada (Ø0.33 mm o menos) o capilar de vidrio (generalmente Ø1 mm) se puede preparar para microinyección10,11. - Introduzca la aguja hasta la mitad en el microcapillary de vidrio; rápidamente y suavemente de la soldadura usando un soplete de gas.
- Conectar la microcapillary de vidrio a la microinyectora y lavarlo con agua destilada tres veces. Asegúrese de que el líquido fluye a través de la aguja.
- Llenar el sistema con agua destilada.
Nota: Asegúrese de que hay no hay burbujas en el sistema.
4. inyección
- Agite la suspensión preparada de microcápsulas (en estéril 0,9% NaCl, o cualquier otro medio utilizado para las inyecciones, con una concentración de 0.5 a 6 millones de microcápsulas por microlitro) usando el baño ultrasónico durante 1 minuto.
Nota: Ya que las microcápsulas tienden a precipitar, durante la siguiente inyección, agitar el frasco con las microcápsulas mecánicamente (mediante un rotor) o manualmente cada pocos minutos para resuspenderlos y evitar su agregación. - Coloque el pescado en una placa Petri con anestésico (0,1 mL/L de aceite de clavo suspendido en agua) para ~ 2-3 minutos, espere hasta que el pescado se convierte en su lado y deja de responder a una ligera pizca de la aleta.
- Con una cuchara, transferir el pescado fuera de la anestesia y colóquela suavemente sobre una esponja húmeda en una posición lateral con la cabeza hacia la izquierda (para una persona diestra) o hacia la derecha (para zurdo).
- Justo antes de la inyección, chupar 1-2 mm de aire en el capilar de vidrio conectado con microinyector. Entonces, carga con aproximadamente 2 μl de las microcápsulas dispersas.
Nota: Antes de la inyección, la solución de la microcápsula debe ajustarse a la temperatura a la que se mantienen los peces. - Estabilizar con suavidad el cuerpo de los peces en la esponja con la mano no dominante.
- Encontrar la línea lateral del pez. Mentalmente Seleccione un segmento que se extiende desde el opérculo hasta el final de la cavidad abdominal. Encontrar la media de este segmento. Poner la aguja 1 mm inferior en dirección ventral.
- Con un movimiento de rascado, mueva suavemente el pescado a un lado las escalas y hace una punción. Inserte la aguja en el cuerpo en un ángulo de 45° a la superficie de la mesa.
- Empuje la aguja hacia la columna vertebral hasta que quede con cuidado contra él.
- Libera aproximadamente 1 μl de la suspensión de las microcápsulas en el riñón y retire lentamente la aguja.
Nota: Para encontrar el sitio de punción adecuada más fácilmente, es útil encontrar el riñón tronco transilluminating los peces utilizando una luz de fondo, como se muestra en la figura 2A y 2Bpráctica.
- Enjuague el pescado desde la cabeza hasta la cola con un chorro de agua para remover cualquier derramados microcápsulas en el sitio de inyección.
5. visualización en Vivo
- Utilice las tijeras de disección para quitar el opérculo de la cabeza de pescado y raspar las branquias de peces. Enjuague las agallas con agua.
- Con una cuchara, transferir el pescado a un portaobjetos y coloque sobre la platina del microscopio fluorescente.
Nota: Asegúrese de que las branquias de los peces no se resequen durante procedimientos sucesivos. Para evitar esto, periódicamente humedecerlos con agua usando una pipeta de Pasteur (aproximadamente cada 1-2 min). - Oscurecer la habitación y utilizar bajos aumentos (x 10 objetivo) Inspeccione las agallas para encontrar las microcápsulas fluorescentes.
Nota: Cuando el procedimiento se utiliza para la introducción de algunas partículas fluorescentes en sistema circulatorio de peces, se recomienda inspeccionar las agallas de varias personas para partículas fluorescentes inesperadas antes de las inyecciones. Branquias de pez cebra de tipo salvaje no tienen autofluorescencia, pero en algunos casos esporádicas partículas fluorescentes (como piezas de comida o unicelulares simbiontes) pueden estar presentes en las agallas. Si es necesario, estas partículas pueden ser reconocidas basados en su forma específica (por ejemplo, piezas de comida tienen forma irregular, a diferencia de microcápsulas esféricas) o espectro de fluorescencia (es decir, color).- Cambiar la lente a una magnitud mayor (objetivo de × 40) y coloque una microcápsula o un grupo de microcápsulas en el centro del campo de visión.
- Gire la palanca hacia el puerto con un espectrómetro de conectado. Registro de la señal espectral.
- Gire la palanca hacia el ocular.
- Repita las mediciones diferentes microcápsulas varias veces.
- Transferencia de los peces en el acuario con adecuada aireación para la recuperación.
Nota: Con un mínimo de práctica, es posible realizar la inyección y la señal de grabación a una velocidad aproximada de 2-3 min por pescado. La medición puede repetirse por un individuos varias veces con el uso de dosis repetidas de bajo, inofensivas de la anestesia o cualquier otro método de fijación. Para la observación a largo plazo, utilizar un sistema de anestesia continua12.
Access restricted. Please log in or start a trial to view this content.
Resultados
Los resultados obtenidos provienen de una de las tres categorías principales del protocolo presentado: la formación de micropartículas fluorescentes por encapsulación de un colorante fluorescente (figura 1), la inyección de riñón de microcápsulas con mayor visualización en Gill capilares (figura 2 y 3) y, finalmente, la en vivo espectral grabación de SNARF-1 fluorescencia para...
Access restricted. Please log in or start a trial to view this content.
Discusión
Para demostrar la inyección de micropartículas en el riñón del pez cebra, utilizamos microcápsulas semipermeables cargadas con un colorante indicador. Así, el protocolo contiene las instrucciones para la fabricación de las microcápsulas con el conjunto de capa por capa de polielectrolitos cargados opuestamente7,8,15,16,17 ,
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen grandemente la ayuda de Bogdan Osadchiy y Evgenii Protasov (Universidad Estatal de Irkutsk, Rusia) en la preparación del Protocolo de video. Esta investigación fue apoyada por la Fundación rusa de la ciencia (#15-14-10008) y la Fundación rusa de investigación básica (#15-29-01003).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
Referencias
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados