このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
シンプルで効果的な管理と腎臓の注入を使用する小型魚の循環システムの微粒子の可視化
要約
小型魚の circulatory system と魚血微粒子の体内可視化に蛍光微粒子の低侵襲、迅速注入の原理を説明します。
要約
生きている有機体にマイクロ サイズ粒子の全身投与は血管可視化薬とワクチンの配信、トランスジェニック細胞と小型の光学センサーの適用できます。しかし、生物学・獣医研究所の使用が多い、小動物に静脈内の薬剤が非常に困難な訓練された人員を必要とします。ここで、我々 は魚の腎臓への注入による微粒子のアダルト ゼブラフィッシュ (動脈分布) の循環系への導入のため堅牢で効率的なメソッドを示します。血管系で導入された微粒子を可視化、魚のえらに単純な生体イメージング手法を提案する.注入されたマイクロ カプセル化蛍光を使用して達成された体内監視ゼブラフィッシュ血液 pH のプローブ、パク-1、記載した技術の可能なアプリケーションの 1 つであります。この記事は、pH 感受性色素のカプセル化の詳細な説明し、迅速な注入の原理と体内蛍光信号の録音のための得られたマイクロ カプセルの可視化を示します。インジェクションの手法は低い死亡率率によって特徴付けられる (0-20%) と高効率 (70-90% 成功)、それは一般に利用できる機器を使用して研究所に簡単。グッピーやメダカなど、他の小さな魚の種にすべて記載されている手順を実行できます。
概要
動物有機体にマイクロ サイズ粒子の管理は小さな光学センサー注入およびトランスジェニック細胞注入3、血管可視化2ワクチン配信1医薬品などの分野で重要な課題4,5します。 ただし、実験小動物の血管系へのマイクロ粒子の注入手順は難しい、特に繊細な水生生物です。ゼブラフィッシュのような人気のある研究標本のお勧めビデオ プロトコルを使用してこれらの手順を明らかにすること。
心内及びキャピラリーのマイクロインジェクション ゼブラフィッシュ血に microobjects の配信するためスタッフとユニークな手術設備が必要です。以前は、レトロな軌道手動注入3がセルを全体を管理するための簡単で効果的な方法として示唆されました。しかし、我々 の経験で目の毛細血管網の小さい区域のためかかりますこの手法から目的の結果を達成するために多くの練習。
本明細書で述べる循環系への堅牢で効率的な微粒子注入法大人ゼブラフィッシュの腎臓組織に直接手動注入による腎血管と毛細血管が豊富であります。この手法は、ゼブラフィッシュの腎臓6に細胞移植ビデオ プロトコルに基づいていますが、外傷性および時間のかかる顕微鏡手順が排除されました。提案手法は低死亡率によって特徴付けられる (0-20%) と高効率 (70-90% 成功)、それは一般に利用できる機器を使用して研究所に簡単。
提案プロトコルの重要な一部が注入された微粒子の (蛍光灯や色付きのもの) 場合ギル毛細血管でインジェクションの品質、数の大まかな相対評価の検証を可能にする可視化注入された粒子、循環血液から直接生理学的な測定のためスペクトル信号の検出。パク-1、最初に提案された Borvinskaya マイクロ カプセル化蛍光プローブを用いたゼブラフィッシュ血液 pH の生体内測定のためのプロトコルを示す記載した技術の可能なアプリケーションの例としてら。2017年5。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての実験手順、動物実験のための EU 指令 2010年/63/EU に従い行った動物科目研究委員会の研究所の生物学イルクーツク州立大学によって承認されています。
1. マイクロ カプセルの作製
注: 蛍光染料を運ぶカプセルは帯電凝集沈殿処理7,8層によってアセンブリを使用して準備されます。すべてのプロシージャは、室温で行われました。
- 蛍光染料を囲む多孔性の CaCO3 microcores を合成するには、ミックス (FITC BSA などほとんどの高分子と結合蛍光染料を使用できます) パク-1-デキストラン溶液 2 mL ~ 2 Mg/ml の濃度で 0.6 ml 各 CaCl 2溶液 1 mol/L のと高速攪拌下で Na2CO3 。
注: は、退色; に蛍光染料の別の感度に注意を払う(パク-1) のような光に敏感な蛍光プローブを使用すると場合、は、可能な限り小さな光として微粒子の操作・と実行する必要があります。 - 撹拌の 5-10 秒後に転送懸濁液 2 mL マイクロ遠心チューブ用と 15 の遠心載荷 CaCO3 microcores をペレットに 10,000-12,000 g で s。
- 上澄みを廃棄し、〜 2 ml の脱イオン水のコアを洗浄し、揺れでペレットを再懸濁します。
- 合計で 3 回遠心洗浄手順を繰り返します。最後の遠心分離後、上清を破棄します。
- Microcores、凝集を抑える超音波風呂で 1 分間、インキュベートします。
注意: は、ヘッドフォンで耳を保護するために忘れないでください。 - テンプレートの第 1 のポリマー層をデポジットするには、2 〜 4 mg/mL の溶液 1 mol/l 塩化ナトリウム poly(allylamine hydrochloride) (PAH) の mL でコアを再懸濁します。
- 一定の揺れと ~ 5 分のためのソリューションに、microcores をしてください。
- 15 日以降後の遠心分離、s は非連結の PAH を持つ上澄みを廃棄します。少なくとも 3 回複数の遠心分離、洗浄手順を脱イオン水で覆われた microcores を洗ってください。最後の遠心分離後、上清を破棄します。
- Microcores、凝集を抑える超音波風呂で 1 分間、インキュベートします。
注: 適用される蛍光色素がカチオンの場合ポリ (スチレンスルホン酸ナトリウム 4-) から開始 (PSS) 1 mol/l 塩化ナトリウム (1.7 の手順を参照してください)。
- テンプレートに第 2 のポリマー層を堆積させるため手順 1.6 〜 2 mL (1 mol/L 塩化ナトリウムとも含んでいる) PSS の 4 mg/mL の溶液を繰り返します。
- 12 高分子層を堆積させるため、1.6 と 1.7 の 6 倍の手順を繰り返します。
注: 勧めできません (〜 12 h 以上) 長い休憩を取るに 3 〜 5 までの手順でレイヤーを報道せず CaCO3 microcores が recrystallize する傾向があるために寄託されています。PSS カバレッジにより、microcores の高い集計の長い一時停止 (PLL-g-PEG) は一番外側の層で PAH またはポリ L リジンはポリエチレング リコールをグラフトした場合にのみお勧めに注意してください。 - 少なくとも 2 時間 PLL-g-ペグ (〜 1 mL マイクロ チューブごと) を 2 mg/mL で覆われた microcores を孵化させなさい。
- 連続遠心分離と再懸濁の手順を介して水と microcores を洗ってください。最後の遠心分離後、上清を破棄します。
- 中空マイクロ カプセルを得るためには、屋根付きの microcores に (NaOH で ph 7.1 調整) 0.1 mol/L エチレンジアミン四酢酸 (EDTA) 溶液 2 mL を追加して CaCO3テンプレートを溶解します。
- 45 s と破棄のマイクロ カプセルを遠心培養 〜 5 分後、EDTA と上清。
- 1.10 1.10.1 の手順を 2 回繰り返します。
- 0.9 %nacl を通じて複数の遠心分離、3 回ステップ 45 内にマイクロ カプセルを洗う洗浄手順が続く s。最後の遠心分離のステップ後上澄みを廃棄します。
メモ: 最終的なマイクロ カプセル注射剤保管され滅菌 (たとえばアンピシリン、0.1 mg/mL を加えること) で、メディアは、生体適合性調査 (中性等張性メディア) の対象とする必要があります。 - 蛍光顕微鏡下で検定の準備のマイクロ カプセルの濃度を推定します。マイクロ カプセルの写真のシリーズを取る、ImageJ の9またはそれと同等のソフトウェアを使用して 100 マイクロ カプセルについての直径を測るし、ヒストグラムを使用してサイズの分布を調査します。
- 得られた店は、暗闇の中でプローブをカプセル化します。
注: 滅菌 0.9% でいくつか洗濯後塩化ナトリウム、4 ° C で数ヶ月保存できるマイクロ カプセル貯蔵中のマイクロ カプセルの完全乾燥はお勧めしません。
2 光のセットアップと調整のマイクロ カプセル化パク-1 の準備
注: マイクロ カプセル化パク - 1 大まかな pH 測定 1 ch 蛍光顕微鏡接続ファイバー分光器にこのプロトコルでが適用されたが蛍光顕微鏡の7の 2 つのチャンネルのイメージを使用して行うことができます。
- 必要な応用の蛍光染料の特性に応じて蛍光顕微鏡に蛍光フィルターのセットを置き、蛍光ランプをオンにします。
- 接眼レンズにレバーを引いてください。
注意: 余分な光は、分光器マトリックスを損傷します。したがって、分光計を使用しない場合で、レバーが「接眼レンズ」モードにあることを確認します。 - 分光計とのコリメーターをもう一方の端に光ファイバーの一方の端を接続します。アダプターを使用して、撮像管の焦点または蛍光顕微鏡の他の利用可能なポートにコリメータを配置します。
- 分光計を入れます。分光器制御プログラムを実行し、測定分光計を準備します。
- 接眼レンズにレバーを引いてください。
- マイクロ カプセル バッチの校正顕微鏡スライドの上 ~ 5 μ L マイクロ カプセル懸濁液 (脱イオン水で μ L あたり 〜 10 000 カプセル) を置き、(たとえば、35 ° C でサーモスタット) で暗い場所でドロップを乾燥します。
- 、マイクロ カプセル化パク-1 のスペクトル特性を調整するには、異なる pH 値が 6 ~ 9 の範囲内の一連のバッファーを使用します。パク-1-デキストランと乾燥マイクロ カプセルにバッファーの ~ 10 μ L をドロップして、coverslip でそれをカバーします。
- 顕微鏡ステージ上にスライド ガラスを配置します。× 40 目的を使用してカプセルを探します。
- カメラのポートに顕微鏡レバーを回します。分光計、蛍光に登録します。接眼レンズに戻ってレバーを回します。
注: スペクトル信号はバック グラウンドのレベルをはるかに超えていることを確認、ビューのフィールドにマイクロ カプセルがされないように泡で (必要な場合は低倍率に切り替え) で。同じマイクロ カプセルの長時間光照射は避けてください。パク-1 は、光に敏感です。 - 異なるマイクロ カプセル 10-15 倍の 2.2.3 のステップを繰り返します。
- すべての登録されているスペクトルの (たとえば、R または Scilab を使用して) 蛍光ピーク比を計算し、(各バッファー) の中央値の比と培地の pH は次の式を使用しての間の回帰線を決定します。
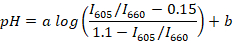
注: パク-1 は、プロトン化や脱プロトン化した色素の排出に対応する 2 つのピークを持つスペクトルを持ち、培地の pH に応答のピークの間の比率。本研究では 605 と 660 nm の蛍光強度比が使用されます。これらの波長は使用するフィルター セットによって選ばれます。aとbは、(たとえば、R を使用して)、非線形回帰によって決定される係数です。0.15 と 1.1 の値が、それぞれの最小値と最大値私605/I660キャリブレーション時に観測されました。 - 約 5 大人動物から魚血の約 10 μ L を収集します。1 μ L/mL をシャーレに場所の魚麻酔のクローブ オイルの懸濁液を水し、動物が横向きになりフィンのつまみに応答を停止するを待ちます (通常 2 〜 3 分)。ガラス スライド上には、魚を転送します。ランセットで魚の尾を切断し、尾静脈から魚血の約 2 μ L を収集します。
注: 血液凝固を防ぐため、ヘパリン (5000 U/mL) を使用して切開を治療し、血液を収集するヘパリン ガラス管および遠心管を使用します。- 電極の先端にピペットで血の約 10 μ L を滴下し、pH 計を用いて pH を決定します。
- 乾燥マイクロ カプセルとスライドに血をドロップし、校正バッファー (手順 2.2 2.3) のとおり、蛍光強度の比を登録します。
- 曲線の一致 (のより多くの詳細を参照してください Borvinskayaら20175) 魚の血液で測定する検量線の直線の係数を調整します。
3. 注射の準備
- 鋭いランセットとプラスチックを除去することによってインスリンのペン (または注射器) の先端から鉄の針をリリースします。
注: 任意の細い針 (Ø0.33 mm 以下) またはガラス毛細管 (通常 Ø1 mm) マイクロインジェクション10,11準備できます。 - 途中で針を挿入ガラス マイクロキャピ ラリー;ゆっくりとすぐにガスのトーチを使用してそれをはんだ付けします。
- ガラスシリンジにガラス マイクロキャピ ラリーを接続し、滅菌水で 3 回フラッシュします。とおしての液体が流れることを確認します。
- 蒸留水には、システムを入力します。
メモ: システムに気泡がないことを確認します。
4. 注入
- マイクロ カプセルの準備の懸濁液を再懸濁します (無菌の 0.9% の塩化ナトリウム、またはその他のメディアに使用 1 マイクロリットルあたり 0.5 に 600 万マイクロ カプセルの濃度の注射) 1 分間超音波洗浄器を使用して。
注: マイクロ カプセルの注射の中に沈殿する傾向があるので振るマイクロ カプセルで機械的に (ロータを使用して) またはそれらを再懸濁します、その凝集を予防し、数分ごと手動で。 - 2 〜 3 の麻酔 (水で中断クローブ オイルの 0.1 mL/L) とシャーレに魚を配置分魚はその側になりフィンの光のピンチに応答を停止するまで待ちます。
- スプーンを使用して、転送、麻酔から魚と軽く側臥位で左 (右利きの人) の方または (左利きの人) のための権利の方の頭で湿ったスポンジの上に置きます。
- 注入直前マイクロインジェクターと接続されているガラス管への空気の 1-2 mm を吸います。その後、分散型マイクロ カプセルの約 2 μ L でそれを読み込みます。
注意: 注入前にマイクロ カプセル ソリューションは魚を保存する温度に調整する必要があります。 - 優しく非支配的な手でスポンジに魚体を安定させます。
- 魚の側線を見つけます。精神的腹部キャビティの端に、蓋から拡張するセグメントを選択します。このセグメントの中央を見つけます。腹側方向に針 1 mm を下に置きます。
- こする動きで優しく魚はさておき、スケールし、パンクを移動します。テーブル面に 45 ° の角度で体に針を挿入します。
- 脊椎に向かって針を押して、それは慎重にそれに合わせます。
- 腎臓に約 1 μ L マイクロ カプセルの懸濁液を解放し、ゆっくりと針を撤回します。
注: 適切な穿刺部位を検索するには、より簡単に便利です図 2 a と 2 bに示すように、下のライトを使用して魚を transilluminating によってトランク腎臓を見つける練習します。
- 注射部位、こぼれたカプセルを削除する水の流れの末尾に頭から魚をすすいでください。
5.生体内可視化
- 解剖はさみを使用して魚の頭から鰓蓋を削除し、魚のえらをはぎ取る。水で顔をすすいでください。
- スプーンを使用して、顕微鏡のスライドに魚を転送し、蛍光顕微鏡のステージの上に置きます。
注: 魚の鰓が連続したプロシージャ中の乾燥しないでくださいことを確認します。これを避けるには、パスツール ピペット (約 1-2 分毎) を使用して水で潤した定期的に。 - 部屋を暗くと蛍光マイクロ カプセルを見つけるためエラを検査 (10 の目的) x の低倍率を使用しています。
注: いくつかの蛍光粒子の魚の循環系への導入の手順を使用すると、お勧めの注射する前に予期しない蛍光粒子のいくつかの個人のえらを検査します。野生型のゼブラフィッシュのえらを蛍光、持っていないが、いくつかのケースで (のような食品の部分または単細胞共生) 散発的な蛍光粒子鰓に存在します。かどうか、必要に応じてそのような粒子認識できる彼らの特定の形状に基づいて (たとえば、品ある不規則な形状、球形マイクロ カプセルとは異なり) または蛍光スペクトル測定 (すなわち色)。- 高い大きさ (40 × 目標) に、レンズを切り替える、ビューのフィールドの中央にカプセルまたはマイクロ カプセルのグループを配置します。
- 接続されている装置のポートにレバーを回します。スペクトルの信号を記録します。
- 接眼レンズに戻ってレバーを回します。
- マイクロ カプセルの異なる複数回の測定を繰り返します。
- 回復のための適切なエアレーションで水槽に魚を転送します。
注: 最小限の練習だ注射し、魚あたり 2 〜 3 分のおおよその速度で記録する信号を実行することが可能。麻酔の繰り返された低、無害な線量または固定の別の方法を使って 1 つ個々 数回測定を繰り返すことができます。長期的な観測は、連続麻酔12システムを使用します。
Access restricted. Please log in or start a trial to view this content.
結果
得られた結果は、提案するプロトコルの 3 つの主要なカテゴリのいずれかから来る: 蛍光色素 (図 1)、さらに可視化とマイクロ カプセルの腎臓射出カプセル化による蛍光微粒子の形成(図 2 および 3) 毛細血管を鰓と、最後に、生体内でスペクトルの記録を監視するパク-1 蛍光血液の pH のレベ...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ゼブラフィッシュ腎臓の微粒子による注入を示すためには、インジケーター染料搭載半透過性マイクロ カプセルを使用しました。したがって、プロトコルを含む逆荷電高分子電解質7,8,15,16,17 の層によってアセンブリを使用してマイクロ カプセルの作製について ,
Access restricted. Please log in or start a trial to view this content.
開示事項
著者が明らかに何もありません。
謝辞
著者は大幅ビデオ プロトコルの準備のために Bogdan Osadchiy とエヴゲニイ Protasov (ロシア、イルクーツク国立大学) の助けを認めます。この研究は、基礎研究 (#15-29-01003) ロシア科学財団 (#15-14-10008) とロシア財団によって支えられました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
参考文献
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved