É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Administração simples e eficaz e visualização de micropartículas no sistema circulatório de peixes pequenos usando injeção de rim
Neste Artigo
Resumo
Este artigo demonstra os princípios de uma injeção rápida, minimamente invasiva de micropartículas fluorescentes para a circulatory system de peixes pequenos e a visualização na vivo das micropartículas em sangue de peixe.
Resumo
A administração sistémica de tamanho micro partículas em um organismo vivo pode ser aplicada para a visualização da vasculatura, drogas e entrega de vacina, implantação de células transgénicas e pequenos sensores ópticos. No entanto, microinjeções intravenosas em animais de pequenos porte, que são principalmente usados em laboratórios biológicos e veterinários, são muito difíceis e exigem pessoal treinado. Aqui, vamos demonstrar um método robusto e eficiente para a introdução de micropartículas no sistema circulatório do adulto peixe-zebra (Danio rerio) por injeção para o rim de peixe. Para visualizar as micropartículas introduzidas na vasculatura, propomos uma técnica simples de intravital imagem em guelras de peixe. In vivo , monitoramento do zebrafish pH sangue foi realizada utilizando um fluorescente microencapsulado injetado sonda, SNARF-1, para demonstrar uma das possíveis aplicações da técnica descrita. Este artigo fornece uma descrição detalhada do encapsulamento do corante sensíveis ao pH e demonstra os princípios da injeção rápida e visualização das microcápsulas obtidas para in vivo de gravação do sinal fluorescente. O método proposto de injeção é caracterizado por uma taxa de mortalidade baixa (0-20%) e alta eficiência (70-90% de sucesso) e é fácil de instituir utilizando equipamentos comumente disponíveis. Todos os procedimentos descritos podem ser executados em outras espécies de peixes pequenos, tais como guppies e medaka.
Introdução
A administração de microtamanho de partículas em um organismo animal é uma tarefa importante em áreas como a droga e vacina entrega1, vasculatura visualização2, implantação de célula transgénicos3e implantação minúsculo sensor óptico 4 , 5. no entanto, o procedimento de implantação para microescala partículas dentro do sistema vascular dos animais de laboratório pequeno é difícil, especialmente para os organismos aquáticos delicados. Para amostras de pesquisa populares como zebrafish, aconselha-se que estes procedimentos ser esclarecido usando protocolos de vídeo.
Microinjeções intracardíacos e capilares exigem microcirurgia únicas instalações e pessoal treinado para a entrega de microobjects em sangue de zebrafish. Anteriormente, uma retro-orbital injeção manual3 foi sugerido como um método fácil e eficaz para a administração de células toda. No entanto, em nossa experiência, por causa da pequena área da rede capilar de olho, é preciso muita prática para alcançar o resultado desejado desta técnica.
Aqui, descrevemos um método para implantação de micropartículas robusta e eficiente para o sistema circulatório por injeção manual diretamente no tecido renal de zebrafish adulto, que é rica em capilares e vasos renais. Esta técnica baseia-se no protocolo de vídeo para transplante de células para o zebrafish rim6, mas foram eliminados os passos microcirúrgicos traumáticos e demorados. O método proposto é caracterizado por baixa mortalidade (0-20%) e alta eficiência (70-90% de sucesso) e é fácil de instituir utilizando equipamentos comumente disponíveis.
Uma parte importante do protocolo proposto é a visualização das implantado micropartículas (se eles são colorida ou fluorescente) nos capilares de gill, que permite a verificação da qualidade da injeção, uma áspera avaliação relativa do número de injetados de partículas e a deteção do sinal espectral para medições fisiológicas diretamente do sangue circulante. Como um exemplo das possíveis aplicações da técnica descrita, demonstramos o protocolo para medições em vivo do pH do sangue zebrafish usando uma sonda fluorescente microencapsulada, SNARF-1, originalmente sugerido em Borvinskaya et al. 20175.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos experimentais foram realizados em conformidade com a directiva da União Europeia 2010/63/UE para experiências em animais e foram aprovados do Animal temas pesquisa Comissão do Instituto de biologia na Universidade Estatal de Irkutsk.
1. fabricação de microcápsulas
Nota: Microcápsulas carregando uma tintura fluorescente são preparadas usando um conjunto de camada por camada de polieletrolitos oposta carregado7,8. Todos os procedimentos foram realizados em temperatura ambiente.
- Para sintetizar porosa CaCO3 microcores encerram o corante fluorescente, misture 2 mL da solução de dextran-SNARF-1 (a maioria dos polímeros-limite tintura fluorescente como FITC-BSA pode ser usada) em uma concentração de ~ 2 mg/mL com 0,6 mL cada uma das soluções 1 mol/L de CaCl 2 de e Na2CO3 sob agitação rápida.
Nota: Preste atenção as diferentes sensibilidades de corantes fluorescentes para fotobranqueamento; Se for usada uma sonda fluorescente sensíveis à luz (como SNARF-1), a manipulação e armazenamento das micropartículas devem ser realizadas com como pouca luz possível. - Após 5-10 s de agitação, transferir a suspensão para 2 mL microcentrifuge tubos e centrifugar por 15 s a 10.000-12.000 g de CaCO3 microcores de Pelotas.
- Desprezar o sobrenadante, lave os núcleos com ~ 2 mL de água desionizada e resuspenda o pellet por agitação.
- Repita o procedimento de centrifugação-lavar três vezes no total. Após a última centrifugação, descarte o sobrenadante.
- Incube a microcores por 1 min em um banho ultra-sônico para reduzir a sua agregação.
Atenção: Não se esqueça de proteger os ouvidos com fones de ouvido. - Para depositar a primeira camada polimérica sobre os modelos, resuspenda os núcleos em ~ 2 mL de uma solução de 4 mg/mL de poly(allylamine hydrochloride) (PAH) em 1 mol/L NaCl.
- Mantenha o microcores na solução para ~ 5 min com agitação constante.
- Depois de 15 s de centrifugação, descartar o sobrenadante com a PAH não acoplado. Lave o microcores coberto com água desionizada, pelo menos 3 vezes por meio de centrifugação múltiplas e etapas de lavagem. Após a última centrifugação, descarte o sobrenadante.
- Incube a microcores por 1 min em um banho ultra-sônico para reduzir a sua agregação.
Nota: Se o corante fluorescente aplicado é catiônico, começar do poli (4-styrenesulfonate de sódio) (PSS) em 1 mol/L NaCl (consulte a etapa 1.7).
- Repita a etapa 1.6 com ~ 2 mL de uma solução de 4 mg/mL de PSS (também contendo 1 mol/L NaCl) para depositar a segunda camada polimérica dos modelos.
- Repita os passos de 1.6 e 1.7 seis vezes para depositar 12 camadas poliméricas.
Nota: Não é aconselhável fazer uma pausa longa (~ 12 h ou mais) no procedimento até ~ 3-5 camadas tenham sido depositadas por CaCO3 microcores sem cobertura tendem a recrystallize. Observe que cobertura PSS provoca uma maior agregação do microcores, e a longa pausa é aconselhável que somente quando PAH ou poli-L-lysine enxertado com polietileno glicol (PEG-PLL-g) é a camada de extrema. - Incube o microcores coberto em 2 mg/mL PLL-g-PEG (~ 1 mL por microtubo) pelo menos 2 h.
- Lave o microcores de água através de centrifugação sequencial e ressuspensão passos. Após a última centrifugação, descarte o sobrenadante.
- Para obter microcápsulas ocas, dissolva os CaCO3 modelos, adicionando 2 mL de 0.1 mol/L ácido etilenodiaminotetracético (EDTA) solução ácida (ajustado ao pH 7.1 com NaOH) para o microcores coberto.
- Depois de ~ 5 min de incubação, Centrifugar as microcápsulas para 45 s e descartar o sobrenadante com o EDTA.
- Repita os passos de 1.10 1.10.1 duas vezes.
- Lave as microcápsulas com 0,9% NaCl três vezes através de centrifugação vários passos dentro de 45 s seguido de etapas de lavagem. Após a última etapa de centrifugação, descarte o sobrenadante.
Nota: A solução final microcápsula para injeção deve ser mantida estéril (por exemplo, adicionando a ampicilina, 0,1 mg/mL), e a mídia deve ser biocompatível com o objeto da investigação (mídia isotônica com pH neutro). - Estime a concentração das microcápsulas preparadas em um hemocytometer sob um microscópio de fluorescência. Tomar uma série de fotos das microcápsulas, medir o diâmetro das sobre cem microcápsulas usando software ImageJ de9 ou equivalente e investigar a distribuição de tamanho usando um histograma.
- Loja a obtidos encapsulado sonda no escuro.
Nota: após várias lavagens em estéril 0,9% NaCl, as microcápsulas podem ser armazenadas durante meses a 4 ° C. Não é recomendado a secagem completa das microcápsulas durante o armazenamento.
2. preparação da óptica de configuração e calibragem de microencapsulados SNARF-1
Nota: Medições de pH áspero com microencapsulados SNARF-1 pode ser feita usando imagens em dois canais de um microscópio fluorescente7, mas neste protocolo um microscópio fluorescente de um canal ligado a um espectrómetro de fibra foi aplicado.
- Coloque o conjunto necessário de filtros de fluorescência para o microscópio fluorescente de acordo com as características do corante fluorescente aplicada e acender a lâmpada fluorescente.
- Puxe a alavanca para as oculares.
Cuidado: Luz de excesso pode danificar a matriz do espectrômetro. Assim, certifique-se de que a alavanca está no modo "ocular", quando o espectrómetro não é usado. - Conecte uma extremidade da fibra óptica para o espectrômetro e a outra extremidade a um colimador. Usando adaptadores, coloque o colimador no foco do tubo da câmera ou outra porta disponível do microscópio fluorescente.
- Ligue o espectrômetro. Execute o programa de controle do espectrômetro e preparar o espectrómetro para medições.
- Puxe a alavanca para as oculares.
- Para a calibração do lote microcapsule, colocar ~ 5 µ l de suspensão de microcápsula (microcápsulas de ~ 10 000 por µ l em água desionizada) em uma corrediça do microscópio e secar a gota em um lugar escuro (por exemplo, em um termostato a 35 ° C).
- Para calibrar as características espectrais do SNARF-1 microencapsulados, use uma série de buffers com valores diferentes de pH na faixa de 6 ~-9. Deixar ~ 10 µ l de uma reserva para as microcápsulas secas com SNARF-1-dextrano e cubra-o com uma lamela.
- Coloque a lâmina de vidro sobre o palco do microscópio. Localize as microcápsulas usando um objectivo de 40 ×.
- Gire a alavanca do microscópio para a porta da câmara. Registre sua fluorescência com o espectrômetro. Gire a alavanca de volta para as oculares.
Nota: Certifique-se de que o sinal espectral está muito além do nível de fundo e certifique-se de que as microcápsulas no campo de visão não estão em uma bolha (alternando para uma baixa ampliação se necessário). Evite iluminação prolongada de microcápsulas as mesmas. SNARF-1 é sensível ao fotobranqueamento. - Repita a etapa 2.2.3 para diferentes microcápsulas 10 - 15 vezes.
- Calcular os rácios de pico de fluorescência (por exemplo, usando o R ou Scilab) para todos os espectros registrados e determinar a linha de regressão entre a proporção mediana (para cada buffer) e pH médio usando a seguinte fórmula:
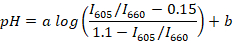
Nota: SNARF-1 tem um espectro com dois picos correspondentes à emissão do corante protonados e deprotonado e a relação entre os picos é sensível ao pH do meio. Neste estudo, a relação entre a intensidade de fluorescência para 605 e 660 nm é usada. Estes comprimentos de onda são escolhidos dependendo do conjunto de filtro usado. a e b são coeficientes a determinar por regressão não-linear (por exemplo, usando o R). Valores de 0,15 e 1.1 são, respectivamente, os valores mínimos e máximos de eu605/i660 observadas durante a calibração. - Recolha cerca de 10 µ l de sangue de peixe de aproximadamente 5 animais adultos. Lugar de peixe em um prato de Petri com 1 µ l/mL suspensão de óleo de cravo para a anestesia de água e esperar até que o animal vira de lado e para de responder com pitadas da nadadeira (normalmente ~ 2-3 min). Transfira o peixe em uma lâmina de vidro. Cortar o rabo de peixe com uma lanceta e coletar aproximadamente 2 µ l de sangue de peixe da veia da cauda.
Nota: Para evitar a coagulação do sangue, tratar a incisão com heparina (5000 U/mL) e usar microcentrifuga tubos e capilares de vidro heparinizado para coletar o sangue.- Cerca de 10 µ l de sangue com uma pipeta para a ponta do microeléctrodo de gotejamento e determinar o pH com um medidor de pH.
- Deixar o sangue numa lâmina com microcápsulas secas e registrar a relação entre a intensidade da fluorescência, como descrito para os buffers de calibração (passos 2.2-2.3).
- Ajuste o coeficiente linear da curva de calibração para fazer a curva coincidir com as medições no sangue (para mais detalhes, consulte Borvinskaya et al . 20175) peixe.
3. preparação para injeção
- Solte a agulha de aço da ponta da caneta de insulina (ou seringa), removendo o plástico com uma lanceta afiada.
Nota: Qualquer agulha fina (Ø0.33 mm ou menos) ou capilar de vidro (geralmente Ø1 mm) pode ser preparado para microinjeção de10,11. - Introduza a agulha no meio do caminho a conta de vidro; rapidamente e suavemente solda-lo usando uma tocha de gás.
- Conectar-se a conta de vidro para o microinjector e nivelá-lo com água estéril, três vezes. Certifique-se de que o líquido flui através da agulha.
- Encha o sistema com água destilada.
Nota: Certifique-se de que não há nenhuma bolha no sistema.
4. injeção
- Ressuspender a preparado suspensão de microcápsulas (estéril 0,9% NaCl, ou qualquer outra mídia usada para as injecções, com uma concentração de 0,5 a 6 milhões de microcápsulas por microlitro) usando o banho ultra-sônico por 1 min.
Nota: Uma vez que as microcápsulas tendem a precipitar-se, durante a injeção seguinte, agitar o frasco com as microcápsulas mecanicamente (usando um rotor) ou manualmente a cada poucos minutos para ressuspendê-los e evitar sua agregação. - Coloque o peixe em um prato de Petri com anestésico (0,1 mL/L de óleo de cravo, suspendido na água) ~ 2-3 min. espere até que o peixe vira de lado e para de responder com uma pitada de luz da nadadeira.
- Usando uma colher, transfira o peixe para fora a anestesia e delicadamente, coloque-o sobre uma esponja úmida em uma posição lateral com a cabeça para a esquerda (para uma pessoa destra) ou para a direita (para canhoto).
- Pouco antes da injeção, chupe 1-2mm de ar para o vidro capilar conectado com microinjector. Em seguida, carregá-lo com cerca de 2 µ l das microcápsulas dispersas.
Nota: Antes da injeção, a solução da microcápsula deve ser ajustada à temperatura a que os peixes são mantidos. - Delicadamente, estabilize o corpo do peixe sobre a esponja com a mão não dominante.
- Encontre a linha lateral dos peixes. Mentalmente, selecione um segmento que se estende do opérculo até o fim da cavidade abdominal. Encontre no meio desse segmento. Coloque a agulha 1 mm inferior na direção ventral.
- Com um movimento de raspagem, movimente suavemente o peixe escamas de lado e fazer uma punção. Insira a agulha no corpo em um ângulo de 45° para a superfície da mesa.
- Empurre a agulha em direção a espinha até cuidadosamente descansa contra ela.
- Cerca de 1 µ l de suspensão de microcápsulas de lançamento para o rim e lentamente, retirar a agulha.
Nota: Para encontrar o local de punção adequada mais facilmente, é útil para a prática de encontrar o rim do porta-malas por transilluminating os peixes usando uma luz de fundo, como mostrado na Figura 2A e 2B.
- Lave o peixe da cabeça à cauda com um fluxo de água para remover qualquer microcápsulas derramadas no local da injeção.
5. visualização in Vivo
- Use a tesoura de dissecação para remover a tampa da brânquia da cabeça do peixe e DDE das guelras de peixe. Enxague as brânquias com água.
- Usando uma colher, transfira o peixe para uma lâmina de microscópio e colocá-lo no palco do microscópio fluorescente.
Nota: Certifique-se que as brânquias dos peixes não secar durante procedimentos sucessivos. Para evitar isso, Umedeça-os periodicamente com água com uma pipeta Pasteur (aproximadamente cada 1-2 min). - Escurecer o quarto e usando baixa ampliação (x objetivo 10) inspecionar as brânquias para encontrar as microcápsulas fluorescentes.
Nota: Quando o procedimento é usado para a introdução de algumas partículas fluorescentes no sistema circulatório de peixes, é recomendável inspecionar brânquias de vários indivíduos para partículas fluorescentes inesperados antes de injeções. Guelras de peixe-zebra selvagem-tipo não tem autofluorescência, mas em alguns casos esporádicas partículas fluorescentes (como pedaços de alimentos ou simbiontes unicelulares) podem estar presentes em suas brânquias. Se necessário, essas partículas podem ser reconhecidas com base na sua forma específica (por exemplo, pedaços de alimentos têm forma irregular, ao contrário de microcápsulas esféricas) ou espectro de fluorescência (i.e., cor).- Mudar a lente para uma magnitude maior (objectivo × 40) e posicione um microcapsule ou um grupo de microcápsulas no centro do campo de visão.
- Gire a alavanca para a porta com um espectrômetro conectado. Grave o sinal espectral.
- Gire a alavanca de volta para a ocular.
- Repita as medições para diferentes microcápsulas várias vezes.
- Transferi os peixes para o aquário com aeração adequada para recuperação.
Nota: Com a prática mínima, é possível realizar a injeção e o sinal de gravação a uma taxa aproximada de 2-3 min por peixe. A medição pode ser repetida para um indivíduo várias vezes com o uso de doses repetidas de baixos, inofensivos de anestesia ou outro método de fixação. Para observação a longo prazo, use um sistema com anestesia contínua12.
Access restricted. Please log in or start a trial to view this content.
Resultados
Os resultados obtidos vêm de um dos três principais categorias do protocolo apresentado: a formação de micropartículas fluorescentes por encapsulamento de um corante fluorescente (Figura 1), a injeção de rim de microcápsulas com mais visualização no Gill capilares (Figura 2 e 3) e, finalmente, na vivo espectral gravação de fluorescência SNARF-1 para monitorar níveis de pH ...
Access restricted. Please log in or start a trial to view this content.
Discussão
Para demonstrar a injeção de micropartículas no rim zebrafish, usamos semi-permeável microcápsulas carregadas com um corante indicador. Assim, o protocolo contém instruções para a preparação das microcápsulas usando o assembly de camada por camada de polieletrolitos oposta carregado7,8,15,16,17 ,18 (
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Autores grandemente reconhecem a ajuda de Bogdan Osadchiy e Evgenii Protasov (Universidade Estatal de Irkutsk, Rússia) em preparação do protocolo de vídeo. Esta pesquisa foi apoiada pela Fundação de ciência russo (#15-14-10008) e a Fundação russo de pesquisa básica (#15-29-01003).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| SNARF-1-dextran, 70000 MW | Thermo Fisher Scientific | D3304 | Fluorescent probe. Any other appropriate polymer-bound fluorescent dye can be used as a microcapsule filler |
| Albumin-fluorescein isothiocyanate conjugate (FITC-BSA) | SIGMA | A9771 | Fluorescent probe |
| Rhodamine B isothiocyanate-Dextran (RITC-dextran) | SIGMA | R9379 | Fluorescent probe |
| Calcium chloride | SIGMA | C1016 | CaCO3 templates formation |
| Sodium carbonate | SIGMA | S7795 | CaCO3 templates formation |
| Poly(allylamine hydrochloride), MW 50000 (PAH) | SIGMA | 283215 | Cationic polymer |
| Poly(sodium 4-styrenesulfonate), MW 70000 (PSS) | SIGMA | 243051 | Anionic polymer |
| Poly-L-lysine [20 kDa] grafted with polyethylene glycol [5 kDa], g = 3.0 to 4.5 (PLL-g-PEG) | SuSoS | PLL(20)-g[3.5]-PEG(5) | Final polymer to increase the biocompatibility of microcapsules |
| Sodium chloride | SIGMA | S8776 | To dissolve applied polymers |
| Water Purification System | Millipore | SIMSV0000 | To prepare deionized water |
| Magnetic stirrer | Stegler | For CaCO3 templates formation | |
| Eppendorf Research plus pipette, 1000 µL | Eppendorf | Dosing solutions | |
| Eppendorf Research plus pipette, 10 µL | Eppendorf | Dosing solutions | |
| Pipette tips, volume range 200 to 1000 µL | F.L. Medical | 28093 | Dosing solutions |
| Pipette tips, volume range 0.1-10 μL | Eppendorf | Z640069 | Dosing solutions |
| Mini-centrifuge Microspin 12, High-speed | BioSan | For microcapsule centrifugation-washing procedure | |
| Microcentrifuge tubes, 2 mL | Eppendorf | Z666513 | Microcapsule synthesis and storage |
| Shaker Intelli-mixer RM-1L | ELMY Ltd. | To reduce microcapsule aggregation | |
| Ultrasonic cleaner | To reduce microcapsule aggregation | ||
| Head phones | To protect ears from ultrasound | ||
| Ethylenediaminetetraacetic acid | SIGMA | EDS | To dissolve the CaCO3 templates |
| Monosodium phosphate | SIGMA | S9638 | Preparation of pH buffers |
| Disodium phosphate | SIGMA | S9390 | Preparation of pH buffers |
| Sodium hydroxide | SIGMA | S8045 | To adjust the pH of the EDTA solution and buffers |
| Thermostat chamber | To dry microcapsules on glass slide | ||
| Hemocytometer blood cell count chamber | To investigate the size distribution and concentration of the prepared microcapsules | ||
| Fluorescent microscope Mikmed 2 | LOMO | In vivo visualization of microcapsules in fish blood | |
| Set of fluorescent filters for SNARF-1 (should be chosen depending on the microscope model; example is provided) | Chroma | 79010 | Visualization of microcapsules with fluorescent probes |
| Fiber spectrometer QE Pro | Ocean Optics | Calibration of microcapsules under microscope | |
| Optical fiber QP400-2-VIS NIR, 400 μm, 2 m | Ocean Optics | To connect spectrometer with microscope port | |
| Collimator F280SMA-A | Thorlabs | To connect spectrometer with microscope port | |
| Glass microscope slide | Fisherbrand | 12-550-A3 | Calibration of microcapsules under microscope |
| Coverslips, 22 x 22 mm | Pearl | MS-SLIDCV | Calibration of microcapsules under microscope |
| Glass microcapillaries Intra MARK, 10 µL | Blaubrand | BR708709 | To collect fish blood |
| Clove oil | SIGMA | C8392 | Fish anesthesia |
| Lancet No 11 | Apexmed international B.V. | P00588 | To cut the fish tail and release the steel needle from the tip of insulin autoinjector |
| Heparin, 5000 U/mL | Calbiochem | L6510-BC | For treating all surfaces that come in contact with fish blood during fish blood collection |
| Seven 2 Go Pro pH-meter with a microelectrode | Mettler Toledo | To determine fish blood pH | |
| Insulin pen needles Micro-Fine Plus, 0.25 x 5 mm | Becton, Dickinson and Company | For injection procedure. Any thin needle (Ø 0.33 mm or less) is appropriate | |
| Glass capillaries, 1 x 75 mm | Hirschmann Laborgeräte GmbH & Co | 9201075 | For injection procedure |
| Gas torch | To solder steel needle to glass capillary | ||
| Microinjector IM-9B | NARISHIGE | For precise dosing of microcapsules suspension | |
| Petri dishes, 60 mm x 15 mm, polystyrene | SIGMA | P5481 | For manipulations with fish under anesthesia |
| Plastic spoon | For manipulations with fish under anesthesia | ||
| Damp sponge | For manipulations with fish under anesthesia | ||
| Dissection scissors | Thermo Scientific | 31212 | To remove the gill cover from the fish head |
| Pasteur pipette, 3.5 mL | BRAND | Z331767 | To moisten fish gills |
Referências
- Rivas-Aravena, A., Sandino, A. M., Spencer, E. Nanoparticles and microparticles of polymers and polysaccharides to administer fish vaccines. Biol. Res. 46 (4), 407-419 (2013).
- Yashchenok, A. M., Jose, J., Trochet, P., Sukhorukov, G. B., Gorin, D. A. Multifunctional polyelectrolyte microcapsules as a contrast agent for photoacoustic imaging in blood. J. Biophotonics. 9 (8), 792-799 (2016).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J. Vis. Exp. (34), e1645(2009).
- Gurkov, A., Shchapova, Е, Bedulina, D., Baduev, B., Borvinskaya, E., Timofeyev, M. Remote in vivo stress assessment of aquatic animals with microencapsulated biomarkers for environmental monitoring. Sci. Rep. 6, e36427(2016).
- Borvinskaya, E., Gurkov, A., Shchapova, E., Baduev, B., Shatilina, Z., Sadovoy, A., et al. Parallel in vivo monitoring of pH in gill capillaries and muscles of fishes using microencapsulated biomarkers. Biol. Open. 6 (5), 673-677 (2017).
- Diep, C. Q., Davidson, A. J. Transplantation of cells directly into the kidney of adult zebrafish. J. Vis. Exp. (51), e2725(2011).
- Kreft, O., Javier, A. M., Sukhorukov, G. B., Parak, W. J. Polymer microcapsules as mobile local pH-sensors. J. Mater. Chem. 17 (42), 4471-4476 (2007).
- Sadovoy, A., Teh, C., Korzh, V., Escobar, M., Meglinski, I. Microencapsulated bio-markers for assessment of stress conditions in aquatic organisms in vivo. Laser Phys. Lett. 9 (7), 542-546 (2012).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - Version 1.44. , imagej.nih.gov/ij/docs/guide/ (2012).
- Poland, R. S., Bull, C., Syed, W. A., Bowers, M. S. Rodent brain microinjection to study molecular substrates of motivated behavior. J. Vis. Exp. (103), e53018(2015).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J. Vis. Exp. (21), e960(2008).
- Johnston, L., Ball, R. E., Acuff, S., Gaudet, J., Sornborger, A., Lauderdale, J. D. Electrophysiological recording in the brain of intact adult zebrafish. J. Vis. Exp. (81), e51065(2013).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J. Vis. Exp. (54), e2839(2011).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: Emerging models of acute kidney injury. Curr Pathobiol Rep. 3 (2), 171-181 (2015).
- Donath, E., Sukhorukov, G. B., Caruso, F., Davi, S. A., Möhwald, H. Novel hollow polymer shells by colloid-templated assembly of polyelectrolytes. Angew. Chem. Int. Ed. 37 (17), 2201-2205 (1998).
- Antipov, A. A., Shchukin, D., Fedutik, Y., Petrov, A. I., Sukhorukov, G. B., Möhwald, H. Carbonate microparticles for hollow polyelectrolyte capsules fabrication. Colloids Surf. A. 224, 175-183 (2003).
- Gaponik, N., Radtchenko, I. L., Gerstenberger, M. R., Fedutik, Y. A., Sukhorukov, G. B., Rogach, A. L. Labeling of biocompatible polymer microcapsules with near-infrared emitting nanocrystals. Nano Lett. 3 (3), 369-372 (2003).
- Volodkin, D. V., Larionova, N. I., Sukhorukov, G. B. Protein encapsulation via porous CaCO3 microparticles templating. Biomacromolecules. 5 (5), 1962-1972 (2004).
- Tzaneva, V., Perry, S. F. A Time differential staining technique coupled with full bilateral gill denervation to study ionocytes in fish. J. Vis. Exp. (97), e52548(2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados