需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
分光光度法测定蓝藻Synechocystis中的蛋白含量
摘要
在这里, 我们提出了一个协议, 以定量地确定蛋白的内容在蓝藻Synechocystis使用分光光度法。提取过程也成功地应用于其他蓝藻和藻类菌株;然而, 由于颜料吸收谱的变化, 有必要分别测试每种菌株的分光光度方程。
摘要
这是一个简单的协议, 以定量测定蛋白的内容在模型蓝藻Synechocystis。藻胆蛋白是 phycobilisomes 中最重要的成分, 是蓝藻中主要的光捕获触角和几种藻类群。Synechocystis的 phycobilisomes 包含两个藻胆蛋白: 藻和复方阿司匹林。该协议描述了一种简单、高效、可靠的方法, 用于定量测定该模型蓝藻中的藻和复方阿司匹林。比较了几种蛋白提取方法和分光光度法。本协议中所述的萃取过程也成功地应用于其他蓝藻菌株, 如Cyanothece 、 Synechococcuselongatus、螺旋藻、节旋藻sp、和念珠菌, 以及红藻类紫球藻藻。然而, 不同分类群的特定藻胆蛋白的消光系数可能不同, 因此建议分别验证每一个单株的分光光度法。该议定书需要很少的时间, 可以在任何标准生命科学实验室进行, 因为它只需要标准设备。
引言
fPhycobiliproteins 是水溶性色素蛋白复合物, 代表原核蓝藻 (蓝藻) 和几种真核生物群中的光收获触角的主要成分 (Glaucophyta、红藻门和Cryptophyta)1。它们主要发生在称为 phycobilisomes 的超分子复合体上, 通常附着在基质侧的光合膜表面, 除Cryptophyta外, 藻胆蛋白在囊体腔2。迄今已确定了四种类型的藻胆蛋白: 核心复方阿司匹林和外围藻、藻红蛋白和 phycoerythrocyanin1。phycobilisomes 作为主要的光收获配合物, 是藻类和蓝藻群体培养生产力的重要因素之一。结果表明, phycobilisomes 截断可提高强光下3的生物量积累。另一方面, 在适度或低辐照度下, 天线截断导致生长速率和生物量积累减少3,4。藻胆蛋白在化妆品行业中作为食品着色剂、药品和食品添加剂, 并作为荧光探针应用于流式细胞术、荧光免疫和荧光显微镜5。
本协议着重于蓝藻Synechocystis模型中藻胆蛋白的定量测定。蓝藻是最早的氧光合自养;他们已经形成了地球的生物圈超过24亿年6。它们在氮、碳、氧和其他元素的全球生物地球化学循环中起着至关重要的作用。在蓝藻中, 单细胞菌株Synechocystis获得了独特的地位, 因为它是第一个蓝藻与整个基因组序列7,8, 它是自然转化的外源 DNA9, 并它执行稳定和相对地快速的成长10,11。在Synechocystis, 核心天线组件, 复方阿司匹林, 是与整体膜蛋白, 并附上藻位于囊体膜外围。
在该协议中比较了蛋白提取和定量的几种方法。最后提取程序成功地应用于Synechocystis, 以及其他蓝藻菌株, 包括Cyanothece sp, Synechococcuselongatus,螺旋藻sp,节旋藻sp和念珠菌, 也成功地应用于红藻类紫球藻藻。因此, 本协议中开发的方法可以被认为是蛋白提取的通用方法。尽管一些经过测试的提取方法导致了总蛋白产量的提高, 这里描述的萃取过程提供了最高的蛋白产量连同叶绿素的最低含量的残留在蛋白提取物。降低叶绿素a的含量是正确藻和复方阿司匹林分光光度定量的关键。
不同藻类和蓝藻物种的蛋白吸收光谱在12、13、14、15、16、17 、甚至在18种单一蓝藻属的几种菌株中。因此, 用于测定Synechocystis中藻和复方阿司匹林的特定波长和吸收系数一般不适用于其他菌株。此外, Synechocystis不包含藻红蛋白和 phycoerythrocyanin, 可以在其他藻类和蓝藻中发现。为了确定非Synechocystis菌株中的藻胆蛋白, 建议分别对各菌株的分光光度方程进行评价。
虽然该议定书包含两个较长的步骤 (夜间冷冻干燥的细胞颗粒和1小时蛋白质提取), 总的劳动时间为藻胆蛋白量化不超过2小时。
研究方案
1. 蓝藻栽培
- 培养Synechocystis细胞在锥形烧瓶或光生物反应器10,19在缓冲 BG11 中等20保持 pH < 10 (例如, 使用17毫米 HEPES10)。
注: 标准栽培条件要求受控温度 (通常为30摄氏度, 最佳温度为35°c)21, 光照 (通常是强度高达800µmol [光子]/[m2·s])21的白色光, 和 CO2供应 (在400毫升平板光生物反应器, 增长饱和 CO2集中是 1700 ppm)21。 - 要确定培养密度, 测量的文化光学密度 spectrophotometrically 在730毫微米 (OD730) 使用一个试管以 1 cm 的光路径. 或者, 使用 hemocytometer 或自动单元格在显微镜下计数细胞计数器。
2. 样品准备
- 低辐照度下工作, 防止蛋白降解。
- 收获 3 x 1 毫升的文化悬浮到安全锁管。使用 triplicates 来估计测量中的技术误差。在无菌条件下进行培养取样, 在层流罩中收获细胞, 并遵循适当的工作和安全做法。
- 在实验室温度下将细胞在 1.5万 x g处离心成5分钟. 注意适当平衡的离心机转子。离心后, 丢弃上清液。一定不要打扰球团。
- 把样品放在冰箱里。要长期贮存, 请将样品保持在摄氏-80 摄氏度。这是防止蛋白退化的必要措施。对于短期储存,-20 °c 是足够的。
- 冷冻干燥样品过夜。在适当的冷冻干燥过程中, 将冷冻干燥冷凝器的温度保持在-60 摄氏度以下, 冷冻干燥室的压力约为1帕。
- 完成冷冻干燥循环后, 应尽快关闭管, 以防止吸收的空气中的水。
3. 细胞均匀化和色素提取
- 将四片玻璃珠 (直径2毫米) 添加到每个取样管上, 然后关闭管。
注: 当用于均匀化的安全锁管的盖子太薄时, 可以在匀质过程中断裂;因此, 本协议只推荐有强盖的安全锁管。 - 融汇样品与玻璃珠十五年代在一个均匀机在实验室温度。
注: 在安全锁管的整个内表面均有适当的匀质试样。 - 添加1毫升的 PBS 缓冲器 (pH 7.4), 预换热器到4摄氏度, 以提取藻胆蛋白的样品。
注意: 从这个步骤上, 保持样品在冰上, 以防止降解的提取蛋白。这是至关重要的。 - 在实验室温度下, 将样品与 PBS 混合5秒。
注: 混合后, 样品呈绿色。 - 混合后, 将样品放在冰上60分钟, 用盖子盖住冰浴, 以防颜料降解。
- 经过60分钟的蛋白萃取, 离心机的样品在 1.5万 x克4 摄氏度为5分钟. 注意适当平衡离心机转子。
注: 离心后, 上清有青色蓝色。
4. 蛋白量化
- 在分光光度测量之前, 用 PBS 缓冲器将光谱仪校准为空白。
- 校准分光光度计后, 将 PBS 从一个分光光度计试管, 用提取的藻胆蛋白代替所丢弃的缓冲器, 将上清液吸管移除。
- 用 0.5 nm 的狭缝宽度量化蛋白浓度 spectrophotometrically。
- 分别测量藻和复方阿司匹林中 phycocyanobilins 在 615 nm (615) 和 652 nm (652) 的 PBS 缓冲器上的吸光度, 并测量在 720 nm (720) 的细胞碎片的吸收量。
- 根据班尼特和 Bogorad12的方程式 (1) 和 (2) 计算藻和复方阿司匹林的浓度:
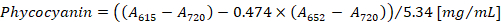
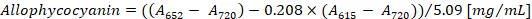
注:615、652和720应符合分光光度计的线性吸收范围。如有必要, 用 PBS 缓冲器稀释样品。
- 重新计算原始样品中的颜料浓度。样品中的颜料浓度与方程 (1) 和 (2) 的结果直接对应, 当1毫升的培养基和1毫升的萃取缓冲器用于分析时。如果使用不同数量的蓝藻样品和/或 PBS 缓冲器, 最后的颜料浓度应根据等式 (3) 计算:
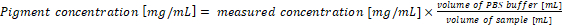 (3)
(3)
注: 在每细胞干重的正则蛋白含量的情况下, 应根据方程式 (4)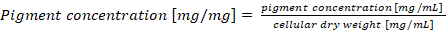 (4) 计算最终颜料浓度。
(4) 计算最终颜料浓度。
5. 测定细胞干重 (可选)
- 在分析天平上重三个空的安全锁管。
注意: 安全锁管干燥是至关重要的。如果将管子贮存在潮湿的环境中, 将管子在冷冻干燥机中干燥几个小时, 然后再称量。轻轻地操纵管子, 只用无粉手套的手, 以避免材料和研究员的手指之间的任何接触。保持所有的持有者和离心机的清洁, 以避免任何材料转移到管。 - 样品 1 x 15 毫升的文化悬浮到15毫升圆锥管。
- 离心机的培养悬浮在15毫升圆锥管在 4000 x g在实验室温度为10分钟. 平衡离心机转子与三额外15毫升圆锥管, 每个包含15毫升的水。离心后, 丢弃12毫升的上清。
- 并用重悬颗粒在剩余的上清和转移 3 x 1 毫升混合物到三1.5 毫升安全锁管子与吸管。如果剩余的颗粒留在15毫升圆锥管, 添加1.5 毫升的去离子水到锥形管, 涡流或摇动管并用重悬余下的颗粒, 并转移 3 x 0.5 毫升的混合物到三1.5 毫升安全锁管 (已经 containing 3 x 1 毫升的颗粒) 与吸管。
注: 将球团除以三1.5 毫升的安全锁管, 可以估计干重测量的任何技术误差。 - 在实验室温度为5分钟, 将1.5 毫升安全锁管中的细胞离心成 1.5万 x克. 平衡离心机转子与另外1.5 毫升安全锁管, 包含1毫升水。离心后, 丢弃上清液。
- 把样品放在冰箱里。长期贮存, 样品保持在摄氏-80 摄氏度;为短期存贮,-20 °c 是充足的。
- 冷冻干燥样品过夜。为适当的冷冻干燥过程, 保持冷冻干燥冷凝器的温度低于-90 °c 和在冷冻干燥室的压力约 1 hPa。
- 冷冻干燥后, 关闭管, 并权衡样品的分析平衡。
注: 干重值可用于每细胞干重蛋白含量的规范化。
结果
对于最初的方法测试, Synechocystis被培养了作为批培养在锥形烧瓶在 BG11 耕种媒介20 (补充与17毫米 HEPES) 在25°c, 在一个温暖的白色光之下强度的50µmol (光子)/(m2·s) 和与 1% CO2在培养的大气。在养殖过程中, 将这些培养物取样到安全锁管和离心 (实验室温度为5分钟 1.5万克), 将清液丢弃, 并将样品储存在-80 摄氏度, 冷冻干燥作为制?...
讨论
该协议描述了一种简单、快速、可重现的方法, 用于量化蓝藻Synechocystis中的蛋白内容。比较了细胞均匀化、蛋白质提取、藻和复方阿司匹林量化的几种方法, 最后的协议代表了每一个过程的最优步骤的组合。作为代表性数据, 藻胆蛋白在Synechocystis细胞中的含量随着光照强度的增加而定量化。尽管分析需要类似的时间和实验室设备作为一些以前发布的方法12,
披露声明
作者没有什么可透露的。
致谢
该议定书是从上一个出版物11通过的。t.z.、d. Č和 J. 由捷克共和国教育、青年和体育部在国家可持续发展方案 (NPU 一) 的支持下, 授予编号 LO1415。J. Č也得到了 GA CR 的支持, 18-24397S 号。捷克的系统生物学 C4SYS 研究基础设施 (项目没有 LM2015055) 支持获得仪器和其他设施的机会。m.a.s. 得到了俄罗斯科学基金会的资助 [14-14-00904]。
材料
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
参考文献
- Mimuro, M., Kikuchi, H., Green, B. R., Parson, W. W. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. , 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100 (2016).
- Bryant, D. A. . The Molecular Biology of Cyanobacteria. , (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130 (2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V., Lobban, C. S., Chapman, D. J., Kremer, B. P. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. , 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., Gault, P. M., Marler, H. J., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. , 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133 (2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。