Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Спектрофотометрические определение содержания Phycobiliprotein в цианобактерии Synechocystis
В этой статье
Резюме
Здесь мы представляем протокол количественно определить содержание phycobiliprotein в цианобактерии Synechocystis спектрофотометрическим методом. Процедура извлечения также успешно применяется для других штаммов водорослей и цианобактерий; Однако из-за различий в спектрах поглощения пигмент, необходимо отдельно проверить спектрофотометрические уравнения для каждого штамма.
Аннотация
Это простой протокол для количественного определения содержания phycobiliprotein в модели цианобактерии Synechocystis. Фикобилипротеинов являются наиболее важных компонентов phycobilisomes, основных светособирающего антенн в цианобактерий и несколько таксонов водорослей. Phycobilisomes Synechocystis содержат два фикобилипротеинов: фикоцианина и аллофикоцианин. Этот протокол описывает простой, эффективный и надежный метод количественного определения фикоцианина и аллофикоцианин в этой модели цианобактерии. Мы сравнили несколько методов добычи phycobiliprotein и спектрофотометрические количественной оценки. Процедура извлечения, как описано в настоящем протоколе был также успешно применяется для других штаммов цианобактерий например Arthrospira sp., Cyanothece sp., Synechococcuselongatus, спирулина sp., и Nostoc sp., а также относительно красных водорослей порфиридиума cruentum. Однако коэффициенты вымирания конкретных фикобилипротеинов из различных таксонов могут отличаться и таким образом, рекомендуется проверить метод спектрофотометрические квантификации для каждое одного штамма индивидуально. Протокол требует немного времени и могут быть выполнены в любой лаборатории стандартного науки о жизни, так как он требует только стандартное оборудование.
Введение
fPhycobiliproteins являются водорастворимый пигмент белковых комплексов, которые представляют собой основные компоненты светособирающего антенн в прокариотических цианобактерий (синезеленых) и несколько эукариотические таксоны (Glaucophyta, Rhodophyta и криптофитов)1. Они возникают главным образом как супрамолекулярные комплексы, называется phycobilisomes, и обычно они прикреплены к поверхности фотосинтетических мембран на стороне стромы, за исключением криптофитов, где фикобилипротеинов локализованы в тилакоидов люмен2. Были определены четыре вида фикобилипротеинов до Дата: аллофикоцианин основных и периферийных фикоцианин, фикоэритрин и Фикоэритроцианин1. Как основной светособирающих комплексов phycobilisomes представляют собой один из важнейших факторов производительности массовой культуры водорослей и цианобактерий. Доказано, что phycobilisomes усечение может повысить накопления биомассы под сильный свет3. С другой стороны под скромным или низкой освещенности, антенна усечения привело темпы роста и биомассы накопления сокращение3,4. Фикобилипротеинов коммерчески используются красители пищевые, фармацевтических препаратов и пищевых добавок, в косметической промышленности, а также флуоресценции зондов с приложениями в проточной цитометрии, флуоресцентного иммуноанализа и микроскопии флуоресцирования5.
Этот протокол фокусируется на количественное определение фикобилипротеинов в модели цианобактерии Synechocystis. Цианобактерии являются ранние oxygenic фотосинтетических автотрофы; они формировании биосферы земли более 2,4 миллиарда лет6. Они играют решающую роль в глобальных биогеохимических циклах, азота, углерода, кислорода и других элементов. Среди цианобактерий, одноклеточные штамм Synechocystis получила уникальное положение, поскольку он был первым цианобактерии с весь геном последовательности7,8, это естественно трансформер экзогенной ДНК9, и Он выполняет стабильным и относительно быстрый рост10,11. В Synechocystis, основной компонент антенна, аллофикоцианин, ассоциируется с составной мембранных белков и прилагаемый фикоцианина расположен на периферии тилакоидной мембраны.
Несколько методов для извлечения phycobiliprotein и количественной оценки сравниваются в рамках настоящего Протокола. Процедура окончательного извлечения был успешно применен Synechocystis, а также другие цианобактерий штаммов, включая Arthrospira Cyanothece sp., Synechococcuselongatus, спирулина sp., СП.и Nostoc sp. и он был также успешно применяется для красных водорослей порфиридиума cruentum. Таким образом метод, разработанный в этом протоколе может рассматриваться как универсальный метод для извлечения phycobiliprotein. Даже несмотря на то, что некоторые из методов испытания извлечения привело к повышению урожайности общего белка, здесь описывается процедура извлечения условии высоким phycobiliprotein дает вместе с наименьшим содержанием остатков хлорофилла в Экстракт Phycobiliprotein. Для правильной фикоцианина и аллофикоцианин спектрофотометрические количественной оценки необходимо уменьшить содержание хлорофилла .
Спектры поглощения phycobiliprotein может значительно различаться между различными водоросли и цианобактерии видов12,13,14,,1516,17 и даже среди нескольких штаммов одного цианобактерий рода18. Таким образом конкретные длинах волн и поглощения коэффициенты, используемые для определения фикоцианина и аллофикоцианин в Synechocystis не применяются обычно для других штаммов. Кроме того Synechocystis не содержат фикоэритрин и Фикоэритроцианин, которые могут быть найдены в некоторых других водорослей и цианобактерий. Для целей определения фикобилипротеинов штаммов Synechocystisпомимо рекомендуется оценить спектрофотометрические уравнения для каждого штамма индивидуально.
Хотя протокол содержит два больше шагов (на ночь паром для лиофильной сушки сотовой окатышей и извлечения протеина 1 час), общее рабочее время для количественной оценки фикобилипротеинов не более 2 часов.
протокол
1. цианобактерий культивирование
- Культивируйте Synechocystis клеток в колбах Эрленмейер или в фотобиореакторах10,19 в буферизации BG11 средний20 для поддержания pH < 10 (например, с помощью 17 мм HEPES10).
Примечание: Стандартные культивирования условия требуют контролируемой температуре (30 ° С, оптимальная температура обычно 35 ° C)21, освещения (как правило, белый свет интенсивности до 800 мкмоль [фотоны] / [m2·s])21и CO 2 поставка (в 400 мл photobioreactor плоских, роста, насыщая концентрации CO2 -1700 ppm)21. - Для определения плотности культуры, измерения оптической плотности культуры спектрофотометрически на 730 Нм (OD730) с помощью кювета с светового луча от 1 см. Кроме того, граф клетки под микроскопом, используя Горяева или автоматизированные ячейки Счетчик.
2. образцы подготовка
- Работа при низкой освещенности для предотвращения деградации phycobiliprotein.
- Урожай 3 x 1 мл суспензии культуры до упора Сейф трубы. Используйте triplicates для оценки технических ошибок в измерении. Для выборки культуры в стерильных условиях, урожай клетки в ламинарных капюшоном и следуйте рекомендациям по работе и безопасности.
- Центрифуга клетки на 15000 x g при температуре лаборатории для 5 минут обращать внимание на ротор надлежащим образом сбалансированной центрифуги. После центрифугирования отбросить supernatants. Будьте уверены, чтобы не мешать гранулы.
- Поместите образцы в морозильную камеру. Для длительного хранения сохранить образцы в-80 ° C. Это необходимо для предотвращения деградации phycobiliprotein. Для краткосрочного хранения-20 ° C является достаточным.
- Freeze-Dry образцы на ночь. Для надлежащего процесса сушки Держите температуру замораживания сушилка конденсатора ниже-60 ° C и давление в камере замораживания сушилка вокруг 1 гПа.
- После окончания цикла Плаурайта, закройте трубку как можно скорее, чтобы предотвратить реабсорбции воды из воздуха.
3. сотовый гомогенизации и пигменты извлечения
- Добавление четырех штук стеклянных шариков (с диаметром 2 мм) для каждого образца трубки и закрыть трубы.
Примечание: Когда крышку трубки Сейф lock используется для гомогенизации слишком тонкая, она может разорвать во время гомогенизации; Таким образом только Сейф замок трубы с сильным крышками рекомендуются для этого протокола. - Однородный образцы с Стеклошарики для 15 s на гомогенизатор температуре лаборатории.
Примечание: Образец надлежащим образом гомогенизированный распространяется всей внутренней поверхности трубы Сейф lock. - Добавьте 1 mL PBS буфера (рН 7,4), охладить до 4 ° C, для пробы для того чтобы извлечь фикобилипротеинов.
Примечание: От этого шага на Храните пробы на льду для предотвращения деградации извлечения белков. Это очень важно. - Смешать образцы с PBS для 5 s на гомогенизатор температуре лаборатории.
Примечание: После смешивания, образцы зеленоватый. - После смешивания, храните пробы на льду на 60 мин Обложка ледяной ванне с крышкой для предотвращения деградации пигменты.
- После 60 мин phycobiliprotein добычи Центрифугуйте образцы на 15000 x g при 4 ° C за 5 мин обращать внимание на правильно сбалансировать ротора центрифуги.
Примечание: После центрифугирования, супернатанта имеет голубой синий цвет.
4. Phycobiliprotein количественная оценка
- До спектрофотометрические измерения калибровки спектрофотометр базовой линии с помощью буфера PBS как пустой.
- Как только калиброванные спектрофотометра, отменить PBS от одного спектрофотометр кювет и Пипетка супернатант с извлеченными фикобилипротеинов вместо с буфера отбрасываются.
- Количественную оценку концентрации phycobiliprotein спектрофотометрически, используя щель шириной 0,5 Нм.
- Измерение поглощения phycocyanobilins фикоцианина и аллофикоцианин против PBS буфере пустыми в 615 Нм (615) и 652 Нм (652), соответственно, и измерения оптической плотности сотовой мусора на 720 Нм (720).
- Рассчитайте концентрацию фикоцианина и аллофикоцианин согласно уравнений (1) и (2) Беннетт и Богорад12:
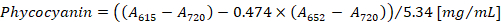
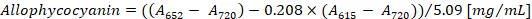
Примечание:615,652и720 должны соответствовать линейной оптической плотности спектр спектрофотометра. При необходимости разбавьте образца с PBS буфера.
- Пересчет концентрации пигмента в оригинальные образцы. Концентрации пигмента в примере соответствует непосредственно с результатами уравнений (1) и (2) когда 1 мл культуры и 1 мл буфера извлечения используются для анализа. В случае с использованием различных объемов цианобактерий образцы или PBS буфера, концентрации пигмента окончательный должен рассчитываться по формуле (3):
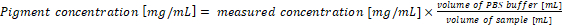 (3)
(3)
Примечание: В случае нормализации содержания phycobiliprotein на сухой массы клеток, концентрации пигмента окончательный должен рассчитываться по формуле (4)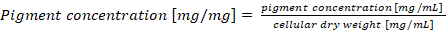 (4)
(4)
5. Определение ячейки сухого веса (опционально)
- Весят три пустые трубы Сейф замок на аналитические весы.
Предупреждение: Важно, что Сейф lock трубки сухим. В случае хранения труб в влажной среде, сухие трубы на несколько часов перед началом взвешивания их замораживания. Манипулировать трубы аккуратно и только с неопудренные перчатках, чтобы избежать любой контакт между материалом и исследователь пальцев. Держите все держатели и центрифуги чистой, чтобы избежать передачи любого материала трубы. - Пример 1 x 15 мл суспензии культуры до 15 мл Конические трубки.
- Центрифуга культуры подвеска в 15 мл конические трубы на 4000 x g при температуре лаборатории для 10 min. баланс ротора центрифуги с трех дополнительных 15 мл конические трубы, каждый содержащий 15 мл воды. После центрифугирования отбросить 12 мл супернатант.
- Ресуспензируйте гранулы в оставшихся супернатант и передачи 3 x 1 мл смеси в три пробирки Сейф замок 1,5 мл с пипеткой. В случае, если некоторые остатки гранулы остаются в 15 мл Конические трубки, добавьте 1,5 мл деионизованной воды в конической трубки, вихревой или трясти трубки Ресуспензируйте оставшиеся Пелле и передачи 3 x 0.5 мл смеси в три пробирки Сейф lock 1,5 мл (уже containi нг 3 x 1 мл гранул) с пипеткой.
Примечание: Деления Пелле за три трубки Сейф замок 1,5 мл позволит оценить любой технической ошибки измерения сухого веса. - Центрифуга клетки в 1,5 мл Сейф замок трубы на 15000 x g при температуре лаборатории для 5 минут баланс ротора центрифуги с дополнительной 1,5 Сейф замок мл, содержащий в 1 мл воды. После центрифугирования отбросить supernatants.
- Поместите образцы в морозильную камеру. Для длительного хранения сохранить образцы в-80 ° C; для краткосрочного хранения,-20 ° C является достаточным.
- Freeze-Dry образцы на ночь. Для надлежащего процесса сушки Держите температуру замораживания сушки конденсатора ниже-90 ° C и давление в камере замораживания сушилка вокруг 1 гПа.
- После для, закройте трубы и взвесить образцы на аналитические весы.
Примечание: Значение сухого веса, может использоваться для нормализации содержания phycobiliprotein на сухой массы клеток.
Результаты
Для первоначального метода испытаний, Synechocystis культивировалось как пакетного культур в колбах Эрленмейер на шейкер в BG11 культивирование средний20 (ДОПОЛНЕНО 17 мм HEPES) при 25 ° C, под теплый белый свет интенсивности 50 мкмоль (фотонов) / (м 2·s) и с 1% CO...
Обсуждение
Этот протокол описывает простой, быстрый и воспроизводимый метод количественного определения содержания phycobiliprotein в модели цианобактерии Synechocystis. Сравниваются несколько методов клеток гомогенизации, экстракции белков и фикоцианина и аллофикоцианин количественной оценки, и Закл...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Протокол был принят от предыдущей публикации11. Т. з., Ch. ум и J. Č. были поддержаны министерства образования, молодежи и спорта Чешской Республики в рамках национальной программы устойчивого развития я (НПУ я), предоставить номер LO1415. J. Č. было также поддержано GA CR, номер гранта 18-24397S. Доступ к документам и другим объектам было поддержано чешский исследовательской инфраструктуры для систем биологии C4SYS (проект не LM2015055). М. а. с. была поддержана грантом от российского фонда науки [№ 14-14-00904].
Материалы
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
Ссылки
- Mimuro, M., Kikuchi, H., Green, B. R., Parson, W. W. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. , 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100 (2016).
- Bryant, D. A. . The Molecular Biology of Cyanobacteria. , (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130 (2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V., Lobban, C. S., Chapman, D. J., Kremer, B. P. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. , 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., Gault, P. M., Marler, H. J., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. , 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133 (2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены