É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Determinação espectrofotométrica de Phycobiliprotein conteúdo em associação Synechocystis
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para determinar quantitativamente o conteúdo de phycobiliprotein na associação Synechocystis , usando um método espectrofotométrico. O procedimento de extração foi aplicado também com sucesso para outras cepas de cianobactérias e algas; no entanto, devido às variações em espectros de absorção do pigmento, é necessário testar as equações espectrofotométricas para cada estirpe individualmente.
Resumo
Este é um protocolo simples para a determinação quantitativa do teor de phycobiliprotein na associação modelo Synechocystis. Phycobiliproteins são os componentes mais importantes de ficobilissoma captadores, as grandes antenas de luz-colheita em cianobactérias e vários táxons de algas. Os ficobilissoma captadores de Synechocystis contêm dois phycobiliproteins: ficocianina e allophycocyanin. Este protocolo descreve uma simples, eficiente e confiável método para a determinação quantitativa de ficocianina e allophycocyanin na associação deste modelo. Comparou-se vários métodos de extração de phycobiliprotein e quantificação espectrofotométrica. O procedimento de extração, conforme descrito neste protocolo foi aplicado também com sucesso para outras cepas de cianobactérias como Cyanothece SP., Synechococcuselongatus, Spirulina sp.,sp intoxicante ., e Nostoc SP., bem como sobre algas vermelhas Porphyridium Dendrobrium. No entanto, os coeficientes de extinção de phycobiliproteins específicas de vários táxons podem diferir e, portanto, recomenda-se validar o método de quantificação espectrofotométrica para cada estirpe única individualmente. O protocolo requer pouco tempo e pode ser executado em qualquer laboratório de Ciências da vida padrão, pois requer equipamento padrão somente.
Introdução
fPhycobiliproteins são complexos de proteína-pigmento hidrossolúvel que representam os componentes principais das antenas de luz-colheita em procariontes cianobactérias (Cyanophyta) e vários táxons eucariontes (Glaucophyta, Rhodophyta e Cryptophyta)1. Eles ocorrem principalmente como complexos supramoleculares chamados ficobilissoma captadores e estão normalmente ligados à superfície das membranas fotossintéticas do lado do estroma, com excepção dos Cryptophyta, onde os phycobiliproteins são localizadas no tilacoides lúmen2. Foram identificados quatro tipos de phycobiliproteins até a data: allophycocyanin o núcleo e o periférico ficocianina, ficoeritrina e phycoerythrocyanin1. Como os principais complexos de luz-colheita, ficobilissoma captadores representam um dos fatores cruciais de produtividade de culturas em massa de algas e cianobactérias. Foi demonstrado que truncamento ficobilissoma captadores pode aumentar o acúmulo de biomassa sob luz forte3. Por outro lado, sob o modesta ou baixa irradiância, o truncamento de antena resultou em taxas de crescimento e acúmulo de biomassa a redução3,4. Phycobiliproteins comercialmente são usados como corantes de alimentos, medicamentos e aditivos alimentares, na indústria de cosmético e como fluorescência sondas com aplicações em citometria de fluxo fluorescentes imunoensaios e de microscopia de fluorescência5.
Este protocolo centra-se na determinação quantitativa de phycobiliproteins na associação modelo Synechocystis. Cianobactérias são os primeiros autotróficos fotossintéticos Membros; Eles têm sido formando da Biosfera da terra por mais de 2,4 bilhões de anos6. Eles jogam um papel crucial nos ciclos biogeoquímicos globais de carbono, nitrogênio, oxigênio e outros elementos. Entre cianobactérias, uma estirpe unicelular Synechocystis ganhou uma posição única, já que foi a primeira associação com o todo o genoma sequenciado7,8, é naturalmente transformável por exógeno DNA9, e Ele executa o crescimento estável e relativamente rápido10,11. Em Synechocystis, o componente central de antena, allophycocyanin, está associado com as proteínas de membrana integrais e a ficocianina anexada está localizada na periferia de membrana tilacoides.
Vários métodos de extração de phycobiliprotein e quantificação são comparados neste protocolo. O procedimento de extração final foi aplicado com êxito Synechocystis, bem como outras estirpes de cianobactérias, incluindo Cyanothece sp de Spirulina SP., Synechococcuselongatus,., intoxicante SP..e Nostoc SP. e foi também aplicado com sucesso algas vermelhas Porphyridium Dendrobrium. Portanto, o método desenvolvido no presente protocolo pode ser considerado como um método universal para a extração de phycobiliprotein. Apesar de alguns dos métodos de extração testados resultaram em rendimentos mais elevados de proteína total, o aqui descrito procedimento de extração, desde o mais alto phycobiliprotein produz juntamente com o menor teor de um resíduo de clorofila na extrato de phycobiliprotein. Redução do teor de clorofila um foi essencial para a correta ficocianina e quantificação espectrofotométrica de allophycocyanin.
Os espectros de absorção de phycobiliprotein pode variar significativamente entre diferentes algas e cianobactérias espécie12,13,14,15,16,17 e até mesmo entre várias cepas de cianobactérias único género18. Portanto, os comprimentos de onda específicos e coeficientes de absorção como usado para a determinação de ficocianina e allophycocyanin em Synechocystis não são geralmente aplicáveis a outras estirpes. Além disso, Synechocystis não contiver ficoeritrina e phycoerythrocyanin que pode ser encontrado em algumas outras algas e cianobactérias. Para a determinação de phycobiliproteins em cepas diferentes Synechocystis, recomenda-se avaliar as equações espectrofotométricas para cada estirpe individualmente.
Embora o protocolo contém duas etapas mais tempo (durante a noite de liofilização de pelotas celulares e extração da proteína 1 hora), o tempo de trabalho total para a quantificação de phycobiliproteins é não mais de 2 horas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. cultivo de cianobactérias
- Cultive células Synechocystis em Erlenmeyers ou em fotobiorreatores10,19 em buffer BG11 médio20 para manter um pH de < 10 (por exemplo, usando 17 mM HEPES10).
Nota: As condições de cultivo padrão exigem uma temperatura controlada (normalmente, 30 ° C, a temperatura ideal é 35 ° C)21, iluminação (normalmente, uma luz branca de uma intensidade até 800 µmol [fótons] / [m2·s])21e um CO fornecimento de 2 (no photobioreactor plana de 400 mL, o crescimento, saturando a concentração de CO2 é 1.700 ppm)21. - Para determinar a densidade de cultura, medir a densidade óptica da cultura por espectrometria no 730 nm (OD730), utilizando uma cubeta com um caminho de luz de 1 cm. Alternativamente, contar as células em um microscópio usando um hemocytometer ou uma célula automatizada contador.
2. preparação de amostras
- Trabalho sob baixa irradiância para prevenir a degradação de phycobiliprotein.
- 3 x 1 mL de suspensão de cultura para cofre-bloqueio tubos de colheita. Use o triplica de estimativa de erros técnicos na medição. Para realizar a amostragem de cultura sob condições estéreis, colher as células em uma capa laminar e siga as práticas de trabalho e segurança adequadas.
- Centrifugar as células a 15.000 x g a temperatura do laboratório por 5 min. Preste atenção para o rotor de centrífuga devidamente equilibrada. Após a centrifugação, descarte os sobrenadantes. Certifique-se para não perturbar a pelota.
- Colocar as amostras no congelador. Para armazenamento a longo prazo, manter as amostras a-80 ° C. Isso é necessário para prevenir a degradação de phycobiliprotein. Para o armazenamento a curto prazo,-20 ° C é suficiente.
- Congela as amostras durante a noite. Para um adequado processo de liofilização, manter a temperatura do condensador Liofilizador abaixo de-60 ° C e a pressão na câmara Liofilizador em torno de 1 hPa.
- Depois de terminar o ciclo de liofilização, feche o tubo logo que possível para evitar a reabsorção de água do ar.
3. pilha de homogeneização e extração de pigmentos
- Adicione quatro pedaços de grânulos de vidro (com um diâmetro de 2 mm) para cada tubo de amostra e fechar os tubos.
Nota: Quando a tampa do cofre-fechamento tubo usado para homogeneização é magra demais, pode quebrar durante a homogeneização; Portanto, apenas segura-bloqueio tubos com tampas fortes são recomendados para este protocolo. - Homogeneizar as amostras com os grânulos de vidro por 15 s em um homogeneizador a temperatura do laboratório.
Nota: Uma amostra devidamente homogeneizada é espalhada sobre a superfície interior dos tubos de bloqueio de segurança. - Adicione 1 mL de tampão PBS (pH 7,4), pré-resfriado a 4 ° C, para as amostras a fim de extrair o phycobiliproteins.
Nota: Este passo no, mantenho as amostras no gelo para evitar a degradação das proteínas extraídas. Isto é crítico. - Misturar as amostras com PBS para 5 s do homogenizador a temperatura do laboratório.
Nota: Após a mistura, as amostras são esverdeadas. - Após a mistura, manter as amostras no gelo por 60 min. tampa o banho de gelo com uma tampa para evitar a degradação de pigmentos.
- Após 60 min de extração phycobiliprotein, Centrifugar as amostras a 15.000 x g a 4 ° C por 5 min. Preste atenção para equilibrar corretamente o rotor de centrífuga.
Nota: Após a centrifugação, o sobrenadante tem uma cor azul ciana.
4. Phycobiliprotein quantificação
- Antes da medição espectrofotométrica, calibre o espectrofotômetro para a linha de base usando o tampão PBS como um espaço em branco.
- Uma vez que o espectrofotômetro calibrado, descartar a PBS de um fluorímetro e pipetar o sobrenadante com phycobiliproteins extraído em vez de com o buffer de descartados.
- Quantificar a concentração de phycobiliprotein espectrofotometricamente, usando uma largura de fenda de 0,5 nm.
- Medir a absorvância do phycocyanobilins em ficocianina e allophycocyanin contra o tampão PBS em branco no 615 nm (615) e 652 nm (652), respectivamente, e medir a absorvância dos restos celulares em 720 nm (720).
- Calcule a concentração de ficocianina e allophycocyanin de acordo com as equações (1) e (2) de Bennett e Bogorad12:
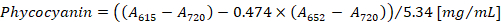
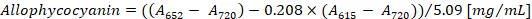
Nota: Um615, um652e um720 devem caber ao intervalo linear absorvância do espectrofotómetro. Se necessário, dilua a amostra com o tampão PBS.
- Recalcule a concentração de pigmento nas amostras originais. A concentração de pigmento na amostra corresponde diretamente com os resultados das equações (1) e (2) quando a 1 mL de cultura e 1 mL de tampão de extração são utilizados para a análise. No caso de utilizar diferentes volumes de amostras de cianobactérias e/ou tampão PBS, a concentração de pigmento final deve ser calculada de acordo com a equação (3):
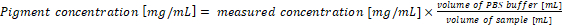 (3)
(3)
Nota: No caso de um normalização phycobiliprotein conteúdo por peso seco de célula, a concentração de pigmento final deve ser calculada de acordo com a equação (4)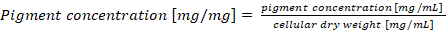 (4)
(4)
5. determinação do peso seco da célula (opcional)
- Pesa três tubos de fechadura de cofre vazios em balanças analíticas.
Atenção: É fundamental que os tubos de bloqueio de segurança estão secos. No caso de armazenar os tubos em um ambiente úmido, seque os tubos durante várias horas em um secador antes da pesagem-los de gelo. Manipular os tubos com cuidado e somente com as mãos enluvadas sem pó para evitar qualquer contato entre o material e os dedos do pesquisador. Manter todos os titulares e limpo para evitar a transferência de qualquer material para os tubos de centrifugação. - 1 x 15 mL de suspensão de cultura em tubo cônico de 15 mL de amostra.
- Centrifugar a suspensão de cultura em tubos cônicos de 15 mL a 4.000 x g a temperatura do laboratório durante 10 min. de equilíbrio do rotor de centrífuga com três adicionais-15ml cónicos tubos, contendo cada uma 15 mL de água. Após a centrifugação, descarte 12 mL do sobrenadante.
- Resuspenda o pellet em restante sobrenadante e transferir 3 x 1 mL da mistura de três tubos de bloqueio de segurança de 1,5 mL com uma pipeta. No caso de algumas sobras da pelota permanecem no tubo cônico de 15 mL, adicionar 1,5 mL de água desionizada ao tubo cônico, vórtice ou agitar o tubo para Ressuspender o restante da pelota e transferir 3 x 0,5 mL da mistura para os três tubos de cofre-fechamento 1,5 mL (já containi ng 3 x 1 mL da pelota) com uma pipeta.
Nota: Dividindo a pelota sobre três tubos de 1,5 mL cofre-fechadura permitirá a estimativa de qualquer erro técnico de medição de peso seco. - Centrifugar as células em tubos de 1,5 mL cofre-bloqueio a 15.000 x g a temperatura do laboratório por 5 min. de equilíbrio do rotor de centrífuga com um tubo de segurança-bloqueio de 1,5 mL adicional que contém 1 mL de água. Após a centrifugação, descarte os sobrenadantes.
- Colocar as amostras no congelador. Para armazenamento a longo prazo, manter as amostras a-80 ° C; para armazenar a curto prazo,-20 ° C é suficiente.
- Congela as amostras durante a noite. Para um adequado processo de liofilização, manter a temperatura do condensador secador de congelamento abaixo de-90 ° C e a pressão na câmara Liofilizador em torno de 1 hPa.
- Após a liofilização, feche os tubos e pesar as amostras em balanças analíticas.
Nota: O valor do peso seco pode ser usado para a normalização do conteúdo por peso seco celular phycobiliprotein.
Access restricted. Please log in or start a trial to view this content.
Resultados
Para os testes do método inicial, Synechocystis era cultivada como culturas de lote em Erlenmeyers num agitador em BG11 cultivo médio20 (suplementado com 17 mM HEPES) a 25 ° C, sob uma luz branca quente de uma intensidade de 50 µmol (fótons) / (m 2·s) e com 1% de CO2 na atmosfera de cultivo. Durante o cultivo, as culturas foram amostradas para tubos de bloqueio seguro e centrifugaram (15.000 x g a temperatura do laborat...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este protocolo descreve um método simples, rápido e reprodutível para a quantificação do teor de phycobiliprotein na associação modelo Synechocystis. Vários métodos de homogeneização de células, extração de proteínas e quantificação de ficocianina e allophycocyanin são comparados, e o protocolo final representa uma combinação das etapas de cada procedimento único ideais. Como dados representativos, o conteúdo de phycobiliproteins foi quantificado em células de Synechocystis sob cr...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Foi adoptado o protocolo de uma anterior publicação de11. T. z., ch. D. e J. Č... foram apoiados pelo Ministério da educação, juventude e desporto da República Checa, no âmbito do programa nacional de sustentabilidade eu (NPU eu), conceder o número LO1415. J. Č... era também apoiada pelos GA CR, Grant number 18-24397S. Acesso aos instrumentos e outras instalações foi apoiado em infra-estrutura checo de investigação para a biologia de sistemas C4SYS (projeto não LM2015055). M. A. S. foi apoiado por uma bolsa da Fundação de ciência russo [n. º 14-14-00904].
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
Referências
- Mimuro, M., Kikuchi, H. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. Green, B. R., Parson, W. W. , Springer. Dordrecht, The Netherlands. 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100(2016).
- Bryant, D. A. The Molecular Biology of Cyanobacteria. , Springer Netherlands. Dordrecht, The Netherlands. (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130(2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. Lobban, C. S., Chapman, D. J., Kremer, B. P. , Cambridge University Press. Cambridge, New York, New Rochelle, Melbourne, Sydney. 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. Gault, P. M., Marler, H. J. , Nova Science Publishers, Inc. New York, NY. 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133(2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados