Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Photometrische Bestimmung des Cyanobakteriums Synechocystis Phycobiliprotein Inhalt
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll zur Phycobiliprotein Inhalt in cyanobakteriums Synechocystis eine photometrische Methode quantitativ zu bestimmen. Extraktionsverfahren wurde auch erfolgreich auf andere Cyanobakterien und Algen Stämme angewendet; jedoch aufgrund von Variationen in Pigment Absorptionsspektren ist es notwendig, die photometrische Gleichungen für jede Belastung individuell zu testen.
Zusammenfassung
Dies ist ein einfaches Protokoll für die quantitative Bestimmung der Phycobiliprotein Inhalt in das Modell cyanobakteriums Synechocystis. Phycobiliproteins sind die wichtigsten Komponenten des Phycobilisomes, das großen Licht-ernten Antennen in Cyanobakterien und einige Algen Taxa. Die Phycobilisomes Synechocystis enthalten zwei Phycobiliproteins: Phycocyanin und Allophycocyanin. Dieses Protokoll beschreibt eine einfache, effiziente, und zuverlässige Methode zur quantitativen Bestimmung von Phycocyanin und Allophycocyanin in diesem Modell Cyanobakterium. Wir haben mehrere Methoden der Phycobiliprotein Extraktion und spektralphotometrische Quantifikation verglichen. Extraktionsverfahren wie in diesem Protokoll beschrieben wurde auch erfolgreich auf andere Cyanobakterien Stämme wie Cyanothece SP., Synechococcuselongatus, Spirulina sp., Arthrospira sp., angewendet. und Nostoc SP., Rotalgen Porphyridium Cruentum. Jedoch die vom Aussterben bedroht-Koeffizienten der spezifischen Phycobiliproteins aus verschiedenen Taxa können unterschiedlich sein und es empfiehlt daher, die photometrische Quantifizierungsmethode für jede einzelne Belastung individuell zu validieren. Das Protokoll erfordert nur geringen Zeitaufwand und kann in jedem standard Life-Science-Labor durchgeführt werden, da es nur standard-Ausrüstung erfordert.
Einleitung
fPhycobiliproteins sind wasserlösliche Pigment-Protein-komplexe, die Hauptkomponenten des Licht-ernten Antennen in prokaryotic Cyanobacteria (Cyanophyta) und mehrere eukaryotischen Taxa (Glaucophyta, Rhodophyta darstellen , und Cryptophyta)1. Sie kommen hauptsächlich als supramolekulare komplexe Phycobilisomes genannt und sie hängen in der Regel an die Oberfläche der photosynthetischen Membranen auf der Stromale Seite, mit Ausnahme von Cryptophyta, wo die Phycobiliproteins, in lokalisiert sind der Thylakoidmembran Lumen2. Vier Arten von Phycobiliproteins wurden auf dem neuesten Stand: die Kern-Allophycocyanin und die peripheren Phycocyanin, Phycoerythrin und Phycoerythrocyanin1. Als die wichtigsten lichtsammelkomplexe repräsentieren Phycobilisomes eines der entscheidenden Faktoren der Algen und Cyanobakterien massenkulturen Produktivität. Es wurde nachgewiesen, dass diese Phycobilisomes Abschneiden Biomasse Akkumulation unter starkem Licht3verbessern kann. Auf der anderen Seite führte unter bescheidenen oder niedrigen Bestrahlungsstärke, die Antenne Abschneiden Wachstumsraten und Biomasse Akkumulation Reduktion3,4. Phycobiliproteins dienen im Handel als Lebensmittel-Farbstoffe, Pharma und Lebensmittel-Zusatzstoffe in der kosmetischen Industrie sowie Fluoreszenz Sonden mit Anwendungen in der Durchflusszytometrie, fluoreszierende Immunoassays und Fluoreszenz-Mikroskopie-5.
Dieses Protokoll konzentriert sich auf die quantitative Bestimmung der Phycobiliproteins in das Modell cyanobakteriums Synechocystis. Cyanobakterien sind die frühesten sauerstoffhaltige photosynthetischen Autotrophe; Sie haben die Biosphäre der Erde für mehr als 2,4 Milliarden Jahren6gebildet. Sie spielen eine entscheidende Rolle im globalen biogeochemischen Kreisläufe von Stickstoff, Kohlenstoff, Sauerstoff und anderen Elementen. Unter den Cyanobakterien, eine einzellige Sorte Synechocystis eine Alleinstellung gewonnen, da war es die erste Cyanobakterium mit dem gesamten Genom sequenziert7,8, ist es natürlich umwandelbar durch exogene DNA-9, und Es führt stabil und relativ schnelles Wachstum10,11. In Synechocystis, die Kernkomponente Antenne Allophycocyanin, die integraler Membranproteine zugeordnet ist und die beigefügten Phycocyanin befindet sich an der Thylakoidmembran Membran Peripherie.
Mehrere Methoden zur Phycobiliprotein Extraktion und Quantifizierung werden in diesem Protokoll verglichen. Die endgültige Extraktionsverfahren wurde erfolgreich Synechocystissowie andere Cyanobakterien Stämme, einschließlich Cyanothece SP., Synechococcuselongatus, Spirulina sp., Arthrospira eingesetzt. SP., und Nostoc SP., und es wurde auch erfolgreich auf Rotalgen Porphyridium Cruentumangewendet. Daher kann die Methode entwickelt, die in diesem Protokoll als eine universelle Methode für die Extraktion von Phycobiliprotein betrachtet werden. Obwohl einige der getesteten Extraktionsmethoden Gesamtprotein Ertragssteigerungen geführt, die hier beschrieben Extraktionsverfahren vorausgesetzt ergibt sich die höchste Phycobiliprotein zusammen mit dem niedrigsten Inhalt von Chlorophyll ein Rückstand in der Phycobiliprotein zu extrahieren. Reduzierung des Gehalts an Chlorophyll ein war entscheidend für die richtige Phycocyanin und Allophycocyanin spektralfotometrische Quantifizierung.
Die Phycobiliprotein Absorptionsspektren können variieren erheblich zwischen den verschiedenen Algen und Cyanobakterien Arten12,13,14,15,16,17 und sogar unter mehrere Stämme von einem einzigen Cyanobakterien Gattung18. Daher sind die spezifischen Wellenlängen und Absorption Koeffizienten zur Bestimmung von Phycocyanin und Allophycocyanin in Synechocystis verwendet nicht allgemein anwendbar auf andere Stämme. Darüber hinaus bietet Synechocystis keine Phycoerythrin und Phycoerythrocyanin, die in einigen anderen Algen und Cyanobakterien gefunden werden können. Für die Zwecke der Bestimmung der Phycobiliproteins Stämme als Synechocystisempfiehlt es sich, die photometrische Gleichungen für jede Belastung individuell zu bewerten.
Obwohl das Protokoll länger zweistufig (über Nacht von der zellulären Pellets und 1 Stunde Proteingewinnung Gefriertrocknung) enthält, ist die gesamte Arbeitszeit für die Quantifizierung der Phycobiliproteins nicht länger als 2 Stunden.
Protokoll
(1) Cyanobakterien Anbau
- Synechocystis Zellen im Erlenmeyerkolben oder in Photobioreaktoren10,19 in gepufferten BG11 Medium20 einen pH-Wert von < 10 (z. B.mit 17 mM HEPES10) weiterhin zu pflegen.
Hinweis: Standard Anbaubedingungen erfordern einen kontrollierten Temperatur (30 ° C, die optimale Temperatur ist in der Regel 35 ° C)21, Beleuchtung (in der Regel ein weißes Licht mit einer Intensität bis zu 800 µmol [Photonen] / [m2·s])21und ein CO 2 Lieferung (in der 400-mL-Flachbildschirm-Photobioreaktor ist das Wachstum Sättigung CO2 -Konzentration 1.700 ppm)21. - Um die Kultur-Dichte zu bestimmen, Messen Sie die Kultur optische Dichte spektralphotometrisch bei 730 nm (OD730) mit einer Küvette mit einer Schichtdicke von 1 cm. Alternativ zählen die Zellen unter dem Mikroskop mit einer Hemocytometer oder einer automatisierten Zelle Zähler.
2. Proben-Vorbereitung
- Arbeiten Sie unter niedrigen Bestrahlungsstärke, Phycobiliprotein Abbau zu verhindern.
- 3 x 1 mL Suspension Kultur zu Safe-Lock Tubes zu ernten. Verwenden Sie Triplicates für die Schätzung von technischen Fehlern bei der Messung. Um die Kultur-Probenahme unter sterilen Bedingungen durchzuführen, Ernten Sie die Zellen in einer laminaren Kapuze und folgen Sie die richtigen Arbeits- und Praktiken.
- Zentrifugieren Sie die Zellen im Labor Temperatur 5 min. Achten Sie auf die ausgewogene Zentrifuge Rotor 15.000 X g . Verwerfen Sie nach Zentrifugation die Überstände. Achten Sie darauf, nicht zu stören das Pellet.
- Setzen Sie die Proben in einer Tiefkühltruhe. Halten Sie für die langfristige Lagerung die Proben bei-80 ° C. Dies ist notwendig, Phycobiliprotein Abbau zu verhindern. Für kurzfristige Lagerung ist-20 ° C ausreichend.
- Gefriertrocknen Sie die Proben über Nacht. Für einen richtigen Gefriertrocknung Prozess halten die Temperatur des Kondensators Einfrieren-Trockner unter-60 ° C und der Druck in der Freeze-Trockner Kammer ca. 1 hPa.
- Schließen Sie nach Beendigung des Gefriertrocknung Zyklus den Schlauch so bald wie möglich auf die Resorption von Wasser aus der Luft zu verhindern.
3. Handy-Homogenisierung und Pigmente Extraktion
- Jede Probenröhrchen vier Stücke von Glasperlen (mit einem Durchmesser von 2 mm) hinzu und schließen Sie die Rohre.
Hinweis: Wenn der Deckel der Safe-Lock-Röhre zur Homogenisierung zu dünn ist, kann es während der Homogenisierung zu brechen; Daher sind nur Safe-Lock Röhren mit starken Deckeln für dieses Protokoll empfohlen. - Homogenisieren der Proben mit den Glasperlen für 15 s auf einem Homogenisator bei Labor-Temperatur.
Hinweis: Eine richtig homogenisierte Probe breitet sich über die ganze innere Fläche der Safe-Lock-Röhren. - Fügen Sie 1 mL PBS-Puffer (pH-Wert 7,4), bis 4 ° C, um die Proben um Phycobiliproteins extrahieren vorgekühlt.
Hinweis: Halten Sie von diesem Schritt auf die Proben auf Eis, um den Abbau der extrahierten Proteine zu verhindern. Dies ist kritisch. - Mischen Sie die Proben mit PBS für 5 s auf den Homogenisator bei Labor-Temperatur.
Hinweis: Nach dem Mischen sind die Proben grünlich. - Nach dem Mischen, halten Sie den Proben auf Eis für 60 min. Abdeckung das Eisbad mit einem Deckel zu Pigmenten Abbau zu verhindern.
- Zentrifugieren Sie nach 60 min Phycobiliprotein Extraktion die Proben bei 15.000 X g bei 4 ° C für 5 min. Achten Sie darauf, die Zentrifuge Rotor richtig auszugleichen.
Hinweis: Nach der Zentrifugation des Überstands hat eine Cyan blaue Farbe.
4. Phycobiliprotein Quantifizierung
- Kalibrieren Sie bevor die photometrische Messung Spektralphotometer zur Grundlinie mit PBS-Puffer als Rohling.
- Nach der Kalibrierung Spektralphotometer verwerfen die PBS von einem Spektrofotometer Küvetten und pipette des Überstands mit extrahierten Phycobiliproteins statt mit dem ausrangierten Puffer.
- Quantifizierung die Phycobiliprotein Konzentration spektrophotometrisch, mit einer Spaltbreite von 0,5 nm.
- Messen Sie die Absorption von Phycocyanobilins in Phycocyanin und Allophycocyanin gegen die PBS-Puffer leer bei 615 nm (ein615) und 652 nm (eine652), bzw., und Messen Sie die Absorption der zelltrümmer bei 720 nm (A720).
- Berechnen Sie die Konzentration von Phycocyanin und Allophycocyanin nach den Gleichungen (1) und (2) von Bennett und Bogorad12:
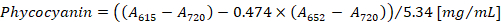
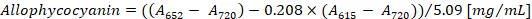
Hinweis: Eine615, eine652und ein720 sollte auf den Bereich der linearen Absorption des Spektralphotometers passen. Falls notwendig, verdünnen Sie die Probe mit PBS-Puffer.
- Neuberechnung der Pigmentkonzentration in die original-Samples. Die Pigmentkonzentration in der Probe entspricht direkt mit den Ergebnissen der Gleichungen (1) und (2) bei 1 mL Kultur und 1 mL des Puffers Extraktion für die Analyse verwendet werden. Bei der Verwendung von unterschiedlichen Mengen von Cyanobakterien Proben und/oder PBS-Puffer, sollte die endgültige Pigmentkonzentration gemäß Gleichung (3) berechnet werden:
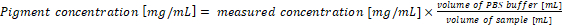 (3)
(3)
Hinweis: Im Falle einer Normalisierung Phycobiliprotein Inhalte pro Zelle Trockengewicht, die endgültige Pigmentkonzentration berechnet werden soll nach Gleichung (4)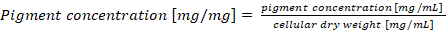 (4)
(4)
5. Ermittlung der Zelle Trockengewicht (Optional)
- Analysenwaagen belasten Sie drei Safe-Lock-Leerhülsen.
Achtung: Es ist wichtig, dass die Safe-Lock-Rohre trocken sind. Trocknen Sie bei Lagerung der Rohre in einer feuchten Umgebung die Rohre für mehrere Stunden in eine Gefriertrocknungsanlage vor dem wiegen sie. Manipulieren Sie die Rohre vorsichtig und nur mit puderfreien Handschuhen, jeglichen Kontakt zwischen dem Material und der Forscher Finger zu vermeiden. Halten Sie alle Inhaber und Zentrifugieren Sie sauber, um die Übertragung von Material an den Rohren zu vermeiden. - Probe 1 x 15 mL Kultur Suspension für 15 mL konische Rohr.
- Zentrifugieren Sie die Kultur-Suspension in den 15 mL konische Röhrchen bei 4.000 X g bei Labor Temperatur 10 min. Gleichgewicht der Zentrifuge Rotor mit drei zusätzlichen 15 mL konische Röhrchen, jedes mit 15 mL Wasser. Verwerfen Sie nach Zentrifugation 12 mL des Überstands.
- Aufschwemmen der Pellets im restlichen überstand und 3 x 1 mL des Gemisches auf drei 1,5 mL-Safe-Lock-Röhren mit einer Pipette übertragen. Für den Fall, dass einige Reste des Geschosses in der 15 mL konische Röhre bleiben, fügen Sie 1,5 mL entionisiertem Wasser zum konischem Rohr, Wirbel oder schütteln das Rohr auf die verbleibenden Aufschwemmen pellet und transfer 3 x 0,5 mL des Gemisches an den drei 1,5 mL-Safe-Lock-Rohren (bereits Containi hinzu 3 x 1 mL des Pellet-ng) mit einer Pipette.
Hinweis: Aufteilung der Pellets über drei 1,5 mL-Safe-Lock-Rohre wird die Schätzung eines technischen Fehlers der Trockengewicht Messung ermöglichen. - Zentrifugieren Sie den Zellen in 1,5 mL-Safe-Lock-Röhren bei 15.000 X g bei Labor Temperatur 5 min. Balance des Zentrifuge Rotors mit einem zusätzlichen 1,5 mL Safe-Lock-Rohr, das enthält 1 mL Wasser. Verwerfen Sie nach der Zentrifugation die Überstände.
- Legen Sie die Proben in den Gefrierschrank. Halten Sie für die langfristige Lagerung die Proben bei-80 ° C; für die kurzfristige Speicherung ist-20 ° C ausreichend.
- Gefriertrocknen Sie die Proben über Nacht. Für einen richtigen Gefriertrocknung Prozess halten die Temperatur der Freeze Trockner Kondensator unter-90 ° C und der Druck in der Freeze-Trockner Kammer ca. 1 hPa.
- Schließen Sie nach Gefriertrocknung die Rohre und Analysenwaagen belasten Sie Proben.
Hinweis: Der Trockengewicht Wert kann für die Normalisierung des Phycobiliprotein Inhalts pro Zelle Trockengewicht verwendet werden.
Ergebnisse
Für die erste Methode Tests Synechocystis wurde angebaut als Batch-Kulturen im Erlenmeyerkolben auf einen Shaker in BG11 Anbau mittleren20 (ergänzt mit 17 mM HEPES) bei 25 ° C, unter ein warmweißes Licht mit einer Intensität von 50 µmol (Photonen) / (m 2·s) und mit 1 % CO2 in der Kultivierung Atmosphäre. Während des Anbaus der Kulturen wurden zu Safe-Lock Tubes abgetastet und zentrifugiert (15.000 X g bei Labor Tempe...
Diskussion
Dieses Protokoll beschreibt eine einfache, schnelle und reproduzierbare Methode zur Quantifizierung der Phycobiliprotein Inhalt in das Modell cyanobakteriums Synechocystis. Verschiedene Methoden der Zelle Homogenisierung, Proteingewinnung und Phycocyanin und Allophycocyanin Quantifizierung werden verglichen und das endgültige Protokoll stellt eine Kombination der optimalen Schritte jedes einzelnen Verfahrens. Als repräsentative Daten wurde der Inhalt des Phycobiliproteins in Synechocystis Zellen unter...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Das Protokoll wurde von einer früheren Veröffentlichung11angenommen. T. Z. D. ch. und J. Č. wurden gefördert durch das Ministerium für Bildung, Jugend und Sport der Tschechischen Republik im Rahmen des nationalen Programms Nachhaltigkeit ich (NPU ich), Nummer LO1415 zu gewähren. J. Č. wurde auch von GA CR, Grant-Nummer 18-24397S unterstützt. Zugang zu Instrumenten und anderen Einrichtungen wurde von der Tschechischen Forschungsinfrastruktur für Systembiologie C4SYS unterstützt (Projekt keine LM2015055). M. A. S. wurde durch einen Zuschuss aus der russischen Science Foundation [Nr. 14-14-00904] unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
Referenzen
- Mimuro, M., Kikuchi, H., Green, B. R., Parson, W. W. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. , 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100 (2016).
- Bryant, D. A. . The Molecular Biology of Cyanobacteria. , (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130 (2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V., Lobban, C. S., Chapman, D. J., Kremer, B. P. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. , 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., Gault, P. M., Marler, H. J., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. , 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133 (2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten