È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Determinazione spettrofotometrica del contenuto di Phycobiliprotein in Cyanobacterium Synechocystis
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per determinare quantitativamente il contenuto di phycobiliprotein nel cianobatterio Synechocystis utilizzando un metodo spettrofotometrico. La procedura di estrazione è stata applicata con successo anche ad altri ceppi di alghe e cianobatteri; Tuttavia, a causa delle variazioni negli spettri di assorbimento del pigmento, è necessario testare individualmente le equazioni spettrofotometriche per ogni ceppo.
Abstract
Si tratta di un semplice protocollo per la determinazione quantitativa del contenuto di phycobiliprotein nel cianobatterio modello Synechocystis. Ficobiliproteine sono i componenti più importanti di ficobilisomi, le antenne di luce-raccolta principali nei cianobatteri e diversi taxa di alghe. I ficobilisomi di Synechocystis contengono due ficobiliproteine: ficocianina e allophycocyanin. Questo protocollo descrive una semplice, efficiente e un metodo affidabile per la determinazione quantitativa di ficocianina e allophycocyanin in questo cianobatterio modello. Abbiamo confrontato i diversi metodi di phycobiliprotein estrazione e quantificazione spettrofotometrica. La procedura di estrazione come descritto in questo protocollo è stata applicata con successo anche ad altri ceppi di cianobatteri come Cyanothece SP., Synechococcuselongatus, Spirulina sp., Arthrospira sp., e Nostoc SP., anche per quanto riguarda le alghe rosse Porphyridium cruentum. Tuttavia, i coefficienti di estinzione di specifici ficobiliproteine da vari taxa possono differire e pertanto, si raccomanda di convalidare il metodo di quantificazione spettrofotometrica per ogni singolo ceppo individualmente. Il protocollo richiede poco tempo e può essere eseguito in qualsiasi laboratorio di scienze biologiche standard poiché si richiede attrezzature solo standard.
Introduzione
fPhycobiliproteins sono complessi pigmento-proteina solubile in acqua che rappresentano i componenti principali delle antenne di luce-raccoglitrici in cellule procariotiche cianobatteri (Cyanophyta) e diversi taxa eucariotiche (Glaucophyta, Rhodophyta e Criptofite)1. Si presentano principalmente come complessi sopramolecolari chiamati ficobilisomi e sono in genere collegati alla superficie delle membrane fotosintetiche sul lato stromale, ad eccezione di Cryptophyta, dove sono localizzate le ficobiliproteine nella thylakoid lumen2. Sono stati identificati quattro tipi di ficobiliproteine fino a Data: allophycocyanin il nucleo e la periferica di ficocianina e ficoeritrina phycoerythrocyanin1. Come i complessi di raccolta di luce principali, ficobilisomi rappresentano uno dei fattori cruciali di produttività di massa colture di alghe e cianobatteri. È stato dimostrato che il troncamento ficobilisomi può migliorare accumulo di biomassa sotto forte luce3. D'altra parte, sotto modesto o basso irraggiamento, il troncamento dell'antenna ha provocato i tassi di crescita e biomassa accumulo riduzione3,4. Ficobiliproteine commercialmente sono utilizzati come coloranti per alimenti, prodotti farmaceutici e additivi alimentari, nell'industria cosmetica e come fluorescenza sonde con applicazioni in citometria a flusso, immunodosaggi fluorescente e di microscopia di fluorescenza5.
Questo protocollo è centrato sulla determinazione quantitativa di ficobiliproteine nel cianobatterio modello Synechocystis. I cianobatteri sono più presto autotrofi fotosintetici ossigenati; Essi hanno stato formando la biosfera terrestre per più di 2,4 miliardi di anni6. Giocano un ruolo cruciale nei cicli biogeochimici globali di azoto, carbonio, ossigeno e altri elementi. Tra i cianobatteri, un ceppo unicellulare Synechocystis guadagnato una posizione unica, poiché era il primo cianobatterio con l'intero genoma sequenziato7,8, è naturalmente trasformabile da DNA esogeno9, e esegue una crescita stabile e relativamente veloce10,11. In Synechocystis, il componente principale dell'antenna, allophycocyanin, è associato con le proteine integrali di membrana e la ficocianina annesso si trova alla periferia di membrana tilacoidale.
Diversi metodi per phycobiliprotein estrazione e quantificazione sono confrontati all'interno di questo protocollo. La procedura di estrazione finale è stata applicata con successo a Synechocystis, nonché ad altri ceppi di cianobatteri, tra cui Cyanothece SP., Synechococcuselongatus, Spirulina sp., Arthrospira SP.e di Nostoc SP. ed è stato applicato con successo anche alghe rosse Porphyridium cruentum. Pertanto, il metodo sviluppato in questo protocollo può essere considerato come un metodo universale per estrazione phycobiliprotein. Anche se alcuni dei metodi di estrazione testata ha provocato i rendimenti più elevati di proteina totale, qui descritta procedura di estrazione purché il phycobiliprotein più alto produce insieme con il più basso contenuto di clorofilla un residuo nella Estratto di Phycobiliprotein. Riduzione del contenuto di clorofilla un era essenziale per la corretta ficocianina e quantificazione spettrofotometrica allophycocyanin.
Gli spettri di assorbimento di phycobiliprotein può variare significativamente tra varie alghe e cianobatteri specie12,13,14,15,16,17 e anche tra i diversi ceppi di un genere di cianobatteri singolo18. Pertanto, le lunghezze d'onda specifiche e coefficienti di assorbimento come usato per la determinazione della ficocianina e allophycocyanin in Synechocystis non sono generalmente applicabili ad altri ceppi. Inoltre, Synechocystis non contiene ficoeritrina e phycoerythrocyanin che può essere trovato in alcune altre alghe e cianobatteri. Ai fini della determinazione di ficobiliproteine in ceppi diversi da Synechocystis, si raccomanda di valutare singolarmente le equazioni spettrofotometriche per ogni ceppo.
Sebbene il protocollo contiene due passi più lunghi (una notte liofilizzazione del pellet cellulare ed estrazione della proteina 1 ora), il tempo di lavoro totale per la quantificazione di ficobiliproteine è non più di 2 ore.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. i cianobatteri coltivazione
- Coltivare cellule Synechocystis in matracci di Erlenmeyer o in fotobioreattori10,19 a tamponato BG11 medio20 per mantenere un pH di < 10 (ad esempio, utilizzando 17 mM HEPES10).
Nota: Condizioni di coltivazione Standard richiedono una temperatura controllata (30 ° C, la temperatura ottimale è in genere, 35 ° C)21, illuminazione (in genere, una luce bianca di intensità fino a 800 µmol [fotoni] / [m2p])21e un CO alimentazione 2 (in fotobioreattore di piatto di 400 mL, la crescita saturando la concentrazione di CO2 è 1.700 ppm)21. - Per determinare la densità di cultura, misurare la densità ottica di cultura spettrofotometricamente a 730 nm (OD730) utilizzando una cuvetta con un percorso ottico di 1 cm. in alternativa, contare le cellule al microscopio usando un emocitometro o una cella automatizzata contatore.
2. preparazione di campioni
- Lavorare sotto basso irraggiamento per prevenire il degrado phycobiliprotein.
- Vendemmia: 3 x 1 mL di sospensione di cultura ai tubi di sicurezza bloccaggio. Utilizzare triplici copie per la stima di errori tecnici nella misurazione. Per eseguire il campionamento di cultura in condizioni sterili, raccogliere le cellule in una cappa laminare e seguire le pratiche di lavoro e di sicurezza adeguate.
- Centrifugare le cellule a 15.000 x g a temperatura di laboratorio per 5 min, prestare attenzione al rotore della centrifuga correttamente bilanciata. Dopo la centrifugazione, eliminare i sovranatante. Essere sicuri di non disturbare il pellet.
- Mettere i campioni in un congelatore. Per l'archiviazione a lungo termine, conservare i campioni a-80 ° C. Ciò è necessario per evitare la degradazione di phycobiliprotein. Per lo stoccaggio a breve termine, da-20 ° C è sufficiente.
- Liofilizzare i campioni durante la notte. Per un corretto processo di liofilizzazione, mantenere la temperatura del condensatore liofilizzatore sotto-60 ° C e la pressione nella camera di liofilizzatore intorno 1 hPa.
- Dopo aver terminato il ciclo di liofilizzazione, chiudere il tubo appena possibile per impedire il riassorbimento di acqua dall'aria.
3. cellula omogeneizzazione e pigmenti di estrazione
- Aggiungere quattro pezzi di perle di vetro (con un diametro di 2 mm) per ogni provetta e chiudere i tubi.
Nota: Quando il coperchio del tubo sicuro-blocco utilizzato per omogeneizzazione è troppo sottile, si può rompere durante l'omogeneizzazione; di conseguenza, solo il sicuro-blocco tubi con coperchi forte sono raccomandati per questo protocollo. - Omogeneizzare i campioni con i branelli di vetro per 15 s su un omogeneizzatore a temperatura di laboratorio.
Nota: Un campione correttamente omogeneizzato si sviluppa sulla superficie interna di tutto dei tubi sicuro-blocco. - Aggiungere 1 mL di tampone PBS (pH 7,4), preraffreddata a 4 ° C, per i campioni al fine di estrarre ficobiliproteine.
Nota: Da questo punto, mantenere i campioni sul ghiaccio per prevenire la degradazione delle proteine estratte. Questo è fondamentale. - Mescolare i campioni con PBS per 5 s sull'omogeneizzatore a temperatura di laboratorio.
Nota: Dopo la miscelazione, i campioni sono verdastri. - Dopo la miscelazione, mantenere i campioni su ghiaccio per 60 min. copertura del bagno di ghiaccio con un coperchio per evitare il degrado di pigmenti.
- Dopo 60 min di phycobiliprotein estrazione, centrifugare i campioni a 15.000 x g a 4 ° C per 5 min, prestare attenzione a bilanciare correttamente il rotore della centrifuga.
Nota: Dopo la centrifugazione, il sovranatante ha un colore blu ciano.
4. Phycobiliprotein quantificazione
- Prima della misurazione spettrofotometrica, calibrare lo spettrofotometro alla linea di base utilizzando il tampone PBS come uno spazio vuoto.
- Una volta lo spettrofotometro è calibrato, scartare il PBS da una cuvette spettrofotometro e pipettare il surnatante con estratti ficobiliproteine anziché con il buffer scartato.
- Quantificare la concentrazione di phycobiliprotein spettrofotometricamente, utilizzando una larghezza di fessura di 0,5 nm.
- Misurare l'assorbanza di phycocyanobilins in ficocianina e allophycocyanin contro il tampone PBS in bianco a 615 nm (un615) e 652 nm (un652), rispettivamente, e misurare l'assorbanza di detriti cellulari a 720 nm (un720).
- Calcolare la concentrazione di ficocianina e allophycocyanin secondo le equazioni (1) e (2) di Bennett e Bogorad12:
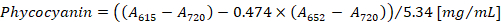
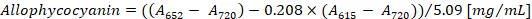
Nota: Un615, un652e un720 dovrebbe adattarsi alla gamma lineare assorbanza dello spettrofotometro. Se necessario, diluire il campione con il tampone PBS.
- Ricalcolare la concentrazione di pigmento nei campioni originali. La concentrazione di pigmento nel campione corrisponde direttamente con i risultati delle equazioni (1) e (2) quando 1 mL di coltura e 1 mL di tampone di estrazione vengono utilizzati per l'analisi. In caso di utilizzo di diversi volumi di campioni di cianobatteri e/o tampone PBS, la concentrazione di pigmento finale deve essere calcolata secondo l'equazione (3):
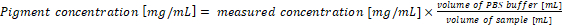 (3)
(3)
Nota: In caso di un contenuto di phycobiliprotein normalizzante per peso a secco delle cellule, la concentrazione di pigmento finale dovrebbe essere calcolata secondo equazione (4)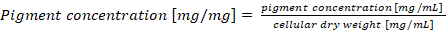 (4)
(4)
5. determinazione del peso secco cellulare (opzionale)
- Pesano tre tubi vuoti di sicurezza bloccaggio su bilance analitiche.
Attenzione: È fondamentale che i tubi di sicurezza bloccaggio siano asciutti. In caso di immagazzinare i tubi in un ambiente umido, asciugare i tubi per diverse ore in un essiccatore prima della pesatura loro congelamento. Manipolare le provette delicatamente e solo con i guanti senza polvere per evitare qualsiasi contatto tra il materiale e le dita del ricercatore. Tenere tutti i sostegni e centrifugare pulite per evitare il trasferimento di qualsiasi materiale per i tubi. - Esempio 1 x 15 mL di sospensione per provetta conica da 15 mL.
- Centrifugare la sospensione di cultura nelle provette coniche da 15 mL a 4.000 x g a temperatura di laboratorio per 10 min. bilanciamento del rotore della centrifuga con tre ulteriori provette coniche da 15 mL, ciascuna contenente 15 mL di acqua. Dopo la centrifugazione, scartando 12 mL di surnatante.
- Risospendere il pellet nel surnatante rimanente e trasferire 3 x 1 mL di miscela a tre tubi di sicurezza bloccaggio 1,5 mL con una pipetta. Nel caso in cui alcuni avanzi del pellet rimangono nel tubo conico da 15 mL, aggiungere 1,5 mL di acqua deionizzata al tubo conico, vortice o agitare il tubo per risospendere il restante a pellet e trasferire i tre tubi di sicurezza bloccaggio di 1,5 mL (già containi 3 x 0,5 mL della miscela ng 3 x 1 mL del pellet) con una pipetta.
Nota: Dividendo il pellet sopra tre tubi di sicurezza bloccaggio 1,5 mL consentirà la stima di qualsiasi errore tecnico di misura il peso a secco. - Centrifugare le cellule in 1,5 mL sicuro-blocco tubi a 15.000 x g a temperatura di laboratorio per 5 min, equilibrio del rotore della centrifuga con un tubo di sicurezza bloccaggio 1,5 mL aggiuntivo contenente 1 mL di acqua. Dopo la centrifugazione, eliminare i sovranatante.
- Mettere i campioni nel congelatore. Per l'archiviazione a lungo termine, conservare i campioni a-80 ° C; per la memorizzazione a breve termine, da-20 ° C è sufficiente.
- Liofilizzare i campioni durante la notte. Per un corretto processo di liofilizzazione, mantenere la temperatura del condensatore asciugatrice congelamento sotto-90 ° C e la pressione nella camera di liofilizzatore intorno 1 hPa.
- Dopo liofilizzazione, chiudere le provette e pesare i campioni su bilance analitiche.
Nota: Il valore di peso a secco può essere utilizzato per la normalizzazione del contenuto phycobiliprotein al peso a secco delle cellule.
Access restricted. Please log in or start a trial to view this content.
Risultati
Per i test di metodo iniziale, Synechocystis era coltivata come batch colture in matracci di Erlenmeyer su un agitatore BG11 coltivazione medio20 (completati con 17 mM HEPES) a 25 ° C, sotto una luce bianca calda di un'intensità di 50 µmol (fotoni) / (m p 2) e con 1% di CO2 nell'atmosfera coltura. Durante la coltivazione, le culture sono state campionate a sicuro-blocco tubi e centrifugati (15.000 x g a temperatura di labo...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo protocollo descrive un metodo semplice, veloce e riproducibile per la quantificazione del contenuto di phycobiliprotein nel cianobatterio modello Synechocystis. Diversi metodi di omogeneizzazione delle cellule, estrazione di proteine e quantificazione di ficocianina e allophycocyanin vengono confrontati e protocollo finale rappresenta una combinazione della procedura ottima di ogni singola procedura. Come dati rappresentativi, il contenuto di ficobiliproteine è stato quantificato in Synechocystis
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Il protocollo è stato adottato da una precedente pubblicazione11. T. Z., ch. D. e J. Č. sono stati sostenuti dal Ministero della pubblica istruzione, gioventù e dello sport della Repubblica Ceca all'interno del programma di sostenibilità nazionale ho (NPU ho), concedere il numero LO1415. J. Č. fu appoggiato anche dal GA CR, concessione numero 18-24397S. Accesso a strumenti e altre strutture è stata sostenuta dall'infrastruttura di ricerca ceco per la biologia dei sistemi C4SYS (non progetto LM2015055). M. A. S. è stata sostenuta da una sovvenzione dalla Fondazione scienza russa [n. 14-14-00904].
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
Riferimenti
- Mimuro, M., Kikuchi, H. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. Green, B. R., Parson, W. W. , Springer. Dordrecht, The Netherlands. 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100(2016).
- Bryant, D. A. The Molecular Biology of Cyanobacteria. , Springer Netherlands. Dordrecht, The Netherlands. (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130(2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. Lobban, C. S., Chapman, D. J., Kremer, B. P. , Cambridge University Press. Cambridge, New York, New Rochelle, Melbourne, Sydney. 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. Gault, P. M., Marler, H. J. , Nova Science Publishers, Inc. New York, NY. 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133(2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon