このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
シアノ バクテリア阻害のフィコビリタンパク質の吸光光度定量
要約
ここでは、定量的阻害吸光光度法によるシアノ バクテリアのフィコビリタンパク質の内容を決定するためのプロトコルを提案する.抽出手順でした; 他のシアノ バクテリアや藻類の系統に適用も正常にただし、色素の吸収スペクトルの違いは、各緊張に吸光光度式を個別にテストする必要が。
要約
モデル シアノ バクテリア阻害フィコビリタンパク質含量の定量のための単純なプロトコルです。フィコビリタンパク質は、フィコビリソーム、シアノ バクテリアにおける主要集光性アンテナの最も重要なコンポーネントといくつかの藻類の分類群。阻害のフィコビリソームを含む 2 つのフィコビリタンパク質: フィコシアニン、アロフィコシアニン。このプロトコルでは、シンプルで効率的とフィコシアニン、アロフィコシアニンこのモデル シアノ バクテリアでの定量のための信頼性の高い方法をについて説明します。フィコビリタンパク質抽出吸光光度定量のいくつかの方法を比較しました。このプロトコルに従って抽出プロシージャもに応用したArthrospira sp.、 Cyanothece 、 Synechococcuselongatusの spスピルリナsp.など他のシアノ バクテリアの系統藍藻sp 紅藻チノリモに関して。様々 な分類から特定のフィコビリタンパク質の消散係数が異なることができ、それは、したがって、すべての単一のひずみの吸光光度定量法を個別に検証にオススメします。プロトコルは、少し時間が必要です、のみ標準装備が必要なので、任意の標準的な生命科学の研究所で実行できます。
概要
fPhycobiliproteins は原核生物のシアノ バクテリア (ラン藻) 光捕集アンテナといくつかの真核生物分類群 (Glaucophyta、紅藻の主要コンポーネントを表す水溶性色素蛋白複合体、およびCryptophyta)1。超分子複合体フィコビリソームを呼ばれてとして主に発生して、彼らは通常間質側Cryptophytaで、フィコビリタンパク質をローカライズする場所を除いて光合成膜の表面に接続されて、チラコイド ルーメン2。日までフィコビリタンパク質の 4 つのタイプが識別されている: コア アロフィコシアニンと末梢フィコシアニン、フィコエ リスリンと phycoerythrocyanin1。主要集光性複合体としてフィコビリソームは藻類やシアノ バクテリアの大量文化生産性の重要な要因の 1 つを表します。フィコビリソーム切り捨ては強い光3の下でバイオマス蓄積を高めることができることが実証されています。一方、中程度あるいは低照度下でアンテナ切り捨ては成長率とバイオマス蓄積低減3,4で起因しました。フィコビリタンパク質、食品添加物、化粧品業界、医薬品、食品の着色剤と蛍光として商業栽培されているプローブをフローサイトメトリー、蛍光イムノアッセイ蛍光顕微鏡5のアプリケーション。
このプロトコルは、モデル シアノ バクテリア阻害のフィコビリタンパク質の定量分析に焦点を当てください。シアノ バクテリアが、最も早く酸素光合成独立栄養;彼らは 24 億年6以上の地球の生物圏を形成しました。彼らは、窒素、炭素、酸素、およびその他の要素のグローバル物質循環に重要な役割を果たします。シアノ バクテリアの間で単細胞ひずみ阻害全体のゲノムを持つ最初のシアノ バクテリアだったのでユニークなポジションを得たシーケンス7、8、外因性 DNA9、当然のことながら変形、安定的かつ比較的高速な成長10,11を実行します。阻害アンテナのコアコンポーネントにアロフィコシアニン、不可欠な膜タンパク質に関連付けられてし、添付のフィコシアニンはチラコイド膜周辺に位置します。
フィコビリタンパク質抽出と定量化のためのいくつかのメソッドは、このプロトコルで比較されます。Cyanothece sp Synechococcuselongatus、スピルリナsp.、 Arthrospiraを含む他のシアノ バクテリアの系統だけでなく阻害、最終的な抽出プロシージャが正常に適用されましたsp.と藍藻の sp は、紅藻チノリモにも正常に適用されました。したがって、このプロトコルで提案する手法は、フィコビリタンパク質抽出のための普遍的な方法として考えることが。ここに抽出手順が説明されている最高のフィコビリタンパク質利回りクロロフィルの残渣の最も低いコンテンツと共に提供されるにもかかわらず、いくつかのテストの抽出方法は、総蛋白収量の結果、フィコビリタンパク質を抽出します。クロロフィルの内容を減らすことは、正しいフィコシアニン、アロフィコシアニン吸光光度定量のために不可欠だった。
フィコビリタンパク質吸収スペクトルが様々 な藻類やシアノ バクテリア種12,13,14,15,16,17の間で大きく異なるし、も単一のシアノ バクテリア属18系統。したがって、特定の波長と吸収係数としてフィコシアニン、アロフィコシアニン阻害での定量は一般的に他の系統に適用されません。また、フィコエ リスリンと他の藻類とシアノ バクテリアで見つけることができる phycoerythrocyanin、阻害は含まれません。阻害以外の系統のフィコビリタンパク質の定量を目的として、各緊張に吸光光度式を個別に評価することをお勧めします。
プロトコルには (細胞ペレットおよび 1 時間蛋白質の抽出の一晩凍結乾燥) 長いの 2 つの手順が含まれています、フィコビリタンパク質定量化のための総労働時間は 2 時間以内。
プロトコル
1 シアノ バクテリア栽培
- エルレンマイヤー フラスコまたは < 10 (例えば、17 mM HEPES10を使用して) の pH を維持するためにバッファーに格納された BG11 の中20フォトバイオリアクター10,19 阻害細胞を養います。
注: 標準的な栽培条件温度制御を必要とする (通常は、30 ° C、最適温度は 35 ° C)21照明 (800 µmol [光] 最大強度の通常、白色光/[m2·s])21、および CO2供給 (400 mL フラット パネル フォトバイオリアクターの CO2濃度を飽和成長は 1,700 ppm)21。 - 文化の密度を決定する 730 でオンカラム文化の光学密度を測定 nm (外径730) を用いたキュベット光路 1 cm. の代わりに、診断または自動化されたセルを用いた顕微鏡下のセルをカウントカウンター。
2. サンプル準備
- フィコビリタンパク質の劣化を防ぐために低照度下で働きます。
- 安全ロック チューブに文化を懸濁液の 3 x 1 mL を収穫します。トリプリケート測定の技術的な間違いの推定のために使用します。無菌条件下で文化サンプリングを実行するには、層流フードのセルを収穫し、適切な作業と安全性のプラクティスに従ってください。
- 15,000 × g 5 分正しくバランスのとれた遠心ローターに注意を払うの温研究室で細胞を遠心します。遠心分離後、上清を破棄します。ペレットを邪魔しないようにします。
- サンプルを冷凍庫に入れてください。長期保存を-80 ° C でサンプルをしてください。これはフィコビリタンパク質の劣化を防ぐために必要です。短期的なストレージ、-20 ° C で十分です。
- サンプルを一晩凍結乾燥します。適切な凍結乾燥プロセスの凍結乾燥機コンデンサー-60 ° C 以下の温度を保ち、凍結乾燥機の圧力チャンバー周り 1 hPa。
- 凍結乾燥のサイクルを終えた後、空気中の水分の再吸収を防ぐために、できるだけ早くチューブを閉じます。
3. セルの均質化と抽出を顔料
- 各サンプル管にガラス ビーズ (直径 2 mm) を 4 枚を追加し、チューブを閉じます。
注: 均質化用安全ロック チューブのふたが薄すぎる、それ間破るができる均質化;したがって、このプロトコルの強い蓋安全ロック チューブのみお勧めします。 - サンプルは 15 のガラスビーズを均質化研究所温ホモジナイザーで s。
注: 正しく均質化されたサンプルは、安全ロック チューブの全体の内側の表面に広がっています。 - 1 mL の PBS バッファー (pH 7.4) のフィコビリタンパク質を抽出するためにサンプルへの 4 ° C に冷却を追加します。
注: このステップから抽出したタンパク質の劣化を防ぐために氷のサンプルを保持します。これは重要です。 - 5 サンプルを PBS でミックス研究所温ホモジナイザーで s。
注: 混合した後、サンプルは緑がかったです。 - 混合した後、顔料の劣化を防ぐためにふた付きの氷浴 60 分カバーのための氷のサンプルを保ちます。
- フィコビリタンパク質抽出の 60 分後 15,000 × gで 5 分遠心ローターのバランスをとるために注意を払うのための 4 ° C でサンプルを遠心します。
注: 遠心分離後上澄みシアン ブルーの色をが。
4. フィコビリタンパク質の定量
- 吸光光度測定の前に空白として PBS バッファーを使用して基準に分光光度計を調整します。
- 分光光度計を校正すると、いったん 1 つの分光光度計のキュベットから PBS を破棄し、破棄されたバッファーの代わりに抽出されたフィコピリン蛋白質の上澄みをピペットします。
- オンカラム、スリット幅は 0.5 を使用してフィコビリタンパク質濃度を定量化 nm。
- フィコシアニン、アロフィコシアニン 615 で空白の PBS バッファーに対して phycocyanobilins の吸光度を測定 nm (615) と 652 nm (652)、それぞれ、720 で細胞の残骸の吸光度を測定して nm (720)。
- (1) と (2) のベネットと Bogorad12フィコシアニン、アロフィコシアニン方程式に従っての濃度を計算します。
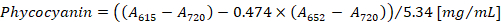
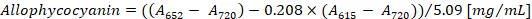
注:615,652, と720は、分光光度計の吸光度の線形範囲に収まるようにします。必要に応じて、PBS バッファーでサンプルを希釈します。
- 元のサンプル中の顔料濃度を再計算します。サンプル中の顔料濃度は式 (1) と (2) 文化の 1 mL と 1 mL 抽出バッファーの使用分析の結果と直接対応しています。シアノ バクテリアのサンプルや PBS バッファーの別のボリュームを使用する場合最終的な顔料濃度は式 (3) に従って計算する必要があります。
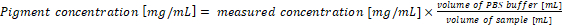 (3)
(3)
注: セルの乾燥重量あたりの正規化フィコビリタンパク質コンテンツの場合最終的な顔料濃度計算するか式 (4) によると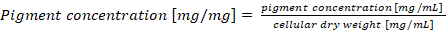 (4)
(4)
5. (オプション) 細胞の乾燥重量の測定
- 分析的なバランスの 3 つの空の安全ロック チューブの重量を量る。
注意: 安全なロック チューブ乾燥していることが重要です。チューブを湿潤環境に格納する場合それらを計量する前に乾燥機の凍結で数時間チューブを乾燥します。チューブを優しく操作と材料と研究者の指の間の接触を避けるために手袋をはめた手のパウダー フリーのみ。すべての者を維持し、クリーン チューブへの任意の材料の転送を避けるために遠心分離機します。 - 15 mL の円錐管に文化を懸濁液の 1 x 15 mL のサンプルです。
- 文化のサスペンション 3 追加 15 mL コニカル チューブ、4,000 x gで 10 分間遠心ローターのバランス研究所温で 15 mL の円錐管の水含む各 15 mL を遠心します。遠心分離の後上澄みの 12 mL を破棄します。
- 残りの上清でペレットを再懸濁し、混合物の 3 x 1 mL をピペットで 3 つの 1.5 mL 安全ロック チューブに転送します。ペレットのいくつかの残り物は、15 mL の円錐管に残る場合に円錐管、渦または横に振る残り再懸濁しますチューブ、ペレットし、3 1.5 mL 安全ロック チューブ (すでに containi の混合物の 3 x 0.5 mL に転送する 1.5 mL の脱イオン水を追加します。ng ペレットの 3 x 1 mL) ピペットと。
注: 3 1.5 mL 安全ロック チューブでペレットを分割乾燥重量測定の技術的なエラーの推定できるようになります。 - 1 mL の水を含むその他の 1.5 mL 安全ロック チューブを遠心ローター 5 分バランス研究所温 15,000 × gで 1.5 mL 安全ロック チューブに細胞を遠心分離機します。、遠心分離後、上清を破棄します。
- 冷凍庫の中にサンプルを置きます。長期保存のためサンプルを保つ-80 ° c;短期保存、-20 ° C で十分です。
- サンプルを一晩凍結乾燥します。適切な凍結乾燥プロセスの凍結乾燥機コンデンサー-90 ° C 以下の温度を保ち、凍結乾燥機の圧力チャンバー周り 1 hPa。
- 凍結乾燥後、管を閉じて、分析的なバランスのサンプルの重量を量る。
注: 細胞の乾燥重量あたりのフィコビリタンパク質コンテンツ正規化の乾物重の値を使用できます。
結果
BG11 栽培中20 (17 mM HEPES を補充) 25 ° c、50 µmol (光子) の強さの暖かい白色光の下で阻害されたシェーカーのエルレンマイヤー フラスコで培養として栽培初期メソッドのテスト/(m2·s) と養殖の雰囲気の中で 1% CO2 。、栽培期間中文化安全ロック チューブにサンプリングされた (15,000 x gで 5 分間実験室の温度) を遠心、上清が...
ディスカッション
このプロトコルでは、単純な高速で、再現性のあるモデル シアノ バクテリア阻害フィコビリタンパク質含量の定量法について説明します。セルの均質化、蛋白質の抽出、フィコシアニン、アロフィコシアニン定量化のいくつかの方法が比較され、最終的なプロトコルは、すべて単一の最適な手順の組み合わせを表します。代表的なデータとして光強度の増加の下で阻害細胞の?...
開示事項
著者が明らかに何もありません。
謝辞
プロトコルは、以前出版11から採用されました。T. Z.、d. ch. と j. Č. 教育省、青年および国家の持続可能性プログラムの中でチェコ共和国のスポーツによって支えられた私 (当社私)、許可番号 LO1415。J. Č。 また GA CR、許可番号 18-24397S によって支えられました。楽器やその他の施設へのアクセスは、システム生物学 (プロジェクトなし LM2015055) C4SYS チェコ研究基盤によって支えられました。M. A. s. はロシアの科学財団 [第 14-14-00904] からの助成金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
参考文献
- Mimuro, M., Kikuchi, H., Green, B. R., Parson, W. W. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. , 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100 (2016).
- Bryant, D. A. . The Molecular Biology of Cyanobacteria. , (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130 (2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V., Lobban, C. S., Chapman, D. J., Kremer, B. P. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. , 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., Gault, P. M., Marler, H. J., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. , 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133 (2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved