Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Determinación espectrofotométrica de ficobiliproteína contenido en la cianobacteria Synechocystis
En este artículo
Resumen
Aquí, presentamos un protocolo para determinar cuantitativamente el contenido de ficobiliproteína en la cianobacteria Synechocystis mediante un método espectrofotométrico. El procedimiento de extracción fue aplicado con éxito a otras cepas de cianobacterias y algas; sin embargo, debido a variaciones en los espectros de absorción del pigmento, es necesario probar las ecuaciones espectrofotométricas para cada cepa individual.
Resumen
Esto es un protocolo simple para la determinación cuantitativa del contenido de ficobiliproteína en la cianobacteria Synechocystisdel modelo. Ficobiliproteínas son los componentes más importantes de phycobilisomes, las antenas principales de recolección de luz en cianobacterias y varios taxones de algas. Phycobilisomes de Synechocystis contienen dos ficobiliproteínas: ficocianina y allophycocyanin. Este protocolo describe un simple, eficiente y confiable método para la determinación cuantitativa de ficocianina y allophycocyanin en esta cianobacteria modelo. Se compararon varios métodos de extracción de ficobiliproteína y cuantificación espectrofotométrica. El procedimiento de extracción como se describe en este protocolo se aplicó con éxito a otras cepas de cianobacterias como Cyanothece SP., Synechococcuselongatus, Spirulina sp., Arthrospira sp., y Nostoc SP., así como las algas rojas Porphyridium cruentum. Sin embargo, los coeficientes de extinción de ficobiliproteínas específicos de distintos taxones pueden variar y por lo tanto, se recomienda validar el método de cuantificación espectrofotométrica para cada cepa individual. El protocolo requiere poco tiempo y puede realizarse en cualquier laboratorio de Ciencias de la vida estándar ya que requiere equipos estándar.
Introducción
fPhycobiliproteins son complejos de proteína pigmento soluble en agua que representan los componentes principales de las antenas de luz-cosechar en procariotas cianobacterias (Cyanophyta) y varios taxones eucariotas (Glaucophyta, Rhodophyta y Cryptophyta)1. Se producen principalmente como complejos supramoleculares llamados phycobilisomes y por lo general se unen a la superficie de las membranas fotosintéticas en el lado del estroma, a excepción de Cryptophyta, donde se localizan las ficobiliproteínas en la tilacoides lumen2. Hasta la fecha se han identificado cuatro tipos de ficobiliproteínas: el núcleo allophycocyanin y la ficocianina, ficoeritrina y phycoerythrocyanin periférica1. Como los complejos principales de recolección de luz, phycobilisomes representan uno de los factores cruciales de la productividad de culturas masivas de algas y cianobacterias. Se ha demostrado que phycobilisomes truncamiento puede aumentar la acumulación de biomasa bajo luz fuerte3. Por otra parte, con irradiación moderada o baja, el truncamiento de la antena daba como resultado tasas de crecimiento y acumulación de biomasa reducción3,4. Ficobiliproteínas comercialmente se utilizan como colorantes de alimentos, productos farmacéuticos y aditivos alimentarios, en la industria cosmética y fluorescencia sondas con aplicaciones en citometría de flujo, inmunoensayos fluorescentes y microscopía de fluorescencia5.
Este protocolo se centra en la determinación cuantitativa de ficobiliproteínas en la cianobacteria Synechocystisdel modelo. Cianobacterias están el primeros autótrofos fotosíntesis oxygenic; ha formando la Biosfera de la tierra por más de 2,4 billones de años6. Desempeñan un papel crucial en los ciclos biogeoquímicos globales de nitrógeno, carbono, oxígeno y otros elementos. Entre cianobacterias, una cepa unicelular Synechocystis ganó una posición única ya que fue el primer cianobacteria con la totalidad del genoma secuenciado7,8, es naturalmente transformable por ADN exógeno9, y realiza un crecimiento estable y relativamente rápido de10,11. En Synechocystis, el componente base de antena, allophycocyanin, se asocia con las proteínas integrales de membrana y la ficocianina adjunto se encuentra en la periferia de la membrana del thylakoid.
Varios métodos para la extracción de ficobiliproteína y cuantificación se comparan dentro de este protocolo. El procedimiento de extracción final fue aplicado con éxito para Synechocystis, así como a otras cepas de cianobacterias, incluyendo Cyanothece SP., Synechococcuselongatus, Spirulina sp., Arthrospira SP.y Nostoc SP. y se aplicó con éxito a algas rojas Porphyridium cruentum. Por lo tanto, el método desarrollado en este protocolo puede considerarse como un método universal para la extracción de ficobiliproteína. A pesar de que algunos de los métodos de extracción probadas resultaron en mayores rendimientos de proteína total, aquí describe procedimiento de extracción siempre ficobiliproteína más rendimientos con el menor contenido de clorofila un residuo en el Extracto de ficobiliproteína. Reducir el contenido de clorofila a fue esencial para la correcta ficocianina y cuantificación espectrofotométrica allophycocyanin.
Los espectros de absorción de ficobiliproteína pueden variar significativamente entre diferentes algas y cianobacterias especies12,13,14,15,16,17 e incluso entre varias cepas de un género de cianobacterias solo18. Por lo tanto, las longitudes de onda específicas y coeficientes de absorción según lo utilizado para la determinación de ficocianina y allophycocyanin en Synechocystis no son generalmente aplicables a otras cepas. Además, Synechocystis no contienen ficoeritrina y phycoerythrocyanin que se puede encontrar en algunas algas y cianobacterias. A los efectos de la determinación de ficobiliproteínas en cepas que no sean de Synechocystis, se recomienda evaluar las ecuaciones espectrofotométricas para cada cepa individual.
Aunque el protocolo contiene dos pasos más (durante la noche la liofilización de los pellets celulares y extracción de proteínas de 1 hora), el tiempo de trabajo total para la cuantificación de ficobiliproteínas es no más de 2 horas.
Protocolo
1. cianobacterias cultivo
- Cultivar células de Synechocystis en matraces Erlenmeyer o en fotobiorreactores10,19 en tampón BG11 medio20 a mantener un pH < 10 (p. ej., con 17 mM HEPES10).
Nota: Las condiciones de cultivo estándar requieren una temperatura controlada (normalmente, 30 ° C, la temperatura óptima es de 35 ° C)21, iluminación (por lo general, una luz blanca de intensidad hasta 800 μmol [fotones] / [m2·s])21y un CO fuente 2 (en el fotobiorreactor de planas de 400 mL, el crecimiento de saturar la concentración de CO2 es 1.700 ppm)21. - Para determinar la densidad de cultivo, medir la densidad óptica de la cultura mediante espectrofotometría a 730 nm (OD730) utilizando una cubeta con una trayectoria de la luz de 1 cm. por otra parte, contar las células bajo el microscopio utilizando un hemocitómetro o una célula automatizada contador.
2. preparación de muestras
- Trabajo con baja radiación para evitar la degradación de ficobiliproteína.
- 3 x 1 mL de suspensión de cultivo en tubos safe-lock de la cosecha. Uso se triplica para la estimación de errores técnicos en la medición. Para realizar el muestreo del cultivo bajo condiciones estériles, cosechar las células en una campana laminar y siga las prácticas de trabajo y seguridad adecuadas.
- Centrifugar las células a 15.000 x g a temperatura de laboratorio durante 5 min ponga atención en el rotor de la centrífuga correctamente equilibrada. Después de la centrifugación, descartar el sobrenadante. Asegúrese de no perturbar el sedimento.
- Poner las muestras en un congelador. Para almacenamiento a largo plazo, mantener las muestras a-80 ° C. Esto es necesario para evitar la degradación de ficobiliproteína. Para el almacenamiento a corto plazo,-20 ° C es suficiente.
- Las muestras por congelación durante la noche. Para un adecuado proceso de liofilización, mantener la temperatura del condensador secador de congelación por debajo de-60 ° C y la presión en la cámara de congelar-secador alrededor de 1 hPa.
- Después de terminar el ciclo de liofilización, cierre el tubo tan pronto como sea posible para evitar la reabsorción de agua desde el aire.
3. célula de homogeneización y extracción de pigmentos
- Añadir cuatro pedazos de granos de cristal (con un diámetro de 2 mm) a cada tubo de muestra y cerrar los tubos.
Nota: Cuando la tapa del tubo de safe-lock usado para la homogeneización es demasiado fina, puede romper durante la homogeneización; por lo tanto, sólo el safe-lock tubos con tapas fuertes se recomiendan para este protocolo. - Homogeneizar las muestras con los granos de cristal de 15 s en un homogeneizador a temperatura de laboratorio.
Nota: Una muestra bien homogeneizada se extiende sobre la superficie interna entera de los tubos safe-lock. - Añadir 1 mL de tampón PBS (pH 7.4), preenfriado a 4 ° C, para las muestras con el fin de extraer ficobiliproteínas.
Nota: De este paso, mantener las muestras en hielo para evitar la degradación de las proteínas extraídas. Esto es fundamental. - Mezclar las muestras con PBS durante 5 s en el homogenizador a temperatura de laboratorio.
Nota: Después de mezclar, las muestras son de color verdosas. - Después de mezclar, mantener las muestras en hielo durante 60 minutos tapa el baño de hielo con una tapa para evitar la degradación de pigmentos.
- Después de 60 min de ficobiliproteína extracción, centrifugar las muestras a 15.000 x g a 4 ° C por 5 min atención para equilibrar adecuadamente el rotor de la centrífuga.
Nota: Después de la centrifugación, el sobrenadante tiene un color azul cian.
4. ficobiliproteína cuantificación
- Antes de la medición espectrofotométrica, calibrar el espectrofotómetro a la línea de base utilizando el tampón de PBS como un blanco.
- Una vez calibrado el espectrofotómetro es descartar el PBS de una cubeta de espectrofotómetro y pipetear el sobrenadante con ficobiliproteínas extraído en vez de con el tampón de desecho.
- Cuantificar la concentración de ficobiliproteína mediante espectrofotometría, utilizando un ancho de corte de 0.5 nm.
- Medir la absorbencia de la phycocyanobilins en ficocianina y allophycocyanin contra el tampón de PBS en blanco a 615 nm (un615) y 652 nm (A652), respectivamente, y medir la absorbencia de la ruina celular a 720 nm (un720).
- Calcular la concentración de ficocianina y allophycocyanin según las ecuaciones (1) y (2) de Bennett y Bogorad12:
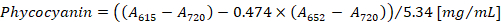
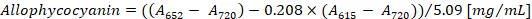
Nota: A615, A652y un720 deben ajustarse a la gama de absorbancia lineal del espectrofotómetro. Si es necesario, diluir la muestra con tampón PBS.
- Calcular la concentración de pigmento en las muestras originales. La concentración de pigmento en la muestra se corresponde directamente con los resultados de las ecuaciones (1) y (2) cuando 1 mL de cultivo y 1 mL de la solución de extracción se utilizan para el análisis. En caso de utilizar diferentes volúmenes de las muestras de cianobacterias o tampón PBS, la concentración de pigmento final debe calcularse según la ecuación (3):
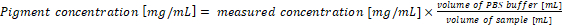 (3)
(3)
Nota: En caso de un contenido de ficobiliproteína normalización por peso seco de la célula, la concentración de pigmento final se calculará según la ecuación (4)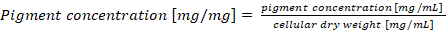 (4)
(4)
5. determinación del peso seco celular (opcional)
- Pesan tres tubos safe-lock vacíos en balanzas analíticas.
PRECAUCIÓN: Es fundamental que los tubos safe-lock están secos. En el caso de almacenar los tubos en un ambiente húmedo, secar los tubos durante varias horas en congelar secador antes de pesarles. Manipular los tubos suavemente y sólo con las manos enguantadas para evitar cualquier contacto entre el material y los dedos del investigador libre de polvo. Mantenga todos los titulares y limpia para evitar a la transferencia de cualquier material de los tubos de centrífuga. - 1 x 15 mL de suspensión de cultivo en tubo cónico de 15 mL de la muestra.
- Centrifugue la suspensión de la cultura en los tubos cónicos de 15 mL a 4.000 x g a temperatura de laboratorio durante 10 min equilibrio del rotor de la centrífuga con tres adicionales 15 mL tubos cónicos, cada uno conteniendo 15 mL de agua. Después de la centrifugación, descartar 12 mL del sobrenadante.
- Resuspender el precipitado en el sobrenadante restante y la transferencia de 3 x 1 mL de la mezcla de tres tubos safe-lock de 1,5 mL con una pipeta. En el caso de algunas sobras de la pelotilla permanecen en el tubo cónico de 15 mL, agregar 1,5 mL de agua desionizada al tubo cónico, vortex o agitar el tubo para suspender de nuevo los restantes de la pelotilla y transferencia de 3 x 0,5 mL de la mezcla de los tres tubos de safe-lock de 1,5 mL (ya containi 3 x 1 mL de la pelotilla del ng) con una pipeta.
Nota: Dividir la pastilla en tres tubos safe-lock de 1,5 mL permitirá la estimación de cualquier error técnico de medición de peso seco. - Centrifugar las células en tubos safe-lock de 1,5 mL a 15.000 x g a temperatura de laboratorio durante 5 min equilibrio del rotor de la centrífuga con un tubo adicional de safe-lock de 1,5 mL que contiene 1 mL de agua. Después de la centrifugación, descartar el sobrenadante.
- Poner las muestras en el congelador. Para el almacenamiento a largo plazo, mantener las muestras a-80 ° C; para el almacenamiento a corto plazo,-20 ° C es suficiente.
- Las muestras por congelación durante la noche. Para un adecuado proceso de liofilización, mantener la temperatura del condensador secador de congelación por debajo de-90 ° C y la presión en la cámara de congelar-secador alrededor de 1 hPa.
- Después de la liofilización, cierre los tubos y pese las muestras en balanzas analíticas.
Nota: El valor del peso seco puede utilizarse para la normalización de los contenidos de ficobiliproteína por peso seco de la célula.
Resultados
Para las pruebas del método inicial, Synechocystis fue cultivado como culturas lote en matraces Erlenmeyer en una coctelera en BG11 cultivo medio20 (complementado con 17 mM HEPES) a 25 ° C, bajo una luz blanca cálida de una intensidad de 50 μmol (fotones) / (m 2·s) y con 1% de CO2 en la atmósfera de cultivo. Durante el cultivo, los cultivos fueron muestreados a los tubos safe-lock y centrifugaron (15.000 x g a temperatu...
Discusión
Este protocolo describe un método sencillo, rápido y reproducible para la cuantificación del contenido de ficobiliproteína en la cianobacteria Synechocystisdel modelo. Se comparan varios métodos de homogeneización de la célula, extracción de proteínas y cuantificación de ficocianina y allophycocyanin y el protocolo final representa una combinación de lo óptimo de cada procedimiento individual. Como datos representativos, se cuantificó el contenido de ficobiliproteínas en Synechocystis cél...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El protocolo fue adoptado de una anterior publicación11. T. Z., CH. D. y J. Č. fueron apoyados por el Ministerio de educación, juventud y deportes de la República Checa en el programa nacional de sustentabilidad (NPU I), concesión número LO1415. J. Č. también fue apoyada por el GA CR, número 18-24397S. Acceso a los instrumentos y otras instalaciones fue apoyado por la infraestructura de investigación Checa para Biología de sistemas C4SYS (no proyecto LM2015055). M. A. S. fue apoyado por una beca de la Fundación de la ciencia rusa [no. 14-14-00904].
Materiales
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
Referencias
- Mimuro, M., Kikuchi, H., Green, B. R., Parson, W. W. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. , 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100 (2016).
- Bryant, D. A. . The Molecular Biology of Cyanobacteria. , (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130 (2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V., Lobban, C. S., Chapman, D. J., Kremer, B. P. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. , 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., Gault, P. M., Marler, H. J., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. , 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133 (2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados