Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Cyanobacterium Synechocystis Phycobiliprotein içeriğinde spektrofotometrik tayini
Bu Makalede
Özet
Burada, kantitatif spektrofotometrik yöntemle Synechocystis cyanobacterium phycobiliprotein içeriğini belirlemek için bir iletişim kuralı mevcut. Çıkarma yordamı diğer Siyanobakteriler ve yosun suşları için de başarıyla uygulandı; Ancak, pigment soğurma spektrumları farklılığı nedeniyle, tek tek her zorlanma için spektrofotometrik denklemler test gereklidir.
Özet
Bu modeli cyanobacterium Synechocystisiçeriğinde phycobiliprotein kantitatif tayini için basit bir protokoldür. Phycobiliproteins phycobilisomes, büyük ışık-hasat anten Siyanobakteriler içinde en önemli bileşenleri ve birkaç yosun özellikleri vardır. Synechocystis phycobilisomes iki phycobiliproteins içerir: phycocyanin ve allophycocyanin. Bu iletişim kuralı, verimli, basit ve güvenilir yöntem phycocyanin ve allophycocyanin bu modeli cyanobacterium yılında niceliksel belirlenmesi için açıklar. Biz phycobiliprotein çıkarma ve spektrofotometrik miktar birkaç yöntem göre. Bu protokol için açıklandığı gibi çıkarma yordamı Cyanothece sp., Synechococcuselongatus, Spirulina sp., Arthrospira sp., gibi diğer Siyanobakteriler suşları için de başarıyla uygulandı ve Nostoc sp., de kırmızı alg Porphyridium cruentumolarak. Ancak, çeşitli özellikleri üzerinden belirli phycobiliproteins tükenme katsayıları farklı olabilir ve bu nedenle, tek tek tek her zorlanma için spektrofotometrik miktar yöntemi doğrulamak için tavsiye edilir. Protokol az zaman gerektirir ve yalnızca standart donanım gerektirir beri herhangi bir standart yaşam bilim laboratuarında gerçekleştirilebilir.
Giriş
fPhycobiliproteins prokaryotik Siyanobakteriler (Cyanophyta) ışık-hasat anten ve birçok ökaryotik takson (Glaucophyta, Rhodophyta ana bileşenlerini temsil suda çözünen pigment-protein kompleksleri vardır ve Cryptophyta)1. Bunlar esas supramolecular kompleksleri phycobilisomes denilen ortaya ve fotosentetik membran yüzeyine stromal tarafında, Cryptophytanereye phycobiliproteins lokalize dışında genellikle takıldıkları thylakoid lümen2. Phycobiliproteins dört tür tarihine kadar tespit edilmiştir: çekirdek allophycocyanin ve periferik phycocyanin, phycoerythrin ve phycoerythrocyanin1. Işık-hasat ana kompleksler, phycobilisomes yosun ve Siyanobakteriler kitle kültürü verimlilik çok önemli faktörlerden biri temsil eder. O phycobilisomes kesme biyokütle birikimi güçlü ışık3altında geliştirebilirsiniz kanıtlanmıştır. Öte yandan, mütevazı veya düşük olma altında büyüme oranları ve biyokütle birikimi azaltma3,4anten kesme sonuçlandı. Phycobiliproteins ticari olarak yiyecek renklendirici, eczacılık ve kozmetik sanayi, gıda katkı maddeleri ve floresan olarak kullanılan probları akış sitometresi, floresan uzun ve floresan mikroskopi5uygulamaları ile.
Bu iletişim kuralı modeli cyanobacterium Synechocystisphycobiliproteins kantitatif tayin odaklanır. Siyanobakteriler temel erken fotosentetik Ototrofların vardır; Onlar Dünya'nın biyosfer 2.4 milyar yıl6' dan daha fazla bilgi için oluşturmuşlardır. Onlar azot, karbon, oksijen ve diğer öğeleri global biyojeokimyasal döngüleri çok önemli bir rol oynamaktadır. Siyanobakteriler arasında tek hücreli zorlanma tüm genomu ile ilk cyanobacterium olduğu benzersiz bir konum elde Synechocystis 7,8sıralı, eksojen DNA9tarafından doğal olarak transformable ve nispeten hızlı ve istikrarlı büyüme10,11gerçekleştirir. Synechocystis, çekirdek anten bileşeni allophycocyanin, integral membran proteinlerinin ile ilişkili ve ekli phycocyanin thylakoid membran çevre üzerinde yer alır.
Phycobiliprotein ayıklama ve miktar için birkaç yöntem bu protokolde karşılaştırılır. Son çıkarma yordamı başarıyla Synechocystisyanı sıra Cyanothece sp., Synechococcuselongatus, Spirulina sp., Arthrospira de dahil olmak üzere diğer Siyanobakteriler suşları için uygulandı SP.ve Nostoc sp. ve de başarıyla uygulanma kırmızı alg Porphyridium cruentum. Bu nedenle, bu protokol için geliştirilen Yöntem phycobiliprotein çıkarılması için evrensel bir yöntem olarak kabul edilebilir. Birkaç test ayıklama yöntemi daha yüksek toplam protein verimleri sonuçlandı olsa bile, klorofil bir kalıntı en düşük içeriği ile birlikte en yüksek phycobiliprotein verimleri sağlanan burada açıklanan çıkarma yordamı phycobiliprotein ayıklayın. Klorofil bir içeriğini azaltmak doğru phycocyanin ve allophycocyanin spektrofotometrik miktar için gerekli.
Phycobiliprotein emme spectra önemli ölçüde çeşitli yosun ve Siyanobakteriler türler12,13,14,15,16,17 arasında farklılık gösterir ve hatta bir tek Siyanobakteriler cins18çeşitli suşları arasında. Bu nedenle, belirli dalga boylarında ve phycocyanin ve Synechocystis allophycocyanin tespiti için kullanılan gibi emme katsayıları genellikle diğer suşları için uygun değildir. Ayrıca, Synechocystis phycoerythrin ve bazı diğer algler ve Siyanobakteriler bulunan phycoerythrocyanin içermiyor. Suşları Synechocystisdışında phycobiliproteins belirlenmesi amacıyla spektrofotometrik denklemler her zorlanma için ayrı ayrı değerlendirmeniz önerilir.
Protokol (hücresel granül ve 1 saatlik protein çıkarma gecede dağılması) iki uzun adımlar içerse de, phycobiliproteins miktar toplam çalışma zamanı 2 saatten daha uzun geldi.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Siyanobakteriler ekimi
- Synechocystis hücreleri Erlenmeyer şişe veya < 10 (17 mM HEPES10kullanarakÖrneğin,) pH korumak için arabelleğe alınan BG11 orta20 photobioreactors10,19 yetiştirmek.
Not: Standart yetiştirme koşulları kontrollü bir sıcaklık gereklidir (genellikle, 30 ° C, en uygun sıcaklık 35 ° C olur)21, aydınlatma (tipik olarak, bir ışık bir yoğunluk en fazla 800 µmol [fotonlar] / [m2·s])21ve bir CO 2 kaynağı (400 mL düz panel photobioreactor CO2 konsantrasyonu doyurarak büyüme 1,700 ppm dir)21. - Kültür yoğunluğu belirlemek için spectrophotometrically, 730 kültür optik yoğunluk ölçmek nm (OD730) alternatif olarak, bir ışık yolu 1 cm. ile bir küvet kullanarak otomatik bir hücre veya bir hemasitometre kullanarak bir mikroskop altında hücreleri saymak sayaç.
2. numune hazırlama
- Phycobiliprotein yıkımı önlemek için düşük olma altında çalışır.
- Hasat kültür süspansiyon güvenli kilit tüpler için 3 x 1 mL. Ölçüm Teknik hata tahmini için triplicates kullanın. Kültür örnekleme Steril koşullar altında gerçekleştirmek için laminer kukuIeta hücrelerde hasat ve uygun çalışma ve iş güvenliği uygulamaları izleyin.
- 15.000 x g , laboratuvar sıcaklığında 5 dk. düzgün dengeli santrifüj rotor dikkat için hücreleri santrifüj kapasitesi. Santrifüjü sonra supernatants atın. Pelet bozmamaya dikkat edin.
- Örnekleri bir dolaba koydum. Uzun süreli depolama için örnekleri-80 ° C'de tutmak. Bu phycobiliprotein yıkımı önlemek gereklidir. Kısa süreli depolama için-20 ° C yeterli olur.
- Örnekleri gecede şeytanibir. Uygun bir freeze-drying işlem için-60 ° C altında donma kurutma makinesi kondansatör sıcaklığı tutmak ve donma kurutma makinesi basıncı Oda yaklaşık 1 inç.
- Freeze-drying döngüsü bittikten sonra en kısa zamanda su hava emiliminin önlemek için tüp kapatın.
3. hücre homojenizasyon ve pigmentler çıkarma
- Her örnek tüp için dört adet cam boncuk (2 mm çaplı) ekleyin ve tüpler kapatın.
Not: homojenizasyon için kullanılan güvenli kilit tüp kapak çok ince olduğunda, homojenizasyon sırasında zarar verebilir; Bu nedenle, yalnızca güvenli kilit tüpler güçlü kapakları ile bu iletişim kuralı için tavsiye edilir. - 15 cam boncuk örnekleriyle homojenize laboratuvar sıcaklığında bir homogenizer s.
Not: Düzgün homojenize bir örnek güvenli kilit tüpler bütün iç yüzeyi üzerine yayılır. - PBS arabellek (pH 7,4), 1 ile 4 ° C arasında phycobiliproteins ayıklamak için örnekleri için precooled mL ekleyin.
Not: Bu adımından örnekleri ayıklanan protein yıkımı önlemek için buz üzerinde tutun. Bu çok önemlidir. - Örnekleri PBS ile 5 için karıştırın, laboratuvar sıcaklığında homogenizer s.
Not: karıştırma sonra yeşilimsi örneklerindendir. - Karıştırma sonra buz 60 dk. kapak örnekleri buz banyosu pigmentler yıkımı önlemek için bir kapak ile tutun.
- Phycobiliprotein ekstraksiyon 60 dk sonra santrifüj kapasitesi 15.000 x g 5 dk. düzgün santrifüj rotor dengelemek için dikkat 4 ° C'de de örnekleri.
Not: Santrifüjü sonra Camgöbeği mavi renk süpernatant vardır.
4. Phycobiliprotein miktar
- Spektrofotometrik ölçüm önce PBS arabellek boş bir parola kullanarak temel spektrofotometre kalibre.
- Spektrofotometre kalibre edilmiş, PBS üzerinden bir spektrofotometre küvet atmak ve süpernatant ile atılan arabelleği ile yerine ayıklanan phycobiliproteins pipette.
- Phycobiliprotein toplama spectrophotometrically, 0,5 yarık genişliğini kullanarak ölçmek nm.
- Phycocyanin ve allophycocyanin karşı PBS arabellek 615 boş phycocyanobilins absorbans ölçmek nm (bir615) ve 652 nm (bir652), sırasıyla ve 720, hücresel enkaz absorbans ölçmek nm (bir720).
- Konsantrasyon phycocyanin ve allophycocyanin denklemler göre (1) ve (2), Bennett ve Bogorad12Hesapla:
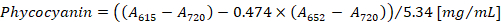
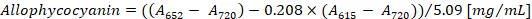
Not:615,652ve bir720 spektrofotometre doğrusal absorbans aralığına uygun olmalıdır. Gerekirse, PBS arabellek örnekle oranında seyreltin.
- Orijinal örnekleri pigment konsantrasyon yeniden hesaplayın. Pigment konsantrasyon örnek denklemler (1) ve (2) kültürünün 1 mL ve 1 mL ayıklama arabellek analizi için kullanılır sonuçları ile doğrudan karşılık gelir. Siyanobakteriler örnekleri ve/veya PBS arabellek farklı birimleri kullanma durumunda, son pigment konsantrasyon Denklem (3) göre hesaplanması gereken:
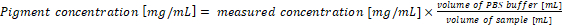 (3)
(3)
Not: hücre Kuru ağırlık başına normalize bir phycobiliprotein içerik durumunda son pigment konsantrasyon Denklem (4) göre hesaplanması gereken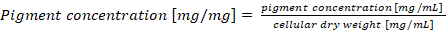 (4)
(4)
5. (isteğe bağlı) hücre Kuru ağırlık tespiti
- Üç boş kasa-kilit tüpler analitik bakiyelere tartın.
Dikkat: Kasa kilidi tüpler kuru önemlidir. Tüpler bir ıslak ortamda saklanması durumunda, tüpler bir dondurma onları ağırlığında önce kurutma makinesi birkaç saat kuru. Tüpler yavaşça işlemek ve malzeme ve araştırmacı parmaklar arasında herhangi bir temas önlemek için yalnızca Pudrasız eldivenli elleri olan. Tüm sahipleri tutmak ve temiz herhangi bir malzeme transfer tüpler için önlemek için santrifüj kapasitesi. - Örnek 15-mL konik tüp kültür süspansiyon 1 x 15 mL.
- Kültür süspansiyon içeren her 15 mL su üç ek 15 mL konik tüpler, 4.000 x g laboratuvar sıcaklık 10 dk. denge santrifüj rotor için de 15 mL konik tüpler santrifüj kapasitesi. Santrifüjü sonra 12 mL süpernatant atmak.
- Pelet kalan süpernatant içinde resuspend ve 3 x 1 mL karışımı üç 1.5 mL güvenli kilit tüpler bir pipet ile aktarın. Pelet artıklardan 15 mL konik tüp içinde kalması durumunda, konik Tüp, girdap veya kalan resuspend için tüp cips ve 3 x 0.5 mL karışımı üç 1.5 mL güvenli kilit tüpler (zaten containi aktarmak sallamak için 1,5 mL deiyonize su ekle NG Pelet 3 x 1 mL) ile bir pipet.
Not: Pelet üç 1.5 mL güvenli kilit tüpler üzerinde bölme Kuru ağırlık ölçü herhangi bir teknik hata tahmin sağlayacaktır. - 1.5 mL güvenli kilit tüpler 15.000 x g , laboratuvar sıcaklığında 5 dk. denge için de hücrelerde 1 mL su içeren ek bir 1.5 mL güvenli kilit tüp ile santrifüj rotor santrifüj kapasitesi. Santrifüjü sonra supernatants atın.
- Örnekleri dondurucuya koydum. Uzun süreli depolama için örnekleri-80 ° C'de tutun; kısa vadeli depolamak için-20 ° C yeterli olur.
- Örnekleri gecede şeytanibir. Uygun bir freeze-drying işlem için donma kurutma makinesi kondansatör-90 ° C'den sıcaklığı tutmak ve donma kurutma makinesi basıncı Oda yaklaşık 1 inç.
- Dağılması sonra tüpler kapatın ve örnekleri analitik bakiyelere tartın.
Not: Kuru ağırlık değeri hücre Kuru ağırlık başına phycobiliprotein içerik normalleştirme için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
İlk yöntem sınavlara Erlenmeyer şişe üzerinde bir shaker kültürlerde toplu olarak ekili Synechocystis (17 mM HEPES ile desteklenmiş) BG11 ekimi orta-20 dakika 50 µmol (fotonlar) bir yoğunluk sıcak bir beyaz ışık altında 25 ° C / (m 2·s) ve kodlamayla atmosferde % 1 CO2 . Ekimi sırasında kültür güvenli kilit tüpler için örnek ve (15.000 x g 5 min için laboratuvar sıcaklığında) centrifuged, süper...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu iletişim kuralı modeli cyanobacterium Synechocystisiçeriğinde phycobiliprotein miktar için basit, hızlı ve tekrarlanabilir yöntemi açıklar. Hücre homojenizasyon, protein çıkarma ve phycocyanin ve allophycocyanin miktar birkaç yöntem karşılaştırılır ve son iletişim kuralı tek her yordam en iyi adımlardan bir birleşimini temsil eder. Temsilcisi veri phycobiliproteins içeriğini ışık şiddeti artan altında Synechocystis hücrelerdeki sayısal. Labaratuar donanımları daha ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Protokol bir önceki yayın11kabul edilmiştir. T. desteklenen Milli Eğitim Bakanlığı, gençlik ve spor ulusal sürdürülebilirlik programı içinde Çek Cumhuriyeti tarafından Z., ö. bölüm ve J. Č. ben (NPU ben), sayı LO1415 verin. J. Č. Ayrıca GA CR, Grant sayı 18-24397S tarafından desteklenmiştir. Erişim cihazları ve diğer özellikler için Çek araştırma altyapı sistemleri biyoloji C4SYS (proje yok LM2015055) tarafından desteklenmiştir. M. A. S. Rus Bilim Vakfı [No 14-14-00904] bir hibe tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
Referanslar
- Mimuro, M., Kikuchi, H. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. Green, B. R., Parson, W. W. , Springer. Dordrecht, The Netherlands. 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100(2016).
- Bryant, D. A. The Molecular Biology of Cyanobacteria. , Springer Netherlands. Dordrecht, The Netherlands. (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130(2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. Lobban, C. S., Chapman, D. J., Kremer, B. P. , Cambridge University Press. Cambridge, New York, New Rochelle, Melbourne, Sydney. 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. Gault, P. M., Marler, H. J. , Nova Science Publishers, Inc. New York, NY. 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133(2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır