需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
鹌鹑绒毛膜尿囊膜 - 光动力诊断和治疗的工具
摘要
禽胚胎的脉络膜尿囊膜(CAM)是各个研究领域非常有用和适用的工具。一种特殊的日本鹌鹑CAM卵外模型适用于光动力处理研究。
摘要
禽胚胎的脉络膜尿囊膜(CAM)是一种薄的胚胎外膜,作为主要的呼吸器官。其特性使其成为研究血管生成、肿瘤生长、药物输送系统或光动力诊断 (PDD) 和光动力疗法 (PDT) 的出色 体内 实验模型。同时,该模型解决了用合适的替代品替换实验动物的要求。 卵外 培养胚胎允许轻松的物质应用、访问、监测和记录。最常用的是小鸡凸轮;但是,本文介绍了日本鹌鹑CAM作为低成本和高通量模型的优势。另一个优点是胚胎发育较短,允许更高的实验周转率。本文探讨了鹌鹑CAM对癌症和微生物感染的PDD和PDT的适用性。作为示例,描述了使用光敏剂金丝桃素与脂蛋白或纳米颗粒组合作为递送系统。确定了白光图像的损伤评分和紫光(405 nm)下CAM组织荧光强度的变化,并分析了组织学切片。鹌鹑CAM清楚地显示了PDT对脉管系统和组织的影响。此外,还可以观察到毛细血管出血、血栓形成、小血管溶解和大血管出血等变化。日本鹌鹑CAM是一种很有前途的光动力诊断和治疗研究的 体内 模型,可用于肿瘤血管生成研究以及抗血管和抗菌治疗。
引言
鸡绒毛膜尿囊膜(CAM)模型是众所周知的,并广泛用于各个研究领域。它是一个血管丰富的胚胎外器官,提供气体交换和矿物质运输1。由于该膜的透明度和可及性,可以实时观察单个血管及其结构变化2。尽管有这些优点,但雏鸡CAM也有一些限制(例如,更大的繁殖设施,鸡蛋生产和饲料消耗),可以通过使用其他鸟类来避免。在该协议中,描述了使用日本鹌鹑(Coturnix japonica)胚胎的替代卵外CAM模型。由于其体积小,它允许使用比鸡CAM更多的实验个体。此外,鹌鹑胚胎较短的16天胚胎发育是另一个优势。鹌鹑CAM上的第一个较大的血管出现在胚胎日(ED)7。这可以直接与雏鸡胚胎发育(4-35 阶段)进行比较;然而,发育的后期阶段不再具有可比性,并且鹌鹑胚胎需要更少的时间3.令人感兴趣的是类似于鸡CAMs的微血管分支的定期发生4,5,6。快速的性成熟,高产蛋量和低成本育种是支持使用这种实验模型7的其他例子。
禽CAM模型通常用于光动力疗法(PDT)研究8。PDT用于治疗几种形式的癌症(局部小肿瘤)和其他非肿瘤疾病。其原理是将荧光药物,光敏剂(PS)输送到受损组织,并用适当波长的光激活。研究中使用的一种前瞻性PS是金丝桃素,最初从药用植物圣约翰草(金丝桃连翘)中分离出来9。这种化合物的强光敏作用是基于其光化学和光物理特性。其特征在于400-600nm范围内的多个荧光激发峰,其诱导约600nm处的荧光发射。金丝桃素在光谱带内的最大吸收值在540-590nm范围内,荧光最大值在590-640nm范围内9。为了达到这些光敏效果,在局部给药10后,金丝桃素被波长为405nm的激光激发。在光的存在下,金丝桃素可表现出杀病毒,抗增殖和细胞毒性作用11,而没有全身毒性,并且迅速从生物体中释放。金丝桃素是一种亲脂性物质,可形成不溶于水的非荧光聚集体,这就是为什么几种类型的纳米载体,例如聚合物纳米颗粒12,13或高密度和低密度脂蛋白(HDL,LDL)14,15,用于帮助其递送和渗透到细胞中。由于CAM是一种天然免疫缺陷系统,肿瘤细胞可以直接植入膜表面。该模型也非常适合根据定义的分数16,17 记录 PDT 诱导的血管损伤程度。与PDT相比,强度较低的光可用于光动力诊断(PDD)。在紫罗兰激发LED光下监测组织也会导致光敏剂18,19,20的光活化,从而导致荧光的发射,但它不能提供足够的能量来启动PDT反应并损害细胞。它使其成为肿瘤可视化和诊断或监测所用PSs的药代动力学的良好工具14,15。
本文介绍了存活率超过 80% 的卵 外 鹌鹑 CAM 测定的制备方法。这种 卵外 培养物成功地应用于大量的实验中。
研究方案
该研究是按照机构指南进行的。所有设备和试剂必须用70%乙醇或紫外线高压灭菌或灭菌。
1. 种蛋孵化
- 在开始孵化之前,将受精鹌鹑蛋储存在10-15°C最多4-5天。仅使用干净且未损坏的鸡蛋。
- 将种蛋在强制通风孵化器中孵化~53-54小时。在关闭种蛋旋转的情况下,在50%-60%的湿度和37.5°C的孵化温度下水平产卵。
2. 卵外 培养物制备
注意:初始孵化后,种蛋适合开始 卵外 培养。
- 用 70% 乙醇消毒鸡蛋表面,不要旋转鸡蛋。
- 在无菌层流柜中,使用小型无菌手术剪刀打开蛋壳并将内容物转移到 6 孔培养板中。如果做得好,胚胎将躺在未损坏的蛋黄上。每个鸡蛋后,用70%乙醇消毒剪刀。
- 向 6 孔板的间隙中加入大约 5 mL 的无菌水,因为湿度对于防止 CAM 变干至关重要。
- 将胚胎放入培养箱中直至进一步实验,同时保持37°C的温度和80%-90%的湿度。
- 当 CAM 完全显影(从 ED7 开始)时,沿着小毛细管在 CAM 表面上放置一个无菌硅胶环(直径 6 mm,厚度约 1.5 mm)。放置戒指时避免使用主要血管。
注意:环定义了工作区,有助于标记物质应用的位置,并防止液体内容物泄漏。 - 根据国家法律终止胚胎培养。
- 重要的是,在工作期间戴上手套或用70%乙醇消毒双手。用真空吸引器吸出未正确倾斜的胚胎或未受精卵。
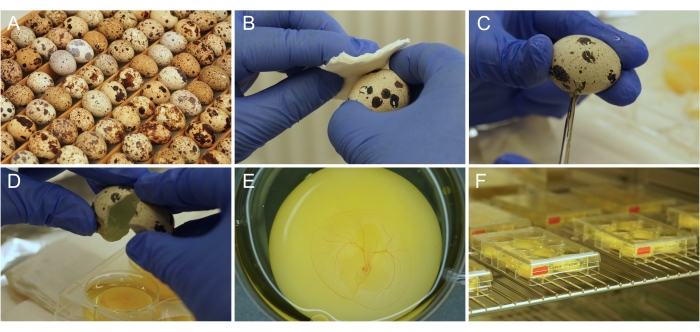
图1: 离卵 培养物制备。 (A) 储存和孵化的日本鹌鹑蛋。(B)用乙醇对蛋表面进行消毒。(C)蛋壳用剪刀剪开。(D)将鸡蛋的内容物倒入井中。(E)适当准备的3天大的胚胎,并具有发育中的CAM脉管系统。(F)储存在培养箱中的培养板。 请点击此处查看此图的大图。
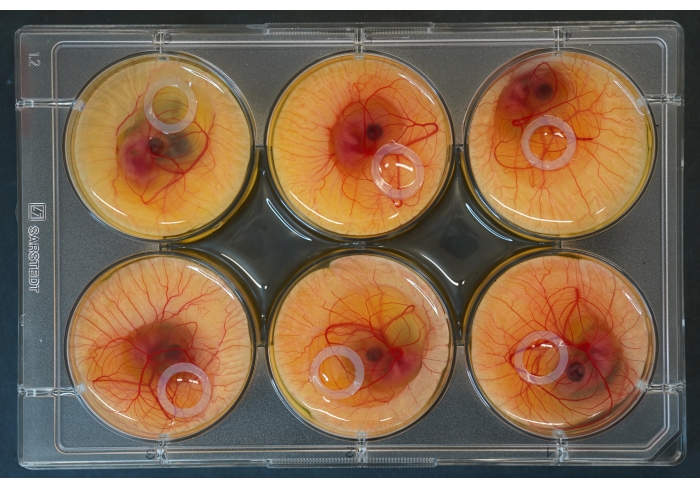
图 2:6 孔培养板,顶部放置胚胎和硅胶环。 请点击此处查看此图的大图。
3.肿瘤细胞接种
注意:所有程序都需要使用无菌层流柜。
- 根据各自的培养方案在烧瓶中培养不同类型的贴壁细胞。
- 从烧瓶中取出旧培养基,并用无菌磷酸盐缓冲盐水(PBS)冲洗细胞层以去除培养基的痕量。
- 胰蛋白酶消化后,通过加入培养基抑制胰蛋白酶并将细胞收获到离心管中。离心细胞并将细胞沉淀重悬于新鲜培养基中。计数细胞并以所需浓度将其重悬于细胞培养基中。
注意:也可以使用例如悬挂滴法21来生产3D细胞培养物,即球状体。
- 将 1 x 105-1 x 106 个肿瘤细胞或 5-15 个球体(每个 CAM)植入 30 μL 细胞培养基溶液中,植入 CAM 顶部的硅胶环中。
注意:体积取决于所用硅胶环的尺寸。如果使用直径较大的硅胶环,则需要更大的体积来覆盖整个区域。根据细胞类型或不同类型的实验,可以使用不同的细胞浓度。有时,CAM的精细刮削用于改善嵌入细胞的粘附。 - 将带有接种细胞的CAM返回培养箱(37°C和80%-90%湿度)。

图3:用肿瘤接种CAM 。 (A)用移液管抽吸球体,以及(B)植入CAM表面。 请点击此处查看此图的大图。
4.光敏剂的应用
- 金丝桃素的应用
- 在昏暗的灯光下,通过将金丝桃素溶解在100%二甲基亚砜(DMSO)中来制备2 mM金丝桃素储备溶液。在用无菌PBS或盐水溶液进行实验前不久准备79μM金丝桃素的工作溶液。确保所有溶液中DMSO的最终浓度始终低于0.2%,这不会影响胚胎的发育。
- 在无菌条件下,将适量的金丝桃素溶液涂在硅胶环上。30 μL 的体积足以填充直径为 6 mm 的环。
- 将胚胎保存在37°C和80%-90%湿度的培养箱中。水溶液中的金丝桃素在组织中单构化后具有光活性,在CAM上施用约3小时后。
- 金丝桃素与低密度脂蛋白、高密度脂蛋白或纳米颗粒作为运输系统的应用
注意:这些转运系统用于改善金丝桃素对细胞和细胞结构的渗透。- 由于光敏性,请在昏暗的灯光下执行所有步骤,包括溶液的制备,并将溶液储存在黑暗中。
- 根据参考文献15,通过在PBS中混合适当体积的脂蛋白和金丝桃素储备溶液来制备金丝桃素-LDL和金丝桃素-HDL制剂。LDL或HDL与金丝桃素的浓度为20:115。
- 根据参考文献12,13通过活阳离子开环聚合合成聚合物纳米颗粒。用PBS调节聚合物纳米颗粒中金丝桃素的浓度至10μM12,13。
5. PDD 和 PDT
- 进行PDD
- 在无菌条件下,在CAM表面上应用光敏剂(金丝桃素,加载金丝桃素的聚合物纳米颗粒或带有脂蛋白载体的金丝桃素),有或没有肿瘤细胞(ED 7-9)。
- 使用紫色激发光(405nm波长的定制圆形LED灯)照亮CAM,并在金丝桃素给药后0,1,3,5,24和48小时的时间间隔内用数码相机记录CAM组织和肿瘤细胞中金丝桃素的荧光。
- 如果研究需要白光下的CAM图像,请在金丝索霉素给药前和实验结束时,在组织固定前不久记录CAM,因为光会影响金丝桃素的光活化。
- 使用图像处理和分析程序(例如,ImageJ22)评估荧光强度。
- 将 RGB 图像通道拆分为单独的红色、绿色和蓝色图像。以 8 位形式分析红色强度图像。评估环内区域的红色强度,并将其近似为金丝桃素荧光。在金丝桃素给药后(即从0小时,给药后立即到48小时)以不同的时间间隔获得整个图像配置文件图(使用ImageJ的配置文件图插件)。
- 进行PDT
- 在金丝桃素应用后至少3小时进行PDT。
- 将光纤放在CAM表面上方,以使激光覆盖硅胶环内的整个区域。
- 用405nm激光以285mW/ cm 2的通量率进行体内照射(1-2分钟)。
- 在光动力处理前后(24小时和48小时)使用白光和405nm荧光记录CAM。
- 从白光下拍摄的图像中检测PDT后24小时和48小时的光损伤。通过半定量评分16:1评估血管损伤 - 无破坏;2 - 部分关闭毛细管(直径≤10μm),不破坏中等或更大(直径≥50μm)和较小的血管(直径10-50μm);3 - 部分关闭毛细血管消失的较小血管;4 - 较大血管部分关闭,较小血管和毛细血管消失;和 5 - 总光血栓形成,大部分血管消失。

图 4:用激光处理 CAM。 这张照片仅用于说明目的。对于 PDD 或 PDT,房间必须是黑暗的。 请点击此处查看此图的大图。
6. 准备 CAM 以进行进一步评估
- 石蜡包埋
- 将CAM组织固定在PBS中含有4%多聚甲醛(PFA)的培养板中至少2小时,最多过夜。
- 取出PFA,小心地从CAM上切出硅胶环内的一部分组织。
- 立即使升序酒精系列中的CAM组织脱水,如下所示。将CAM组织置于70%乙醇中3分钟,伊红溶液2分钟(以便组织更容易在石蜡块中定位),96%乙醇3 x 5分钟(始终在新培养皿中),100%乙醇5分钟和二甲苯2 x 10分钟。
- 使用刮刀或细刷子,尽快将样品转移到培养皿(59°C)中溶解的石蜡中。24小时后,将组织置于组织学模具中,用石蜡包埋培养基填充,使其在冰箱中固化。从包埋介质上切下凝固的CAM,将其在托盘中旋转90°,再次用包埋介质填充,然后使其凝固。
- 在切片机上准备5-10μm切片进行组织病理学分析,以确定PDT诱导的损伤。
- 用于组织学的冷冻CAM切片的制备
注意:对于包括组织学在内的某些方法,在低温恒温器切片机上制备的冷冻切片更合适。请按照以下步骤准备冻结的 CAM 部分。- 小心地将天然或 4% 多聚甲醛固定的 CAM 安装在载玻片上。
- 用最佳切割温度化合物(OCT)将嵌入模具填充成两半,并在液氮或干冰和乙醇的混合物中冷冻。
- 冷冻后,小心地倾斜CAM并将其从载玻片滑到冷冻的OCT介质的顶部。再次放入模具中,用OCT介质覆盖,并按照步骤6.2.2冷冻。
- 鹌鹑CAM的分形分析
注意:PDT引起的脉管系统变化可以通过计算分形维数系数19来评估。- 在层流柜中,将CAM溢在培养板中,该培养板具有4%多聚甲醛和2%戊二醛在PBS中的预热(37°C)固定溶液。
- 48小时后取出固定溶液。用微型剪刀和细刷小心地将CAM与胚胎分开,然后在PBS中清洗。
- 将洗好的 CAM 安装在载玻片上,让它慢慢干燥。
- 使用数码相机和透射仪作为均匀白光源拍摄载玻片。
- 使用 ImageJ 软件处理数字图像22.对于分析,从具有远端动脉分支的区域中选择一个正方形区域(512 × 512 像素)。按照参考文献31中描述的程序对图像进行二值化和骨架化,并计算分形维数系数(Df)。
- CAM组织的分子分析
- 对于分子分析,仔细分离天然CAM,在液氮中冷冻,并储存在-80°C。
- 根据 RNA 分离23、逆转录为 cDNA 和定量 PCR24 的标准方案确定基因表达。
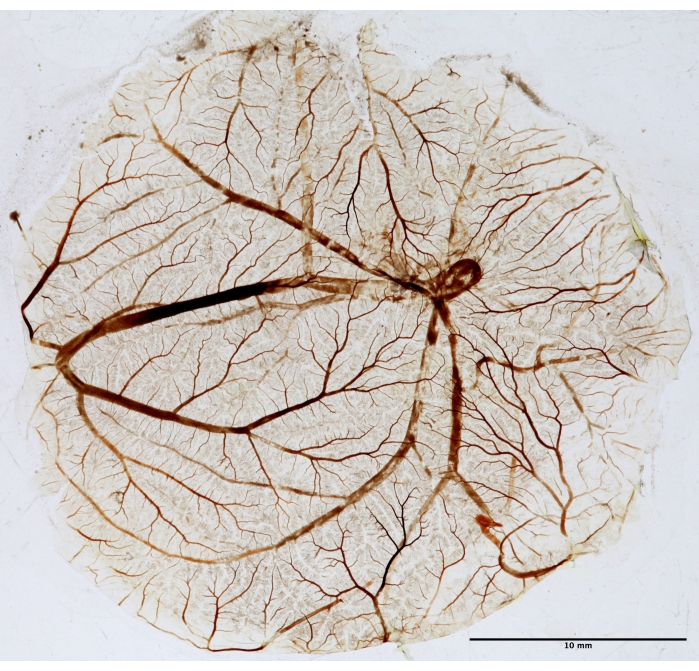
图 5:用于分形分析的 CAM 组织。 PDT 后,将 CAM 固定、安装在载玻片上并干燥以进行分形分析。照片是使用透射仪在白光下拍摄的。 请点击此处查看此图的大图。
结果
在白光下,CAM表面肿瘤的定位是困难的。用于PDD的光敏剂(此处为金丝桃素)有望被肿瘤选择性吸收,并有助于可视化肿瘤。添加金丝桃素和使用荧光灯(例如,405nm)可以很好地显示肿瘤(鳞状细胞癌TE1)的位置(图6A)。组织学分析显示重要的肿瘤细胞侵入健康组织。异常鳞状细胞的同心结构,通常在鳞状细胞癌组织(角蛋白珍珠)中描述,是可见的(图...
讨论
为了成功的 卵外 培养,遵循上述协议很重要。此外,如果鸡蛋打开得不够小心或在培养过程中湿度不足,蛋黄袋会粘在壳上并经常破裂。在鸡蛋孵化约60小时时开始卵 外 培养可确保胚胎的高存活率,因为它们已经足够大,可以在处理中存活下来。在后期发育阶段,CAM变薄并粘附在蛋壳上,导致膜破裂。
从孵化第7天开始,胚胎对搅拌的敏感性降低;CAM区几乎覆盖...
披露声明
作者没有利益冲突。
致谢
这项工作得到了VEGA 2/0042/21和APVV 20-0129的支持。V. Huntošová的贡献是项目实施的结果:现代医学跨学科研究的开放科学社区(缩写:OPENMED),ITMS2014+:313011V455,由ERDF资助的运营计划综合基础设施支持。
材料
| Name | Company | Catalog Number | Comments |
| 6-Well Cell Culture Plate | Sarstedt | 83.392 | Transparent polystyrene, sterile |
| CO2 Incubator ESCO CCL-0508 | ESCO, Singapore | CCL-050B-8 | CO2 cell culture incubator |
| cryocut Leica CM 1800 | Reichert-Jung, USA | ||
| digital camera Canon EOS 6D II | Canon, Japan | ||
| diode laser 405 nm | Ocean Optics, USA | ||
| DMSO | Sigma-Aldrich | 67-68-5 | dimethyl sulfoxid |
| eosin | Sigma-Aldrich | 15086-94-9 | |
| ethanol | Sigma-Aldrich | 64-17-5 | |
| fine brush size 2 | Faber-Castell | 281802 | brush for CAM separation and manipulation |
| glutaraldehyde | Sigma-Aldrich | 111-30-8 | |
| hematoxylin | Sigma-Aldrich | 517-28-2 | |
| hypericin | Sigma-Aldrich | 84082-80-4 | |
| incubator Bios Midi | Bios Sedl any, Czech Republic any, Czech Republic | Forced draught incubator for initial incubation | |
| incubator Memmert IF160 | Memmert, Germany | Forced air circulation incubator for CAM incubation | |
| Kaiser slimlite plano, LED light box | Kaiser, Germany | 2453 | Transilluminator |
| LED light 405 nm | custom made circular LED light | ||
| macro lens Canon MP- E 65 mm f/2.8 | Canon, Japan | ||
| microscope Kapa 2000 | Kvant, Slovakia | optical microscope | |
| microtome Auxilab 508 | Auxilab, Spain | manual rotary microtome | |
| paraformaldehyde | Sigma-Aldrich | 30525-89-4 | |
| Paraplast Plus | Sigma-Aldrich | P3683 | parafin medium for tissue embedding |
| PBS | Sigma-Aldrich | P4417 | Phosphate saline buffer |
| scissors Castroviejo | Orimed | OR66-108 | micro scissors for CAM separation |
| software ImageJ 1.53 | public domain | image processing and analysis program | |
| stock solution HDL | Sigma-Aldrich | 437641-10MG | high density lipoproteins |
| stock solution LDL | Sigma-Aldrich | 437644-10MG | low density lipoproteins |
| Tissue-Tek O.C.T. Compound | Sakura Finetek | 4583 | Optimal Cutting Temperature Compound 118 mL squeeze bottles |
参考文献
- Nowak-Sliwinska, P., van Beijnum, J. R., van Berkel, M., vanden Bergh, H., Griffioen, A. W. Vascular regrowth following photodynamic therapy in the chicken embryo chorioallantoic membrane. Angiogenesis. 13 (4), 281-292 (2010).
- van Leengoed, H. L. L. M., vander Veen, N., Versteeg, A. A. C., Ouellet, R., van Lier, J. E., Star, W. M. In-vivo photodynamic effects of phthalocyanines in a skin-fold observation chamber model: role of central metal ion and degree of sulfonation. Photochemistry Photobiology. 58 (4), 575-580 (1993).
- Ainsworth, S. J., Stanley, R. L., Evans, D. J. R. Developmental stages of the Japanese quail. Journal of Anatomy. 216 (1), 3 (2010).
- De Fouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the microcirculation in the chick chorioallantoic membrane during normal angiogenesis. Microvascular Research. 38 (2), 136-147 (1989).
- Sandau, K., Kurz, H. Modelling of vascular growth processes: a stochastic biophysical approach to embryonic angiogenesis. Journal of Microscopy. 175 (3), 205-213 (1994).
- Kurz, H., Ambrosy, S., Wilting, J., Marmé, D., Christ, B. Proliferation pattern of capillary endothelial cells in chorioallantoic membrane development indicates local growth control, which is counteracted by vascular endothelial growth factor application. Developmental Dynamics. 203 (2), 174-186 (1995).
- Huss, D., Poynter, G., Lansford, R. Japanese quail (Coturnix japonica) as laboratory animal model. Lab Animal. 37 (11), 513-519 (2008).
- Gottfried, V., Lindenbaum, E. S., Kimel, S. The chick chorioallantoic membrane (CAM) as an in-vivo model for photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 12 (2), 204-207 (1992).
- Miškovský, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological molecules. Current Drug Targets. 3 (1), 55-84 (2002).
- Čavarga, I., et al. Photodynamic effect of hypericin after topical application in the ex ovo quail chorioallantoic membrane model. Planta Medica. 80 (1), 56-62 (2014).
- Martinez-Poveda, B., Quesada, A. R., Medina, M. A. Hypericin in the dark inhibits key steps of angiogenesis in vitro. Europan Journal of Pharmacology. 516 (2), 97-103 (2005).
- Datta, S., et al. Unravelling the excellent chemical stability and bioavailability of solvent responsive curcumin-loaded 2-ethyl-2-oxazoline-grad-2-(4-dodecyloxyphenyl)- 2-oxazoline copolymer nanoparticles for drug delivery. Biomacromolecules. 19 (7), 2459-2471 (2018).
- Huntošová, V., et al. Alkyl Chain length in poly(2-oxazoline)-based amphiphilic gradient copolymers regulates the delivery of hydrophobic molecules: a case of the biodistribution and the photodynamic activity of the photosensitizer hypericin. Biomacromolecules. 22 (10), 4199-4216 (2021).
- Buríková, M., et al. Hypericin fluorescence kinetics in the presence of low density lipoproteins: study on quail CAM assay for topical delivery. General Physiology and Biophysic. 35 (4), 459-468 (2016).
- Lenkavska, L., et al. Benefits of hypericin transport and delivery by low- and high-density lipoproteins to cancer cells: From in vitro to ex ovo. Photodiagnosis and Photodynamic Therapy. 25, 214-224 (2019).
- Rück, A., Böhmler, A., Steiner, R. PDT with TOOKAD studied in the chorioallantoic membrane of fertilized eggs. Photodiagnosis and Photodynamic Therapy. 2 (1), 79-90 (2005).
- Gottfried, V., Davidi, R., Averbuj, C., Kimel, S. In vivo damage to chorioallantoic membrane blood vessels by porphycene-induced photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 30 (2-3), 115-121 (1995).
- Buzzá, H. H., Silva, L. V., Moriyama, L. T., Bagnato, V. S., Kurachi, C. Evaluation of vascular effect of Photodynamic Therapy in chorioallantoic membrane using different photosensitizers. Journal of Photochemistry and Photobiology B: Biology. 138, 1-7 (2014).
- Dougherty, T. J., et al. Photodynamic therapy. Journal of the National Cancer Institute. 90, 889-905 (1998).
- Xiang, L., et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor. Journal of Biomedical Optics. 12 (1), 01400-01408 (2007).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), 2720 (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Máčajová, M., Čavarga, I., Sýkorová, M., Valachovič, M., Novotná, V., Bilčík, B. Modulation of angiogenesis by topical application of leptin and high and low molecular heparin using the Japanese quail chorioallantoic membrane model. Saudi Journal of Biological Sciences. 27 (6), 1488-1493 (2020).
- Mangir, N., Dikici, S., Claeyssens, F., MacNeil, S. Using Ex Ovo chick chorioallantoic membrane (CAM) assay to evaluate the biocompatibility and angiogenic response to biomaterials. ACS Biomaterials Science Engineering. 5 (7), 3190-3200 (2019).
- Marshall, K. M., Kanczler, J. M., Oreffo, R. O. C. Evolving applications of the egg: chorioallantoic membrane assay and ex vivo organotypic culture of materials for bone tissue engineering. Journal of Tissue Engineering. 11, 1-25 (2020).
- Merlos Rodrigo, M. A., et al. Extending the applicability of in ovo and ex ovo chicken chorioallantoic membrane assays to study cytostatic activity in neuroblastoma cells. Frontiers in Oncology. 11, 1-10 (2021).
- Meta, M., Kundeková, B., Bilčík, B., Máčajová, M. The effect of silicone ring application on CAM vasculature in Japanese Quail (Coturnix japonica). Proceedings of the Student Scientific Conference Faculty of Natural Sciences of Comenius University, Bratislava, Slovakia. , 385-390 (2019).
- Kohli, N., et al. Pre-screening the intrinsic angiogenic capacity of biomaterials in an optimised ex ovo chorioallantoic membrane model. Journal of Tissue Engineering. 11, 1-15 (2020).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic membrane models of various avian species differences and applications. Biology-Basel. 10 (4), 301 (2021).
- Parsons-Wingerter, P., Elliott, K. E., Clark, J. I., Farr, A. G. Fibroblast growth factor-2 selectively stimulates angiogenesis of small vessels in arterial tree. Arteriosclerosis, Thrombosis and Vascular Biology. 20 (5), 1250-1256 (2000).
- Buzzá, H. H., Zangirolami, A. C., Davis, A., Gómez-García, P. B., Kurachi, C. Fluorescence analysis of a tumor model in the chorioallantoic membrane used for the evaluation of different photosensitizers for photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 19, 78-83 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。