Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bıldırcın Korioallantoik Membran - Fotodinamik Tanı ve Tedavi için Bir Araç
Bu Makalede
Özet
Kuş embriyosunun koryoallantoik membranı (CAM), çeşitli araştırma alanları için çok yararlı ve uygulanabilir bir araçtır. Japon bıldırcın CAM'in özel bir ex ovo modeli, fotodinamik tedavi araştırması için uygundur.
Özet
Bir kuş embriyosunun koryoalantoik zarı (CAM), birincil solunum organı olarak işlev gören ince, ekstraembriyonik bir zardır. Özellikleri, anjiyogenez, tümör büyümesi, ilaç dağıtım sistemleri veya fotodinamik tanı (PDD) ve fotodinamik tedaviyi (PDT) incelemek için mükemmel bir in vivo deneysel model olmasını sağlar. Aynı zamanda, bu model deney hayvanlarının uygun bir alternatifle değiştirilmesi gerekliliğini de ele almaktadır. Ex ovo ekili embriyo, kolay madde uygulaması, erişimi, izleme ve dokümantasyon sağlar. En sık kullanılan civciv CAM'dir; ancak, bu makalede, Japon bıldırcın CAM'in düşük maliyetli ve yüksek verimli bir model olarak avantajları açıklanmaktadır. Diğer bir avantaj, daha yüksek deneysel ciroya izin veren daha kısa embriyonik gelişmedir. Bıldırcın TAT'ının kanser ve mikrobiyal enfeksiyonların PDD ve PDT'sine uygunluğu burada araştırılmıştır. Örnek olarak, fotosensitizör hiperisinin lipoproteinler veya nanopartiküller ile kombinasyon halinde bir dağıtım sistemi olarak kullanımı açıklanmaktadır. Beyaz ışıktaki görüntülerden kaynaklanan hasar skoru ve mor ışık altında (405 nm) CAM dokusunun floresan yoğunluğundaki değişiklikler, histolojik kesitlerin analizi ile birlikte belirlendi. Bıldırcın TAT PDT'nin vaskülatür ve doku üzerindeki etkisini açıkça göstermiştir. Ayrıca, kılcal kanama, tromboz, küçük damarların lizisi ve daha büyük damarların kanaması gibi değişiklikler gözlenebilir. Japon bıldırcın TAT fotodinamik tanı ve tedavi araştırmaları için umut verici bir in vivo modeldir ve tümör anjiyogenezinin yanı sıra antivasküler ve antimikrobiyal tedavi çalışmalarında da uygulamalar vardır.
Giriş
Tavuk koryoalantoik membran (CAM) modeli iyi bilinmektedir ve çeşitli araştırma alanlarında yaygın olarak kullanılmaktadır. Gaz değişimi ve mineral taşınımı sağlayan zengin vaskülarize ekstraembriyonik bir organdır1. Bu zarın şeffaflığı ve erişilebilirliği nedeniyle, bireysel kan damarları ve yapısal değişiklikleri gerçek zamanlı olarak gözlemlenebilir2. Avantajlarına rağmen, civciv CAM'ın diğer kuş türlerini kullanarak önlenebilecek bazı sınırlamaları (örneğin, daha büyük üreme tesisleri, yumurta üretimi ve yem tüketimi) vardır. Bu protokolde, Japon bıldırcın (Coturnix japonica) embriyosunu kullanan alternatif bir ex ovo CAM modeli tanımlanmıştır. Küçük boyutu nedeniyle, tavuk CAM'den çok daha fazla sayıda deneysel bireyin kullanılmasına izin verir. Ayrıca, bıldırcın embriyolarının 16 günlük embriyonik gelişiminin daha kısa olması başka bir avantajdır. Bıldırcın CAM üzerindeki ilk büyük damarlar embriyonik günde (ED) 7'de ortaya çıkar. Bu doğrudan civciv embriyo gelişimi ile karşılaştırılabilir (aşama 4-35); Bununla birlikte, gelişimin sonraki aşamaları artık karşılaştırılabilir değildir ve bıldırcın embriyosu3 için daha az zaman gerektirir. İlgi çekici olan, tavuk CAM'lerinin 4,5,6'sına benzer mikrovasküler dallanmanın düzenli olarak ortaya çıkmasıdır. Hızlı cinsel olgunlaşma, yüksek yumurta üretimi ve düşük maliyetli üreme, bu deneysel modelin kullanımını destekleyen diğer örneklerdir7.
Bir kuş CAM modeli genellikle fotodinamik terapi (PDT) çalışmalarında kullanılır8. PDT, çeşitli kanser türlerini (küçük lokalize tümörler) ve diğer onkolojik olmayan hastalıkları tedavi etmek için kullanılır. İlkesi, bir floresan ilacın, bir fotosensitizörün (PS) hasarlı dokuya verilmesi ve uygun dalga boyundaki ışıkla aktivasyonudur. Araştırmada kullanılan prospektif PS, başlangıçta tıbbi bitki St. John's wort'tan (Hypericum perforatum) izole edilen hiperisindir9. Bu bileşiğin güçlü ışığa duyarlı etkileri, fotokimyasal ve fotofiziksel özelliklerine dayanmaktadır. Bunlar, yaklaşık 600 nm'de floresan emisyonunu indükleyen 400-600 nm aralığında çoklu floresan uyarma zirveleri ile karakterize edilir. Spektral bant içindeki hiperisin absorpsiyon maksimumu 540-590 nm aralığındadır ve floresan maksimumu 590-640 nm aralığında9'dur. Bu ışığa duyarlı etkileri elde etmek için, hiperisin, yerel uygulamadan sonra 405 nm dalga boyunda lazer ışığı tarafından uyarılır10. Işık varlığında, hiperisin virücidal, antiproliferatif ve sitotoksik etkiler gösterebilir11, sistemik toksisite yoktur ve organizmadan hızla salınır. Hiperisin, suda çözünmeyen, floresan olmayan agregalar oluşturan lipofilik bir maddedir, bu nedenle polimerik nanopartiküller 12,13 veya yüksek ve düşük yoğunluklu lipoproteinler (HDL, LDL) 14,15 gibi çeşitli nanotaşıyıcı tipleri, hücrelere verilmesine ve nüfuz etmesine yardımcı olmak için kullanılır. TAT doğal olarak immün yetmezlikli bir sistem olduğundan, tümör hücreleri doğrudan membran yüzeyine implante edilebilir. Model ayrıca, PDT'ye bağlı vasküler hasarın derecesini tanımlanmış bir skor 16,17'ye göre kaydetmek için de çok uygundur. Fotodinamik tanı (PDD) için PDT'ye kıyasla daha düşük yoğunluklu ışık kullanılabilir. Menekşe uyarım LED ışığı altında dokunun izlenmesi aynı zamanda fotosensitizörlerin fotoaktivasyonuna yol açar18,19,20 Bu da floresan ışık emisyonuna neden olur, ancak bir PDT reaksiyonu başlatmak ve hücrelere zarar vermek için yeterli enerji sağlamaz. Tümör görselleştirme ve kullanılmış PSs14,15'in farmakokinetiğini teşhis etmek veya izlemek için iyi bir araçtır.
Bu makalede, bıldırcın ex ovo CAM testinin% 80'in üzerinde hayatta kalma oranları ile hazırlanması anlatılmaktadır. Bu ex ovo kültürü çok sayıda deneyde başarıyla uygulanmıştır.
Protokol
Araştırma kurumsal kılavuzlara uygun olarak gerçekleştirilmiştir. Tüm ekipman ve reaktifler otoklavlanmalı veya %70 etanol veya UV ışığı ile sterilize edilmelidir.
1. Yumurta inkübasyonu
- Döllenmiş bıldırcın yumurtalarını kuluçkaya başlamadan önce en fazla 4-5 gün boyunca 10-15 ° C'de saklayın. Sadece temiz ve hasarsız yumurtalar kullanın.
- Yumurtaları ~ 53-54 saat boyunca zorla çekilen bir inkübatörde inkübe edin. Yumurtaları, yumurta dönüşü kapalıyken,% 50-60 nem ve 37.5 ° C kuluçka sıcaklığında yatay olarak yerleştirin.
2. Ex ovo kültür hazırlığı
NOT: İlk inkübasyondan sonra, yumurtalar ex ovo yetiştiriciliğine başlamak için uygundur.
- Yumurta yüzeyini, yumurtayı döndürmeden% 70 etanol ile dezenfekte edin.
- Steril laminer akışlı bir kabinde, yumurta kabuğunu küçük steril cerrahi makas kullanarak açın ve içeriği 6 delikli bir kültür plakasına aktarın. Düzgün bir şekilde yapılırsa, embriyo hasarsız bir yumurta sarısının üzerine uzanacaktır. Her yumurtadan sonra, makasları% 70 etanol ile dezenfekte edin.
- 6 delikli plakadaki boşluklara yaklaşık 5 mL steril su ekleyin, çünkü CAM'ın kurumasını önlemek için nem gereklidir.
- Embriyoları daha sonraki deneylere kadar bir inkübatöre yerleştirin, 37 ° C sıcaklık ve% 80 -% 90 nem oranını koruyun.
- CAM tamamen geliştirildiğinde (ED7'den), küçük kılcal damarlar boyunca CAM yüzeyine sterilize edilmiş bir silikon halka (6 mm çapında ve yaklaşık 1,5 mm kalınlığında) yerleştirin. Halkayı yerleştirirken büyük kan damarlarından kaçının.
NOT: Halka, çalışma alanını tanımlar, madde uygulama yerinin işaretlenmesine yardımcı olur ve sıvı içeriğinin dışarı sızmasını önler. - Embriyoların yetiştiriciliğini ülkenin mevzuatına göre sonlandırın.
- Daha da önemlisi, eldiven giyin veya çalışma sırasında ellerinizi %70 etanol ile dezenfekte edin. Yanlış uçlanmış embriyoları veya döllenmemiş yumurtaları bir vakum aspiratörü ile aspire edin.
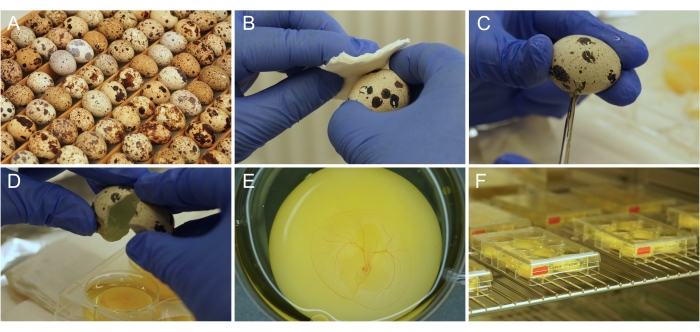
Resim 1: Ex ovo kültür hazırlığı. (A) Japon bıldırcın yumurtası depolandığı ve kuluçkaya yatırıldığı şekliyle. (B) Etanol ile yumurta yüzeyinin dezenfeksiyonu. (C) Yumurta kabuğu makasla kesilir. (D) Yumurtanın içeriği kuyuya boşaltılır. (E) TAT vaskülatürü gelişen, uygun şekilde hazırlanmış 3 günlük embriyo. (F) Bir inkübatörde saklanan kültür plakaları. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
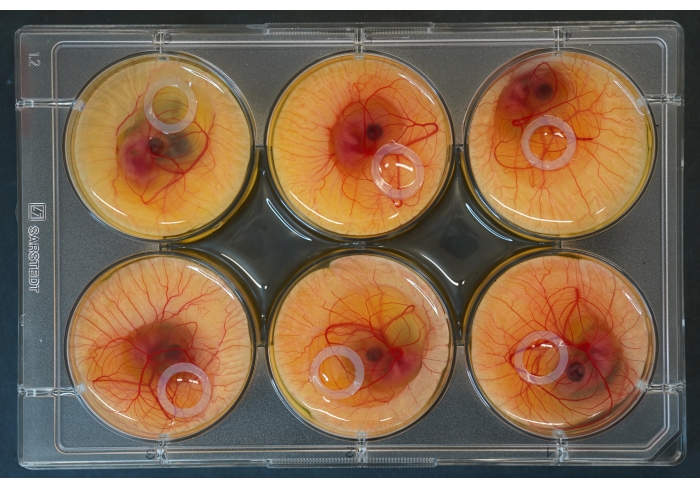
Şekil 2: Üstüne embriyolar ve silikon halkalar yerleştirilmiş 6 delikli kültür plakası. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Tümör hücrelerinin aşılanması
NOT: Tüm prosedürler steril laminer akış kabininin kullanılmasını gerektirir.
- İlgili kültür protokollerine göre şişelerdeki farklı yapışkan hücre tiplerini kültürleyin.
- Eski ortamı şişelerden çıkarın ve ortamın izlerini gidermek için hücre tabakasını steril fosfat tamponlu salin (PBS) ile durulayın.
- Tripsinizasyondan sonra, kültür ortamını ekleyerek tripsini inhibe edin ve hücreleri santrifüj tüplerine toplayın. Hücreleri santrifüj edin ve hücre peletini taze bir kültür ortamında yeniden askıya alın. Hücreleri sayın ve istenen konsantrasyonda bir hücre kültürü ortamında yeniden askıya alın.
NOT: 3B hücre kültürleri, yani örneğin asılı bırakma yöntemi21'i kullanarak sferoidler üretmek de mümkündür.
- 1 x 10 5-1 x 106 tümör hücresi veya5-15 sferoid (CAM başına) 30 μL hücre orta çözeltisi içinde CAM'ın üstündeki silikon halkaya implante edin.
NOT: Hacim, kullanılan silikon halkanın boyutuna bağlıdır. Daha büyük çaplı bir silikon halka kullanılıyorsa, tüm alanı kaplamak için daha büyük bir hacme ihtiyaç vardır. Hücre tipine bağlı olarak veya farklı deney türleri için çeşitli hücre konsantrasyonları kullanılabilir. Bazen, gömülü hücrelerin yapışmasını iyileştirmek için CAM'ın ince kazınması kullanılır. - Aşılanmış hücrelere sahip CAM'leri inkübatöre geri döndürün (37 °C ve% 80 -% 90 nem).

Şekil 3: TAT tümörlerinin aşılanması . (A) Sferoidlerin pipetle aspirasyonu ve (B) TAT yüzeyine implantasyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Fotosensitizör uygulaması
- Hiperisin uygulaması
- Loş aydınlatma altında,% 100 dimetil sülfoksit (DMSO) içinde çözerek 2 mM'lik bir hiperisin stok çözeltisi hazırlayın. Steril PBS veya tuzlu su çözeltisi ile deneyden kısa bir süre önce 79 μM çalışan bir hiperisin çözeltisi hazırlayın. Tüm çözeltilerdeki DMSO'nun nihai konsantrasyonunun her zaman% 0.2'nin altında olduğundan emin olun, bu da embriyonun gelişimini etkilemez.
- Steril koşullar altında, silikon halkaya uygun miktarda hiperisin çözeltisi uygulayın. 6 mm çapında bir halkayı doldurmak için 30 μL'lik bir hacim yeterlidir.
- Embriyoları bir inkübatörde 37 ° C'de ve% 80 -% 90 nemde tutun. Sulu bir çözeltideki hiperisin, dokudaki monomerizasyonundan sonra, CAM üzerine uygulanmasından yaklaşık 3 saat sonra fotoaktiftir.
- Hiperisinin LDL, HDL veya nanopartiküllerle taşıma sistemleri olarak uygulanması
NOT: Bu taşıma sistemleri, hiperisinin hücrelere ve hücre yapılarına nüfuzunu artırmak için kullanılır.- Fotosensitivite nedeniyle, çözeltilerin hazırlanması da dahil olmak üzere tüm adımları loş ışıkta gerçekleştirin ve çözümleri karanlıkta saklayın.
- PBS'de referans15'e göre uygun hacimlerde lipoproteinler ve hiperisin stok çözeltileri karıştırarak hiperisin-LDL ve hiperisin-HDL formülasyonlarını hazırlayın. LDL veya HDL'nin hiperisin konsantrasyonu 20: 115'tir.
- Polimer nanopartikülleri,12,13 referanslarına göre canlı katyonik halka açma polimerizasyonu ile sentezleyin. PBS ile polimer nanopartiküllerdeki hiperisin konsantrasyonunu 10 μM 12,13'e ayarlayın.
5. PDD ve PDT
- PDD Yürütme
- Steril koşullar altında, tümör hücreleri olsun veya olmasın, CAM yüzeyine fotosensitizör (hiperisin, hiperisin yüklü polimerik nanopartiküller veya lipoprotein taşıyıcılı hiperisin) uygulayın (ED 7-9).
- CAM'i mor uyarma ışığı (405 nm dalga boyunda özel yapım dairesel LED ışığı) kullanarak aydınlatın ve hiperisin uygulamasından sonra 0, 1, 3, 5, 24 ve 48 saatlik zaman aralıklarında CAM dokusundaki ve tümör hücrelerindeki hiperisin floresansını dijital bir kamera ile kaydedin.
- Araştırma TAT'ın beyaz ışıkta bir görüntüsünü gerektiriyorsa, ışık hiperisinin fotoaktivasyonunu etkilediğinden, hiperisin uygulamasından önce ve deneyin sonunda, doku fiksasyonundan kısa bir süre önce TAT'yi kaydedin.
- Bir görüntü işleme ve analiz programı kullanarak floresan yoğunluğunu değerlendirin (örneğin, ImageJ22).
- RGB görüntü kanallarını ayrı kırmızı, yeşil ve mavi görüntülere bölün. Kırmızı yoğunluklu görüntüyü 8 bit biçiminde analiz edin. Halkanın içindeki alandan kırmızı yoğunluğu değerlendirin ve hiperisin floresansı olarak yaklaştırın. Tüm görüntü profili grafiklerini (ImageJ'nin Profile Plot eklentisini kullanarak) hiperisin uygulamasından sonra farklı zaman aralıklarında elde edin (yani, 0 saatten itibaren, uygulamadan hemen sonra, 48 saate kadar).
- PDT Yürütme
- Hiperisin uygulamasından en az 3 saat sonra PDT'yi gerçekleştirin.
- Lazer ışınının silikon halka içindeki tüm alanı kaplaması için optik fiberi CAM yüzeyinin üzerine yerleştirin.
- 405 nm lazer ışığı ile 285 mW/cm2 fluence hızında in vivo ışınlama (1-2 dakika) gerçekleştirin.
- Fotodinamik işlemden önce ve sonra (24 saat ve 48 saat) beyaz ışık ve 405 nm floresan ışık kullanarak CAM kaydedin.
- Beyaz ışıkta çekilen görüntülerden PDT'den 24 saat ve 48 saat sonra fotohasarı tespit edin. Vasküler hasarı yarı kantitatif bir skorla değerlendirin16: 1 - yıkım yok; 2 - orta veya daha büyük (çap ≤50 μm) ve daha küçük damarların (çap 10-50 μm) tahrip olmadan kılcal damarların (çap ≥10 μm) kısmi olarak kapatılması; 3 - kılcal damarların kaybolmasıyla daha küçük damarların kısmen kapanması; 4 - Daha küçük damarlar ve kılcal damarların kaybolması ile daha büyük damarların kısmen kapanması; ve 5 - damarların çoğunun kaybolduğu toplam fototromboz.

Şekil 4: TAT lazer ışığı ile tedavisi. Bu resim örnek amaçlı çekilmiştir. PDD veya PDT için oda karanlık olmalıdır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. TAT'ın daha ileri değerlendirme için hazırlanması
- Parafin gömme
- CAM dokusunu PBS'de% 4 paraformaldehit (PFA) içeren bir yetiştirme plakasına en az 2 saat ve maksimum bir gece boyunca sabitleyin.
- PFA'yı çıkarın ve CAM'den silikon halka içindeki dokunun bir kısmını dikkatlice kesin.
- Artan alkol serisindeki TAT dokusunu derhal aşağıdaki gibi dehidre edin. CAM dokusunu 3 dakika boyunca% 70 etanol, 2 dakika boyunca eozin çözeltisi (dokunun parafin bloğunda daha kolay yer alması için), 3 x 5 dakika için% 96 etanol (her zaman yeni bir Petri kabında) ve 5 dakika boyunca% 100 etanol ve 2 x 10 dakika boyunca ksilen içine yerleştirin.
- Spatula veya ince bir fırça kullanarak, numuneleri Petri kaplarındaki çözünmüş parafinlere (59 ° C) mümkün olduğunca çabuk aktarın. 24 saat sonra, dokuyu histolojik kalıba yerleştirin, parafin gömme ortamıyla doldurun ve buzdolabında katılaşmasına izin verin. Katılaştırılmış CAM'i gömme ortamından kesin, tepsiye 90° çevirin, gömme ortamıyla tekrar doldurun ve katılaşmasını bekleyin.
- PDT'ye bağlı hasarı belirlemek için histopatolojik analiz için mikrotom üzerinde 5-10 μm kesitler hazırlayın.
- Histoloji için dondurulmuş CAM bölümlerinin hazırlanması
NOT: Histoloji dahil bazı metodolojiler için kriyostat mikrotomu üzerine hazırlanan dondurulmuş kesitler daha uygundur. Dondurulmuş CAM bölümlerini hazırlamak için aşağıdaki adımları izleyin.- Doğal veya% 4 paraformaldehit sabit CAM'i cam kızağa dikkatlice monte edin.
- Gömme kalıbını optimum kesme sıcaklığı bileşiği (OCT) ile yarıya kadar doldurun ve sıvı azot veya kuru buz ve etanol karışımında dondurun.
- Dondurulduktan sonra, CAM'ı dikkatlice eğin ve cam kaydırağından donmuş OCT ortamının üstüne kaydırın. Tekrar kalıba yerleştirin, OCT ortamı ile örtün ve Adım 6.2.2'deki gibi dondurun.
- Bıldırcın CAM'ın fraktal analizi
NOT: PDT'nin neden olduğu vaskülatür değişiklikleri, fraktal boyut katsayısı19 hesaplanarak değerlendirilebilir.- Laminer akış kabininde, PBS'de% 4 paraformaldehit ve% 2 glutaraldehit önceden ısıtılmış (37 ° C) fiksasyon çözeltisi ile bir yetiştirme plakasında taşma CAM.
- Fiksasyon çözeltisini 48 saat sonra çıkarın. CAM'ı embriyodan mikro makas ve ince bir fırça ile dikkatlice ayırın ve PBS'de yıkayın.
- Yıkanmış CAM'i bir cam slayta monte edin ve yavaşça kurumasını bekleyin.
- Homojen beyaz ışık kaynağı olarak bir dijital kamera ve bir transilluminator kullanarak slaytın fotoğrafını çekin.
- ImageJ yazılımını kullanarak dijital görüntüleri işleyin22. Analiz için, distal arteriyel dalları olan alandan kare bir bölge (512 × 512 piksel) seçin. Görüntüleri binarize edin ve iskeletleştirin ve referans31'de açıklanan prosedürleri izleyerek fraktal boyut katsayısını (Df) hesaplayın.
- TAT dokusunun moleküler analizi
- Moleküler analiz için, doğal CAM'i dikkatlice ayırın, sıvı azotta dondurun ve -80 ° C'de saklayın.
- RNA izolasyonu23, cDNA'ya ters transkripsiyon ve kantitatif PCR24 için standart protokollere göre gen ekspresyonunu belirleyin.
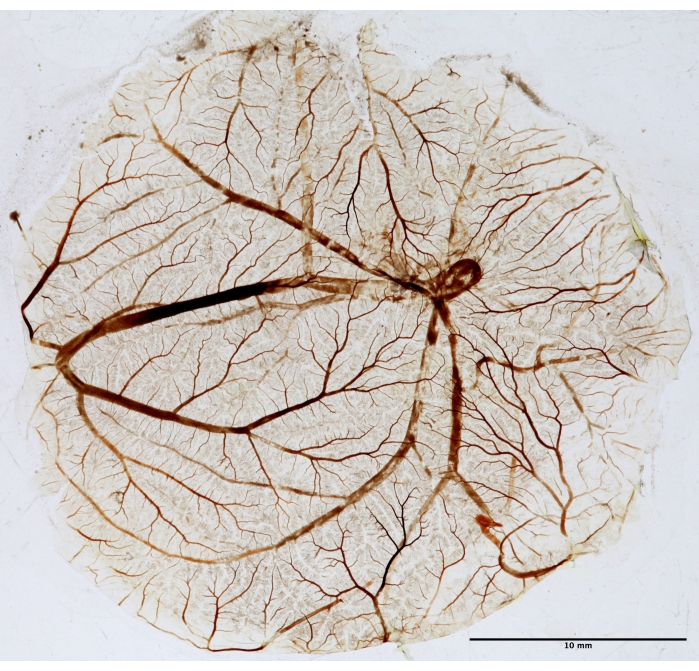
Şekil 5: Fraktal analiz için TAT dokusu. PDT'den sonra, CAM sabitlenir, bir slayta monte edilir ve fraktal analiz için kurutulur. Resim bir transilluminator kullanılarak beyaz ışıkta çekildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Tümörün TAT yüzeyindeki lokalizasyonu beyaz ışıkta zordur. PDD'de kullanılan fotosensitizörün (burada, hiperisin) tümör tarafından seçici olarak alınması beklenir, ve tümörün görselleştirilmesine yardımcı olur. Hiperisin ilavesi ve floresan ışık kullanımı (örneğin, 405 nm) tümörün (skuamöz hücreli karsinom TE1) pozisyonunu çok iyi göstermiştir (Şekil 6A). Histolojik analiz, sağlıklı dokuları istila eden hayati tümör hücrelerini gösterdi. Genelli...
Tartışmalar
Başarılı ex ovo yetiştiriciliği için, yukarıdaki protokolü takip etmek önemlidir. Ayrıca, yumurtalar yeterince dikkatli açılmazsa veya ekim sırasında yetersiz nem varsa, yumurta sarısı çuvalı kabuğa yapışır ve sıklıkla yırtılır. Yaklaşık 60 saatlik yumurta inkübasyonu sırasında bir ex ovo yetiştiriciliğinin başlaması, embriyoların yüksek hayatta kalma oranını sağlar, çünkü bunlar zaten kullanımdan kurtulacak kadar büyüktür. Daha sonraki gelişim aşamalar?...
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Çalışma VEGA 2/0042/21 ve APVV 20-0129 tarafından desteklenmiştir. V. Huntošová'nın katkısı, proje uygulamasının sonucudur: Tıpta modern disiplinlerarası araştırmalar için açık bilimsel topluluk (Kısaltma: OPENMED), ITMS2014+: 313011V455, ERDF tarafından finanse edilen Operasyonel Program Entegre Altyapısı tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 6-Well Cell Culture Plate | Sarstedt | 83.392 | Transparent polystyrene, sterile |
| CO2 Incubator ESCO CCL-0508 | ESCO, Singapore | CCL-050B-8 | CO2 cell culture incubator |
| cryocut Leica CM 1800 | Reichert-Jung, USA | ||
| digital camera Canon EOS 6D II | Canon, Japan | ||
| diode laser 405 nm | Ocean Optics, USA | ||
| DMSO | Sigma-Aldrich | 67-68-5 | dimethyl sulfoxid |
| eosin | Sigma-Aldrich | 15086-94-9 | |
| ethanol | Sigma-Aldrich | 64-17-5 | |
| fine brush size 2 | Faber-Castell | 281802 | brush for CAM separation and manipulation |
| glutaraldehyde | Sigma-Aldrich | 111-30-8 | |
| hematoxylin | Sigma-Aldrich | 517-28-2 | |
| hypericin | Sigma-Aldrich | 84082-80-4 | |
| incubator Bios Midi | Bios Sedl any, Czech Republic any, Czech Republic | Forced draught incubator for initial incubation | |
| incubator Memmert IF160 | Memmert, Germany | Forced air circulation incubator for CAM incubation | |
| Kaiser slimlite plano, LED light box | Kaiser, Germany | 2453 | Transilluminator |
| LED light 405 nm | custom made circular LED light | ||
| macro lens Canon MP- E 65 mm f/2.8 | Canon, Japan | ||
| microscope Kapa 2000 | Kvant, Slovakia | optical microscope | |
| microtome Auxilab 508 | Auxilab, Spain | manual rotary microtome | |
| paraformaldehyde | Sigma-Aldrich | 30525-89-4 | |
| Paraplast Plus | Sigma-Aldrich | P3683 | parafin medium for tissue embedding |
| PBS | Sigma-Aldrich | P4417 | Phosphate saline buffer |
| scissors Castroviejo | Orimed | OR66-108 | micro scissors for CAM separation |
| software ImageJ 1.53 | public domain | image processing and analysis program | |
| stock solution HDL | Sigma-Aldrich | 437641-10MG | high density lipoproteins |
| stock solution LDL | Sigma-Aldrich | 437644-10MG | low density lipoproteins |
| Tissue-Tek O.C.T. Compound | Sakura Finetek | 4583 | Optimal Cutting Temperature Compound 118 mL squeeze bottles |
Referanslar
- Nowak-Sliwinska, P., van Beijnum, J. R., van Berkel, M., vanden Bergh, H., Griffioen, A. W. Vascular regrowth following photodynamic therapy in the chicken embryo chorioallantoic membrane. Angiogenesis. 13 (4), 281-292 (2010).
- van Leengoed, H. L. L. M., vander Veen, N., Versteeg, A. A. C., Ouellet, R., van Lier, J. E., Star, W. M. In-vivo photodynamic effects of phthalocyanines in a skin-fold observation chamber model: role of central metal ion and degree of sulfonation. Photochemistry Photobiology. 58 (4), 575-580 (1993).
- Ainsworth, S. J., Stanley, R. L., Evans, D. J. R. Developmental stages of the Japanese quail. Journal of Anatomy. 216 (1), 3 (2010).
- De Fouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the microcirculation in the chick chorioallantoic membrane during normal angiogenesis. Microvascular Research. 38 (2), 136-147 (1989).
- Sandau, K., Kurz, H. Modelling of vascular growth processes: a stochastic biophysical approach to embryonic angiogenesis. Journal of Microscopy. 175 (3), 205-213 (1994).
- Kurz, H., Ambrosy, S., Wilting, J., Marmé, D., Christ, B. Proliferation pattern of capillary endothelial cells in chorioallantoic membrane development indicates local growth control, which is counteracted by vascular endothelial growth factor application. Developmental Dynamics. 203 (2), 174-186 (1995).
- Huss, D., Poynter, G., Lansford, R. Japanese quail (Coturnix japonica) as laboratory animal model. Lab Animal. 37 (11), 513-519 (2008).
- Gottfried, V., Lindenbaum, E. S., Kimel, S. The chick chorioallantoic membrane (CAM) as an in-vivo model for photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 12 (2), 204-207 (1992).
- Miškovský, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological molecules. Current Drug Targets. 3 (1), 55-84 (2002).
- Čavarga, I., et al. Photodynamic effect of hypericin after topical application in the ex ovo quail chorioallantoic membrane model. Planta Medica. 80 (1), 56-62 (2014).
- Martinez-Poveda, B., Quesada, A. R., Medina, M. A. Hypericin in the dark inhibits key steps of angiogenesis in vitro. Europan Journal of Pharmacology. 516 (2), 97-103 (2005).
- Datta, S., et al. Unravelling the excellent chemical stability and bioavailability of solvent responsive curcumin-loaded 2-ethyl-2-oxazoline-grad-2-(4-dodecyloxyphenyl)- 2-oxazoline copolymer nanoparticles for drug delivery. Biomacromolecules. 19 (7), 2459-2471 (2018).
- Huntošová, V., et al. Alkyl Chain length in poly(2-oxazoline)-based amphiphilic gradient copolymers regulates the delivery of hydrophobic molecules: a case of the biodistribution and the photodynamic activity of the photosensitizer hypericin. Biomacromolecules. 22 (10), 4199-4216 (2021).
- Buríková, M., et al. Hypericin fluorescence kinetics in the presence of low density lipoproteins: study on quail CAM assay for topical delivery. General Physiology and Biophysic. 35 (4), 459-468 (2016).
- Lenkavska, L., et al. Benefits of hypericin transport and delivery by low- and high-density lipoproteins to cancer cells: From in vitro to ex ovo. Photodiagnosis and Photodynamic Therapy. 25, 214-224 (2019).
- Rück, A., Böhmler, A., Steiner, R. PDT with TOOKAD studied in the chorioallantoic membrane of fertilized eggs. Photodiagnosis and Photodynamic Therapy. 2 (1), 79-90 (2005).
- Gottfried, V., Davidi, R., Averbuj, C., Kimel, S. In vivo damage to chorioallantoic membrane blood vessels by porphycene-induced photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 30 (2-3), 115-121 (1995).
- Buzzá, H. H., Silva, L. V., Moriyama, L. T., Bagnato, V. S., Kurachi, C. Evaluation of vascular effect of Photodynamic Therapy in chorioallantoic membrane using different photosensitizers. Journal of Photochemistry and Photobiology B: Biology. 138, 1-7 (2014).
- Dougherty, T. J., et al. Photodynamic therapy. Journal of the National Cancer Institute. 90, 889-905 (1998).
- Xiang, L., et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor. Journal of Biomedical Optics. 12 (1), 01400-01408 (2007).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), 2720 (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Máčajová, M., Čavarga, I., Sýkorová, M., Valachovič, M., Novotná, V., Bilčík, B. Modulation of angiogenesis by topical application of leptin and high and low molecular heparin using the Japanese quail chorioallantoic membrane model. Saudi Journal of Biological Sciences. 27 (6), 1488-1493 (2020).
- Mangir, N., Dikici, S., Claeyssens, F., MacNeil, S. Using Ex Ovo chick chorioallantoic membrane (CAM) assay to evaluate the biocompatibility and angiogenic response to biomaterials. ACS Biomaterials Science Engineering. 5 (7), 3190-3200 (2019).
- Marshall, K. M., Kanczler, J. M., Oreffo, R. O. C. Evolving applications of the egg: chorioallantoic membrane assay and ex vivo organotypic culture of materials for bone tissue engineering. Journal of Tissue Engineering. 11, 1-25 (2020).
- Merlos Rodrigo, M. A., et al. Extending the applicability of in ovo and ex ovo chicken chorioallantoic membrane assays to study cytostatic activity in neuroblastoma cells. Frontiers in Oncology. 11, 1-10 (2021).
- Meta, M., Kundeková, B., Bilčík, B., Máčajová, M. The effect of silicone ring application on CAM vasculature in Japanese Quail (Coturnix japonica). Proceedings of the Student Scientific Conference Faculty of Natural Sciences of Comenius University, Bratislava, Slovakia. , 385-390 (2019).
- Kohli, N., et al. Pre-screening the intrinsic angiogenic capacity of biomaterials in an optimised ex ovo chorioallantoic membrane model. Journal of Tissue Engineering. 11, 1-15 (2020).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic membrane models of various avian species differences and applications. Biology-Basel. 10 (4), 301 (2021).
- Parsons-Wingerter, P., Elliott, K. E., Clark, J. I., Farr, A. G. Fibroblast growth factor-2 selectively stimulates angiogenesis of small vessels in arterial tree. Arteriosclerosis, Thrombosis and Vascular Biology. 20 (5), 1250-1256 (2000).
- Buzzá, H. H., Zangirolami, A. C., Davis, A., Gómez-García, P. B., Kurachi, C. Fluorescence analysis of a tumor model in the chorioallantoic membrane used for the evaluation of different photosensitizers for photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 19, 78-83 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır