Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Membrane chorio-allantoïdienne de caille - Un outil pour le diagnostic photodynamique et la thérapie
Dans cet article
Résumé
La membrane chorio-allantoïdienne (CAM) de l’embryon aviaire est un outil très utile et applicable pour divers domaines de recherche. Un modèle ex ovo spécial de CAM de caille japonaise convient à l’investigation de traitement photodynamique.
Résumé
La membrane chorio-allantoïdienne (CAM) d’un embryon aviaire est une fine membrane extraembryonnaire qui fonctionne comme un organe respiratoire primaire. Ses propriétés en font un excellent modèle expérimental in vivo pour étudier l’angiogenèse, la croissance tumorale, les systèmes d’administration de médicaments ou le diagnostic photodynamique (PDD) et la thérapie photodynamique (PDT). Dans le même temps, ce modèle répond à la nécessité de remplacer les animaux de laboratoire par une alternative appropriée. L’embryon cultivé ex ovo permet une application, un accès, une surveillance et une documentation faciles de la substance. Le plus fréquemment utilisé est le poussin CAM; cependant, cet article décrit les avantages de la FAO de caille japonaise en tant que modèle à faible coût et à haut débit. Un autre avantage est le développement embryonnaire plus court, qui permet un renouvellement expérimental plus élevé. La pertinence de la MCP de caille pour le TDP et la TPD du cancer et des infections microbiennes est explorée ici. À titre d’exemple, l’utilisation de l’hypericine photosensibilisatrice en combinaison avec des lipoprotéines ou des nanoparticules comme système d’administration est décrite. Le score de dommages à partir d’images en lumière blanche et de changements dans l’intensité de fluorescence du tissu CAM sous lumière violette (405 nm) a été déterminé, ainsi que l’analyse des coupes histologiques. La CAM de caille a clairement montré l’effet de la PDT sur le système vasculaire et les tissus. De plus, des changements tels qu’une hémorragie capillaire, une thrombose, une lyse de petits vaisseaux et un saignement de vaisseaux plus gros ont pu être observés. La MCP de caille japonaise est un modèle in vivo prometteur pour le diagnostic photodynamique et la recherche thérapeutique, avec des applications dans les études de l’angiogenèse tumorale, ainsi que dans la thérapie antivasculaire et antimicrobienne.
Introduction
Le modèle de membrane chorio-allantoïdienne (CAM) de poulet est bien connu et largement utilisé dans divers domaines de recherche. C’est un organe extraembryonnaire richement vascularisé qui assure les échanges gazeux et le transport des minéraux1. Grâce à la transparence et à l’accessibilité de cette membrane, les vaisseaux sanguins individuels et leurs changements structurels peuvent être observés en temps réel2. Malgré les avantages, la MCP des poussins présente également certaines limites (p. ex., des installations d’élevage plus grandes, la production d’œufs et la consommation d’aliments) qui pourraient être évitées en utilisant d’autres espèces aviaires. Dans ce protocole, un modèle alternatif ex ovo CAM utilisant un embryon de caille japonaise (Coturnix japonica) est décrit. En raison de sa petite taille, il permet l’utilisation d’un nombre beaucoup plus important d’individus expérimentaux que le poulet CAM. De plus, le développement embryonnaire plus court de 16 jours des embryons de caille est un autre avantage. Les premiers vaisseaux plus gros sur la CAM de caille apparaissent le jour embryonnaire (ED) 7. Cela peut être directement comparé au développement de l’embryon de poussin (stades 4-35); Cependant, les stades ultérieurs de développement ne sont plus comparables et nécessitent moins de temps pour l’embryon de caille3. Il est intéressant de noter l’apparition régulière de ramifications microvasculaires similaires à celles des CAM 4,5,6 chez le poulet. La maturation sexuelle rapide, la production élevée d’œufs et l’élevage à faible coût sont d’autres exemples qui favorisent l’utilisation de ce modèle expérimental7.
Un modèle de MCP aviaire est souvent utilisé dans les études de thérapie photodynamique (PDT)8. La PDT est utilisée pour traiter plusieurs formes de cancer (petites tumeurs localisées) et d’autres maladies non oncologiques. Son principe réside dans l’administration d’un médicament fluorescent, un photosensibilisant (PS), au tissu endommagé et son activation avec la lumière de la longueur d’onde appropriée. Un PS potentiel utilisé dans la recherche est l’hypéricine, isolée à l’origine de la plante médicinale millepertuis (Hypericum perforatum)9. Les forts effets photosensibilisants de ce composé sont basés sur ses propriétés photochimiques et photophysiques. Ceux-ci sont caractérisés par de multiples pics d’excitation de fluorescence dans la gamme 400-600 nm, qui induisent l’émission de fluorescence à environ 600 nm. Les maxima d’absorption de l’hypéricine dans la bande spectrale sont dans la gamme 540-590 nm, et les maxima de fluorescence sont dans la gamme 590-640 nm9. Pour obtenir ces effets photosensibilisants, l’hypéricine est excitée par la lumière laser à une longueur d’onde de 405 nm après administration locale10. En présence de lumière, l’hypéricine peut présenter des effets virucides, antiprolifératifs et cytotoxiques11, alors qu’il n’y a pas de toxicité systémique, et elle est rapidement libérée de l’organisme. L’hypéricine est une substance lipophile qui forme des agrégats insolubles dans l’eau et non fluorescents, c’est pourquoi plusieurs types de nanotransporteurs, tels que les nanoparticules polymères 12,13 ou les lipoprotéines de haute et basse densité (HDL, LDL)14,15, sont utilisés pour aider à sa livraison et à sa pénétration dans les cellules. Étant donné que la MCA est un système naturellement immunodéficient, les cellules tumorales peuvent être implantées directement sur la surface de la membrane. Le modèle est également bien adapté pour enregistrer l’étendue des lésions vasculaires induites par la PDT selon un score définide 16,17. Une lumière de plus faible intensité par rapport à la PDT peut être utilisée pour le diagnostic photodynamique (TED). La surveillance du tissu sous excitation violette La lumière LED conduit également à la photoactivation des photosensibilisateurs18,19,20 qui entraîne une émission de lumière fluorescente, mais elle ne fournit pas assez d’énergie pour démarrer une réaction PDT et endommager les cellules. Il en fait un bon outil pour la visualisation et le diagnostic des tumeurs ou la surveillance de la pharmacocinétique des PSs14,15 utilisés.
Cet article décrit la préparation du test CAM ex ovo de caille avec des taux de survie supérieurs à 80%. Cette culture ex ovo a été appliquée avec succès dans un grand nombre d’expériences.
Protocole
La recherche a été réalisée conformément aux lignes directrices institutionnelles. Tout l’équipement et les réactifs doivent être autoclavés ou stérilisés avec de l’éthanol à 70 % ou de la lumière UV.
1. Incubation des œufs
- Conservez les œufs de caille fécondés à 10-15 °C pendant un maximum de 4-5 jours avant de commencer l’incubation. N’utilisez que des œufs propres et intacts.
- Incuber les œufs dans un incubateur à tirage forcé pendant ~ 53-54 h. Pondez les œufs horizontalement avec la rotation des œufs désactivée, à 50%-60% d’humidité et à une température d’incubation de 37,5 °C.
2. Préparation de la culture ex ovo
NOTE: Après l’incubation initiale, les œufs conviennent au démarrage de la culture ex ovo .
- Désinfectez la surface de l’œuf avec de l’éthanol à 70%, sans faire tourner l’œuf.
- Dans une armoire laminaire stérile, ouvrez la coquille d’œuf à l’aide de petits ciseaux chirurgicaux stériles et transférez le contenu dans une plaque de culture à 6 puits. Si cela est fait correctement, l’embryon reposera sur un jaune intact. Après chaque œuf, désinfectez les ciseaux avec de l’éthanol à 70%.
- Ajoutez environ 5 ml d’eau stérile dans les espaces de la plaque à 6 puits, car l’humidité est essentielle pour empêcher le CAM de se dessécher.
- Placez les embryons dans un incubateur jusqu’à de nouvelles expériences, tout en maintenant une température de 37 ° C et 80% à 90% d’humidité.
- Lorsque le CAM est complètement développé (à partir de ED7), placez un anneau en silicone stérilisé (6 mm de diamètre et environ 1,5 mm d’épaisseur) sur la surface du CAM, le long des petits capillaires. Évitez les principaux vaisseaux sanguins lors de la mise en place de l’anneau.
REMARQUE: L’anneau définit l’espace de travail, aide à marquer le lieu d’application de la substance et empêche le contenu liquide de s’échapper. - Mettre fin à la culture des embryons conformément à la législation du pays.
- Il est important de porter des gants ou de garder les mains désinfectées avec de l’éthanol à 70% pendant le travail. Aspirer des embryons mal inclinés ou des ovules non fécondés avec un aspirateur sous vide.
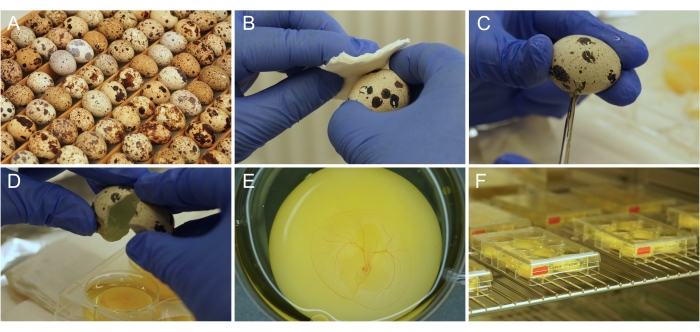
Figure 1 : Préparation de la culture ex ovo. (A) Œufs de caille japonaise tels qu’ils sont entreposés et incubés. (B) Désinfection de la surface des œufs à l’éthanol. (C) La coquille d’œuf est coupée avec des ciseaux. (D) Le contenu de l’œuf est vidé dans le puits. (E) Embryon de 3 jours correctement préparé, avec un système vasculaire CAM en développement. F) Plaques de culture stockées dans un incubateur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
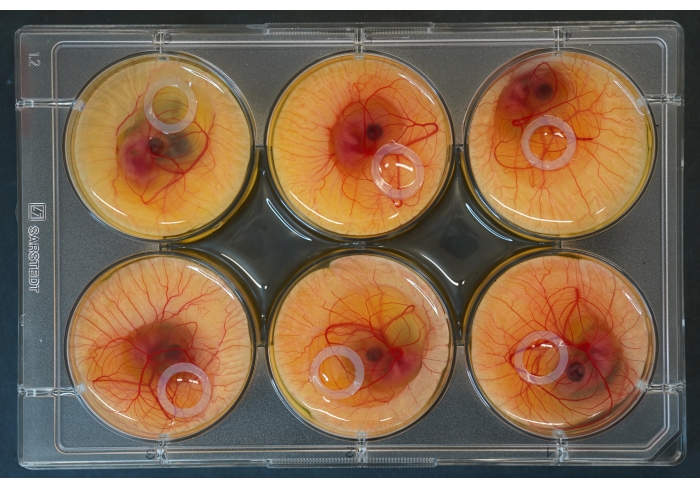
Figure 2 : Plaque de culture à 6 puits avec des embryons et des anneaux en silicone placés sur le dessus. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Inoculation des cellules tumorales
REMARQUE: Toutes les procédures nécessitent l’utilisation d’une armoire à flux laminaire stérile.
- Culture de différents types de cellules adhérentes dans des flacons selon les protocoles de culture respectifs.
- Retirez l’ancien milieu des flacons et rincez la couche cellulaire avec une solution saline tamponnée au phosphate (PBS) stérile pour éliminer les traces du milieu.
- Après trypsinisation, inhiber la trypsine en ajoutant le milieu de culture et récolter les cellules dans des tubes de centrifugation. Centrifuger les cellules et remettre en suspension la pastille cellulaire dans un milieu de culture frais. Compter les cellules et les remettre en suspension dans un milieu de culture cellulaire à la concentration désirée.
NOTE: Il est également possible de produire des cultures cellulaires 3D, c’est-à-dire des sphéroïdes en utilisant, par exemple, la méthode de la goutte suspendue21.
- Implanter 1 x 10 5-1 x 106 cellules tumorales ou5-15 sphéroïdes (par CAM) dans 30 μL de solution de milieu cellulaire dans l’anneau de silicone au-dessus du CAM.
REMARQUE: Le volume dépend de la taille de l’anneau en silicone utilisé. Si un anneau en silicone de plus grand diamètre est utilisé, un volume plus important est nécessaire pour couvrir toute la zone. Selon le type de cellule, ou pour différents types d’expériences, différentes concentrations cellulaires peuvent être utilisées. Parfois, le grattage fin de CAM est utilisé pour améliorer l’adhérence des cellules intégrées. - Remettre les CAM avec les cellules inoculées dans l’incubateur (37 °C et 80%-90% d’humidité).

Figure 3 : Inoculation de la MCP avec des tumeurs. (A) Aspiration de sphéroïdes avec une pipette, et (B) implantation sur la surface CAM. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Application de photosensibilisateur
- Application de l’hypéricine
- Sous un éclairage tamisé, préparer une solution mère d’hypéricine à 2 mM en la dissolvant dans du diméthylsulfoxyde (DMSO) à 100%. Préparer une solution de travail d’hypéricine à 79 μM peu de temps avant l’expérience avec du PBS stérile ou une solution saline. Assurez-vous que la concentration finale de DMSO dans toutes les solutions est toujours inférieure à 0,2%, ce qui n’affecte pas le développement de l’embryon.
- Dans des conditions stériles, appliquer un volume approprié de solution d’hypéricine sur l’anneau de silicone. Un volume de 30 μL est suffisant pour remplir un anneau d’un diamètre de 6 mm.
- Conservez les embryons dans un incubateur à 37 °C et 80 % à 90 % d’humidité. L’hypéricine en solution aqueuse est photoactive après sa monomérisation dans le tissu, environ 3 h après son application sur le CAM.
- Application de l’hypéricine avec LDL, HDL ou nanoparticules comme systèmes de transport
NOTE: Ces systèmes de transport sont utilisés pour améliorer la pénétration de l’hypéricine dans les cellules et les structures cellulaires.- En raison de la photosensibilité, effectuez toutes les étapes, y compris la préparation des solutions, sous un éclairage tamisé et stockez les solutions dans l’obscurité.
- Préparer les formulations d’hypéricine-LDL et d’hypericine-HDL en mélangeant les volumes appropriés de lipoprotéines et de solutions mères d’hypéricine dans du PBS conformément à la référence15. La concentration de LDL ou HDL à l’hypéricine est de 20:115.
- Synthétiser des nanoparticules de polymère par polymérisation à ouverture de cycle cationique vivant selon les références12,13. Ajuster la concentration d’hypéricine dans les nanoparticules polymères avec PBS à 10 μM12,13.
5. PDD et PDT
- Effectuer un PDD
- Dans des conditions stériles, appliquer un photosensibilisant (hypéricine, nanoparticules polymères chargées d’hypéricine ou hypéricine avec transporteur de lipoprotéines) sur la surface CAM, avec ou sans cellules tumorales (ED 7-9).
- Illuminer le CAM à l’aide d’une lumière d’excitation violette (lumière LED circulaire sur mesure de longueur d’onde de 405 nm) et enregistrer la fluorescence de l’hypéricine dans les tissus CAM et les cellules tumorales avec un appareil photo numérique à des intervalles de temps de 0, 1, 3, 5, 24 et 48 h après l’administration d’hypéricine.
- Si la recherche nécessite une image de la MCP en lumière blanche, enregistrer la MCP avant l’administration d’hypéricine et à la fin de l’expérience, peu de temps avant la fixation des tissus, car la lumière affecte la photoactivation de l’hypéricine.
- Évaluer l’intensité de fluorescence à l’aide d’un programme de traitement et d’analyse d’images (p. ex., ImageJ22).
- Divisez les canaux d’image RVB en images rouges, vertes et bleues distinctes. Analysez l’image d’intensité rouge sous forme 8 bits. Évaluez l’intensité rouge de la zone à l’intérieur de l’anneau et approximez-la comme la fluorescence de l’hypéricine. Obtenez des tracés de profil d’image entiers (en utilisant le plugin Profile Plot d’ImageJ) à différents intervalles de temps après l’administration d’hypéricine (c’est-à-dire de 0 h, juste après l’administration, jusqu’à 48 h).
- Effectuer la TPD
- Effectuer la PDT au moins 3 h après l’application de l’hypéricine.
- Placez la fibre optique au-dessus de la surface du CAM pour que le rayon laser couvre toute la zone à l’intérieur de l’anneau en silicone.
- Effectuer une irradiation in vivo (1-2 min) avec une lumière laser de 405 nm à un taux de fluence de 285 mW/cm2.
- Enregistrer la FAO en utilisant la lumière blanche et la lumière fluorescente de 405 nm avant et après le traitement photodynamique (24 h et 48 h).
- Détectez les photodommages 24 h et 48 h après la TPD à partir des images prises en lumière blanche. Évaluer les dommages vasculaires par un score semi-quantitatif16: 1 - pas de destruction; 2 - fermeture partielle des capillaires (diamètre ≤10 μm) sans destruction des vaisseaux moyens ou grands (diamètre ≥50 μm) et plus petits (diamètre 10-50 μm); 3 - fermeture partielle des petits vaisseaux avec des capillaires en train de disparaître; 4 - fermeture partielle des grands navires avec disparition des petits vaisseaux et capillaires; et 5 - photothrombose totale avec la disparition de la plupart des vaisseaux.

Figure 4 : Traitement de la FAO à la lumière laser. Cette photo a été prise à des fins d’illustration. Pour PDD ou PDT, la pièce doit être sombre. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Préparation de la MCP en vue d’une évaluation plus approfondie
- Encastrement de paraffine
- Fixer le tissu CAM dans une plaque de culture avec 4% de paraformaldéhyde (PFA) dans du PBS pendant un minimum de 2 h et un maximum de nuit.
- Retirez le PFA et découpez soigneusement du CAM une partie du tissu à l’intérieur de l’anneau en silicone.
- Déshydrater immédiatement le tissu CAM dans la série d’alcool ascendante comme suit. Placer le tissu CAM dans de l’éthanol à 70% pendant 3 min, une solution d’éosine pendant 2 min (pour faciliter la localisation du tissu dans le bloc de paraffine), de l’éthanol à 96% pendant 3 x 5 min (toujours dans une nouvelle boîte de Pedia), et de l’éthanol à 100% pendant 5 min et du xylène pendant 2 x 10 min.
- À l’aide d’une spatule ou d’une brosse fine, transférer les échantillons le plus rapidement possible dans la paraffine dissoute dans des boîtes de Petri (59 °C). Après 24 h, placez le tissu dans un moule histologique, remplissez-le de milieu d’enrobage de paraffine et laissez-le se solidifier au réfrigérateur. Coupez le CAM solidifié du milieu d’enrobage, retournez-le dans le plateau de 90°, remplissez-le à nouveau avec le milieu d’enrobage et laissez-le se solidifier.
- Préparer des coupes de 5 à 10 μm sur un microtome pour l’analyse histopathologique afin de déterminer les dommages induits par la PDT.
- Préparation des coupes CAM congelées pour l’histologie
NOTE: Pour certaines méthodologies, y compris l’histologie, les coupes congelées préparées sur microtome cryostat sont plus appropriées. Suivez les étapes ci-dessous pour préparer les sections CAM congelées.- Montez soigneusement la FAO native ou fixée au paraformaldéhyde à 4 % sur la lame de verre.
- Remplissez le moule d’encastrement à moitié avec un composé à température de coupe optimale (OCT) et congelez dans de l’azote liquide ou un mélange de glace sèche et d’éthanol.
- Après la congélation, inclinez délicatement et faites glisser le CAM de la lame en verre sur le dessus du milieu OCT congelé. Placer à nouveau dans le moule, couvrir avec un milieu OCT et congeler comme à l’étape 6.2.2.
- Analyse fractale de la CAM de caille
NOTE: Les changements vasculaires causés par la PDT peuvent être évalués en calculant le coefficient de dimension fractale19.- Dans l’armoire à flux laminaire, faire déborder CAM dans une plaque de culture avec une solution de fixation préchauffée (37 °C) de 4% de paraformaldéhyde et 2% de glutaraldéhyde dans du PBS.
- Retirer la solution de fixation après 48 h. Séparez soigneusement le CAM de l’embryon avec des micro-ciseaux et une brosse fine et lavez-le dans PBS.
- Montez le CAM lavé sur une lame de verre et laissez-le sécher lentement.
- Photographiez la diapositive à l’aide d’un appareil photo numérique et d’un transilluminateur comme source de lumière blanche homogène.
- Traiter des images numériques à l’aide du logiciel ImageJ22. Pour l’analyse, sélectionnez une région carrée (512 × 512 pixels) dans la zone avec des branches artérielles distales. Binariser et squelettiser les images et calculer le coefficient de dimension fractale (Df) en suivant les procédures décrites dans la référence31.
- Analyse moléculaire du tissu CAM
- Pour l’analyse moléculaire, séparer soigneusement le CAM natif, congeler dans de l’azote liquide et conserver à -80 °C.
- Déterminer l’expression génique selon les protocoles standard pour l’isolement de l’ARN23, la transcription inverse en ADNc et la PCRquantitative 24.
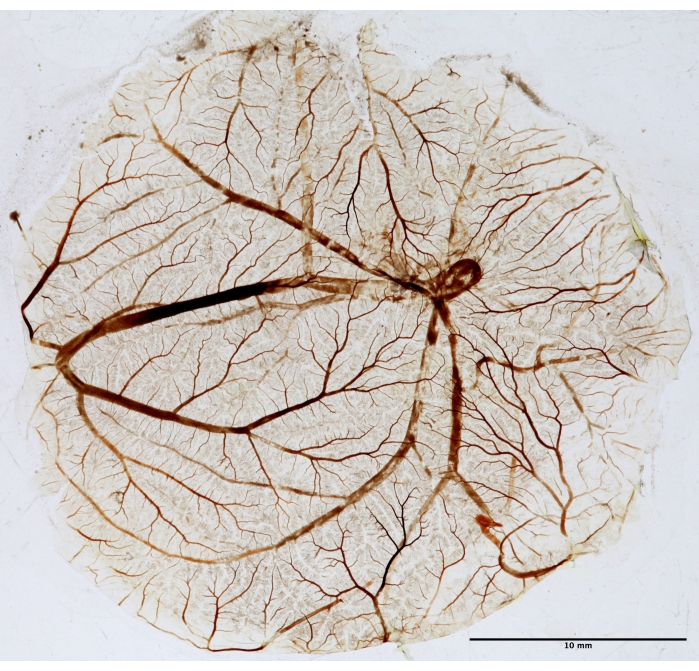
Figure 5 : Tissu CAM pour l’analyse fractale. Après la PDT, la FAO est fixée, montée sur une lame et séchée pour l’analyse fractale. La photo a été prise en lumière blanche à l’aide d’un transilluminateur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
La localisation de la tumeur sur la surface CAM est difficile en lumière blanche. Le photosensibilisateur (ici, l’hypéricine) utilisé dans le PDD devrait être absorbé sélectivement par la tumeur et aide à visualiser la tumeur. L’ajout d’hypéricine et l’utilisation de la lumière fluorescente (par exemple, 405 nm) ont très bien montré la position de la tumeur (carcinome épidermoïde TE1) (Figure 6A). L’analyse histologique a montré que les cellules tumorales vitales enva...
Discussion
Pour une culture ex ovo réussie, il est important de suivre le protocole ci-dessus. De plus, si les œufs ne sont pas ouverts assez soigneusement ou s’il n’y a pas suffisamment d’humidité pendant la culture, le sac de jaune colle à la coquille et se rompt souvent. Le début d’une culture ex ovo au moment d’environ 60 h d’incubation des œufs assure le taux de survie élevé des embryons, car ils sont déjà assez grands pour survivre à la manipulation. Aux stades ultérieurs du développ...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Les travaux ont été soutenus par VEGA 2/0042/21 et APVV 20-0129. La contribution de V. Huntošová est le résultat de la mise en œuvre du projet: Communauté scientifique ouverte pour la recherche interdisciplinaire moderne en médecine (acronyme: OPENMED), ITMS2014+: 313011V455 soutenu par l’infrastructure intégrée du programme opérationnel, financé par le FEDER.
matériels
| Name | Company | Catalog Number | Comments |
| 6-Well Cell Culture Plate | Sarstedt | 83.392 | Transparent polystyrene, sterile |
| CO2 Incubator ESCO CCL-0508 | ESCO, Singapore | CCL-050B-8 | CO2 cell culture incubator |
| cryocut Leica CM 1800 | Reichert-Jung, USA | ||
| digital camera Canon EOS 6D II | Canon, Japan | ||
| diode laser 405 nm | Ocean Optics, USA | ||
| DMSO | Sigma-Aldrich | 67-68-5 | dimethyl sulfoxid |
| eosin | Sigma-Aldrich | 15086-94-9 | |
| ethanol | Sigma-Aldrich | 64-17-5 | |
| fine brush size 2 | Faber-Castell | 281802 | brush for CAM separation and manipulation |
| glutaraldehyde | Sigma-Aldrich | 111-30-8 | |
| hematoxylin | Sigma-Aldrich | 517-28-2 | |
| hypericin | Sigma-Aldrich | 84082-80-4 | |
| incubator Bios Midi | Bios Sedl any, Czech Republic any, Czech Republic | Forced draught incubator for initial incubation | |
| incubator Memmert IF160 | Memmert, Germany | Forced air circulation incubator for CAM incubation | |
| Kaiser slimlite plano, LED light box | Kaiser, Germany | 2453 | Transilluminator |
| LED light 405 nm | custom made circular LED light | ||
| macro lens Canon MP- E 65 mm f/2.8 | Canon, Japan | ||
| microscope Kapa 2000 | Kvant, Slovakia | optical microscope | |
| microtome Auxilab 508 | Auxilab, Spain | manual rotary microtome | |
| paraformaldehyde | Sigma-Aldrich | 30525-89-4 | |
| Paraplast Plus | Sigma-Aldrich | P3683 | parafin medium for tissue embedding |
| PBS | Sigma-Aldrich | P4417 | Phosphate saline buffer |
| scissors Castroviejo | Orimed | OR66-108 | micro scissors for CAM separation |
| software ImageJ 1.53 | public domain | image processing and analysis program | |
| stock solution HDL | Sigma-Aldrich | 437641-10MG | high density lipoproteins |
| stock solution LDL | Sigma-Aldrich | 437644-10MG | low density lipoproteins |
| Tissue-Tek O.C.T. Compound | Sakura Finetek | 4583 | Optimal Cutting Temperature Compound 118 mL squeeze bottles |
Références
- Nowak-Sliwinska, P., van Beijnum, J. R., van Berkel, M., vanden Bergh, H., Griffioen, A. W. Vascular regrowth following photodynamic therapy in the chicken embryo chorioallantoic membrane. Angiogenesis. 13 (4), 281-292 (2010).
- van Leengoed, H. L. L. M., vander Veen, N., Versteeg, A. A. C., Ouellet, R., van Lier, J. E., Star, W. M. In-vivo photodynamic effects of phthalocyanines in a skin-fold observation chamber model: role of central metal ion and degree of sulfonation. Photochemistry Photobiology. 58 (4), 575-580 (1993).
- Ainsworth, S. J., Stanley, R. L., Evans, D. J. R. Developmental stages of the Japanese quail. Journal of Anatomy. 216 (1), 3 (2010).
- De Fouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the microcirculation in the chick chorioallantoic membrane during normal angiogenesis. Microvascular Research. 38 (2), 136-147 (1989).
- Sandau, K., Kurz, H. Modelling of vascular growth processes: a stochastic biophysical approach to embryonic angiogenesis. Journal of Microscopy. 175 (3), 205-213 (1994).
- Kurz, H., Ambrosy, S., Wilting, J., Marmé, D., Christ, B. Proliferation pattern of capillary endothelial cells in chorioallantoic membrane development indicates local growth control, which is counteracted by vascular endothelial growth factor application. Developmental Dynamics. 203 (2), 174-186 (1995).
- Huss, D., Poynter, G., Lansford, R. Japanese quail (Coturnix japonica) as laboratory animal model. Lab Animal. 37 (11), 513-519 (2008).
- Gottfried, V., Lindenbaum, E. S., Kimel, S. The chick chorioallantoic membrane (CAM) as an in-vivo model for photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 12 (2), 204-207 (1992).
- Miškovský, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological molecules. Current Drug Targets. 3 (1), 55-84 (2002).
- Čavarga, I., et al. Photodynamic effect of hypericin after topical application in the ex ovo quail chorioallantoic membrane model. Planta Medica. 80 (1), 56-62 (2014).
- Martinez-Poveda, B., Quesada, A. R., Medina, M. A. Hypericin in the dark inhibits key steps of angiogenesis in vitro. Europan Journal of Pharmacology. 516 (2), 97-103 (2005).
- Datta, S., et al. Unravelling the excellent chemical stability and bioavailability of solvent responsive curcumin-loaded 2-ethyl-2-oxazoline-grad-2-(4-dodecyloxyphenyl)- 2-oxazoline copolymer nanoparticles for drug delivery. Biomacromolecules. 19 (7), 2459-2471 (2018).
- Huntošová, V., et al. Alkyl Chain length in poly(2-oxazoline)-based amphiphilic gradient copolymers regulates the delivery of hydrophobic molecules: a case of the biodistribution and the photodynamic activity of the photosensitizer hypericin. Biomacromolecules. 22 (10), 4199-4216 (2021).
- Buríková, M., et al. Hypericin fluorescence kinetics in the presence of low density lipoproteins: study on quail CAM assay for topical delivery. General Physiology and Biophysic. 35 (4), 459-468 (2016).
- Lenkavska, L., et al. Benefits of hypericin transport and delivery by low- and high-density lipoproteins to cancer cells: From in vitro to ex ovo. Photodiagnosis and Photodynamic Therapy. 25, 214-224 (2019).
- Rück, A., Böhmler, A., Steiner, R. PDT with TOOKAD studied in the chorioallantoic membrane of fertilized eggs. Photodiagnosis and Photodynamic Therapy. 2 (1), 79-90 (2005).
- Gottfried, V., Davidi, R., Averbuj, C., Kimel, S. In vivo damage to chorioallantoic membrane blood vessels by porphycene-induced photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 30 (2-3), 115-121 (1995).
- Buzzá, H. H., Silva, L. V., Moriyama, L. T., Bagnato, V. S., Kurachi, C. Evaluation of vascular effect of Photodynamic Therapy in chorioallantoic membrane using different photosensitizers. Journal of Photochemistry and Photobiology B: Biology. 138, 1-7 (2014).
- Dougherty, T. J., et al. Photodynamic therapy. Journal of the National Cancer Institute. 90, 889-905 (1998).
- Xiang, L., et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor. Journal of Biomedical Optics. 12 (1), 01400-01408 (2007).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), 2720 (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Máčajová, M., Čavarga, I., Sýkorová, M., Valachovič, M., Novotná, V., Bilčík, B. Modulation of angiogenesis by topical application of leptin and high and low molecular heparin using the Japanese quail chorioallantoic membrane model. Saudi Journal of Biological Sciences. 27 (6), 1488-1493 (2020).
- Mangir, N., Dikici, S., Claeyssens, F., MacNeil, S. Using Ex Ovo chick chorioallantoic membrane (CAM) assay to evaluate the biocompatibility and angiogenic response to biomaterials. ACS Biomaterials Science Engineering. 5 (7), 3190-3200 (2019).
- Marshall, K. M., Kanczler, J. M., Oreffo, R. O. C. Evolving applications of the egg: chorioallantoic membrane assay and ex vivo organotypic culture of materials for bone tissue engineering. Journal of Tissue Engineering. 11, 1-25 (2020).
- Merlos Rodrigo, M. A., et al. Extending the applicability of in ovo and ex ovo chicken chorioallantoic membrane assays to study cytostatic activity in neuroblastoma cells. Frontiers in Oncology. 11, 1-10 (2021).
- Meta, M., Kundeková, B., Bilčík, B., Máčajová, M. The effect of silicone ring application on CAM vasculature in Japanese Quail (Coturnix japonica). Proceedings of the Student Scientific Conference Faculty of Natural Sciences of Comenius University, Bratislava, Slovakia. , 385-390 (2019).
- Kohli, N., et al. Pre-screening the intrinsic angiogenic capacity of biomaterials in an optimised ex ovo chorioallantoic membrane model. Journal of Tissue Engineering. 11, 1-15 (2020).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic membrane models of various avian species differences and applications. Biology-Basel. 10 (4), 301 (2021).
- Parsons-Wingerter, P., Elliott, K. E., Clark, J. I., Farr, A. G. Fibroblast growth factor-2 selectively stimulates angiogenesis of small vessels in arterial tree. Arteriosclerosis, Thrombosis and Vascular Biology. 20 (5), 1250-1256 (2000).
- Buzzá, H. H., Zangirolami, A. C., Davis, A., Gómez-García, P. B., Kurachi, C. Fluorescence analysis of a tumor model in the chorioallantoic membrane used for the evaluation of different photosensitizers for photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 19, 78-83 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon