Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Хориоаллантоическая мембрана перепела - инструмент для фотодинамической диагностики и терапии
В этой статье
Резюме
Хориоаллантоическая мембрана (CAM) птичьего эмбриона является очень полезным и применимым инструментом для различных областей исследований. Специальная ex ovo модель японского перепела CAM подходит для фотодинамического исследования лечения.
Аннотация
Хориоаллантоическая мембрана (CAM) птичьего эмбриона представляет собой тонкую, экстраэмбриональную мембрану, которая функционирует как первичный орган дыхания. Его свойства делают его отличной экспериментальной моделью in vivo для изучения ангиогенеза, роста опухоли, систем доставки лекарств или фотодинамической диагностики (PDD) и фотодинамической терапии (PDT). В то же время эта модель отвечает требованию о замене экспериментальных животных подходящей альтернативой. Ex ovo культивируемый эмбрион обеспечивает легкое нанесение вещества, доступ, мониторинг и документирование. Наиболее часто используемым является цыпленок CAM; Однако в данной статье описываются преимущества японской перепелиной CAM как недорогой и высокопроизводительной модели. Еще одним преимуществом является более короткое эмбриональное развитие, что позволяет увеличить экспериментальную текучесть кадров. Здесь исследуется пригодность перепелиного CAM для PDD и PDT рака и микробных инфекций. В качестве примера описано применение фотосенсибилизатора гиперицина в комбинации с липопротеинами или наночастицами в качестве системы доставки. Определена оценка повреждений от изображений в белом свете и изменения интенсивности флуоресценции ткани CAM при фиолетовом свете (405 нм) совместно с анализом гистологических срезов. Перепелиный CAM четко показал влияние ФДТ на сосудистую систему и ткани. Кроме того, могут наблюдаться такие изменения, как капиллярное кровоизлияние, тромбоз, лизис мелких сосудов и кровотечение из более крупных сосудов. Японский перепел CAM является перспективной моделью in vivo для фотодинамической диагностики и исследований терапии, с применением в исследованиях опухолевого ангиогенеза, а также антиваскулярной и антимикробной терапии.
Введение
Модель куриной хориоаллантоической мембраны (CAM) хорошо известна и широко используется в различных областях исследований. Это богато васкуляризованный экстраэмбриональный орган, обеспечивающий газообмен и транспорт минералов1. Благодаря прозрачности и доступности этой мембраны отдельные кровеносные сосуды и их структурные изменения можно наблюдать в режиме реального времени2. Несмотря на преимущества, цыпленок CAM также имеет некоторые ограничения (например, более крупные селекционные мощности, производство яиц и потребление кормов), которых можно избежать, используя другие виды птиц. В этом протоколе описана альтернативная модель ex ovo CAM с использованием эмбриона японского перепела (Coturnix japonica). Благодаря своим небольшим размерам, он позволяет использовать гораздо большее количество экспериментальных особей, чем куриный CAM. Более того, более короткое 16-дневное эмбриональное развитие перепелиных эмбрионов является еще одним преимуществом. Первые более крупные сосуды на перепелином CAM появляются в эмбриональный день (ЭД) 7. Это можно напрямую сравнить с развитием эмбриона цыпленка (стадии 4-35); однако более поздние стадии развития уже не сопоставимы и требуют меньше времени для эмбриона перепела3. Интерес представляет регулярное возникновение микрососудистых разветвлений, аналогичных таковым у куриных CAMs 4,5,6. Быстрое половое созревание, высокая яйценоскость и недорогая селекция являются другими примерами, которые благоприятствуют использованию этой экспериментальной модели7.
Птичья модель CAM часто используется в исследованиях фотодинамической терапии (ФДТ)8. ФДТ используется для лечения нескольких форм рака (небольшие локализованные опухоли) и других неонкологических заболеваний. Его принцип заключается в доставке флуоресцентного препарата, фотосенсибилизатора (ПС), к поврежденной ткани и его активации светом соответствующей длины волны. Одним из проспективных ПС, используемых в исследованиях, является гиперицин, первоначально выделенный из лекарственного растения зверобой (Hypericum perforatum)9. Сильные фотосенсибилизирующие эффекты этого соединения основаны на его фотохимических и фотофизических свойствах. Они характеризуются множественными пиками возбуждения флуоресценции в диапазоне 400-600 нм, которые индуцируют излучение флуоресценции примерно на 600 нм. Максимумы поглощения гиперицина в спектральном диапазоне находятся в диапазоне 540-590 нм, а максимумы флуоресценции находятся в диапазоне 590-640 нм9. Для достижения этих фотосенсибилизирующих эффектов гиперицин возбуждается лазерным светом на длине волны 405 нм после местного введения10. При наличии света гиперицин может проявлять вирулицидный, антипролиферативный и цитотоксический эффекты11, при этом отсутствует системная токсичность, и он быстро высвобождается из организма. Гиперицин является липофильным веществом, которое образует нерастворимые в воде, нефлуоресцентные агрегаты, поэтому несколько типов нанонесущих, таких как полимерные наночастицы12,13 или липопротеины высокой и низкой плотности (ЛПВП, ЛПНП)14,15, используются для его доставки и проникновения в клетки. Поскольку CAM является естественно иммунодефицитной системой, опухолевые клетки могут быть имплантированы непосредственно на поверхность мембраны. Модель также хорошо подходит для регистрации степени повреждения сосудов, вызванного ФДТ, в соответствии с определенной оценкой16,17. Свет более низкой интенсивности по сравнению с ФДТ может быть использован для фотодинамической диагностики (ФДД). Мониторинг тканей под фиолетовым возбуждением светодиодный свет также приводит к фотоактивации фотосенсибилизаторов 18,19,20, что приводит к излучению флуоресцентного света, но это не обеспечивает достаточно энергии для запуска реакции ФДТ и повреждения клеток. Это делает его хорошим инструментом для визуализации и диагностики опухолей или мониторинга фармакокинетики используемых PSs14,15.
В данной статье описана подготовка анализа перепела ex ovo CAM с выживаемостью более 80%. Эта культура ex ovo успешно применялась в большом количестве экспериментов.
протокол
Исследование проводилось в соответствии с институциональными руководящими принципами. Все оборудование и реагенты должны быть автоклавированы или стерилизованы 70% этанолом или ультрафиолетовым светом.
1. Инкубация яиц
- Храните оплодотворенные перепелиные яйца при 10-15 °C максимум за 4-5 дней до начала инкубации. Используйте только чистые и неповрежденные яйца.
- Высиживать яйца в инкубаторе принудительной тяги ~ 53-54 ч. Откладывайте яйца горизонтально с выключенным вращением яиц при влажности 50-60% и температуре инкубации 37,5 °C.
2. Ex ovo культура подготовка
ПРИМЕЧАНИЕ: После первоначальной инкубации яйца пригодны для начала культивирования ex ovo .
- Продезинфицируйте поверхность яйца 70% этанолом, не вращая яйцо.
- В стерильном ламинарно-проточном шкафу откройте яичную скорлупу с помощью небольших стерильных хирургических ножниц и перенесите содержимое в 6-луночную культуральную пластину. Если все сделано правильно, эмбрион будет лежать поверх неповрежденного желтка. После каждого яйца дезинфицируйте ножницы 70% этанолом.
- Добавьте приблизительно 5 мл стерильной воды в промежутки в плите из 6 скважин, так как влажность необходима для предотвращения высыхания CAM.
- Поместите эмбрионы в инкубатор до дальнейших экспериментов, сохраняя при этом температуру 37 °C и влажность 80%-90%.
- Когда CAM будет полностью развит (от ED7), поместите стерилизованное силиконовое кольцо (диаметром 6 мм и толщиной около 1,5 мм) на поверхность CAM, вдоль небольших капилляров. Избегайте крупных кровеносных сосудов при размещении кольца.
ПРИМЕЧАНИЕ: Кольцо определяет рабочее пространство, помогает отметить место нанесения вещества и предотвращает утечку жидкого содержимого. - Прекратить культивирование эмбрионов в соответствии с законодательством страны.
- Важно носить перчатки или дезинфицировать руки 70% этанолом во время работы. Аспирировать неправильно опрокинутые эмбрионы или неоплодотворенные яйцеклетки вакуумным аспиратором.
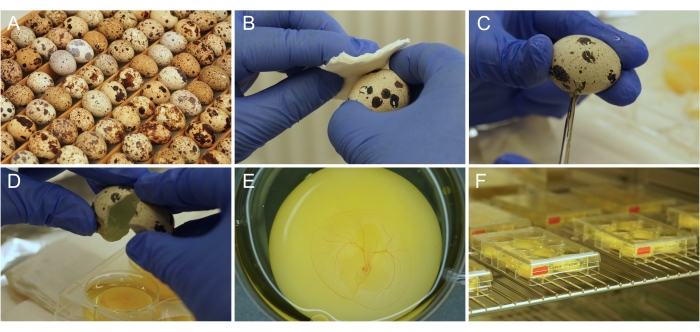
Рисунок 1: Ex ovo культура приготовления. (A) Японские перепелиные яйца по мере их хранения и инкубации. (B) Дезинфекция поверхности яиц этанолом. (C) Яичная скорлупа разрезается ножницами. (D) Содержимое яйца опорожняется в колодец. (E) Правильно подготовленный 3-дневный эмбрион с развивающейся сосудистой системой CAM. F) культуральные пластины, хранящиеся в инкубаторе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
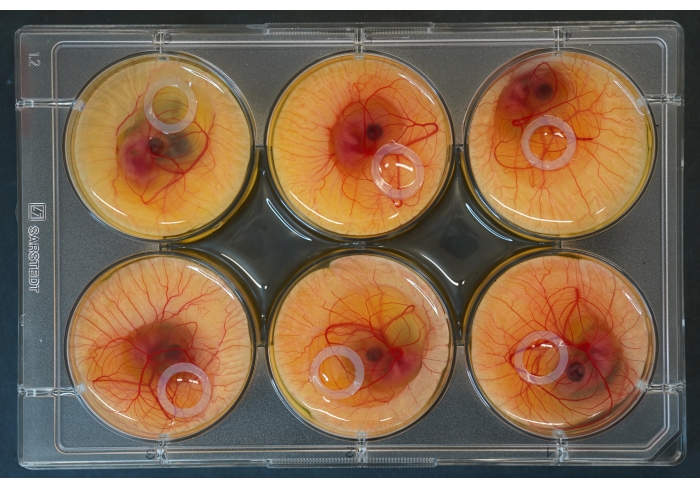
Рисунок 2: 6-луночная культуральная пластина с эмбрионами и силиконовыми кольцами, размещенными сверху. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Инокуляция опухолевых клеток
ПРИМЕЧАНИЕ: Все процедуры требуют использования стерильного ламинарного проточного шкафа.
- Культивируйте различные типы адгезивных клеток в колбах в соответствии с соответствующими протоколами культивирования.
- Удалите старую среду из колб и промойте клеточный слой стерильным фосфатно-буферным физиологическим раствором (PBS), чтобы удалить следы среды.
- После трипсинизации ингибируют трипсин путем добавления питательной среды и собирают клетки в центрифужные трубки. Центрифугируйте клетки и повторно суспендируйте клеточную гранулу в свежей питательной среде. Подсчитайте клетки и повторно суспендируйте их в клеточной питательной среде в нужной концентрации.
ПРИМЕЧАНИЕ: Также возможно получение 3D клеточных культур, т.е. сфероидов, используя, например, метод 21 висячейкапли.
- Имплантировать 1 х 105-1 х 106 опухолевых клеток или 5-15 сфероидов (на КАМ) в 30 мкл раствора клеточной среды в силиконовое кольцо поверх КАМ.
ПРИМЕЧАНИЕ: Объем зависит от размера используемого силиконового кольца. Если используется силиконовое кольцо с большим диаметром, для покрытия всей площади необходим больший объем. В зависимости от типа клеток или для различных типов экспериментов могут использоваться различные концентрации клеток. Иногда тонкое соскоб CAM используется для улучшения адгезии встроенных ячеек. - Верните в инкубатор CAMs с инокулированными клетками (37 °C и влажность 80%-90%).

Рисунок 3: Инокуляция КАМ опухолями. (А) Аспирация сфероидов пипеткой и (Б) имплантация на поверхность КАМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Применение фотосенсибилизатора
- Применение гиперицина
- При тусклом освещении готовят 2 мМ запасного раствора гиперицина, растворяя его в 100% диметилсульфоксиде (ДМСО). Готовят рабочий раствор гиперицина 79 мкМ незадолго до эксперимента стерильным PBS или физиологическим раствором. Обеспечить конечную концентрацию ДМСО во всех растворах всегда под 0,2%, что не влияет на развитие эмбриона.
- В стерильных условиях нанесите соответствующий объем раствора гиперицина на силиконовое кольцо. Объема в 30 мкл достаточно для заполнения кольца диаметром 6 мм.
- Храните эмбрионы в инкубаторе при температуре 37 °C и влажности 80-90%. Гиперицин в водном растворе является фотоактивным после его мономеризации в ткани, примерно через 3 ч после его нанесения на КАМ.
- Применение гиперицина с ЛПНП, ЛПВП или наночастицами в качестве транспортных систем
ПРИМЕЧАНИЕ: Эти транспортные системы используются для улучшения проникновения гиперицина в клетки и клеточные структуры.- Благодаря светочувствительности выполняют все этапы, включая приготовление растворов, при тусклом освещении и хранят растворы в темноте.
- Получают препараты гиперицин-ЛПНП и гиперицин-ЛПВП путем смешивания соответствующих объемов липопротеинов и растворов гиперицинов в PBS в соответствии со ссылкой15. Концентрация ЛПНП или ЛПВП в гиперицине составляет 20:115.
- Синтезируют полимерные наночастицы путем живой катионной кольцевой полимеризации согласно ссылкам12,13. Отрегулировать концентрацию гиперицина в полимерных наночастицах с ПБС до 10 мкМ 12,13.
5. PDD и PDT
- Проведение PDD
- В стерильных условиях применяют фотосенсибилизатор (гиперицин, гиперицин-нагруженные полимерные наночастицы или гиперицин с липопротеином носителем) на поверхность CAM, с опухолевыми клетками или без них (ED 7-9).
- Освещают CAM с помощью фиолетового света возбуждения (изготовленный на заказ круговой светодиодный свет с длиной волны 405 нм) и регистрируют флуоресценцию гиперицина в ткани CAM и опухолевых клетках с помощью цифровой камеры с интервалами времени 0, 1, 3, 5, 24 и 48 ч после введения гиперицина.
- Если исследование требует изображения CAM в белом свете, запишите CAM перед введением гиперицина и в конце эксперимента, незадолго до фиксации ткани, так как свет влияет на фотоактивацию гиперицина.
- Оцените интенсивность флуоресценции с помощью программы обработки и анализа изображений (например, ImageJ22).
- Разделите каналы изображения RGB на отдельные красные, зеленые и синие изображения. Проанализируйте изображение красной интенсивности в 8-битном виде. Оцените интенсивность красного цвета из области внутри кольца и аппроксимируйте ее как флуоресценцию гиперицинов. Получайте целые графики профиля изображения (с помощью плагина ImageJ Profile Plot) через разные промежутки времени после введения гиперицина (т.е. от 0 ч, сразу после введения, до 48 ч).
- Проведение ФДТ
- Выполняют ФДТ не менее чем через 3 ч после применения гиперицина.
- Поместите оптическое волокно над поверхностью CAM, чтобы лазерный луч покрыл всю область внутри силиконового кольца.
- Выполняют облучение in vivo (1-2 мин) лазерным светом 405 нм со скоростью флюенса 285 мВт/см2.
- Запись CAM с использованием белого света и флуоресцентного света 405 нм до и после фотодинамической обработки (24 ч и 48 ч).
- Обнаружение фотоповреждений через 24 ч и 48 ч после ФДТ по снимкам, сделанным при белом свете. Оценить поражение сосудов по полуколичественной оценке16:1 – без разрушения; 2 - частичное закрытие капилляров (диаметр ≤10 мкм) без разрушения средних или более крупных (диаметр ≥50 мкм) и более мелких сосудов (диаметр 10-50 мкм); 3 - частичное закрытие более мелких сосудов с исчезновением капилляров; 4 - частичное закрытие более крупных сосудов с более мелкими сосудами и исчезновением капилляров; и 5 - общий фототромбоз с исчезновением большинства сосудов.

Рисунок 4: Обработка CAM лазерным светом. Этот снимок был сделан в иллюстративных целях. Для PDD или PDT комната должна быть темной. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Подготовка CAM к дальнейшей оценке
- Встраивание парафина
- Зафиксируйте ткань CAM в культивационной пластине с 4% параформальдегидом (PFA) в PBS в течение минимум 2 ч и максимум на ночь.
- Удалите PFA и аккуратно вырежьте из CAM часть ткани внутри силиконового кольца.
- Немедленно обезвоживают ткань CAM в восходящем спиртовом ряду следующим образом. Поместите ткань CAM в 70% этанол в течение 3 мин, раствор эозина в течение 2 мин (для более легкого расположения ткани в парафиновом блоке), 96% этанол в течение 3 х 5 мин (всегда в новой чашке Петри) и 100% этанол в течение 5 мин и ксилол в течение 2 х 10 мин.
- С помощью шпателя или тонкой щетки как можно быстрее перенесите образцы на растворенный парафин в чашках Петри (59 °C). Через 24 ч поместите ткань в гистологическую форму, заполните ее парафиновой встраивающей средой и дайте ей затвердеть в холодильнике. Вырежьте затвердевший CAM из среды для встраивания, поверните его в лоток на 90°, снова заполните его встраиваемой средой и дайте ему затвердеть.
- Подготовьте 5-10 мкм срезов на микротоме для гистопатологического анализа для определения повреждений, вызванных ФДТ.
- Подготовка замороженных CAM-срезов к гистологии
ПРИМЕЧАНИЕ: Для некоторых методологий, включая гистологию, более подходят замороженные участки, приготовленные на криостатных микротомах. Выполните следующие действия для подготовки замороженных секций CAM.- Осторожно установите нативный или 4% параформальдегид-фиксированный CAM на стеклянном слайде.
- Заполните встраиваемую форму до половины оптимальным температурным соединением резки (OCT) и заморозьте в жидком азоте или смеси сухого льда и этанола.
- После замораживания осторожно наклоните и сдвиньте CAM со стеклянного слайда на верхнюю часть замороженной среды OCT. Снова поместите в форму, накройте средой OCT и заморозьте, как показано на шаге 6.2.2.
- Фрактальный анализ перепелиного CAM
ПРИМЕЧАНИЕ: Сосудистые изменения, вызванные ФДТ, могут быть оценены путем расчета фрактального коэффициента размерности19.- В ламинарном проточном шкафу переливаем CAM в культивационной пластине с предварительно нагретым (37 °C) фиксирующим раствором 4% параформальдегида и 2% глутаральдегида в PBS.
- Удалить раствор для фиксации через 48 ч. Тщательно отделите CAM от эмбриона микроножницами и тонкой щеткой и вымойте его в PBS.
- Установите промытый CAM на стеклянную горку и дайте ему медленно высохнуть.
- Сфотографируйте слайд с помощью цифровой камеры и трансиллюминатора в качестве источника однородного белого света.
- Обработка цифровых изображений с помощью программного обеспечения ImageJ22. Для анализа выберите квадратную область (512 × 512 пикселей) из области с дистальными артериальными ветвями. Бинаризация и скелетонизация изображений и вычисление коэффициента фрактальной размерности (Df) в соответствии с процедурами, описанными в ссылке31.
- Молекулярный анализ ткани CAM
- Для молекулярного анализа тщательно отделите нативный CAM, заморозьте в жидком азоте и храните при -80 °C.
- Определение экспрессии генов в соответствии со стандартными протоколами выделения РНК23, обратной транскрипции в кДНК и количественной ПЦР24.
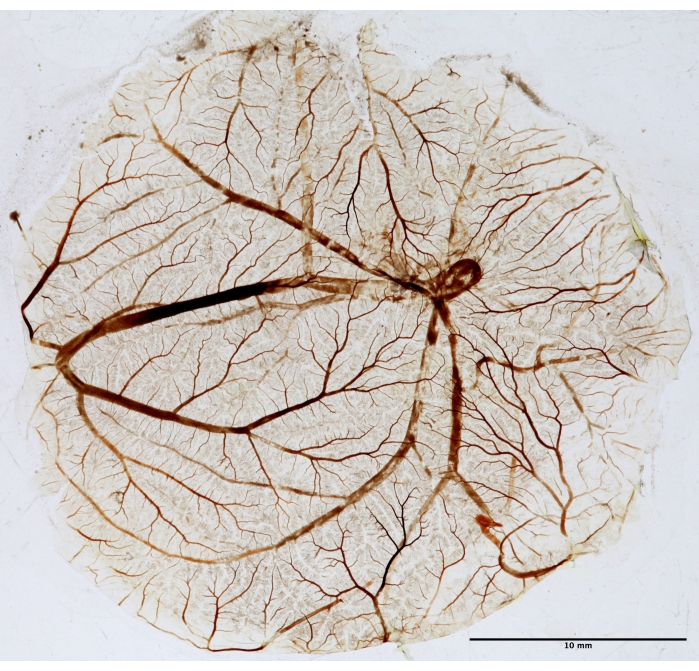
Рисунок 5: CAM-ткань для фрактального анализа. После PDT CAM фиксируется, монтируется на слайде и высушивается для фрактального анализа. Снимок был сделан в белом свете с помощью трансиллюминатора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Локализация опухоли на поверхности CAM затруднена при белом свете. Фотосенсибилизатор (здесь, гиперицин), используемый при PDD, как ожидается, будет избирательно поглощаться опухолью и помогает визуализировать опухоль. Добавление гиперицина и использование флуоресцентного света (наприм...
Обсуждение
Для успешного выращивания ex ovo важно следовать протоколу выше. Более того, если яйца не открыты достаточно тщательно или во время выращивания недостаточно влажности, желточный мешок прилипает к скорлупе и часто разрывается. Начало культивирования ex ovo во время около 60 ч инкуба...
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Работа была поддержана VEGA 2/0042/21 и APVV 20-0129. Вклад В. Хантошовой является результатом реализации проекта: Открытое научное сообщество для современных междисциплинарных исследований в области медицины (Аббревиатура: OPENMED), ITMS2014+: 313011V455 при поддержке Интегрированной инфраструктуры Операционной программы, финансируемой ERDF.
Материалы
| Name | Company | Catalog Number | Comments |
| 6-Well Cell Culture Plate | Sarstedt | 83.392 | Transparent polystyrene, sterile |
| CO2 Incubator ESCO CCL-0508 | ESCO, Singapore | CCL-050B-8 | CO2 cell culture incubator |
| cryocut Leica CM 1800 | Reichert-Jung, USA | ||
| digital camera Canon EOS 6D II | Canon, Japan | ||
| diode laser 405 nm | Ocean Optics, USA | ||
| DMSO | Sigma-Aldrich | 67-68-5 | dimethyl sulfoxid |
| eosin | Sigma-Aldrich | 15086-94-9 | |
| ethanol | Sigma-Aldrich | 64-17-5 | |
| fine brush size 2 | Faber-Castell | 281802 | brush for CAM separation and manipulation |
| glutaraldehyde | Sigma-Aldrich | 111-30-8 | |
| hematoxylin | Sigma-Aldrich | 517-28-2 | |
| hypericin | Sigma-Aldrich | 84082-80-4 | |
| incubator Bios Midi | Bios Sedl any, Czech Republic any, Czech Republic | Forced draught incubator for initial incubation | |
| incubator Memmert IF160 | Memmert, Germany | Forced air circulation incubator for CAM incubation | |
| Kaiser slimlite plano, LED light box | Kaiser, Germany | 2453 | Transilluminator |
| LED light 405 nm | custom made circular LED light | ||
| macro lens Canon MP- E 65 mm f/2.8 | Canon, Japan | ||
| microscope Kapa 2000 | Kvant, Slovakia | optical microscope | |
| microtome Auxilab 508 | Auxilab, Spain | manual rotary microtome | |
| paraformaldehyde | Sigma-Aldrich | 30525-89-4 | |
| Paraplast Plus | Sigma-Aldrich | P3683 | parafin medium for tissue embedding |
| PBS | Sigma-Aldrich | P4417 | Phosphate saline buffer |
| scissors Castroviejo | Orimed | OR66-108 | micro scissors for CAM separation |
| software ImageJ 1.53 | public domain | image processing and analysis program | |
| stock solution HDL | Sigma-Aldrich | 437641-10MG | high density lipoproteins |
| stock solution LDL | Sigma-Aldrich | 437644-10MG | low density lipoproteins |
| Tissue-Tek O.C.T. Compound | Sakura Finetek | 4583 | Optimal Cutting Temperature Compound 118 mL squeeze bottles |
Ссылки
- Nowak-Sliwinska, P., van Beijnum, J. R., van Berkel, M., vanden Bergh, H., Griffioen, A. W. Vascular regrowth following photodynamic therapy in the chicken embryo chorioallantoic membrane. Angiogenesis. 13 (4), 281-292 (2010).
- van Leengoed, H. L. L. M., vander Veen, N., Versteeg, A. A. C., Ouellet, R., van Lier, J. E., Star, W. M. In-vivo photodynamic effects of phthalocyanines in a skin-fold observation chamber model: role of central metal ion and degree of sulfonation. Photochemistry Photobiology. 58 (4), 575-580 (1993).
- Ainsworth, S. J., Stanley, R. L., Evans, D. J. R. Developmental stages of the Japanese quail. Journal of Anatomy. 216 (1), 3 (2010).
- De Fouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the microcirculation in the chick chorioallantoic membrane during normal angiogenesis. Microvascular Research. 38 (2), 136-147 (1989).
- Sandau, K., Kurz, H. Modelling of vascular growth processes: a stochastic biophysical approach to embryonic angiogenesis. Journal of Microscopy. 175 (3), 205-213 (1994).
- Kurz, H., Ambrosy, S., Wilting, J., Marmé, D., Christ, B. Proliferation pattern of capillary endothelial cells in chorioallantoic membrane development indicates local growth control, which is counteracted by vascular endothelial growth factor application. Developmental Dynamics. 203 (2), 174-186 (1995).
- Huss, D., Poynter, G., Lansford, R. Japanese quail (Coturnix japonica) as laboratory animal model. Lab Animal. 37 (11), 513-519 (2008).
- Gottfried, V., Lindenbaum, E. S., Kimel, S. The chick chorioallantoic membrane (CAM) as an in-vivo model for photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 12 (2), 204-207 (1992).
- Miškovský, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological molecules. Current Drug Targets. 3 (1), 55-84 (2002).
- Čavarga, I., et al. Photodynamic effect of hypericin after topical application in the ex ovo quail chorioallantoic membrane model. Planta Medica. 80 (1), 56-62 (2014).
- Martinez-Poveda, B., Quesada, A. R., Medina, M. A. Hypericin in the dark inhibits key steps of angiogenesis in vitro. Europan Journal of Pharmacology. 516 (2), 97-103 (2005).
- Datta, S., et al. Unravelling the excellent chemical stability and bioavailability of solvent responsive curcumin-loaded 2-ethyl-2-oxazoline-grad-2-(4-dodecyloxyphenyl)- 2-oxazoline copolymer nanoparticles for drug delivery. Biomacromolecules. 19 (7), 2459-2471 (2018).
- Huntošová, V., et al. Alkyl Chain length in poly(2-oxazoline)-based amphiphilic gradient copolymers regulates the delivery of hydrophobic molecules: a case of the biodistribution and the photodynamic activity of the photosensitizer hypericin. Biomacromolecules. 22 (10), 4199-4216 (2021).
- Buríková, M., et al. Hypericin fluorescence kinetics in the presence of low density lipoproteins: study on quail CAM assay for topical delivery. General Physiology and Biophysic. 35 (4), 459-468 (2016).
- Lenkavska, L., et al. Benefits of hypericin transport and delivery by low- and high-density lipoproteins to cancer cells: From in vitro to ex ovo. Photodiagnosis and Photodynamic Therapy. 25, 214-224 (2019).
- Rück, A., Böhmler, A., Steiner, R. PDT with TOOKAD studied in the chorioallantoic membrane of fertilized eggs. Photodiagnosis and Photodynamic Therapy. 2 (1), 79-90 (2005).
- Gottfried, V., Davidi, R., Averbuj, C., Kimel, S. In vivo damage to chorioallantoic membrane blood vessels by porphycene-induced photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 30 (2-3), 115-121 (1995).
- Buzzá, H. H., Silva, L. V., Moriyama, L. T., Bagnato, V. S., Kurachi, C. Evaluation of vascular effect of Photodynamic Therapy in chorioallantoic membrane using different photosensitizers. Journal of Photochemistry and Photobiology B: Biology. 138, 1-7 (2014).
- Dougherty, T. J., et al. Photodynamic therapy. Journal of the National Cancer Institute. 90, 889-905 (1998).
- Xiang, L., et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor. Journal of Biomedical Optics. 12 (1), 01400-01408 (2007).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), 2720 (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Máčajová, M., Čavarga, I., Sýkorová, M., Valachovič, M., Novotná, V., Bilčík, B. Modulation of angiogenesis by topical application of leptin and high and low molecular heparin using the Japanese quail chorioallantoic membrane model. Saudi Journal of Biological Sciences. 27 (6), 1488-1493 (2020).
- Mangir, N., Dikici, S., Claeyssens, F., MacNeil, S. Using Ex Ovo chick chorioallantoic membrane (CAM) assay to evaluate the biocompatibility and angiogenic response to biomaterials. ACS Biomaterials Science Engineering. 5 (7), 3190-3200 (2019).
- Marshall, K. M., Kanczler, J. M., Oreffo, R. O. C. Evolving applications of the egg: chorioallantoic membrane assay and ex vivo organotypic culture of materials for bone tissue engineering. Journal of Tissue Engineering. 11, 1-25 (2020).
- Merlos Rodrigo, M. A., et al. Extending the applicability of in ovo and ex ovo chicken chorioallantoic membrane assays to study cytostatic activity in neuroblastoma cells. Frontiers in Oncology. 11, 1-10 (2021).
- Meta, M., Kundeková, B., Bilčík, B., Máčajová, M. The effect of silicone ring application on CAM vasculature in Japanese Quail (Coturnix japonica). Proceedings of the Student Scientific Conference Faculty of Natural Sciences of Comenius University, Bratislava, Slovakia. , 385-390 (2019).
- Kohli, N., et al. Pre-screening the intrinsic angiogenic capacity of biomaterials in an optimised ex ovo chorioallantoic membrane model. Journal of Tissue Engineering. 11, 1-15 (2020).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic membrane models of various avian species differences and applications. Biology-Basel. 10 (4), 301 (2021).
- Parsons-Wingerter, P., Elliott, K. E., Clark, J. I., Farr, A. G. Fibroblast growth factor-2 selectively stimulates angiogenesis of small vessels in arterial tree. Arteriosclerosis, Thrombosis and Vascular Biology. 20 (5), 1250-1256 (2000).
- Buzzá, H. H., Zangirolami, A. C., Davis, A., Gómez-García, P. B., Kurachi, C. Fluorescence analysis of a tumor model in the chorioallantoic membrane used for the evaluation of different photosensitizers for photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 19, 78-83 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены