É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Membrana corioalantóica de codorna - Uma ferramenta para diagnóstico fotodinâmico e terapia
Neste Artigo
Resumo
A membrana corioalantóica (CAM) do embrião aviário é uma ferramenta muito útil e aplicável para várias áreas de pesquisa. Um modelo ex ovo especial de CAM de codorna japonesa é adequado para investigação de tratamento fotodinâmico.
Resumo
A membrana corioalantóica (CAM) de um embrião aviário é uma membrana fina e extraembrionária que funciona como um órgão respiratório primário. Suas propriedades o tornam um excelente modelo experimental in vivo para estudar angiogênese, crescimento tumoral, sistemas de liberação de drogas ou diagnóstico fotodinâmico (PDD) e terapia fotodinâmica (TFD). Ao mesmo tempo, este modelo aborda a exigência de substituição de animais experimentais por uma alternativa adequada. O embrião cultivado Ex ovo permite fácil aplicação, acesso, monitoramento e documentação de substâncias. O mais utilizado é o CAM de pintinhos; no entanto, este artigo descreve as vantagens da codorna japonesa CAM como um modelo de baixo custo e alto rendimento. Outra vantagem é o menor desenvolvimento embrionário, que permite maior rotatividade experimental. A adequação da CAM de codorna para PDD e PDT de câncer e infecções microbianas é explorada aqui. Como exemplo, descreve-se o uso do fotossensibilizador hipericina em combinação com lipoproteínas ou nanopartículas como sistema de entrega. O escore de dano das imagens em luz branca e as alterações na intensidade de fluorescência do tecido CAM sob luz violeta (405 nm) foram determinados, juntamente com a análise dos cortes histológicos. A CAM de codorna mostrou claramente o efeito da TFD sobre a vasculatura e o tecido. Além disso, alterações como hemorragia capilar, trombose, lise de pequenos vasos e sangramento de vasos maiores puderam ser observadas. A CAM de codorna japonesa é um modelo in vivo promissor para diagnóstico fotodinâmico e pesquisa terapêutica, com aplicações em estudos de angiogênese tumoral, bem como terapia antivascular e antimicrobiana.
Introdução
O modelo de membrana corioalantóica de frango (CAM) é bem conhecido e amplamente utilizado em várias áreas de pesquisa. É um órgão extraembrionário ricamente vascularizado que proporciona troca gasosa e transporte mineral1. Devido à transparência e acessibilidade dessa membrana, vasos sanguíneos individuais e suas alterações estruturais podem ser observados em tempo real2. Apesar das vantagens, o CAM de pintos também tem algumas limitações (por exemplo, instalações de reprodução maiores, produção de ovos e consumo de ração) que poderiam ser evitadas usando outras espécies aviárias. Neste protocolo, um modelo alternativo ex ovo CAM usando embrião de codorna japonesa (Coturnix japonica) é descrito. Devido ao seu pequeno tamanho, permite o uso de um número muito maior de indivíduos experimentais do que o CAM de frango. Além disso, o desenvolvimento embrionário mais curto de 16 dias dos embriões de codornas é outra vantagem. Os primeiros vasos maiores na CAM das codornas aparecem no dia embrionário (DE) 7. Isso pode ser diretamente comparado com o desenvolvimento do embrião de pintinho (estágios 4-35); no entanto, os estágios posteriores de desenvolvimento não são mais comparáveis e requerem menos tempo para o embrião de codorna3. De interesse é a ocorrência regular de ramificação microvascular semelhante à dos CAMs de frango 4,5,6. A rápida maturação sexual, a alta produção de ovos e a reprodução de baixo custo são outros exemplos que favorecem o uso desse modelo experimental7.
Um modelo de MAC aviário é frequentemente utilizado em estudos de terapia fotodinâmica (TFD)8. A TFD é usada para tratar várias formas de câncer (pequenos tumores localizados) e outras doenças não oncológicas. Seu princípio está na entrega de um fármaco fluorescente, um fotossensibilizador (PS), ao tecido danificado e sua ativação com luz do comprimento de onda apropriado. Uma PS prospectiva utilizada em pesquisa é a hipericina, originalmente isolada da erva medicinal de São João (Hypericum perforatum)9. Os fortes efeitos fotossensibilizantes deste composto são baseados em suas propriedades fotoquímicas e fotofísicas. Estes são caracterizados por múltiplos picos de excitação por fluorescência na faixa de 400-600 nm, que induzem a emissão de fluorescência a cerca de 600 nm. Os máximos de absorção de hipericina dentro da banda espectral estão na faixa de 540-590 nm, e os máximos de fluorescência estão na faixa de 590-640 nm9. Para alcançar esses efeitos fotossensibilizantes, a hipericina é excitada pela luz do laser a um comprimento de onda de 405 nm após a administração local10. Na presença de luz, a hipericina pode apresentar efeitos virucidados, antiproliferativos e citotóxicos11, enquanto não há toxicidade sistêmica e é rapidamente liberada do organismo. A hipericina é uma substância lipofílica que forma agregados não fluorescentes insolúveis em água, razão pela qual vários tipos de nanocarreadores, como nanopartículas poliméricas12,13 ou lipoproteínas de alta e baixa densidade (HDL, LDL)14,15, são utilizados para auxiliar sua entrega e penetração nas células. Como a CAM é um sistema naturalmente imunodeficiente, as células tumorais podem ser implantadas diretamente na superfície da membrana. O modelo também é adequado para registrar a extensão do dano vascular induzido por TFD de acordo com um escore definido16,17. Luz de menor intensidade em comparação com a TFD pode ser utilizada para o diagnóstico fotodinâmico (TGD). O monitoramento do tecido sob excitação violeta da luz LED também leva à fotoativação de fotossensibilizadores18,19,20 que resulta em uma emissão de luz fluorescente, mas não fornece energia suficiente para iniciar uma reação PDT e danificar as células. Torna-se uma boa ferramenta para visualização e diagnóstico de tumores ou monitoramento da farmacocinética dos PSs utilizados14,15.
Este artigo descreve a preparação do ensaio de codorna ex ovo CAM com taxas de sobrevivência superiores a 80%. Esta cultura ex ovo foi aplicada com sucesso em um grande número de experimentos.
Protocolo
A pesquisa foi realizada em conformidade com as diretrizes institucionais. Todos os equipamentos e reagentes devem ser autoclavados ou esterilizados com etanol a 70% ou luz UV.
1. Incubação de ovos
- Armazenar ovos de codorna fertilizados a 10-15 °C por um máximo de 4-5 dias antes de iniciar a incubação. Use apenas ovos limpos e não danificados.
- Incube os ovos em uma incubadora de tração forçada por ~ 53-54 h. Coloque os ovos horizontalmente com a rotação do ovo desligada, a 50%-60% de umidade e temperatura de incubação de 37,5 °C.
2. Preparação ex ovocultura
NOTA: Após a incubação inicial, os ovos são adequados para iniciar o cultivo ex ovo.
- Desinfete a superfície do ovo com etanol a 70%, sem girar o ovo.
- Em um armário de fluxo laminar estéril, abra a casca do ovo usando uma pequena tesoura cirúrgica estéril e transfira o conteúdo para uma placa de cultura de 6 poços. Se feito corretamente, o embrião ficará em cima de uma gema não danificada. Após cada ovo, desinfete a tesoura com etanol a 70%.
- Adicione aproximadamente 5 mL de água estéril às lacunas na placa de 6 poços, pois a umidade é essencial para evitar que o CAM seque.
- Coloque os embriões em uma incubadora até novos experimentos, mantendo uma temperatura de 37 °C e 80%-90% de umidade.
- Quando o CAM estiver totalmente desenvolvido (a partir de ED7), coloque um anel de silicone esterilizado (6 mm de diâmetro e aproximadamente 1,5 mm de espessura) na superfície do CAM, ao longo dos pequenos capilares. Evite os principais vasos sanguíneos ao colocar o anel.
NOTA: O anel define o espaço de trabalho, ajuda a marcar o local de aplicação da substância e impede que o conteúdo do líquido vaze. - Encerrar o cultivo dos embriões de acordo com a legislação do país.
- É importante ressaltar que use luvas ou mantenha as mãos desinfetadas com etanol a 70% durante o trabalho. Aspirar embriões inadequadamente inclinados ou ovos não fertilizados com um aspirador a vácuo.
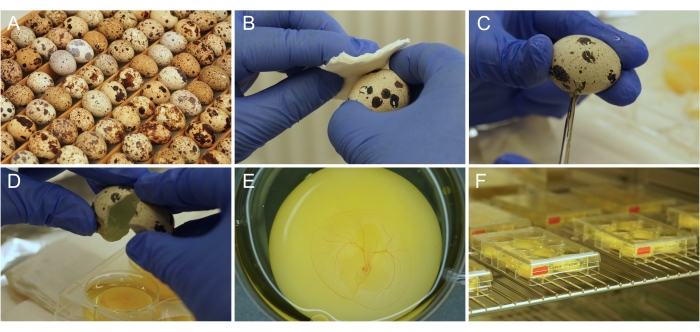
Figura 1: Preparação ex ovocultura . A) Ovos de codorna japonesa tal como são armazenados e incubados. (B) Desinfecção da superfície do ovo com etanol. (C) A casca do ovo é cortada com uma tesoura. (D) O conteúdo do ovo é esvaziado no poço. (E) Embrião de 3 dias de idade devidamente preparado, com vasculatura CAM em desenvolvimento. (F) Placas de cultura armazenadas em incubadora. Por favor, clique aqui para ver uma versão maior desta figura.
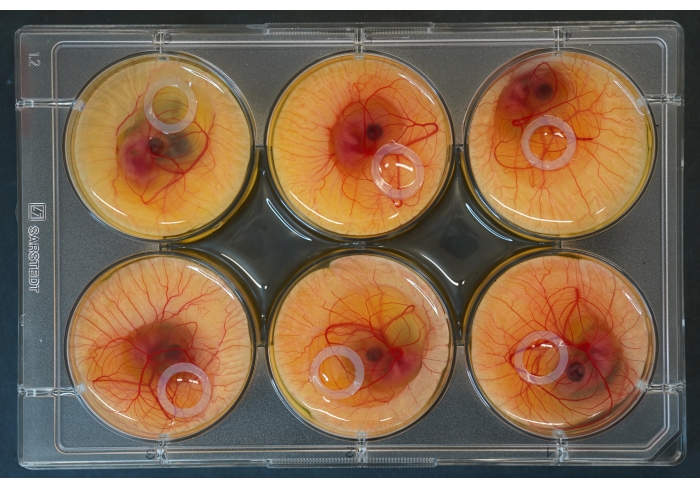
Figura 2: Placa de cultura de 6 poços com embriões e anéis de silicone colocados no topo. Clique aqui para ver uma versão maior desta figura.
3. Inoculação de células tumorais
NOTA: Todos os procedimentos requerem o uso de um gabinete de fluxo laminar estéril.
- Cultivar diferentes tipos de células aderentes em frascos de acordo com os respectivos protocolos de cultura.
- Retirar o meio velho dos frascos e enxaguar a camada celular com solução salina estéril tamponada com fosfato (PBS) para remover vestígios do meio.
- Após a tripsinização, inibir a tripsina adicionando o meio de cultura e colher as células em tubos de centrífuga. Centrifugar as células e ressuspender o pellet celular em um meio de cultura fresco. Conte as células e ressuscite-as em um meio de cultura celular na concentração desejada.
NOTA: Também é possível produzir culturas de células 3D, ou seja, esferoides utilizando, por exemplo, o método da queda suspensa21.
- Implante 1 x 10 5-1 x 106 células tumorais ou5-15 esferoides (por CAM) em 30 μL de solução de meio celular no anel de silicone no topo do CAM.
NOTA: O volume depende do tamanho do anel de silicone utilizado. Se um anel de silicone com um diâmetro maior é usado, um volume maior é necessário para cobrir toda a área. Dependendo do tipo de célula, ou para diferentes tipos de experimentos, várias concentrações celulares podem ser usadas. Às vezes, a raspagem fina de CAM é usada para melhorar a adesão das células incorporadas. - Devolver os CAMs com células inoculadas à incubadora (37 °C e 80%-90% de umidade).

Figura 3: Inoculação da MAC com tumores . (A) Aspiração de esferoides com pipeta e (B) implantação na superfície da CAM. Por favor, clique aqui para ver uma versão maior desta figura.
4. Aplicação do fotossensibilizador
- Aplicação de hipericina
- Sob iluminação fraca, prepare uma solução-mãe de hipericina a 2 mM, dissolvendo-a em 100% de dimetilsulfóxido (DMSO). Preparar uma solução de trabalho de 79 μM de hipericina pouco antes do experimento com PBS estéril ou solução salina. Garantir que a concentração final de DMSO em todas as soluções seja sempre inferior a 0,2%, o que não afeta o desenvolvimento do embrião.
- Em condições estéreis, aplique um volume apropriado de solução de hipericina no anel de silicone. Um volume de 30 μL é suficiente para encher um anel com um diâmetro de 6 mm.
- Mantenha os embriões em uma incubadora a 37 °C e 80% a 90% de umidade. A hipericina em solução aquosa é fotoativa após sua monomerização no tecido, aproximadamente 3 h após sua aplicação no CAM.
- Aplicação de hipericina com LDL, HDL ou nanopartículas como sistemas de transporte
NOTA: Estes sistemas de transporte são utilizados para melhorar a penetração da hipericina nas células e estruturas celulares.- Devido à fotossensibilidade, execute todas as etapas, incluindo a preparação das soluções, sob iluminação fraca e armazene as soluções no escuro.
- Preparar as formulações de hipericina-LDL e hipericina-HDL misturando volumes apropriados de lipoproteínas e soluções-estoque de hipericina em PBS de acordo com a referência15. A concentração de LDL ou HDL em hipericina é de 20:115.
- Sintetizar nanopartículas poliméricas por polimerização catiônica viva de abertura de anel de acordo com as referências12,13. Ajustar a concentração de hipericina em nanopartículas poliméricas com PBS para 10 μM12,13.
5. PDD e PDT
- Conduta PDD
- Em condições estéreis, aplique fotossensibilizador (hipericina, nanopartículas poliméricas carregadas de hipericina ou hipericina com portador de lipoproteínas) na superfície da CAM, com ou sem células tumorais (DE 7-9).
- Iluminar o CAM usando luz de excitação violeta (luz LED circular personalizada de comprimento de onda de 405 nm) e registrar a fluorescência da hipericina no tecido CAM e células tumorais com uma câmera digital em intervalos de tempo de 0, 1, 3, 5, 24 e 48 h após a administração de hipericina.
- Se a pesquisa exigir uma imagem da CAM em luz branca, registre a CAM antes da administração de hipericina e no final do experimento, pouco antes da fixação tecidual, pois a luz afeta a fotoativação da hipericina.
- Avalie a intensidade de fluorescência usando um programa de processamento e análise de imagem (por exemplo, ImageJ22).
- Divida os canais de imagem RGB em imagens vermelhas, verdes e azuis separadas. Analise a imagem de intensidade vermelha em formato de 8 bits. Avalie a intensidade vermelha da área dentro do anel e aproxime-a como a fluorescência da hipericina. Obtenha gráficos de perfil de imagem inteiros (usando o plug-in Profile Plot do ImageJ) em diferentes intervalos de tempo após a administração de hipericina (ou seja, a partir de 0 h, logo após a administração, até 48 h).
- Realizar PDT
- Realizar a TFD pelo menos 3 h após a aplicação de hipericina.
- Coloque a fibra óptica acima da superfície do CAM para que o raio laser cubra toda a área dentro do anel de silicone.
- Realizar irradiação in vivo (1-2 min) com uma luz laser de 405 nm a uma taxa de fluência de 285 mW/cm2.
- Registrar CAM usando luz branca e luz fluorescente de 405 nm antes e após o tratamento fotodinâmico (24 h e 48 h).
- Detectar fotodanos 24 h e 48 h após PDT a partir das imagens tiradas em luz branca. Avaliar o dano vascular por um escore semiquantitativo16: 1 - sem destruição; 2 - fechamento parcial dos capilares (diâmetro ≤10 μm) sem destruição de vasos médios ou maiores (diâmetro ≥50 μm) e menores (diâmetro 10-50 μm); 3 - fechamento parcial de vasos menores com desaparecimento capilar; 4 - fechamento parcial de vasos maiores com vasos menores e desaparecimento capilar; e 5 - trombose fotográfica total com a maioria dos vasos desaparecendo.

Figura 4: Tratamento da MAC com luz laser. Esta foto foi tirada para fins ilustrativos. Para PDD ou PDT, a sala deve estar escura. Por favor, clique aqui para ver uma versão maior desta figura.
6. Preparação do CAM para uma avaliação mais aprofundada
- Incorporação de parafina
- Fixar o tecido CAM em uma placa de cultivo com paraformaldeído (PFA) a 4% em PBS por um período mínimo de 2 h e máximo durante a noite.
- Remova o PFA e corte cuidadosamente do CAM uma parte do tecido dentro do anel de silicone.
- Desidrate imediatamente o tecido CAM em séries de álcool ascendentes da seguinte forma. Coloque o tecido CAM em etanol a 70% por 3 min, solução de eosina por 2 min (para facilitar a localização do tecido no bloco de parafina), etanol a 96% por 3 x 5 min (sempre em uma nova placa de Petri) e etanol a 100% por 5 min e xileno por 2 x 10 min.
- Com uma espátula ou uma escova fina, transferir as amostras o mais rapidamente possível para a parafina dissolvida em placas de Petri (59 °C). Após 24 h, coloque o tecido no molde histológico, preencha-o com meio de incorporação de parafina e deixe-o solidificar na geladeira. Corte o CAM solidificado do meio de incorporação, vire-o na bandeja em 90°, preencha-o novamente com o meio de incorporação e deixe-o solidificar.
- Prepare seções de 5-10 μm em um micrótomo para análise histopatológica para determinar o dano induzido por TFD.
- Preparação de seções CAM congeladas para histologia
NOTA: Para algumas metodologias, incluindo histologia, as seções congeladas preparadas em micrótomo criostato são mais adequadas. Siga as etapas abaixo para preparar as seções CAM congeladas.- Monte cuidadosamente o CAM nativo ou fixado em paraformaldeído a 4% na lâmina de vidro.
- Encha o molde de incorporação até a metade com composto de temperatura de corte ideal (OCT) e congele em nitrogênio líquido ou uma mistura de gelo seco e etanol.
- Após o congelamento, incline e deslize cuidadosamente o CAM da lâmina de vidro para a parte superior do meio OCT congelado. Colocar novamente no molde, cobrir com o meio OCT e congelar como na Etapa 6.2.2.
- Análise fractal da CAM de codornas
NOTA: As alterações de vasculatura causadas pela TFD podem ser avaliadas pelo cálculo do coeficiente de dimensão fractal19.- No gabinete de fluxo laminar, transbordar CAM em uma placa de cultivo com uma solução de fixação pré-aquecida (37 °C) de paraformaldeído a 4% e glutaraldeído a 2% em PBS.
- Retirar a solução de fixação após 48 h. Separe cuidadosamente o CAM do embrião com microtesouras e uma escova fina e lave-o em PBS.
- Monte o CAM lavado em uma lâmina de vidro e deixe secar lentamente.
- Fotografe o slide usando uma câmera digital e um transiluminador como fonte de luz branca homogênea.
- Processe imagens digitais usando o software ImageJ22. Para a análise, selecione uma região quadrada (512 × 512 pixels) da área com ramos arteriais distais. Binarize e esqueletizar as imagens e calcular o coeficiente de dimensão fractal (Df) seguindo os procedimentos descritos na referência31.
- Análise molecular do tecido CAM
- Para análise molecular, separe cuidadosamente o CAM nativo, congele em nitrogênio líquido e armazene a -80 °C.
- Determinar a expressão gênica de acordo com protocolos padrão para isolamento de RNA23, transcrição reversa em cDNA e PCR quantitativa24.
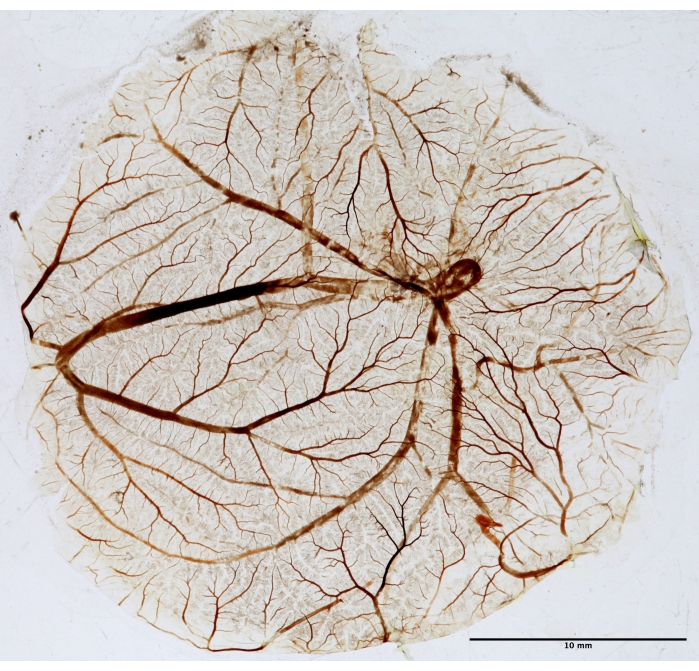
Figura 5: Tecido CAM para análise fractal. Após a TFD, o CAM é fixo, montado em uma lâmina e seco para análise fractal. A foto foi tirada em luz branca usando um transiluminador. Por favor, clique aqui para ver uma versão maior desta figura.
Resultados
A localização do tumor na superfície CAM é difícil na luz branca. Espera-se que o fotossensibilizador (aqui, hipericina) usado no PDD seja absorvido seletivamente pelo tumor e ajude a visualizar o tumor. A adição de hipericina e o uso de luz fluorescente (por exemplo, 405 nm) mostraram a posição muito bem do tumor (carcinoma espinocelular TE1) (Figura 6A). A análise histológica mostrou células tumorais vitais invadindo tecidos saudáveis. Estruturas concêntricas de células esca...
Discussão
Para um cultivo ex ovo bem-sucedido, é importante seguir o protocolo acima. Além disso, se os ovos não forem abertos com cuidado suficiente ou se houver umidade insuficiente durante o cultivo, o saco de gema gruda na casca e muitas vezes se rompe. O início de um cultivo ex ovo no momento de cerca de 60 h de incubação dos ovos garante a alta taxa de sobrevivência dos embriões, pois eles já são grandes o suficiente para sobreviver ao manuseio. Nos estágios posteriores de desenvolvimento, a CAM ...
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
O trabalho foi apoiado pela VEGA 2/0042/21 e APVV 20-0129. A contribuição de V. Huntošová é o resultado da implementação do projeto: Comunidade científica aberta para a investigação interdisciplinar moderna em medicina (Acrónimo: OPENMED), ITMS2014+: 313011V455 apoiada pelo Programa Operacional Infraestrutura Integrada, financiado pelo FEDER.
Materiais
| Name | Company | Catalog Number | Comments |
| 6-Well Cell Culture Plate | Sarstedt | 83.392 | Transparent polystyrene, sterile |
| CO2 Incubator ESCO CCL-0508 | ESCO, Singapore | CCL-050B-8 | CO2 cell culture incubator |
| cryocut Leica CM 1800 | Reichert-Jung, USA | ||
| digital camera Canon EOS 6D II | Canon, Japan | ||
| diode laser 405 nm | Ocean Optics, USA | ||
| DMSO | Sigma-Aldrich | 67-68-5 | dimethyl sulfoxid |
| eosin | Sigma-Aldrich | 15086-94-9 | |
| ethanol | Sigma-Aldrich | 64-17-5 | |
| fine brush size 2 | Faber-Castell | 281802 | brush for CAM separation and manipulation |
| glutaraldehyde | Sigma-Aldrich | 111-30-8 | |
| hematoxylin | Sigma-Aldrich | 517-28-2 | |
| hypericin | Sigma-Aldrich | 84082-80-4 | |
| incubator Bios Midi | Bios Sedl any, Czech Republic any, Czech Republic | Forced draught incubator for initial incubation | |
| incubator Memmert IF160 | Memmert, Germany | Forced air circulation incubator for CAM incubation | |
| Kaiser slimlite plano, LED light box | Kaiser, Germany | 2453 | Transilluminator |
| LED light 405 nm | custom made circular LED light | ||
| macro lens Canon MP- E 65 mm f/2.8 | Canon, Japan | ||
| microscope Kapa 2000 | Kvant, Slovakia | optical microscope | |
| microtome Auxilab 508 | Auxilab, Spain | manual rotary microtome | |
| paraformaldehyde | Sigma-Aldrich | 30525-89-4 | |
| Paraplast Plus | Sigma-Aldrich | P3683 | parafin medium for tissue embedding |
| PBS | Sigma-Aldrich | P4417 | Phosphate saline buffer |
| scissors Castroviejo | Orimed | OR66-108 | micro scissors for CAM separation |
| software ImageJ 1.53 | public domain | image processing and analysis program | |
| stock solution HDL | Sigma-Aldrich | 437641-10MG | high density lipoproteins |
| stock solution LDL | Sigma-Aldrich | 437644-10MG | low density lipoproteins |
| Tissue-Tek O.C.T. Compound | Sakura Finetek | 4583 | Optimal Cutting Temperature Compound 118 mL squeeze bottles |
Referências
- Nowak-Sliwinska, P., van Beijnum, J. R., van Berkel, M., vanden Bergh, H., Griffioen, A. W. Vascular regrowth following photodynamic therapy in the chicken embryo chorioallantoic membrane. Angiogenesis. 13 (4), 281-292 (2010).
- van Leengoed, H. L. L. M., vander Veen, N., Versteeg, A. A. C., Ouellet, R., van Lier, J. E., Star, W. M. In-vivo photodynamic effects of phthalocyanines in a skin-fold observation chamber model: role of central metal ion and degree of sulfonation. Photochemistry Photobiology. 58 (4), 575-580 (1993).
- Ainsworth, S. J., Stanley, R. L., Evans, D. J. R. Developmental stages of the Japanese quail. Journal of Anatomy. 216 (1), 3 (2010).
- De Fouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the microcirculation in the chick chorioallantoic membrane during normal angiogenesis. Microvascular Research. 38 (2), 136-147 (1989).
- Sandau, K., Kurz, H. Modelling of vascular growth processes: a stochastic biophysical approach to embryonic angiogenesis. Journal of Microscopy. 175 (3), 205-213 (1994).
- Kurz, H., Ambrosy, S., Wilting, J., Marmé, D., Christ, B. Proliferation pattern of capillary endothelial cells in chorioallantoic membrane development indicates local growth control, which is counteracted by vascular endothelial growth factor application. Developmental Dynamics. 203 (2), 174-186 (1995).
- Huss, D., Poynter, G., Lansford, R. Japanese quail (Coturnix japonica) as laboratory animal model. Lab Animal. 37 (11), 513-519 (2008).
- Gottfried, V., Lindenbaum, E. S., Kimel, S. The chick chorioallantoic membrane (CAM) as an in-vivo model for photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 12 (2), 204-207 (1992).
- Miškovský, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological molecules. Current Drug Targets. 3 (1), 55-84 (2002).
- Čavarga, I., et al. Photodynamic effect of hypericin after topical application in the ex ovo quail chorioallantoic membrane model. Planta Medica. 80 (1), 56-62 (2014).
- Martinez-Poveda, B., Quesada, A. R., Medina, M. A. Hypericin in the dark inhibits key steps of angiogenesis in vitro. Europan Journal of Pharmacology. 516 (2), 97-103 (2005).
- Datta, S., et al. Unravelling the excellent chemical stability and bioavailability of solvent responsive curcumin-loaded 2-ethyl-2-oxazoline-grad-2-(4-dodecyloxyphenyl)- 2-oxazoline copolymer nanoparticles for drug delivery. Biomacromolecules. 19 (7), 2459-2471 (2018).
- Huntošová, V., et al. Alkyl Chain length in poly(2-oxazoline)-based amphiphilic gradient copolymers regulates the delivery of hydrophobic molecules: a case of the biodistribution and the photodynamic activity of the photosensitizer hypericin. Biomacromolecules. 22 (10), 4199-4216 (2021).
- Buríková, M., et al. Hypericin fluorescence kinetics in the presence of low density lipoproteins: study on quail CAM assay for topical delivery. General Physiology and Biophysic. 35 (4), 459-468 (2016).
- Lenkavska, L., et al. Benefits of hypericin transport and delivery by low- and high-density lipoproteins to cancer cells: From in vitro to ex ovo. Photodiagnosis and Photodynamic Therapy. 25, 214-224 (2019).
- Rück, A., Böhmler, A., Steiner, R. PDT with TOOKAD studied in the chorioallantoic membrane of fertilized eggs. Photodiagnosis and Photodynamic Therapy. 2 (1), 79-90 (2005).
- Gottfried, V., Davidi, R., Averbuj, C., Kimel, S. In vivo damage to chorioallantoic membrane blood vessels by porphycene-induced photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 30 (2-3), 115-121 (1995).
- Buzzá, H. H., Silva, L. V., Moriyama, L. T., Bagnato, V. S., Kurachi, C. Evaluation of vascular effect of Photodynamic Therapy in chorioallantoic membrane using different photosensitizers. Journal of Photochemistry and Photobiology B: Biology. 138, 1-7 (2014).
- Dougherty, T. J., et al. Photodynamic therapy. Journal of the National Cancer Institute. 90, 889-905 (1998).
- Xiang, L., et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor. Journal of Biomedical Optics. 12 (1), 01400-01408 (2007).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), 2720 (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Máčajová, M., Čavarga, I., Sýkorová, M., Valachovič, M., Novotná, V., Bilčík, B. Modulation of angiogenesis by topical application of leptin and high and low molecular heparin using the Japanese quail chorioallantoic membrane model. Saudi Journal of Biological Sciences. 27 (6), 1488-1493 (2020).
- Mangir, N., Dikici, S., Claeyssens, F., MacNeil, S. Using Ex Ovo chick chorioallantoic membrane (CAM) assay to evaluate the biocompatibility and angiogenic response to biomaterials. ACS Biomaterials Science Engineering. 5 (7), 3190-3200 (2019).
- Marshall, K. M., Kanczler, J. M., Oreffo, R. O. C. Evolving applications of the egg: chorioallantoic membrane assay and ex vivo organotypic culture of materials for bone tissue engineering. Journal of Tissue Engineering. 11, 1-25 (2020).
- Merlos Rodrigo, M. A., et al. Extending the applicability of in ovo and ex ovo chicken chorioallantoic membrane assays to study cytostatic activity in neuroblastoma cells. Frontiers in Oncology. 11, 1-10 (2021).
- Meta, M., Kundeková, B., Bilčík, B., Máčajová, M. The effect of silicone ring application on CAM vasculature in Japanese Quail (Coturnix japonica). Proceedings of the Student Scientific Conference Faculty of Natural Sciences of Comenius University, Bratislava, Slovakia. , 385-390 (2019).
- Kohli, N., et al. Pre-screening the intrinsic angiogenic capacity of biomaterials in an optimised ex ovo chorioallantoic membrane model. Journal of Tissue Engineering. 11, 1-15 (2020).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic membrane models of various avian species differences and applications. Biology-Basel. 10 (4), 301 (2021).
- Parsons-Wingerter, P., Elliott, K. E., Clark, J. I., Farr, A. G. Fibroblast growth factor-2 selectively stimulates angiogenesis of small vessels in arterial tree. Arteriosclerosis, Thrombosis and Vascular Biology. 20 (5), 1250-1256 (2000).
- Buzzá, H. H., Zangirolami, A. C., Davis, A., Gómez-García, P. B., Kurachi, C. Fluorescence analysis of a tumor model in the chorioallantoic membrane used for the evaluation of different photosensitizers for photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 19, 78-83 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados