A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ממברנת שליו כוריואלנטואית - כלי לאבחון וטיפול פוטודינמי
In This Article
Summary
הממברנה הכוריאלנטואית (CAM) של עובר העופות היא כלי שימושי מאוד וישים לתחומי מחקר שונים. דגם אקס אובו מיוחד של שליו יפני CAM מתאים לחקירת טיפול פוטודינמי.
Abstract
הממברנה הכוריאלנטואית (CAM) של עובר עופות היא קרום דק, חוץ-עובריוני, המתפקד כאיבר נשימה ראשוני. תכונותיו הופכות אותו למודל ניסויי מצוין של in vivo לחקר אנגיוגנזה, גידול גידולים, מערכות אספקת תרופות או אבחון פוטודינמי (PDD) וטיפול פוטודינמי (PDT). יחד עם זאת, מודל זה נותן מענה לדרישה להחלפת חיות הניסוי בחלופה מתאימה. עובר מעובד לשעבר מאפשר יישום חומרים קלים, גישה, ניטור ותיעוד. הנפוץ ביותר הוא צ'יק CAM; עם זאת, מאמר זה מתאר את היתרונות של CAM שליו יפני כמודל בעלות נמוכה ותפוקה גבוהה. יתרון נוסף הוא ההתפתחות העוברית הקצרה יותר, המאפשרת תחלופה ניסיונית גבוהה יותר. ההתאמה של CAM שליו עבור PDD ו- PDT של סרטן וזיהומים מיקרוביאליים נחקרת כאן. כדוגמה, מתואר השימוש בהיפריצין פוטוסנסיטייזר בשילוב עם ליפופרוטאינים או ננו-חלקיקים כמערכת משלוח. נקבע ציון הנזק מתמונות באור לבן ושינויים בעוצמת הפלואורסצנטיות של רקמת CAM תחת אור סגול (405 ננומטר), יחד עם ניתוח של קטעים היסטולוגיים. CAM שליו הראה בבירור את ההשפעה של PDT על כלי הדם והרקמות. יתר על כן, ניתן היה לראות שינויים כמו דימום נימי, פקקת, תזה של כלי דם קטנים ודימום של כלי דם גדולים יותר. שליו יפני CAM הוא מודל מבטיח in vivo לאבחון פוטודינמי ומחקר טיפול, עם יישומים במחקרים של אנגיוגנזה של גידול, כמו גם טיפול אנטי-וסקולרי ואנטי-מיקרוביאלי.
Introduction
מודל קרום העוף הכוריאלנטואי (CAM) ידוע ונמצא בשימוש נרחב בתחומי מחקר שונים. זהו איבר אקסטרה-אמבריוני עשיר בכלי הדם המספק חילופי גזים והובלת מינרלים1. בשל השקיפות והנגישות של קרום זה, כלי דם בודדים ושינויים מבניים שלהם ניתן לראות בזמן אמת2. למרות היתרונות, ל-Chick CAM יש גם כמה מגבלות (למשל, מתקני רבייה גדולים יותר, ייצור ביצים וצריכת מזון) שניתן להימנע מהן על ידי שימוש במיני עופות אחרים. בפרוטוקול זה מתואר מודל ex ovo CAM חלופי המשתמש בעובר שליו יפני (Coturnix japonica). בשל גודלו הקטן, הוא מאפשר שימוש במספר גדול בהרבה של אנשים ניסיוניים מאשר עוף CAM. יתר על כן, ההתפתחות העוברית הקצרה יותר של 16 יום של עוברי שליו היא יתרון נוסף. הכלים הגדולים הראשונים על שליו CAM מופיעים ביום עוברי (ED) 7. ניתן להשוות זאת ישירות להתפתחות עובר אפרוח (שלבים 4-35); עם זאת, השלבים המאוחרים יותר של ההתפתחות כבר אינם ברי השוואה ודורשים פחות זמן עבור עובר שליו3. מעניין הוא המופע הרגיל של הסתעפות כלי דם דומה לזה של עוף CAMs 4,5,6. התבגרות מינית מהירה, ייצור ביצים גבוה וגידול בעלות נמוכה הן דוגמאות אחרות המעדיפות את השימוש במודל ניסיוניזה 7.
מודל CAM של עופות משמש לעתים קרובות במחקרי טיפול פוטודינמי (PDT)8. PDT משמש לטיפול במספר צורות של סרטן (גידולים מקומיים קטנים) ומחלות לא אונקולוגיות אחרות. העיקרון שלה הוא בהעברת תרופה פלואורסצנטית, פוטוסנסיטייזר (PS), לרקמה הפגועה והפעלתה עם אור באורך הגל המתאים. PS פרוספקטיבי אחד המשמש במחקר הוא היפריצין, שבודד במקור מצמח המרפא וורט סנט ג'ון (Hypericum perforatum)9. ההשפעות החזקות של רגישות לאור של תרכובת זו מבוססות על תכונותיה הפוטוכימיות והפוטופיזיקליות. אלה מאופיינים במספר פסגות עירור פלואורסצנטיות בטווח של 400-600 ננומטר, הגורמות לפליטת פלואורסצנציה בכ-600 ננומטר. מקסימום הקליטה של היפריצין בתוך הפס הספקטרלי נמצא בתחום 540-590 ננומטר, ומקסימה פלואורסצנטית נמצאת בטווח 590-640 ננומטר9. כדי להשיג את ההשפעות האלה של רגישות לאור, היפריצין מתרגש מאור לייזר באורך גל של 405 ננומטר לאחר מתןמקומי 10. בנוכחות אור, hypericin יכול להפגין השפעות וירוסידליות, antiproliferative, ו cytotoxic11, בעוד אין רעילות מערכתית, והוא משתחרר במהירות מן האורגניזם. היפריצין הוא חומר ליפופילי היוצר אגרגטים בלתי מסיסים במים, שאינם פלואורסצנטיים, ולכן מספר סוגים של ננו-נשארים, כגון ננו-חלקיקים פולימריים 12,13 או ליפופרוטאינים בצפיפות גבוהה ונמוכה (HDL, LDL)14,15, משמשים כדי לסייע בהעברתו ובחדירתו לתאים. מכיוון ש-CAM היא מערכת חיסונית טבעית, ניתן להשתיל תאי גידול ישירות על פני הממברנה. המודל מתאים גם לרישום היקף הנזק הנגרם לכלי דם כתוצאה מ-PDT על פי ציוןמוגדר 16,17. אור בעוצמה נמוכה יותר בהשוואה ל-PDT יכול לשמש לאבחון פוטודינמי (PDD). ניטור הרקמה תחת עירור סגול נורית LED מוביל גם לפוטואקטיבציה של פוטו-סנסיטייזרים18,19,20 שמביאה לפליטת אור פלואורסצנטי, אך היא אינה מספקת מספיק אנרגיה כדי להתחיל תגובת PDT ולפגוע בתאים. זה עושה את זה כלי טוב עבור הדמיה של הגידול ואבחון או ניטור הפרמקוקינטיקה של PSsמשומש 14,15.
מאמר זה מתאר את ההכנה של שליו ex ovo CAM מבחן עם שיעורי הישרדות מעל 80%. תרבות אובו לשעבר זו יושמה בהצלחה במספר רב של ניסויים.
Protocol
המחקר בוצע בהתאם להנחיות המוסדיות. כל הציוד והריאגנטים חייבים להיות אוטומטיים או מעוקרים עם 70% אתנול או אור UV.
1. דגירה של ביצים
- אחסנו ביצי שליו מופרות בטמפרטורה של 10-15 מעלות צלזיוס למשך 4-5 ימים לכל היותר לפני תחילת הדגירה. יש להשתמש רק בביצים נקיות ולא פגומות.
- לדגור את הביצים באינקובטור דראפט כפוי במשך ~ 53-54 שעות. מטילים את הביצים בצורה אופקית כאשר סיבוב הביצים כבוי, בלחות של 50%-60% ובטמפרטורת דגירה של 37.5 מעלות צלזיוס.
2. הכנת תרבות אובו לשעבר
הערה: לאחר הדגירה הראשונית, הביצים מתאימות להתחלת טיפוח האקס-אובו .
- לחטא את פני השטח של הביצה עם 70% אתנול, מבלי לסובב את הביצה.
- בארון זרימה למינרית סטרילית, פותחים את קליפת הביצה באמצעות מספריים כירורגיים סטריליים קטנים ומעבירים את התכולה לצלחת תרבית בת 6 בארות. אם נעשה כראוי, העובר ישכב על גבי חלמון לא פגום. לאחר כל ביצה, לחטא את המספריים עם 70% אתנול.
- הוסיפו כ-5 מ"ל מים סטריליים למרווחים בלוח 6 הבארות, שכן לחות חיונית כדי למנוע מה-CAM להתייבש.
- מניחים את העוברים באינקובטור עד לניסויים נוספים, תוך שמירה על טמפרטורה של 37 מעלות צלזיוס ולחות של 80%-90%.
- כאשר ה-CAM מפותח במלואו (מ-ED7), הניחו טבעת סיליקון מעוקרת (בקוטר 6 מ"מ ובעובי של כ-1.5 מ"מ) על משטח ה-CAM, לאורך הנימים הקטנים. יש להימנע משימוש בכלי דם עיקריים בעת הנחת הטבעת.
הערה: הטבעת מגדירה את סביבת העבודה, מסייעת לסמן את מקום מריחת החומר ומונעת מתכולת הנוזל לדלוף החוצה. - להפסיק את טיפוח העוברים על פי החקיקה של המדינה.
- חשוב לציין, ללבוש כפפות או לשמור על ידיים מחטאות עם 70% אתנול במהלך העבודה. לשאוף עוברים עם טיפ לא תקין או ביצים לא מופרות עם שואב ואקום.
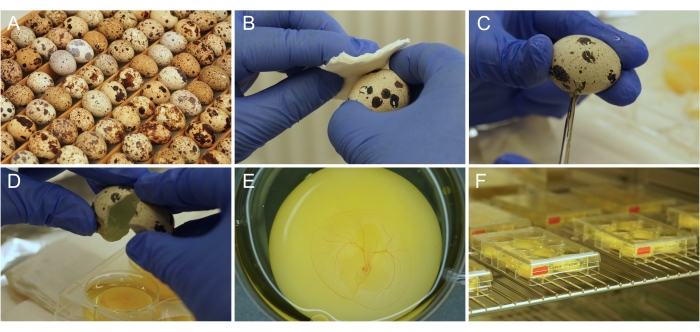
איור 1: הכנה לתרבית אובו לשעבר . (A) ביצי שליו יפניות כפי שהן מאוחסנות ודוגרות. (B) חיטוי פני הביצה באתנול. (C) קליפת הביצה נחתכת במספריים. (D) תכולת הביצית מתרוקנת לתוך הבאר. (E) עובר בן 3 ימים מוכן כראוי, עם התפתחות כלי דם CAM. (F) לוחות תרבית המאוחסנים באינקובטור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
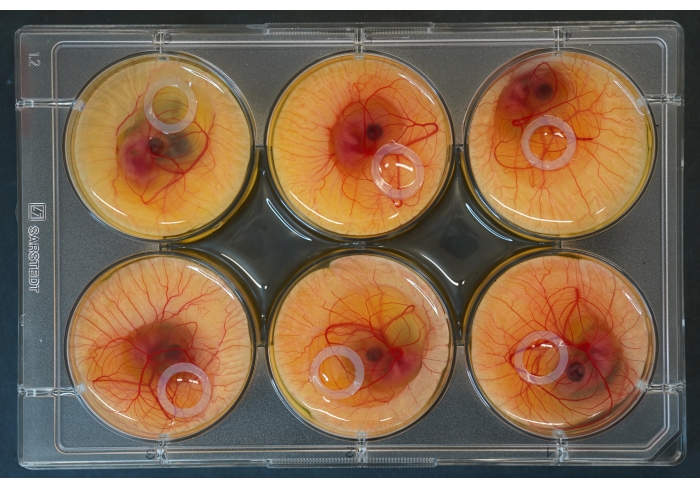
איור 2: צלחת תרבית בת 6 בארות עם עוברים וטבעות סיליקון מונחים מעל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. חיסון תאי הגידול
הערה: כל ההליכים דורשים שימוש בארון זרימה למינרית סטרילי.
- תרבית סוגים שונים של תאים דבקים בבקבוקונים על פי פרוטוקולי התרבית המתאימים.
- הסר את המדיום הישן מהצלוחיות ושטוף את שכבת התא בתמיסת מלח סטרילית עם אגירת פוספט (PBS) כדי להסיר עקבות של המדיום.
- לאחר טריפסיניזציה, לעכב את הטריפסין על ידי הוספת מדיום התרבית וקצירת התאים לתוך צינורות צנטריפוגה. צנטריפוגה של התאים והשעיית כדור התא במדיום תרבית רעננה. לספור את התאים ולתלות אותם מחדש במדיום תרבית תאים בריכוז הרצוי.
הערה: ניתן גם לייצר תרביות תאים תלת-ממדיות, כלומר ספרואידים באמצעות, למשל, שיטת הטיפה התלויה21.
- שתל 1 x 10 5-1 x 10 6תאי גידול או 5-15 ספרואידים (לכל CAM) ב 30 μL של תמיסה בינונית התא לתוך טבעת הסיליקון על גבי CAM.
הערה: עוצמת הקול תלויה בגודל טבעת הסיליקון שבה נעשה שימוש. אם משתמשים בטבעת סיליקון בקוטר גדול יותר, יש צורך בנפח גדול יותר כדי לכסות את כל האזור. בהתאם לסוג התא, או עבור סוגים שונים של ניסויים, ניתן להשתמש בריכוזי תאים שונים. לפעמים, גירוד עדין של CAM משמש כדי לשפר את ההידבקות של תאים מוטבעים. - החזירו את ה-CAMs עם תאים מחוסנים לאינקובטור (37 מעלות צלזיוס ולחות של 80%-90%).

איור 3: חיסון CAM עם גידולים . (A) שאיפה של ספרואידים עם פיפטה, ו-(B) השתלה על משטח ה-CAM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. יישום של פוטוסנסיטייזר
- יישום של היפריצין
- תחת תאורה עמומה, הכינו תמיסת מלאי של 2 mM של היפריצין על ידי המסתו ב-100% דימתיל סולפוקסיד (DMSO). הכן תמיסת עבודה של 79 μM של היפריצין זמן קצר לפני הניסוי עם PBS סטרילי או תמיסת מלח. ודא שהריכוז הסופי של DMSO בכל הפתרונות הוא תמיד מתחת ל -0.2%, מה שלא משפיע על התפתחות העובר.
- בתנאים סטריליים, להחיל נפח מתאים של תמיסת hypericin על טבעת הסיליקון. נפח של 30 μL מספיק כדי למלא טבעת בקוטר של 6 מ"מ.
- שמור את העוברים באינקובטור בטמפרטורה של 37 מעלות צלזיוס ולחות של 80%-90%. היפריצין בתמיסה מימית הוא פוטואקטיבי לאחר המונומריזציה שלו ברקמה, כ -3 שעות לאחר יישומו ב- CAM.
- יישום של היפריצין עם LDL, HDL או ננו-חלקיקים כמערכות הובלה
הערה: מערכות הובלה אלה משמשות לשיפור החדירה של היפריצין לתאים ולמבני תאים.- בשל הרגישות לאור, בצע את כל השלבים, כולל הכנת פתרונות, תחת תאורה עמומה ואחסן את הפתרונות בחושך.
- הכן את פורמולות ההיפריצין-LDL וההיפריצין-HDL על ידי ערבוב כמויות מתאימות של ליפופרוטאינים ותמיסות מלאי היפריצין ב- PBS על פי הפניה15. הריכוז של LDL או HDL להיפריקין הוא 20:115.
- סינתזה של ננו-חלקיקי פולימר על ידי פילמור חי של פתיחת טבעת קטיונית על פי הפניות12,13. התאם את ריכוז ההיפריצין בננו-חלקיקים פולימריים עם PBS ל-10 μM12,13.
5. PDD ו-PDT
- התנהגות PDD
- בתנאים סטריליים, יש למרוח פוטוסנסיטייזר (היפריצין, ננו-חלקיקים פולימריים טעונים בהיפריצין, או היפריצין עם נשא ליפופרוטאין) על משטח ה-CAM, עם או בלי תאי גידול (ED 7-9).
- להאיר את ה-CAM באמצעות אור עירור סגול (אור LED מעגלי בהתאמה אישית באורך גל של 405 ננומטר) ולתעד את הפלואורסצנטיות של היפריצין ברקמת CAM ובתאי הגידול באמצעות מצלמה דיגיטלית במרווחי זמן של 0, 1, 3, 5, 24 ו-48 שעות לאחר מתן היפריצין.
- אם המחקר דורש תמונה של ה- CAM באור לבן, רשום את ה- CAM לפני מתן היפריצין ובסוף הניסוי, זמן קצר לפני קיבוע הרקמה, מכיוון שהאור משפיע על הפוטואקטיבציה של היפריצין.
- הערך את עוצמת הפלואורסצנציה באמצעות תוכנית עיבוד וניתוח תמונה (לדוגמה, ImageJ22).
- פצלו ערוצי תמונה מסוג RGB לתמונות נפרדות באדום, ירוק וכחול. נתח את תמונת העוצמה האדומה בצורת 8 סיביות. הערך את העוצמה האדומה מהאזור בתוך הטבעת והערך אותה כפלואורסצנציה של היפריצין. השג עלילות פרופיל תמונה שלמות (באמצעות תוסף Profile Plot של ImageJ) במרווחי זמן שונים לאחר מתן היפריצין (כלומר, מ-0 שעות, מיד לאחר הניהול, עד 48 שעות).
- התנהגות PDT
- בצע את PDT לפחות 3 שעות לאחר יישום hypericin.
- הנח את הסיב האופטי מעל פני השטח של ה-CAM כדי שקרן הלייזר תכסה את כל השטח בתוך טבעת הסיליקון.
- בצע הקרנה in vivo (1-2 דקות) עם אור לייזר של 405 ננומטר בקצב שטף של 285 mW/cm2.
- הקלט CAM באמצעות אור לבן ואור פלואורסצנטי של 405 ננומטר לפני ואחרי טיפול פוטודינמי (24 שעות ו-48 שעות).
- זהה פוטו-נזק 24 שעות ו-48 שעות לאחר PDT מהתמונות שצולמו באור לבן. להעריך נזק וסקולרי על ידי ציון חצי quantitative16: 1 - אין הרס; 2 - סגירה חלקית של נימים (קוטר ≤10 מיקרומטר) ללא הרס של כלים בינוניים או גדולים יותר (קוטר ≥50 מיקרומטר) וכלי קטן יותר (קוטר 10-50 מיקרומטר); 3 - סגירה חלקית של כלי שיט קטנים יותר עם נימים נעלמים; 4 - סגירה חלקית של כלי שיט גדולים יותר עם כלי קטן יותר ונימים נעלמים; ו 5 - פקקת צילום הכוללת עם רוב הכלים נעלמים.

איור 4: טיפול ב-CAM באמצעות אור לייזר. תמונה זו צולמה לצורך המחשה. עבור PDD או PDT, החדר חייב להיות חשוך. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
6. הכנת CAM להערכה נוספת
- הטמעת פרפין
- תקן את רקמת ה-CAM בצלחת טיפוח עם 4% פרפורמלדהיד (PFA) ב-PBS למשך שעתיים לפחות ומקסימום לילה.
- מוציאים את ה-PFA וחותכים בזהירות מה-CAM חלק מהרקמה בתוך טבעת הסיליקון.
- מיד לייבש את רקמת CAM בסדרת אלכוהול עולה כדלקמן. מניחים את רקמת ה- CAM ב- 70% אתנול למשך 3 דקות, תמיסת eosin למשך 2 דקות (למיקום קל יותר של הרקמה בבלוק הפרפין), 96% אתנול למשך 3 x 5 דקות (תמיד בצלחת פטרי חדשה), ו 100% אתנול למשך 5 דקות וקסילן למשך 2 x 10 דקות.
- באמצעות מרית או מברשת דקה, מעבירים את הדגימות מהר ככל האפשר לפרפין המומס בצלחות פטרי (59 מעלות צלזיוס). לאחר 24 שעות, מניחים את הרקמה בתבנית היסטולוגית, ממלאים אותה במדיום הטמעת פרפין, ומאפשרים לה להתמצק במקרר. חותכים את ה-CAM המוצק ממדיום ההטבעה, הופכים אותו למגש ב-90°, ממלאים אותו שוב במדיום ההטבעה ומניחים לו להתמצק.
- הכן 5-10 מקטעי מיקרומטר על מיקרוטום לניתוח היסטופתולוגי כדי לקבוע נזק הנגרם על ידי PDT.
- הכנת מקטעי CAM קפואים להיסטולוגיה
הערה: עבור מתודולוגיות מסוימות, כולל היסטולוגיה, חלקים קפואים שהוכנו על מיקרוטום cryostat מתאימים יותר. בצע את השלבים הבאים להכנת מקטעי CAM קפואים.- הרכיבו בזהירות CAM מקורי או 4% קבוע בפרפורמלדהיד על מגלשת הזכוכית.
- מלאו את התבנית עד למחצית בתרכובת טמפרטורת חיתוך אופטימלית (OCT) והקפיאו בחנקן נוזלי או בתערובת של קרח יבש ואתנול.
- לאחר ההקפאה, הטה בזהירות והחלק את ה- CAM ממגלשת הזכוכית אל החלק העליון של מדיום ה- OCT הקפוא. מניחים שוב בתבנית, מכסים במדיום OCT ומקפיאים כמו בשלב 6.2.2.
- ניתוח פרקטלי של CAM שליו
הערה: ניתן להעריך שינויים בכלי הדם הנגרמים על-ידי PDT על-ידי חישוב מקדם הממד הפרקטלי19.- בארון הזרימה הלמינרית, CAM עולה על גדותיו בצלחת טיפוח עם תמיסת קיבוע מחוממת מראש (37 מעלות צלזיוס) של 4% פרפורמלדהיד ו-2% גלוטראלדהיד ב-PBS.
- הסר את פתרון הקיבוע לאחר 48 שעות. הפרידו בזהירות את ה- CAM מהעובר באמצעות מיקרו-מספריים ומברשת עדינה ושטפו אותו ב- PBS.
- הרכיבו את ה-CAM השטוף על מגלשת זכוכית ותנו לו להתייבש באיטיות.
- צלם את השקופית באמצעות מצלמה דיגיטלית וטרנס-אילומינטור כמקור לאור לבן הומוגני.
- עיבוד תמונות דיגיטליות באמצעות תוכנת ImageJ22. לצורך הניתוח, בחר אזור ריבועי (512 × 512 פיקסלים) מהאזור עם ענפי עורקים דיסטליים. בינאריזציה ושלד של התמונות וחישוב מקדם הממד הפרקטלי (Df) בהתאם להליכים המתוארים בהפניה31.
- ניתוח מולקולרי של רקמת CAM
- לצורך ניתוח מולקולרי, יש להפריד בזהירות את ה-CAM המקורי, להקפיא בחנקן נוזלי ולאחסן בטמפרטורה של -80°C.
- קביעת ביטוי גנים על פי פרוטוקולים סטנדרטיים לבידוד RNA23, שעתוק הפוך ל-cDNA ו-PCR24 כמותי.
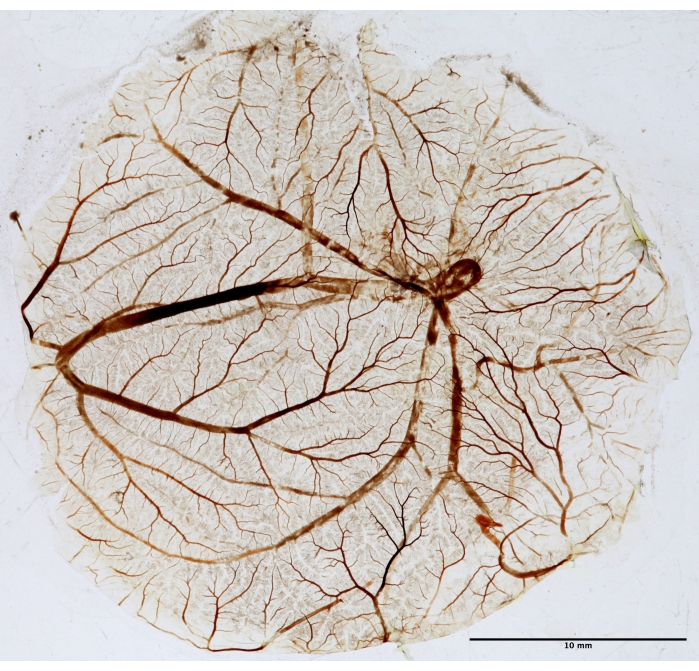
איור 5: רקמת CAM לניתוח פרקטלי. לאחר PDT, CAM קבוע, מותקן על מגלשה, מיובש לניתוח פרקטלי. התמונה צולמה באור לבן באמצעות טרנס-אילומינטור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאות
לוקליזציה של הגידול על פני השטח CAM קשה באור לבן. פוטוסנסיטייזר (כאן, היפריצין) המשמש ב- PDD צפוי להיקלט באופן סלקטיבי על ידי הגידול ומסייע לדמיין את הגידול. תוספת של היפריצין והשימוש באור פלואורסצנטי (למשל, 405 ננומטר) הראו את מיקום הגידול (קרצינומה של תאי קשקש TE1) בצורה טובה מאוד (איו?...
Discussion
לטיפוח מוצלח של ex ovo , חשוב לעקוב אחר הפרוטוקול לעיל. יתר על כן, אם הביצים לא נפתחות בזהירות מספקת או שאין לחות מספקת במהלך הטיפוח, שק החלמון נדבק לקליפה ולעתים קרובות נקרע. תחילתו של גידול אובו לשעבר בזמן של כ -60 שעות של דגירה ביצה מבטיחה את שיעור ההישרדות הגבוה של העוברים, שכן הם כב?...
Disclosures
למחברים אין ניגודי עניינים.
Acknowledgements
העבודה נתמכה על ידי VEGA 2/0042/21 ו- APVV 20-0129. תרומתו של V. Huntošová היא תוצאה של יישום הפרויקט: קהילה מדעית פתוחה למחקר בינתחומי מודרני ברפואה (ראשי תיבות: OPENMED), ITMS2014+: 313011V455 הנתמכת על ידי התשתית המשולבת של התוכנית התפעולית, במימון ERDF.
Materials
| Name | Company | Catalog Number | Comments |
| 6-Well Cell Culture Plate | Sarstedt | 83.392 | Transparent polystyrene, sterile |
| CO2 Incubator ESCO CCL-0508 | ESCO, Singapore | CCL-050B-8 | CO2 cell culture incubator |
| cryocut Leica CM 1800 | Reichert-Jung, USA | ||
| digital camera Canon EOS 6D II | Canon, Japan | ||
| diode laser 405 nm | Ocean Optics, USA | ||
| DMSO | Sigma-Aldrich | 67-68-5 | dimethyl sulfoxid |
| eosin | Sigma-Aldrich | 15086-94-9 | |
| ethanol | Sigma-Aldrich | 64-17-5 | |
| fine brush size 2 | Faber-Castell | 281802 | brush for CAM separation and manipulation |
| glutaraldehyde | Sigma-Aldrich | 111-30-8 | |
| hematoxylin | Sigma-Aldrich | 517-28-2 | |
| hypericin | Sigma-Aldrich | 84082-80-4 | |
| incubator Bios Midi | Bios Sedl any, Czech Republic any, Czech Republic | Forced draught incubator for initial incubation | |
| incubator Memmert IF160 | Memmert, Germany | Forced air circulation incubator for CAM incubation | |
| Kaiser slimlite plano, LED light box | Kaiser, Germany | 2453 | Transilluminator |
| LED light 405 nm | custom made circular LED light | ||
| macro lens Canon MP- E 65 mm f/2.8 | Canon, Japan | ||
| microscope Kapa 2000 | Kvant, Slovakia | optical microscope | |
| microtome Auxilab 508 | Auxilab, Spain | manual rotary microtome | |
| paraformaldehyde | Sigma-Aldrich | 30525-89-4 | |
| Paraplast Plus | Sigma-Aldrich | P3683 | parafin medium for tissue embedding |
| PBS | Sigma-Aldrich | P4417 | Phosphate saline buffer |
| scissors Castroviejo | Orimed | OR66-108 | micro scissors for CAM separation |
| software ImageJ 1.53 | public domain | image processing and analysis program | |
| stock solution HDL | Sigma-Aldrich | 437641-10MG | high density lipoproteins |
| stock solution LDL | Sigma-Aldrich | 437644-10MG | low density lipoproteins |
| Tissue-Tek O.C.T. Compound | Sakura Finetek | 4583 | Optimal Cutting Temperature Compound 118 mL squeeze bottles |
References
- Nowak-Sliwinska, P., van Beijnum, J. R., van Berkel, M., vanden Bergh, H., Griffioen, A. W. Vascular regrowth following photodynamic therapy in the chicken embryo chorioallantoic membrane. Angiogenesis. 13 (4), 281-292 (2010).
- van Leengoed, H. L. L. M., vander Veen, N., Versteeg, A. A. C., Ouellet, R., van Lier, J. E., Star, W. M. In-vivo photodynamic effects of phthalocyanines in a skin-fold observation chamber model: role of central metal ion and degree of sulfonation. Photochemistry Photobiology. 58 (4), 575-580 (1993).
- Ainsworth, S. J., Stanley, R. L., Evans, D. J. R. Developmental stages of the Japanese quail. Journal of Anatomy. 216 (1), 3 (2010).
- De Fouw, D. O., Rizzo, V. J., Steinfeld, R., Feinberg, R. N. Mapping of the microcirculation in the chick chorioallantoic membrane during normal angiogenesis. Microvascular Research. 38 (2), 136-147 (1989).
- Sandau, K., Kurz, H. Modelling of vascular growth processes: a stochastic biophysical approach to embryonic angiogenesis. Journal of Microscopy. 175 (3), 205-213 (1994).
- Kurz, H., Ambrosy, S., Wilting, J., Marmé, D., Christ, B. Proliferation pattern of capillary endothelial cells in chorioallantoic membrane development indicates local growth control, which is counteracted by vascular endothelial growth factor application. Developmental Dynamics. 203 (2), 174-186 (1995).
- Huss, D., Poynter, G., Lansford, R. Japanese quail (Coturnix japonica) as laboratory animal model. Lab Animal. 37 (11), 513-519 (2008).
- Gottfried, V., Lindenbaum, E. S., Kimel, S. The chick chorioallantoic membrane (CAM) as an in-vivo model for photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 12 (2), 204-207 (1992).
- Miškovský, P. Hypericin - a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological molecules. Current Drug Targets. 3 (1), 55-84 (2002).
- Čavarga, I., et al. Photodynamic effect of hypericin after topical application in the ex ovo quail chorioallantoic membrane model. Planta Medica. 80 (1), 56-62 (2014).
- Martinez-Poveda, B., Quesada, A. R., Medina, M. A. Hypericin in the dark inhibits key steps of angiogenesis in vitro. Europan Journal of Pharmacology. 516 (2), 97-103 (2005).
- Datta, S., et al. Unravelling the excellent chemical stability and bioavailability of solvent responsive curcumin-loaded 2-ethyl-2-oxazoline-grad-2-(4-dodecyloxyphenyl)- 2-oxazoline copolymer nanoparticles for drug delivery. Biomacromolecules. 19 (7), 2459-2471 (2018).
- Huntošová, V., et al. Alkyl Chain length in poly(2-oxazoline)-based amphiphilic gradient copolymers regulates the delivery of hydrophobic molecules: a case of the biodistribution and the photodynamic activity of the photosensitizer hypericin. Biomacromolecules. 22 (10), 4199-4216 (2021).
- Buríková, M., et al. Hypericin fluorescence kinetics in the presence of low density lipoproteins: study on quail CAM assay for topical delivery. General Physiology and Biophysic. 35 (4), 459-468 (2016).
- Lenkavska, L., et al. Benefits of hypericin transport and delivery by low- and high-density lipoproteins to cancer cells: From in vitro to ex ovo. Photodiagnosis and Photodynamic Therapy. 25, 214-224 (2019).
- Rück, A., Böhmler, A., Steiner, R. PDT with TOOKAD studied in the chorioallantoic membrane of fertilized eggs. Photodiagnosis and Photodynamic Therapy. 2 (1), 79-90 (2005).
- Gottfried, V., Davidi, R., Averbuj, C., Kimel, S. In vivo damage to chorioallantoic membrane blood vessels by porphycene-induced photodynamic therapy. Journal of Photochemistry and Photobiology, B: Biology. 30 (2-3), 115-121 (1995).
- Buzzá, H. H., Silva, L. V., Moriyama, L. T., Bagnato, V. S., Kurachi, C. Evaluation of vascular effect of Photodynamic Therapy in chorioallantoic membrane using different photosensitizers. Journal of Photochemistry and Photobiology B: Biology. 138, 1-7 (2014).
- Dougherty, T. J., et al. Photodynamic therapy. Journal of the National Cancer Institute. 90, 889-905 (1998).
- Xiang, L., et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor. Journal of Biomedical Optics. 12 (1), 01400-01408 (2007).
- Foty, R. A simple hanging drop cell culture protocol for generation of 3D spheroids. Journal of Visualized Experiments. (51), 2720 (2011).
- Abramoff, M. D., Magelhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Máčajová, M., Čavarga, I., Sýkorová, M., Valachovič, M., Novotná, V., Bilčík, B. Modulation of angiogenesis by topical application of leptin and high and low molecular heparin using the Japanese quail chorioallantoic membrane model. Saudi Journal of Biological Sciences. 27 (6), 1488-1493 (2020).
- Mangir, N., Dikici, S., Claeyssens, F., MacNeil, S. Using Ex Ovo chick chorioallantoic membrane (CAM) assay to evaluate the biocompatibility and angiogenic response to biomaterials. ACS Biomaterials Science Engineering. 5 (7), 3190-3200 (2019).
- Marshall, K. M., Kanczler, J. M., Oreffo, R. O. C. Evolving applications of the egg: chorioallantoic membrane assay and ex vivo organotypic culture of materials for bone tissue engineering. Journal of Tissue Engineering. 11, 1-25 (2020).
- Merlos Rodrigo, M. A., et al. Extending the applicability of in ovo and ex ovo chicken chorioallantoic membrane assays to study cytostatic activity in neuroblastoma cells. Frontiers in Oncology. 11, 1-10 (2021).
- Meta, M., Kundeková, B., Bilčík, B., Máčajová, M. The effect of silicone ring application on CAM vasculature in Japanese Quail (Coturnix japonica). Proceedings of the Student Scientific Conference Faculty of Natural Sciences of Comenius University, Bratislava, Slovakia. , 385-390 (2019).
- Kohli, N., et al. Pre-screening the intrinsic angiogenic capacity of biomaterials in an optimised ex ovo chorioallantoic membrane model. Journal of Tissue Engineering. 11, 1-15 (2020).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic membrane models of various avian species differences and applications. Biology-Basel. 10 (4), 301 (2021).
- Parsons-Wingerter, P., Elliott, K. E., Clark, J. I., Farr, A. G. Fibroblast growth factor-2 selectively stimulates angiogenesis of small vessels in arterial tree. Arteriosclerosis, Thrombosis and Vascular Biology. 20 (5), 1250-1256 (2000).
- Buzzá, H. H., Zangirolami, A. C., Davis, A., Gómez-García, P. B., Kurachi, C. Fluorescence analysis of a tumor model in the chorioallantoic membrane used for the evaluation of different photosensitizers for photodynamic therapy. Photodiagnosis and Photodynamic Therapy. 19, 78-83 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved