需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过直接生物测定法鉴定海葵粗提取物中的溶血和磷脂酶活性
摘要
在这里,我们描述了一种从海葵中获得粗毒血清提取物并检测其溶血和磷脂酶活性的方案。
摘要
海葵毒液组合物包括多肽和非蛋白质分子。细胞溶解成分在设计新的分子工具方面具有很高的生物技术和生物医学潜力。海葵毒液位于外胚层和称为线囊的亚细胞结构的腺细胞中,两者都分布在整个海葵体内。这一特征意味着挑战,因为细胞和线虫囊囊必须裂解以释放与其他无毒分子一起释放毒液成分。因此,首先,毒液来源于粗提取物(不同和不同的分子和组织碎片的混合物)。下一步是检测具有特定生物活性的多肽。在这里,我们描述了一种获得海葵粗提取物和生物测定的有效策略,以鉴定细胞溶解素的存在。第一步涉及廉价和直接的技术(搅拌和冻融循环)来释放细胞溶解素。我们获得了最高的细胞溶解活性和蛋白质(从20克干重中获得约500毫克蛋白质)。接下来,通过SDS-PAGE凝胶检测分子量在10 kDa和250 kDa之间的蛋白质来分析提取物的多肽复杂性。在溶血测定中,我们使用绵羊红细胞并测定HU50 (11.1±0.3μg/ mL)。相比之下,使用蛋黄作为底物在琼脂糖固体介质中测定粗提取物中磷脂酶的存在。总体而言,本研究使用高效且廉价的方案来制备粗提取物,并应用可复制的生物测定来鉴定细胞溶解素,具有生物技术和生物医学兴趣的分子。
引言
海洋动物是生物活性化合物的丰富来源。近几十年来,海葵毒液的组成引起了科学的关注,因为它由多种多肽组成,具有溶血性,细胞毒性,酶促性(磷脂酶,蛋白酶,几丁质酶)和神经毒性活性和对蛋白水解活性的抑制作用1。此外,这些多肽是开发分子工具在生物技术和治疗用途中的潜在来源2,3。
关于海葵毒液及其分子成分的报道很少,因为获得毒液的复杂性,甚至分离和毒素的表征。报告中使用的提取方法涉及裂解和排空与毒液产生1相关且无关的细胞内容物。
所有蜈蝓病患者的一个特殊特征是缺乏集中在单个解剖区域的毒液生产和释放系统。相反,线虫囊是保持毒液4,5的结构。其他类型的细胞,称为表皮腺细胞,也分泌毒素,并且也分布在海葵体内6。
获得毒液的第一个也是最关键的挑战是在后续过程中产生具有充分操作的提取物,而不会灭活或降解不稳定的蛋白质。接下来,必须裂解细胞,并且组分 - 在这种情况下,必须有效和快速地提取多肽,避免蛋白水解和水解,同时消除其他细胞组分7。
使用不同的方法获得海葵的粗提取物;有些涉及牺牲生物体,而另一些则允许它保持活力。暗示使用生物体整个身体的方法允许从毒液8中释放大多数毒素,而保持生物体存活的方法仅提取毒液的某些成分9。提取物的制备需要通过特定的生物测定法评估目标物质的存在和效力,其中包括通过 体内 或 体外 方法观察药理作用的策略10。
海葵毒含有细胞溶解多肽,成孔毒素(PFT)11和磷脂酶12;这些分子是研究蛋白质 - 脂质相互作用,癌症治疗中的分子工具以及基于纳米孔3的生物传感器的模型。海葵PFT的分类是根据其大小或分子量进行的,从5 kDa到80 kDa。20 kDa PFT是研究最多和被称为放线菌素11的,因其在开发分子工具方面具有特别感兴趣的生物医学潜力,可用于抗癌,抗菌和基于纳米孔的生物传感器。另一种细胞溶解素,包括磷脂酶,特别是磷脂酶A2(PLA2)13,释放脂肪酸并水解磷脂,破坏细胞膜的稳定性。由于这种作用机制,PLA2有望成为炎症性疾病研究和应用的重要模型。它可以作为研究细胞膜14中脂质行为的模型。
在这里,我们描述了一种有效的方案,用于从海葵 Anthopleura dowii Verrill(1869)获得粗提取物,并检测溶血素和磷脂酶。两者都是相关的毒素,可以用作设计新分子工具的模板。
研究方案
海葵是根据墨西哥联邦政府水产养殖、渔业和食品国家委员会的指导方针(许可证号PPF / DGOPTA 07332.250810.4060)收集的。墨西哥国立自治大学生物技术研究所生物伦理学委员会批准了海葵的所有实验。绵羊血液样本是在动物生产和健康实用教学和研究中心(CEPIPSA,墨西哥国立自治大学)购买的。
1. 生物体收集
- 收集海葵 A. dowii。
注:此处,这些生物是在墨西哥加利福尼亚州恩塞纳达巴哈海岸附近的潮间带的低潮期间收集的(图1A,B)。 - 将生物体用装有海水的容器运输到实验室(图1C)。
- 在实验室中,用蒸馏水手工清洁生物体,以去除粘附在身体上的大基质颗粒。
- 立即将生物体在-80°C下在超低温冰箱中冷冻72小时。
- 将生物体置于特殊玻璃中冷冻干燥,冻干条件为-20°C,0.015 psi,持续48小时。
- 将冻干生物储存在-20°C直至使用。
2. 组织水合作用
- 用60mL(1/3 w / v)50mM磷酸钠缓冲液,pH 7.5和1抑制剂鸡尾酒片剂重建20g干重的冻干生物(材料表)。
- 在磁力搅拌器中,将样品以〜800rpm,4°C连续搅拌12小时。
3. 毒素释放
- 为了诱导细胞裂解和线虫囊放电,将样品在-20°C下冷冻12小时,然后将容器置于室温(RT)的水中,直到其解冻至90%。重复此过程三次。
注:样品解冻100%;将样品保持在~4°C以防止蛋白质降解至关重要。 - 观察在共聚焦显微镜下排出的线虫囊。在载玻片上取10μL样品,并在其上放置盖玻片。在共聚焦显微镜下以100倍和60倍放大倍率观察。这里不需要染料。
- 在ImageJ软件中处理在共聚焦显微镜中捕获的图像(版本1.53c,Wayne Rasband,美国国立卫生研究院,https://imagej.nih.gov/ij)。
- 如果线囊内的小管脱离线圈并在外面,则线囊排出;然后,继续执行下一步。否则,只需再进行一次冻融循环。
- 为了澄清提取物,将样品以25,400× g 离心40分钟,4°C,回收上清液,然后再次离心。重复此步骤3-4次。
- 回收上清液并丢弃沉淀。上清液或粗提取物含有毒液成分(毒素)和其他细胞分子,如脂质、碳水化合物和核酸。
4. 总蛋白定量
- 使用商业布拉德福德比色测定15 试剂盒确定粗提取物的蛋白质浓度(材料表)。
- 稀释染料试剂(一份染料与四份蒸馏水)。
- 在磷酸盐缓冲液(50mM磷酸钠,pH 7.5)中以1mg / mL浓度制备牛血清白蛋白(BSA)馏分V(材料表)溶液。
- 准备 表 1 中列出的解决方案,一式三份。
- 在摇摇杯中用力混合每种溶液4秒。
- 在室温下孵育样品5分钟,不摇动。
- 测量 595 nm 处的吸光度 (AU)。
- 绘制样品BSA吸光度的平均值(AU与蛋白质浓度),并确定图形的方程(等式1)。
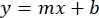 等式 1
等式 1
其中 y 是吸光度, m 是线的斜率, x 是蛋白质浓度, b 是 y 截距。要计算粗提取物浓度,请按如下方式求解 x :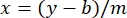 等式 2
等式 2
5. 确定多肽毒液的复杂性
- 根据手册组装用于垂直凝胶电泳的玻璃容器。
- 制备丙烯酰胺混合物(30%):丙烯酰胺29.2克,双丙烯酰胺0.8克,最终体积100毫升。使用0.45μm膜过滤溶液。将溶液储存在4°C的深色瓶中。 然后,制备用于拆分凝胶的混合物(表2)。
- SDS-PAGE凝胶由分辨凝胶和堆叠凝胶组成。根据 表2中定义的溶液体积制备凝胶。在制备过程中,确保将每个混合物保持在4°C以减少聚合时间。
注意:每种混合物的体积因所用设备的品牌而异;对于该方案,体积对应于制备15%丙烯酰胺凝胶,0.75mm厚,用于垂直电泳室(材料表)。 - 丙烯酰胺聚合后,〜10min,加入堆叠凝胶的混合物。
- 为堆叠凝胶准备混合物,立即将其添加到玻璃板中,然后放置梳子以形成用于加载样品的孔。
- 一旦堆叠凝胶聚合(〜15分钟),取出梳子并将玻璃容器置于腔室中进行垂直电泳。
- 将200mL电极缓冲液(0.25M Tris,0.192M甘氨酸,0.1%SDS)放入电泳室中。
- 分析粗提取物:将30μg粗提取物与5μL蛋白质上样缓冲液(25%甘油,15%十二烷基硫酸钠,25%2-巯基乙醇,0.125mM Tris pH 7,溴酚蓝0.1mg / mL)混合以使蛋白质变性。最终体积必须为<50 μL。
- 在90°C下加热5分钟,冷却,并以1,400× g离心3秒。
- 将样品上样于堆叠凝胶的孔中。加载标准分子量标。
- 在25 mA恒定电流下运行电泳1小时30分钟。
- 从电泳室中取出玻璃容器以继续进行凝胶蛋白的染色。
6. 蛋白质染色
- 在50 mL蒸馏水中冲洗凝胶以除去缓冲电极上的碎屑。
- 丢弃水。
- 为避免凝胶蛋白的扩散,加入固定溶液(60 mL乙醇,20 mL乙酸和20 mL蒸馏水,最终体积100 mL)。在室温下孵育40分钟,以80rpm振荡。倾析溶液。
- 加入蛋白质交联溶液(15mL乙醇,0.25mL戊二醛,50mL蒸馏水,最终体积65.25mL),并在室温下孵育30分钟,以80rpm振荡。删除解决方案。
- 用100mL蒸馏水洗涤凝胶5分钟,然后除去水。重复此过程四次。
- 用50mL考马斯亮蓝R-250过滤溶液(40%甲醇,10%乙酸,50%蒸馏水,0.1%染料,最终体积100mL)进行蛋白质染色,在实验室旋转振荡器中以60rpm在室温下搅拌15分钟。
- 回收可用于染色其他凝胶的溶液。
- 为了消除多余的染料,加入脱色溶液(40 mL甲醇,10 mL乙酸,50 mL蒸馏水)。在室温下继续搅拌(80 rpm),直到条带(染色的蛋白质)可视化。
- 将凝胶保存在50 mL蒸馏水中,并在凝胶记录系统中扫描图像。
7. 准备红细胞溶液
- 从绵羊的颈静脉中提取1毫升血液。
- 从注射器中取出针头,立即将血液排入装有50mL Alsever溶液(0.002 M柠檬酸,0.07M NaCl,0.1M葡萄糖和0.027M柠檬酸钠作为抗凝剂,pH 7.4)的管中。
- 慢慢地将溶液倒置三次。
- 保持在4°C以转移到实验室。
- 在4°C下以804× g 离心5分钟,弃去上清液。
- 将沉淀重悬于30 mL Alsever溶液中。通过沿管的内壁滑动来添加溶液,并使用巴斯德塑料移液器缓慢地重悬细胞。再次以804× g 离心5分钟,4°C。 重复此过程,直到上清液澄清。
- 加入15 mL阿尔塞夫溶液;用巴斯德塑料移液器缓慢重悬沉淀。
- 保持Alsever溶液的最终体积,以达到大约2 x 106 细胞/ mL的浓度。然后,使用Neubauer室或血细胞计数器对细胞进行计数。
注意:计数血细胞计数器载玻片中的红细胞(改进的Neubauer)。幻灯片是 30 毫米 x 70 毫米 x 4 毫米的幻灯片。中心有两个银色脚踏板(图2A)(一个顶部和一个底部网格),每个3 mm x 3 mm,网格两侧有两个通道。计数单元格位于角落和中心方块( 图2B中的红色正方形)。用于计数的细胞的最佳浓度应为106 个细胞的数量级。中央盒子的表面积为0.1 cm2,相当于0.0001 mL。 - 将盖玻片放在幻灯片上。
- 将10μL样品放在载玻片和盖玻片之间,等待样品释放。
- 在光学显微镜(放大倍率为60x)中,在第一个方框中进行计数。仅对中心网格中的单元格以及接触框上边距或左边距的单元格进行计数。
- 使用以下等式确定细胞浓度:
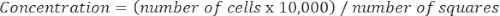 等式 3
等式 3
如果样品非常浓缩并且需要稀释,则使用以下等式: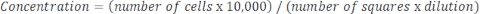 等式 4
等式 4
注意:当服用红细胞溶液进行溶血测试时,用塑料巴斯德移液管缓慢匀浆溶液。 - 执行一式三份的步骤以减少错误。
8. 溶血试验
- 在锥形96孔板中制备 表3 所示的溶液混合物(一式三份)。
注意:缓慢混合红细胞以保持均匀的悬浮液。 - 在37°C下孵育1小时,不摇动。
- 在4°C下以804× g 离心板5分钟。
- 在另一个具有平底的96孔板中回收上清液。
- 如果粗提取物含有细胞溶解素,红细胞将裂解并释放血红蛋白。读取415nm处的吸光度。
- 使用以下公式计算溶血百分比:
%溶血= ((Acrude提取物 - AAlsever缓冲液)/ (AH2O-AAlsever)) x 100
注意:Acrude提取物,AAlsever缓冲液和AH2O分别对应于粗提取物中红细胞的吸光度,Alsever溶液的吸光度和蒸馏水的吸光度。 - 在每个冷冻和解冻周期之前和之后,用来自粗提取物的50μg总蛋白进行溶血测试。
- 确定达到100%溶血活性所需的冷冻和解冻周期数。
- 计算在50%的红细胞中产生溶血的提取物的量(HU50);遵循 表3中描述的相同协议,增加海葵粗提物的量,并使用适当的软件(例如,产地, 材料表)进行乙状调整设计图。
9. 磷脂酶测定
- 在蒸馏水中用1%SDS清洗一个鸡蛋。
- 在无菌条件下将蛋黄与蛋清分开。
- 制备50 mL 0.86%NaCl溶液,并通过0.22μm过滤器过滤。然后,制备溶液A:加入12mL蛋黄和36mL0.86%NaCl溶液。
- 制备溶液B:将300mg琼脂糖混合在50mL缓冲液(50mM Tris,pH 7.5)中,通过0.22μm过滤器过滤。在微波炉中加热溶液直至沸腾。在温水中冷却至43-45°C。
- 准备溶液C:准备10 mM CaCl2 并用0.22μm过滤器过滤。
- 制备溶液D:10毫克罗丹明6G在1毫升蒸馏水中。
- 在无菌条件下(层流罩),向溶液B中加入500μL溶液A和C以及100μL溶液D,混合并将25mL倒入每个培养皿(90×15mm)中。
- 等待溶液在无菌条件下固化(30分钟)。
- 用细管制作孔(直径约2-3毫米)。
- 在一个孔中共加入20μL磷酸盐缓冲液(阴性对照),在另一个孔中加入20μL确定的磷脂酶(阳性对照)。
- 将不同量的粗提取蛋白5,15,25,35,45μg置于剩余的孔中,每个孔的最终体积为20μL。
- 等待琼脂吸附所有样品(30分钟)。
- 在37°C孵育20小时。
- 如果在孔周围形成光环,则表明磷脂酶活性。测量用游标卡尺形成的光晕。
注意:一式三份进行实验(步骤从9.1-9.14)。
结果
用于获得海葵粗提取物的方案的代表性结果表明,结合两种技术(搅拌和冷冻和解冻循环)产生了线虫囊肿的有效排出,蛋白质总量为500mg(8mg / mL)(图3)。
粗提取物的蛋白质复杂性可以通过SDS-PAGE电泳从10 kDa和大于250 kDa观察到。此外,在15 kDa和20 kDa的分子量区检测到细胞溶解素,其分子量范围可能对应于磷脂酶13 或放线菌素
讨论
对新化合物的高需求在科学和工业的不同领域都有应用,这导致了对毒液的研究。毒液代表了丰富的分子来源,可作为生成新分子工具的模板。然而,这些毒液的复杂性需要实施和组合各种方法来获取和研究它们。
在这里,我们展示了一种获取和分析海葵 Anthopleura dowii的毒液的方法,Verrill 1869,可用于探索其他海葵物种的毒液,从冻干标本开始,然后粗提取。冻干步?...
披露声明
作者声明,他们对本文的发表没有竞争利益。
致谢
这项工作得到了Apoyo a Proyectos de Investigación e Innovación Tecnológica(PAPIIT)的支持,赠款编号为IT200819。作者感谢Tom Musselman,Rock Paper Editing,LLC,检查了这份手稿的英语语法;以及萨曼塔·希门尼斯(CICESE,恩塞纳达)和胡安·曼努埃尔·巴尔博萨·卡斯蒂略(墨西哥国立自治大学塞卢拉研究所)的技术援助。我们还感谢Augusto César Lizarazo Chaparro博士(CEPIPSA)获得绵羊血液。我们特别感谢ICAT-UNAM的José Saniger Blesa博士,感谢他实验室的录像设施。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Corning | 430766 | |
| 2-Bromophenol blue | Sigma | B75808 | |
| 2-mercaptoetanol | Sigma-Aldrich | M6250-100ML | |
| 50 mL conical centrifuge tubes | Corning | 430828 | |
| Acetic Acid Glacial | J.T. Baker | 9515-03 | |
| Acrylamide | Promega | V3115 | |
| Agarose | Promega | V3125 | |
| Bisacrylamide | Promega | V3143 | |
| Bovine Serum Albumin Fraction V | Sigma | A3059-100G | |
| Bradford Protein Assays | Bio-Rad | 5000006 | |
| Calcium chloride | Sigma-Aldrich | C3306 | |
| Cell culture plates 96 well, V-bottom | Corning | 3894 | |
| Centrifuge | Eppendorf | 5804R | |
| Centrifuge tubes | Corning | CLS430829 | |
| ChemiDoc MP system | Bio-Rad | 1708280 | |
| Citric acid | Sigma-Aldrich | 251275 | |
| Clear flat.bottom 96-Well Plates | Thermo Scientific | 3855 | |
| Coomassie Brilliant Blue G-250 | Bio-Rad | #1610406 | |
| Coomassie brilliant blue R-250 | Bio-Rad | 1610400 | |
| Dextrose | J.T. Baker | 1916-01 | |
| Ductless Enclosure | Labconco | Vertical | https://imagej.nih.gov/ij ImageJ 1.53c |
| Gel Doc EZ | Bio Rad. | Gel Documentation System | |
| Glycerol | Sigma-Aldrich | G5516-4L | |
| Hemocytometer | Marienfeld | 650030 | |
| ImageJ (Software) | NIH, USA | Version 1.53c | |
| Incubator 211 | Labnet | I5211 DS | |
| Methanol | J.T. Baker | 9049-03 | |
| Mini-PROTEAN tetra cell | Bio-Rad | 1658000EDU | |
| Na2HPO4 | J.T. Baker | 3824-01 | |
| NaCl | J.T. Baker | 3624-01 | |
| NaH2PO4.H2O | J.T. Baker | 3818-05 | |
| Origin software | version 9 | To design the plot with sigmoidal adjustments | |
| Petridish | Falcon | 351007 | |
| Pipetman kit | Gilson | F167380 | |
| Precast mini gel | BioRad | 1658004 | |
| Prestained Protein Ladder | Thermo Scientific | 26620 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | |
| Rhodamine 6G | Sigma-Aldrich | 252433 | |
| SDS | Sigma-Aldrich | L4509 | |
| Sodium citrate dihydrate | JT Baker | 3646-01 | |
| Spectrophotometer | THERMO SCIENTIFIC | G10S UV-VIS | |
| Tris Base | Sigma-Aldrich | 77-86-1 | |
| Volt Power Supply | Hoefer | PS300B |
参考文献
- Frazão, B., Vasconcelos, V., Antunes, A. Sea anemone (Cnidaria, Anthozoa, Actiniaria) toxins: an overview. Marine Drugs. 10 (8), 1812-1851 (2012).
- Jayathilake, J. M. N. J., Gunathilake, K. V. K. Cnidarian toxins: recent evidences for potential therapeutic uses. The European Zoological Journal. 87 (1), 708-713 (2020).
- Ramírez-Carreto, S., Miranda-Zaragoza, B., Rodríguez-Almazán, C. Actinoporins: From the structure and function to the generation of biotechnological and therapeutic tools. Biomolecules. 10 (4), 539 (2020).
- Fautin, D. G. Structural diversity, systematics, and evolution of cnidae. Toxicon. Official Journal of the International Society on Toxinology. 54 (8), 1054-1064 (2009).
- Moran, Y., et al. Analysis of soluble protein contents from the nematocysts of a model sea anemone sheds light on venom evolution. Marine Biotechnology. 15 (3), 329-339 (2013).
- Moran, Y., et al. Neurotoxin localization to ectodermal gland cells uncovers an alternative mechanism of venom delivery in sea anemones. Proceedings of the Royal Society B: Biological Sciences. 279 (1732), 1351-1358 (2012).
- Grabski, A. C. Advances in preparation of biological extracts for protein purification. Methods in Enzymology. 463, 285-303 (2009).
- Bulati, M., et al. Partially purified extracts of sea anemone Anemonia viridis affect the growth and viability of selected tumour cell lines. BioMed Research International. 2016, 3849897 (2016).
- Orts, D. J. B., et al. Biochemical and electrophysiological characterization of two sea anemone type 1 potassium toxins from a geographically distant population of Bunodosoma caissarum. Marine Drugs. 11 (3), 655-679 (2013).
- Hader, D., Erzinger, G. . Bioassays: Advanced Methods and Applications. , (2017).
- Anderluh, G., Macek, P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria). Toxicon: Official Journal of the International Society on Toxinology. 40 (2), 111-124 (2002).
- Nevalainen, T. J., et al. Phospholipase A2 in cnidaria. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 139 (4), 731-735 (2004).
- Razpotnik, A., et al. A new phospholipase A2 isolated from the sea anemone Urticina crassicornis - its primary structure and phylogenetic classification. The FEBS Journal. 277 (12), 2641-2653 (2010).
- Dennis, E. A., Cao, J., Hsu, Y. -. H., Magrioti, V., Kokotos, G. Phospholipase A2 enzymes: Physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chemical Reviews. 111 (10), 6130-6185 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Kwon, Y. -. C., Jewett, M. C. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Scientific Reports. 5, 8663 (2015).
- Eno, A. E., Konya, R. S., Ibu, J. O. Biological properties of a venom extract from the sea anemone, Bunodosoma cavernata. Toxicon: Official Journal of the International Society on Toxinology. 36 (12), 2013-2020 (1998).
- Morales-Landa, J. L., et al. Antimicrobial, antiprotozoal, and toxic activities of Cnidarian extracts from the Mexican Caribbean Sea. Pharmaceutical Biology. 45 (1), 37-43 (2007).
- Sánchez-Rodríguez, J., Cruz-Vazquez, K. Isolation and biological characterization of neurotoxic compounds from the sea anemone Lebrunia danae (Duchassaing and Michelotti, 1860). Archives of Toxicology. 80 (7), 436-441 (2006).
- de Oliveira, J. S., et al. Caissarolysin I (Bcs I), a new hemolytic toxin from the Brazilian sea anemone Bunodosoma caissarum: purification and biological characterization. Biochimica Et Biophysica Acta. 1760 (3), 453-461 (2006).
- Norton, R. S., et al. Purification and characterisation of proteins with cardiac stimulatory and haemolytic activity from the anemone Actinia tenebrosa. Toxicon: Official Journal of the International Society on Toxinology. 28 (1), 29-41 (1990).
- Gondran, M., Eckeli, A. L., Migues, P. V., Gabilan, N. H., Rodrigues, A. L. S. The crude extract from the sea anemone, Bunodosoma caissarum elicits convulsions in mice: possible involvement of the glutamatergic system. Toxicon: Official Journal of the International Society on Toxinology. 40 (12), 1667-1674 (2002).
- Dion, A. S., Pomenti, A. A. Ammoniacal silver staining of proteins: mechanism of glutaraldehyde enhancement. Analytical Biochemistry. 129 (2), 490-496 (1983).
- Ramírez-Carreto, S., et al. Identification of a pore-forming protein from sea anemone Anthopleura dowii Verrill (1869) venom by mass spectrometry. The Journal of Venomous Animals and Toxins Including Tropical Diseases. 25, 147418 (2019).
- Nelson, G. J. Studies on the lipids of sheep red blood cells. I. Lipid composition in low and high potassium red cells. Lipids. 2 (1), 64-71 (1967).
- Ramírez-Carreto, S., et al. Transcriptomic and proteomic analysis of the tentacles and mucus of Anthopleura dowii Verrill, 1869. Marine Drugs. 17 (8), 436 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。