Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Deniz Anemonlardan Elde Edilen Ham Ekstraktlarda Hemolitik ve Fosfolipaz Aktivitesinin Basit Biyotahlillerle Tanımlanması
Bu Makalede
Özet
Burada, deniz anemonundan ham zehir ekstraktı elde etmek ve hemolitik ve fosfolipaz aktivitesini tespit etmek için bir protokol tarif ediyoruz.
Özet
Deniz anemon zehiri bileşimi polipeptit ve protein olmayan molekülleri içerir. Sitolitik bileşenler, yeni moleküler araçların tasarlanması için yüksek biyoteknolojik ve biyomedikal potansiyele sahiptir. Deniz anemon zehiri, ektodermden glandüler hücrelerde ve her ikisi de deniz anemon gövdesi boyunca dağılmış olan nematokistler adı verilen alt hücresel yapılarda bulunur. Bu özellik zorluklar anlamına gelir, çünkü zehir bileşenlerini diğer toksik olmayan moleküllerle serbest bırakmak için hücreler ve nematosist lize edilmelidir. Bu nedenle, ilk olarak, zehir ham bir ekstrakttan (farklı ve çeşitli moleküllerin ve doku kalıntılarının karışımı) türetilir. Bir sonraki adım, spesifik biyoaktivitelere sahip polipeptitleri tespit etmektir. Burada, sitolisinlerin varlığını tanımlamak için deniz anemonunun ham ekstraktını ve biyotahlilini elde etmek için etkili bir strateji açıklıyoruz. İlk adım, sitolisinleri serbest bırakmak için ucuz ve basit teknikleri (karıştırılmış ve dondurarak çözülme döngüsü) içerir. En yüksek sitolitik aktiviteyi ve proteini elde ettik (20 g kuru ağırlıktan ~ 500 mg protein). Daha sonra, ekstraktın polipeptit karmaşıklığı, 10 kDa ile 250 kDa arasında moleküler ağırlıklara sahip proteinleri tespit eden SDS-PAGE jeli ile analiz edildi. Hemolitik tahlilde koyun kırmızı kan hücreleri kullandık ve HU50 (11.1 ± 0.3 μg / mL) belirledik. Buna karşılık, ham ekstraktta fosfolipazların varlığı, agarozlu katı bir ortamda substrat olarak yumurta sarısı kullanılarak belirlendi. Genel olarak, bu çalışma ham ekstraktı hazırlamak için verimli ve ucuz bir protokol kullanır ve sitolisinleri, biyoteknolojik ve biyomedikal çıkarları olan molekülleri tanımlamak için tekrarlanabilir biyotahliller uygular.
Giriş
Deniz hayvanları, biyolojik olarak aktif bileşiklerin zengin bir kaynağıdır. Son yıllarda, deniz anemon zehirinin bileşimi, hemolitik , sitotoksik, enzimatik (fosfolipaz, proteaz, kitinaz) ve nörotoksik aktiviteye sahip polipeptitlerin çeşitliliğini ve proteolitik aktivite üzerindeki inhibitör etkileri içerdiğinden bilimsel dikkat çekmiştir1. Ek olarak, bu polipeptitler biyoteknolojik ve terapötik kullanımda moleküler araçların geliştirilmesi için potansiyel kaynaklardır 2,3.
Deniz anemon zehiri ve moleküler bileşenleri hakkında, zehirin elde edilmesinin, hatta izolasyonun ve toksinlerin karakterizasyonunun karmaşıklığı nedeniyle çok az rapor vardır. Raporlarda kullanılan ekstraksiyon yöntemleri, zehir üretimi ile ilişkili ve ilgisi olmayan hücrelerin içeriğinin lizis ve boşaltılmasını içeriyordu1.
Tüm cnidarian'larda özel bir özellik, tek bir anatomik bölgede merkezileştirilmiş zehirin üretimi ve serbest bırakılması için bir sistemin olmamasıdır. Bunun yerine, nematosistler zehiritutan yapılardır 4,5. Epidermal bez hücreleri olarak adlandırılan diğer hücre tipleri de toksinler salgılar ve ayrıca deniz anemonlarının vücuduna dağılır6.
Zehirin elde edilmesindeki ilk ve en önemli zorluk, kararsız proteinlerin inaktivasyonu veya bozulması olmadan, sonraki işlemlerde yeterli manipülasyona sahip bir ekstraktın üretilmesidir. Daha sonra, hücreler lize edilmeli ve bileşenler - bu durumda, polipeptitler verimli ve hızlı bir şekilde ekstrakte edilmeli, proteoliz ve hidrolizden kaçınırken, diğer hücresel bileşenleri ortadan kaldırmalıdır7.
Bir deniz anemonunun ham ekstraktını elde etmek için farklı yöntemler kullanılır; bazıları organizmayı feda etmeyi içerirken, diğerleri canlı tutulmasına izin verir. Organizmanın tüm vücudunun kullanımını ima eden yöntemler, zehirin sadece bazı bileşenlerini çıkaran organizmaları canlı tutan yöntemlere kıyasla, zehir8'den çoğu toksinin salınmasına izin verir9. Bir ekstraktın hazırlanması, ilgilenilen bir maddenin varlığının ve gücünün, farmakolojik etkileri in vivo veya in vitro yöntemlerle gözlemleme stratejilerini içeren belirli bir biyotahlil yoluyla değerlendirilmesini gerektirir10.
Deniz anemon zehiri sitolitik polipeptitler, gözenek oluşturan toksinler (PFT'ler)11 ve fosfolipazlar12 içerir; Bu moleküller, protein-lipid etkileşimi, kanser terapisindeki moleküler araçlar ve nanopore3'e dayanan biyosensörlerin incelenmesinde modellerdir. Deniz anemonlu PFT'lerin sınıflandırılması, boyutlarına veya moleküler ağırlıklarına göre, 5 kDa'dan 80 kDa'ya kadar gerçekleştirilir. En çok çalışılan ve aktinoporinler11 olarak bilinen 20 kDa PFT, antikanser, antimikrobiyal ve nanopor bazlı biyosensörler gibi olası uygulamalar için moleküler araçların geliştirilmesindeki biyomedikal potansiyeli nedeniyle özellikle ilgi çekicidir. Fosfolipazlar, özellikle fosfolipaz A2 (PLA2)13 dahil olmak üzere başka bir sitolisin, bir yağ asidi nedeniyle serbest bırakır ve fosfolipitleri hidrolize ederek hücre zarını dengesizleştirir. Bu etki mekanizması nedeniyle, PLA2, enflamatuar hastalıklardaki çalışma ve uygulamalar için önemli bir model olmayı vaat etmektedir. Hücre zarındaki lipit davranışı çalışmaları için bir model olarak hizmet edebilir14.
Burada, deniz anemonundan ham ekstrakt elde etmek için etkili bir protokol açıklıyoruz Anthopleura dowii Verrill, 1869 ve hemolizinleri ve fosfolipazları tespit etmek. Her ikisi de yeni moleküler araçlar tasarlamak için bir şablon olarak kullanılabilecek ilgili toksinlerdir.
Protokol
Deniz anemonları, Meksika Federal Hükümeti Ulusal Su Ürünleri Yetiştiriciliği, Balıkçılık ve Gıda Komisyonu yönergelerine göre toplanmıştır (izin numarası PPF / DGOPTA 07332.250810.4060). Meksika Ulusal Özerk Üniversitesi Biyoteknoloji Enstitüsü Biyoetik Komitesi, deniz anemonlarıyla yapılan tüm deneyleri onayladı. Koyun kanı örneği, Hayvansal Üretim ve Sağlık Pratik Öğretim ve Araştırma Merkezi'nden (CEPIPSA, Meksika Ulusal Özerk Üniversitesi) satın alındı.
1. Organizma toplama
- Deniz anemonunu A. dowii'yi toplayın.
NOT: Burada, organizmalar düşük gelgit dönemlerinde Ensenada Baja, Kaliforniya, Meksika kıyılarındaki intertidal bölgede toplanmıştır (Şekil 1A, B). - Organizmaları deniz suyu içeren kaplarda laboratuvara taşır (Şekil 1C).
- Laboratuvarda, vücuda yapışan büyük substrat parçacıklarını çıkarmak için organizmaları elle damıtılmış suyla temizleyin.
- Organizmaları derhal -80 ° C'de ultra dondurucuda 72 saat boyunca dondurun.
- Organizmaları, 48 saat boyunca -20 ° C, 0.015 psi liyofilizasyon koşulları ile dondurarak kurutma için özel bardaklara yerleştirin.
- Liyofilize organizmaları kullanıma kadar -20 °C'de saklayın.
2. Doku hidrasyonu
- Liyofilize organizmaların 20 g kuru ağırlığını, 60 mL (1/3 w/v) 50 mM sodyum fosfat tamponu, pH 7.5 ve 1 inhibitör kokteyl tableti (Malzeme Tablosu) ile yeniden oluşturun.
- Manyetik bir karıştırıcıda, numuneyi 12 saat boyunca ~ 800 rpm, 4 ° C'de sürekli olarak karıştırın.
3. Toksin salınımı
- Hücre lizisini ve nematokist deşarjını indüklemek için, numuneyi 12 saat boyunca -20 ° C'de dondurun ve daha sonra% 90'a kadar çözülene kadar kabı oda sıcaklığında (RT) suya koyun. Bu yordamı üç kez tekrarlayın.
NOT: Numune %100 çözülmez; protein bozulmasını önlemek için numuneyi ~ 4 ° C'de tutmak çok önemlidir. - Konfokal mikroskop altında boşaltılan nematosisti gözlemleyin. Numunenin 10 μL'sini bir slayta alın ve üzerine bir kapak kayması yerleştirin. Konfokal mikroskop altında 100x ve 60x büyütmede gözlemleyin. Burada bir boya gerekli değildi.
- Konfokal mikroskopta yakalanan görüntüleri ImageJ yazılımında işleyin (sürüm 1.53c, Wayne Rasband, Ulusal Sağlık Enstitüleri, ABD, https://imagej.nih.gov/ij).
- Nematosist içindeki tübül açılır ve dışarıdaysa, nematosistler boşaltılır; ardından bir sonraki adımla devam edin. Aksi takdirde, sadece bir tane daha donma-çözülme döngüsü yapın.
- Ekstraktı netleştirmek için, numuneyi 40 dakika, 4 ° C boyunca 25.400 x g'de santrifüj yapın, süpernatanı geri kazanın ve tekrar santrifüj yapın. Bu adımı 3-4 kez tekrarlayın.
- Süpernatantı kurtarın ve peleti atın. Süpernatant veya ham ekstrakt, zehir bileşenlerini (toksinler) ve lipitler, karbonhidratlar ve nükleik asitler gibi diğer hücre moleküllerini içerir.
4. Toplam proteinin kantitasyonu
- Ticari bir Bradford kolorimetrik tahlil15 kiti (Malzeme Tablosu) kullanarak ham ekstraktın protein konsantrasyonunu belirleyin.
- Boya reaktifini seyreltin (dört parça damıtılmış su ile boyanın bir kısmı).
- Sığır serum albümini (BSA) Fraksiyon V (Malzeme Tablosu) çözeltisini fosfat tamponunda (50 mM sodyum fosfat, pH 7.5) 1 mg/mL konsantrasyonda hazırlayın.
- Tablo 1'de listelenen çözümleri üçlü olarak hazırlayın.
- Her bir çözeltiyi 4 s boyunca bir çalkalayıcıda kuvvetlice karıştırın.
- Numuneleri RT'de 5 dakika boyunca titremeden inkübe edin.
- 595 nm'de absorbansı (AU) ölçün.
- Örnek BSA absorbanslarının ortalamalarını çizin (AU vs protein konsantrasyonu) ve grafiğin denklemini belirleyin (Denklem 1).
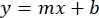 Denklem 1
Denklem 1
burada y absorbanstır, m çizginin eğimidir, x protein konsantrasyonudur ve b y-kesişimidir. Ham ekstrakt konsantrasyonunu hesaplamak için, x için aşağıdaki gibi çözün: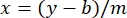 Denklem 2
Denklem 2
5. Polipeptit zehir karmaşıklığını belirleyin
- Dikey jel elektroforezi için cam kabı kılavuza göre monte edin.
- Akrilamid karışımı hazırlayın (% 30): 29.2 g akrilamid , 0.8 g bis-akrilamid , 100 mL'lik son hacim. Çözeltiyi 0,45 μm membran kullanarak filtreleyin. Çözeltiyi 4 ° C'de karanlık bir şişede saklayın. Ardından, karışımı çözücü jel için hazırlayın (Tablo 2).
- SDS-PAGE jeli, bir çözme jeli ve bir istifleme jelinden oluşur. Jelleri Tablo 2'de tanımlanan çözelti hacimlerine göre hazırlayın. Hazırlama sırasında, polimerizasyon süresini azaltmak için her karışımı 4 ° C'de tuttuğunuzdan emin olun.
NOT: Her karışımın hacmi, kullanılan ekipmanın markasına bağlı olarak değişir; Bu protokol için, hacimler dikey bir elektroforez odası (Malzeme Tablosu) için 0.75 mm kalınlığında% 15 akrilamid jelin hazırlanmasına karşılık gelir. - Akrilamid polimerize olduktan sonra, ~ 10 dakika, istifleme jeli karışımını ekleyin.
- İstifleme jeli için karışımı hazırlayın, hemen cam plakalara ekleyin ve numuneleri yüklemek için kuyucukları oluşturmak için bir tarak yerleştirin.
- İstifleme jeli polimerize olduktan sonra (~ 15 dakika), tarağı çıkarın ve cam kabı dikey elektroforez için bir odaya yerleştirin.
- Elektroforez odasına 200 mL elektrot tamponu (0.25 M Tris, 0.192 M glisin, % 0.1 SDS) yerleştirin.
- Ham ekstraktı analiz edin: Proteinleri denatüre etmek için 30 μg ham ekstraktı 5 μL protein yükleme tamponu (% 25 gliserol,% 15 sodyum dodesil sülfat,% 25 2-merkaptoetanol, 0.125 mM Tris pH 7, bromofenol mavisi 0.1 mg / mL) ile karıştırın. Son hacim <50 μL olmalıdır.
- 5 dakika boyunca 90 °C'de ısıtın, serin ve 1.400 x g'de 3 sn santrifüj yapın.
- Numuneleri istifleme jelinin kuyucuklarına yükleyin. Standart bir moleküler ağırlık merdiveni yükleyin.
- Elektroforezi 1 saat 30 dakika boyunca 25 mA sabitinde çalıştırın.
- Jel proteinlerinin boyanmasına devam etmek için cam kapları elektroforez odasından çıkarın.
6. Protein boyama
- Tampon elektrodundaki kalıntıları gidermek için jeli 50 mL damıtılmış suda durulayın.
- Suyu atın.
- Jel proteinlerinin difüzyonunu önlemek için, fiksasyon çözeltisini (60 mL etanol, 20 mL asetik asit ve 20 mL damıtılmış su, son hacim 100 mL) ekleyin. RT'de 80 rpm'de sallama ile 40 dakika boyunca kuluçkaya yatırın. Çözümü boşaltın.
- Protein çapraz bağlama çözeltisini (15 mL etanol, 0.25 mL glutaraldehit, 50 mL damıtılmış su, son hacim 65.25 mL) ekleyin ve RT'de 80 rpm'de çalkalayarak 30 dakika kuluçkaya yatırın. Çözümü kaldırın.
- Jeli 5 dakika boyunca 100 mL damıtılmış suyla yıkayın ve suyu çıkarın. Bu yordamı dört kez tekrarlayın.
- RT'deki bir laboratuvar döner osilatöründe 15 dakika boyunca 60 rpm'de karıştırarak 50 mL Coomassie parlak mavi R-250 filtrelenmiş çözelti (%40 metanol, %10 asetik asit, %50 damıtılmış su, %0,1 boya, son hacim 100 mL) ile protein boyama işlemini gerçekleştirin.
- Diğer jelleri boyamak için kullanılabilecek çözeltiyi geri kazanın.
- Fazla boyayı ortadan kaldırmak için, bir leke giderme çözeltisi ekleyin (40 mL metanol, 10 mL asetik asit, 50 mL damıtılmış su). Bantlar (lekeli proteinler) görselleşene kadar RT'de karıştırmaya (80 rpm) devam edin.
- Jeli 50 mL damıtılmış suda tutun ve görüntüyü bir Jel dokümantasyon sisteminde tarayın.
7. Kırmızı kan hücresi çözeltisi hazırlayın
- Bir koyunun juguler damarından 1 mL kan çıkarın.
- İğneyi şırıngadan çıkarın ve kanı derhal 50 mL Alsever çözeltisi (0.002 M sitrik asit, 0.07 M NaCl, 0.1 M dekstroz ve antikoagülan olarak 0.027 M sodyum sitrat, pH 7.4) içeren bir tüpe boşaltın.
- Çözeltiyi yavaşça üç kez tersine çevirin.
- Laboratuvara transfer için 4 °C'de tutun.
- 4 °C'de 5 dakika boyunca 804 x g'de santrifüj yapın ve süpernatanı atın.
- Peleti 30 mL Alsever çözeltisinde yeniden askıya alın. Çözeltiyi tüpün iç duvarları boyunca kaydırarak ekleyin ve bir Pasteur plastik pipet kullanarak hücreleri yavaşça askıya alın. 5 dakika, 4 ° C için 804 x g'de tekrar santrifüj. Süpernatant netleşene kadar bu prosedürü tekrarlayın.
- 15 mL Alsever çözeltisi ekleyin; Peleti bir Pasteur plastik pipet ile yavaşça askıya alın.
- Yaklaşık olarak 2 x 106 hücre / mL konsantrasyon elde etmek için Alsever çözeltisinin son hacmini koruyun. Ardından, hücreleri saymak için bir Neubauer odası veya hemositometre kullanın.
NOT: Hemasitometre slaytındaki eritrositleri sayın (Geliştirilmiş Neubauer). Slayt, 30 mm x 70 mm x 4 mm'lik bir slayttır. Merkezde iki gümüş ayak plakası (Şekil 2A) (bir üst ve bir alt ızgara), her biri 3 mm x 3 mm ve ızgaranın yanlarında iki kanal vardır. Hücreleri sayma köşe ve merkez karelerdedir ( Şekil 2B'deki kırmızı kareler). Sayma için en uygun hücre konsantrasyonu 106 hücre sırasına göre olmalıdır. Merkezi kutu, 0.0001 mL'ye eşdeğer olan 0.1cm2'lik bir yüzey alanına sahiptir. - Slaytın üzerine bir kapak kapağı yerleştirin.
- Numunenin 10 μL'sini slayt ve kapak kayması arasına yerleştirin ve numunenin dağılmasını bekleyin.
- Optik mikroskopta (büyütme 60x), sayımı ilk kare kutuda gerçekleştirin. Yalnızca orta ızgaradaki hücreleri ve kutunun üst veya sol kenar boşluğuna dokunanları sayın.
- Aşağıdaki denklemi kullanarak hücre konsantrasyonunu belirleyin:
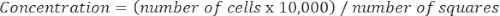 Denklem 3
Denklem 3
Numune çok konsantre ise ve seyreltme gerekiyorsa, aşağıdaki denklemi kullanın: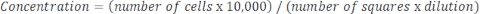 Denklem 4
Denklem 4
NOT: Hemoliz testi için eritrosit çözeltisini alırken, çözeltiyi plastik bir Pasteur pipetle yavaşça homojenize edin. - Hatayı azaltmak için üçlü bölümdeki adımları uygulayın.
8. Hemoliz testi
- Tablo 3'te belirtilen çözelti karışımlarını (üçlü olarak) konik 96 delikli plakalarda hazırlayın.
NOT: Homojen bir süspansiyon sağlamak için eritrositleri yavaşça karıştırın. - 37 °C'de 1 saat boyunca titremeden inkübe edin.
- Plakayı 4 ° C'de 5 dakika boyunca 804 x g'de santrifüj yapın.
- Süpernatantı düz tabanlı başka bir 96 delikli plakada kurtarın.
- Ham ekstrakt sitolisinler içeriyorsa, eritrositler hemoglobini lize eder ve serbest bırakır. Absorbansı 415 nm'de okuyun.
- Aşağıdaki denklemi kullanarak hemoliz yüzdesini hesaplayın:
% Hemoliz = ((Ham ekstrakt-AAlsever tamponu) / (AH2O-AAlsever)) x 100
NOT: Ham ekstrakt, AAlsever tamponu ve AH2O, sırasıyla ham ekstrakt ile eritrositlerin emilimine, Alsever çözeltisinin emilimine ve damıtılmış suyun emilimine karşılık gelir. - Her dondurma ve çözülme döngüsünden önce ve sonra, ham ekstrakttan toplam 50 μg protein ile bir hemoliz testi yapın.
- % 100 hemolitik aktiviteye ulaşmak için gereken donma ve çözülme döngülerinin sayısını belirleyin.
- Eritrositlerin% 50'sinde hemoliz üreten ekstrakt miktarını hesaplayın (HU50); Tablo 3'te açıklanan aynı protokolü takip edin, deniz anemonu ham ekstraktının miktarını artırın ve uygun yazılımı kullanarak grafiği sigmoidal ayarlamalarla tasarlayın (örneğin, Menşe, Malzeme Tablosu).
9. Fosfolipaz testi
- Bir tavuk yumurtasını% 1 SDS ile damıtılmış suda yıkayın.
- Yumurta sarısını steril koşullar altında yumurta akından ayırın.
- 50 mL% 0.86 NaCl çözeltisi hazırlayın ve 0.22 μm'lik bir filtreden süzün. Ardından, Çözelti A'yı hazırlayın: 12 mL yumurta sarısı ve 36 mL% 0.86 NaCl çözeltisi ekleyin.
- B Çözeltisini Hazırlayın: 50 mL tamponda (50 mM Tris, pH 7.5) 300 mg agarozu karıştırın, 0.22 μm'lik bir filtreden süzün. Çözeltiyi kaynayana kadar bir mikrodalgada ısıtın. 43-45 ° C'ye ulaşmak için ılık suda soğutun.
- C Çözeltisini Hazırlayın: 10 mM CaCl2 hazırlayın ve 0,22 μm'lik bir filtreyle filtreleyin.
- Çözelti D'yi hazırlayın: 1 mL damıtılmış suda 10 mg rodamin 6G.
- Steril koşullar altında (laminer akış başlığı), B çözeltisine 500 μL A ve C çözeltisi ve 100 μL çözelti D ekleyin, karıştırın ve her Petri kabına (90 x 15 mm) 25 mL dökün.
- Çözeltinin steril koşullar altında katılaşmasını bekleyin (30 dakika).
- İnce bir tüp ile kuyucuklar (~ 2-3 mm çapında) yapın.
- Bir kuyucuğa toplam 20 μL fosfat tamponu (negatif kontrol) ve başka bir kuyucuğa 20 μL belirlenmiş bir fosfolipaz (pozitif kontrol) ekleyin.
- Ham ekstrakt proteininin farklı miktarlarını, 5, 15, 25, 35, 45 μg, kalan kuyucuklara, her biri 20 μL'lik bir son hacimde yerleştirin.
- Agar'ın tüm örnekleri adsorbe etmesini bekleyin (30 dakika).
- 20 saat boyunca 37 °C'de inkübe edin.
- Kuyunun etrafında bir halo oluşursa, bu fosfolipaz aktivitesini gösterir. Vernier kumpas ile oluşan haleyi ölçün.
NOT: Denemeyi üçlü olarak gerçekleştirin (9.1-9.14 arasındaki adımlar).
Sonuçlar
Deniz anemonunun ham ekstraktını elde etmek için kullanılan protokolün temsili sonuçları, iki tekniğin (ajitasyon ve donma ve çözülme döngüleri) birleştirilmesinin nematosistlerin etkili bir şekilde boşaltılmasını sağladığını ve toplam protein miktarının 500 mg (8 mg / mL) olduğunu göstermiştir (Şekil 3).
Ham ekstraktın protein karmaşıklığı, SDS-PAGE elektroforezi yoluyla 10 kDa'dan ve 250 kDa'dan daha büyük olarak gözlemlene...
Tartışmalar
Bilim ve endüstrinin farklı alanlarındaki uygulamalara sahip yeni bileşiklere olan yüksek talep, zehir çalışmalarına yol açmıştır. Venom, yeni moleküler araçlar üretmek için bir şablon görevi gören zengin bir molekül kaynağını temsil eder. Bununla birlikte, bu zehirlerin karmaşıklığı, bunları elde etmek ve incelemek için çeşitli yöntemlerin uygulanmasını ve birleştirilmesini gerektirir.
Burada, liyofilize örneklerle başlayan diğer deniz anemon türlerini...
Açıklamalar
Yazarlar, bu makalenin yayınlanmasıyla ilgili olarak rakip bir çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışma Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT) tarafından IT200819 hibe numarası ile desteklenmiştir. Yazarlar, Tom Musselman, Rock Paper Editing, LLC'ye bu makalenin İngilizce dilbilgisini kontrol ettiği için teşekkür eder; ve Samanta Jiménez (CICESE, Ensenada) ve Juan Manuel Barbosa Castillo'nun (Instituto de Fisiología Celular, UNAM) teknik yardımı. Ayrıca koyun kanı elde ettiği için Dr. Augusto César Lizarazo Chaparro'ya (CEPIPSA) teşekkür ederiz. Özellikle ICAT-UNAM Dr. José Saniger Blesa'ya video kaydı için laboratuvarındaki tesisler için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Corning | 430766 | |
| 2-Bromophenol blue | Sigma | B75808 | |
| 2-mercaptoetanol | Sigma-Aldrich | M6250-100ML | |
| 50 mL conical centrifuge tubes | Corning | 430828 | |
| Acetic Acid Glacial | J.T. Baker | 9515-03 | |
| Acrylamide | Promega | V3115 | |
| Agarose | Promega | V3125 | |
| Bisacrylamide | Promega | V3143 | |
| Bovine Serum Albumin Fraction V | Sigma | A3059-100G | |
| Bradford Protein Assays | Bio-Rad | 5000006 | |
| Calcium chloride | Sigma-Aldrich | C3306 | |
| Cell culture plates 96 well, V-bottom | Corning | 3894 | |
| Centrifuge | Eppendorf | 5804R | |
| Centrifuge tubes | Corning | CLS430829 | |
| ChemiDoc MP system | Bio-Rad | 1708280 | |
| Citric acid | Sigma-Aldrich | 251275 | |
| Clear flat.bottom 96-Well Plates | Thermo Scientific | 3855 | |
| Coomassie Brilliant Blue G-250 | Bio-Rad | #1610406 | |
| Coomassie brilliant blue R-250 | Bio-Rad | 1610400 | |
| Dextrose | J.T. Baker | 1916-01 | |
| Ductless Enclosure | Labconco | Vertical | https://imagej.nih.gov/ij ImageJ 1.53c |
| Gel Doc EZ | Bio Rad. | Gel Documentation System | |
| Glycerol | Sigma-Aldrich | G5516-4L | |
| Hemocytometer | Marienfeld | 650030 | |
| ImageJ (Software) | NIH, USA | Version 1.53c | |
| Incubator 211 | Labnet | I5211 DS | |
| Methanol | J.T. Baker | 9049-03 | |
| Mini-PROTEAN tetra cell | Bio-Rad | 1658000EDU | |
| Na2HPO4 | J.T. Baker | 3824-01 | |
| NaCl | J.T. Baker | 3624-01 | |
| NaH2PO4.H2O | J.T. Baker | 3818-05 | |
| Origin software | version 9 | To design the plot with sigmoidal adjustments | |
| Petridish | Falcon | 351007 | |
| Pipetman kit | Gilson | F167380 | |
| Precast mini gel | BioRad | 1658004 | |
| Prestained Protein Ladder | Thermo Scientific | 26620 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | |
| Rhodamine 6G | Sigma-Aldrich | 252433 | |
| SDS | Sigma-Aldrich | L4509 | |
| Sodium citrate dihydrate | JT Baker | 3646-01 | |
| Spectrophotometer | THERMO SCIENTIFIC | G10S UV-VIS | |
| Tris Base | Sigma-Aldrich | 77-86-1 | |
| Volt Power Supply | Hoefer | PS300B |
Referanslar
- Frazão, B., Vasconcelos, V., Antunes, A. Sea anemone (Cnidaria, Anthozoa, Actiniaria) toxins: an overview. Marine Drugs. 10 (8), 1812-1851 (2012).
- Jayathilake, J. M. N. J., Gunathilake, K. V. K. Cnidarian toxins: recent evidences for potential therapeutic uses. The European Zoological Journal. 87 (1), 708-713 (2020).
- Ramírez-Carreto, S., Miranda-Zaragoza, B., Rodríguez-Almazán, C. Actinoporins: From the structure and function to the generation of biotechnological and therapeutic tools. Biomolecules. 10 (4), 539 (2020).
- Fautin, D. G. Structural diversity, systematics, and evolution of cnidae. Toxicon. Official Journal of the International Society on Toxinology. 54 (8), 1054-1064 (2009).
- Moran, Y., et al. Analysis of soluble protein contents from the nematocysts of a model sea anemone sheds light on venom evolution. Marine Biotechnology. 15 (3), 329-339 (2013).
- Moran, Y., et al. Neurotoxin localization to ectodermal gland cells uncovers an alternative mechanism of venom delivery in sea anemones. Proceedings of the Royal Society B: Biological Sciences. 279 (1732), 1351-1358 (2012).
- Grabski, A. C. Advances in preparation of biological extracts for protein purification. Methods in Enzymology. 463, 285-303 (2009).
- Bulati, M., et al. Partially purified extracts of sea anemone Anemonia viridis affect the growth and viability of selected tumour cell lines. BioMed Research International. 2016, 3849897 (2016).
- Orts, D. J. B., et al. Biochemical and electrophysiological characterization of two sea anemone type 1 potassium toxins from a geographically distant population of Bunodosoma caissarum. Marine Drugs. 11 (3), 655-679 (2013).
- Hader, D., Erzinger, G. . Bioassays: Advanced Methods and Applications. , (2017).
- Anderluh, G., Macek, P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria). Toxicon: Official Journal of the International Society on Toxinology. 40 (2), 111-124 (2002).
- Nevalainen, T. J., et al. Phospholipase A2 in cnidaria. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 139 (4), 731-735 (2004).
- Razpotnik, A., et al. A new phospholipase A2 isolated from the sea anemone Urticina crassicornis - its primary structure and phylogenetic classification. The FEBS Journal. 277 (12), 2641-2653 (2010).
- Dennis, E. A., Cao, J., Hsu, Y. -. H., Magrioti, V., Kokotos, G. Phospholipase A2 enzymes: Physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chemical Reviews. 111 (10), 6130-6185 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Kwon, Y. -. C., Jewett, M. C. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Scientific Reports. 5, 8663 (2015).
- Eno, A. E., Konya, R. S., Ibu, J. O. Biological properties of a venom extract from the sea anemone, Bunodosoma cavernata. Toxicon: Official Journal of the International Society on Toxinology. 36 (12), 2013-2020 (1998).
- Morales-Landa, J. L., et al. Antimicrobial, antiprotozoal, and toxic activities of Cnidarian extracts from the Mexican Caribbean Sea. Pharmaceutical Biology. 45 (1), 37-43 (2007).
- Sánchez-Rodríguez, J., Cruz-Vazquez, K. Isolation and biological characterization of neurotoxic compounds from the sea anemone Lebrunia danae (Duchassaing and Michelotti, 1860). Archives of Toxicology. 80 (7), 436-441 (2006).
- de Oliveira, J. S., et al. Caissarolysin I (Bcs I), a new hemolytic toxin from the Brazilian sea anemone Bunodosoma caissarum: purification and biological characterization. Biochimica Et Biophysica Acta. 1760 (3), 453-461 (2006).
- Norton, R. S., et al. Purification and characterisation of proteins with cardiac stimulatory and haemolytic activity from the anemone Actinia tenebrosa. Toxicon: Official Journal of the International Society on Toxinology. 28 (1), 29-41 (1990).
- Gondran, M., Eckeli, A. L., Migues, P. V., Gabilan, N. H., Rodrigues, A. L. S. The crude extract from the sea anemone, Bunodosoma caissarum elicits convulsions in mice: possible involvement of the glutamatergic system. Toxicon: Official Journal of the International Society on Toxinology. 40 (12), 1667-1674 (2002).
- Dion, A. S., Pomenti, A. A. Ammoniacal silver staining of proteins: mechanism of glutaraldehyde enhancement. Analytical Biochemistry. 129 (2), 490-496 (1983).
- Ramírez-Carreto, S., et al. Identification of a pore-forming protein from sea anemone Anthopleura dowii Verrill (1869) venom by mass spectrometry. The Journal of Venomous Animals and Toxins Including Tropical Diseases. 25, 147418 (2019).
- Nelson, G. J. Studies on the lipids of sheep red blood cells. I. Lipid composition in low and high potassium red cells. Lipids. 2 (1), 64-71 (1967).
- Ramírez-Carreto, S., et al. Transcriptomic and proteomic analysis of the tentacles and mucus of Anthopleura dowii Verrill, 1869. Marine Drugs. 17 (8), 436 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır