このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
簡単なバイオアッセイによる海アネモンからの粗抽出物中の溶血性およびホスホリパーゼ活性の同定
要約
ここでは、イソギンチャクから粗毒抽出物を取得し、その溶血作用およびホスホリパーゼ活性を検出するためのプロトコールについて記載する。
要約
イソギンチャク毒組成物は、ポリペプチド分子および非タンパク質分子を含む。細胞溶解成分は、新しい分子ツールを設計するための高いバイオテクノロジーおよび生物医学的可能性を秘めています。イソギンチャク毒は、線虫嚢胞と呼ばれる外胚葉および細胞下構造からの腺細胞に位置し、どちらもイソギンチャク体全体に分布している。この特性は、細胞および線虫嚢胞を溶解して他の非毒性分子と共に毒成分を放出しなければならないため、課題を意味する。したがって、まず、毒は粗抽出物(異なる多様な分子および組織破片の混合物)に由来する。次のステップは、特異的な生理活性を有するポリペプチドを検出することである。ここで、イソギンチャク粗抽出物を得るための効率的な戦略と、サイトライシンの存在を同定するためのバイオアッセイについて説明する。最初のステップは、細胞ライシンを放出するための安価で簡単な技術(攪拌および凍結融解サイクル)を含む。我々は、最も高い細胞溶解活性およびタンパク質(乾燥重量の20gから〜500mgのタンパク質)を得た。次に、抽出物のポリペプチド複雑性をSDS−PAGEゲルによって分析し、10kDa〜250kDaの間の分子量を有するタンパク質を検出した。溶血アッセイでは、ヒツジ赤血球を使用し、HU50 (11.1 ± 0.3 μg/mL)を測定した。対照的に、粗抽出物中のホスホリパーゼの存在は、アガロースを有する固体培地中の基質として卵黄を用いて決定した。全体として、この研究は、粗抽出物を調製するために効率的で安価なプロトコルを使用し、複製可能なバイオアッセイを適用して、生物工学的および生物医学的関心を有する細胞分解分子を同定する。
概要
海洋動物は生物学的に活性な化合物の豊富な供給源です。ここ数十年で、イソギンチャク毒の組成は、溶血性、細胞毒性、酵素的(ホスホリパーゼ、プロテアーゼ、キチナーゼ)、および神経毒性活性およびタンパク質分解活性に対する阻害効果を有する多様なポリペプチドを含むため、科学的注目を集めている1。加えて、これらのポリペプチドは、バイオテクノロジーおよび治療的使用における分子ツールの開発のための潜在的な供給源である2,3。
イソギンチャク毒とその分子成分に関する報告は、毒物の入手の複雑さ、さらには毒素の単離、および特性評価のためにほとんどない。報告書で使用された抽出方法は、毒産生1に関連および無関係である細胞の内容物を溶解および空にすることを含んでいた。
すべての狂信者の特定の特徴は、単一の解剖学的領域に集中した毒の生産と放出のためのシステムがないことである。代わりに、線虫嚢胞は毒4,5を保持する構造である。表皮腺細胞と呼ばれる他の種類の細胞も毒素を分泌し、イソギンチャク6の体全体に分布している。
毒物を得る上で最初で最も重要な課題は、不安定なタンパク質の不活性化または分解なしに、後続のプロセスで十分な操作を伴う抽出物の生成である。次に、細胞を溶解しなければならず、そして成分−この場合、ポリペプチドを効率的かつ迅速に抽出しなければならず、タンパク質分解および加水分解を回避しながら、他の細胞成分7を除去しなければならない。
イソギンチャクの粗抽出物を得るために異なる方法が使用される。生物を犠牲にすることを含むものもあれば、生き続けることを許すものもあります。生物の全身の使用を暗示する方法は、毒9の一部の成分のみを抽出する生物を生き続ける方法と比較して、毒8からほとんどの毒素の放出を可能にする。抽出物の調製には、インビボまたはインビトロ法によって薬理学的効果を観察する戦略を含む特定のバイオアッセイを通して目的の物質の存在および効力を評価することが必要である10。
イソギンチャク毒は、細胞溶解性ポリペプチド、孔形成毒素(PFT)11、およびホスホリパーゼ12を含有する。これらの分子は、タンパク質-脂質相互作用の研究におけるモデルであり、がん治療における分子ツールであり、ナノポア3に基づくバイオセンサーである。イソギンチャクPFTの分類は、5kDaから80kDaまでのそれらのサイズまたは分子量に従って行われる。アクチノポリン11として最も研究され、知られている20kDaのPFTは、抗癌、抗菌、およびナノポアベースのバイオセンサーとして可能な用途のための分子ツールの開発におけるその生物医学的可能性のために特に興味深い。ホスホリパーゼ、具体的にはホスホリパーゼA2(PLA2)13を含む別のサイトライシンは、リン脂質を加水分解して脂肪酸を放出し、細胞膜を不安定にする。この作用機序のために、PLA2は炎症性疾患における研究および応用のための必須モデルとなることが約束される。細胞膜14における脂質挙動の研究のためのモデルとして役立つ可能性がある。
ここでは、イソギンチャク Anthopleura dowii Verrill, 1869から粗抽出物を得て、ヘモリシンおよびホスホリパーゼを検出するための効率的なプロトコールについて述べる。どちらも関連する毒素であり、新しい分子ツールを設計するためのテンプレートとして使用できます。
プロトコル
イソギンチャクは、メキシコ連邦政府の水産養殖、漁業、および食品のための国家委員会のガイドラインに従って収集されました(許可番号PPF / DGOPTA 07332.250810.4060)。メキシコ国立自治大学バイオテクノロジー研究所の生命倫理委員会は、イソギンチャクによるすべての実験を承認しました。羊の血液サンプルは、動物生産と健康の実践的な教育と研究のためのセンター(CEPIPSA、メキシコ国立自治大学)で購入されました。
1. 生物の収集
- イソギンチャク A.ドウィイを収集します。
注:ここでは、生物はメキシコのカリフォルニア州エンセナダバハ沖の潮間帯で干潮期に収集されました(図1A、B)。 - 生物を海水を入れた容器に入れて実験室に輸送する(図1C)。
- 実験室では、蒸留水で生物を手できれいにし、体に付着している大きな基質粒子を取り除きます。
- 生物を-80°Cで超冷凍庫で直ちに72時間凍結する。
- 凍結乾燥用の特別なガラスに生物を入れ、凍結乾燥条件を-20°C、0.015psi、48時間行う。
- 凍結乾燥生物を使用時まで-20°Cで保存する。
2. 組織水分補給
- 凍結乾燥生物の乾燥重量20gを、60mL(1/3w/v)の50mMリン酸ナトリウム緩衝液、pH7.5、および1阻害剤カクテル錠剤で再構成する(材料表)。
- マグネチックスターラー中で、試料を〜800rpm、4°C、12時間で連続的に撹拌する。
3. 毒素放出
- 細胞溶解および線虫嚢胞排出を誘導するために、サンプルを-20°Cで12時間凍結し、次いで容器を室温(RT)の水に入れ、90%まで融解する。この手順を 3 回繰り返します。
注:サンプルは100%解凍しません。タンパク質の分解を防ぐために、サンプルを〜4°Cに維持することが重要です。 - 排出された線虫嚢胞を共焦点顕微鏡で観察する。10 μLのサンプルをスライドに取り、その上にカバースリップを置きます。共焦点顕微鏡で倍率100倍、60倍で観察する。ここでは染料は必要なかった。
- 共焦点顕微鏡で撮影した画像をImageJソフトウェア(バージョン1.53c、ウェイン・ラズバンド、米国国立衛生研究所、https://imagej.nih.gov/ij)で処理します。
- 線虫嚢胞の内側の細管がコイルを解き、外側にある場合、線虫嚢胞は排出される。その後、次のステップに進みます。それ以外の場合は、もう 1 回だけ凍結融解サイクルを実行します。
- 抽出物を清澄にするために、サンプルを25,400 x g で40分間遠心分離し、4°C、上清を回収し、そしてそれを再び遠心分離する。この手順を3~4回繰り返します。
- 上清を回収し、ペレットを廃棄する。上清または粗抽出物は、毒素成分(毒素)および脂質、炭水化物、および核酸などの他の細胞分子を含有する。
4. 総タンパク質の定量
- 市販のブラッドフォード比色アッセイ15 キット(材料表)を用いて粗抽出物のタンパク質濃度を決定する。
- 色素試薬を希釈する(色素の1部を蒸留水4部で希釈する)。
- ウシ血清アルブミン(BSA)画分V(材料表)溶液をリン酸緩衝液(50mMリン酸ナトリウム、pH7.5)中で1mg/mL濃度で調製する。
- 表1に列挙した溶液を3連で準備する。
- 各溶液をシェーカーで4秒間激しく混合する。
- サンプルを振盪することなくRTで5分間インキュベートします。
- 595nmにおける吸光度(AU)を測定する。
- サンプルBSA吸光度の平均(AU対タンパク質濃度)をプロットし、グラフの式(式1)を求めた。
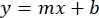 式 1
式 1
ここで、y は吸光度、m は線の傾き、x はタンパク質濃度、b は y 切片です。粗抽出濃度を計算するには、次のように x を解きます。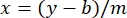 式 2
式 2
5. ポリペプチド毒の複雑さを決定する
- 垂直ゲル電気泳動用のガラス容器をマニュアルに従って組み立てます。
- アクリルアミドミックス(30%)を調製する:アクリルアミド29.2g、ビスアクリルアミド0.8g、最終容量100mL。0.45 μmの膜を使用して溶液をろ過する。この溶液を4°Cの濃い瓶に保存する。 次いで、この混合物を分割ゲル用に調製した(表2)。
- SDS-PAGEゲルは、分割ゲルとスタッキングゲルで構成されています。 表2に規定する溶液容量に従ってゲルを調製する。調製中は、重合時間を短縮するために各ミックスを4°Cに維持することを確認してください。
注:各混合物の体積は、使用される機器のブランドによって異なります。このプロトコールの場合、体積は、垂直電気泳動チャンバー用の厚さ0.75mmの15%アクリルアミドゲルの調製に対応する(材料表)。 - アクリルアミドが重合した後、〜10分間、スタッキングゲルの混合物を加える。
- スタッキングゲル用の混合物を準備し、直ちにそれをガラス板に加え、櫛を置いてサンプルを装填するためのウェルを形成する。
- スタッキングゲルが重合したら(約15分)、櫛を取り出し、ガラス容器を垂直電気泳動用のチャンバーに入れます。
- 200 mLの電極バッファー(0.25 M トリス、0.192 M グリシン、0.1% SDS)を電気泳動チャンバーに入れます。
- 粗抽出物を分析する:粗抽出物30 μgを5 μLのタンパク質担持緩衝液(25%グリセロール、15%ドデシル硫酸ナトリウム、25%2-メルカプトエタノール、0.125mM Tris pH 7、ブロモフェノールブルー0.1mg/mL)と混合してタンパク質を変性させる。最終容量は<50 μLでなければなりません。
- 90°Cで5分間加熱し、冷却し、1,400 x gで3秒間遠心分離 する。
- スタッキングゲルのウェルにサンプルをロードします。標準的な分子量のはしごをロードします。
- 電気泳動を25mAの定数で1時間30分間実行します。
- ガラス容器を電気泳動チャンバーから取り出し、ゲルタンパク質の染色を進行させた。
6. タンパク質染色
- ゲルを50mLの蒸留水ですすぎ、バッファー電極から破片を除去します。
- 水を捨てる。
- ゲルタンパク質の拡散を避けるために、固定溶液(エタノール60mL、酢酸20mL、および蒸留水20mL、最終容量100mL)を加える。RTで40分間インキュベートし、80rpmで振とうする。解をデカントします。
- タンパク質架橋溶液(エタノール15 mL、グルタルアルデヒド0.25 mL、蒸留水50 mL、最終容量65.25 mL)を加え、80 rpmで振とうしながらRTで30分間インキュベートした。ソリューションを削除します。
- ゲルを100mLの蒸留水で5分間洗浄し、水を除去する。この手順を 4 回繰り返します。
- 50 mLのクーマシーブリリアントブルーR-250ろ過溶液(40%メタノール、10%酢酸、50%蒸留水、0.1%色素、最終容量100mL)でタンパク質染色を行い、RTの実験室用回転振動子で60rpmで15分間撹拌する。
- 溶液を回収し、これを他のゲルを染色するために使用することができる。
- 過剰な色素を除去するために、脱染溶液(40mLのメタノール、10mLの酢酸、50mLの蒸留水)を加える。バンド(染色されたタンパク質)が可視化するまでRTで攪拌(80rpm)し続ける。
- ゲルを50 mLの蒸留水に入れ、ゲル文書化システムで画像をスキャンします。
7.赤血球溶液を調製する
- 羊の頸静脈から1mLの血液を抽出する。
- 注射器から針を取り出し、直ちに50mLのアルセバー溶液(0.002Mクエン酸、0.07MNaCl、0.1Mデキストロース、および抗凝固剤として0.027Mクエン酸ナトリウム、pH7.4)を含むチューブに血液を排出する。
- 溶液をゆっくりと3回反転させます。
- 実験室に移すために4°Cに保ちなさい。
- 804 x g で4°Cで5分間遠心分離し、上清を捨てる。
- ペレットを30mLのアルセバー溶液に再懸濁する。チューブの内壁に沿って溶液をスライドさせて加え、パスツールプラスチックピペットを使用して、細胞をゆっくりと再懸濁します。804 x g で5分間、4°Cで再度遠心分離機。 上清が透明になるまでこの手順を繰り返します。
- 15mLのアルセバー溶液を加える。パスツールプラスチックピペットでペレットをゆっくりと再懸濁します。
- アルセバー溶液の最終容量を維持して、約2 x106 細胞/ mLの濃度を達成する。次に、ノイバウアーチャンバーまたは血球計数器を使用して細胞を計数します。
注:赤血球計スライド(改善ノイバウアー)で赤血球を数えます。スライドは 30 mm x 70 mm x 4 mm スライドです。中央には、2つの銀色のフットプレート(図2A)(上部と下部のグリッド1つ)があり、それぞれ3 mm x 3 mm、グリッドの側面に2つのチャンネルがあります。カウントセルは、角と中央の正方形(図2Bの赤い四角)にあります。計数のための細胞の最適濃度は、106個の細胞のオーダーでなければならない。中央の箱の表面積は0.1cm2で、これは0.0001mLに相当します。 - スライドの上にカバースリップを置きます。
- スライドとカバースリップの間に10 μLのサンプルを置き、サンプルが支払われるのを待ちます。
- 光学顕微鏡(倍率60倍)で、第1の四角い箱でカウントを行う。中央のグリッド内のセルと、ボックスの上部または左余白に接触するセルのみを数えます。
- 次の式を使用して細胞濃度を決定します。
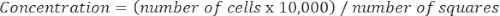 式 3
式 3
サンプルが非常に濃縮され、希釈が必要な場合は、次の式を使用します。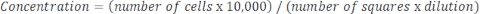 式4
式4
注:溶血試験のために赤血球溶液を服用するときは、プラスチック製のパスツールピペットで溶液をゆっくりと均質化してください。 - 手順を 3 連で実行して、エラーを減らします。
8. 溶血アッセイ
- 表3に示す溶液混合物( 3 連)を円錐形の96ウェルプレートに調製する。
注:赤血球をゆっくりと混合して、均質な懸濁液を維持します。 - 振とうせずに37°Cで1時間インキュベートする。
- プレートを804 x g で4°Cで5分間遠心分離します。
- 上清を平底の別の96ウェルプレートに回収する。
- 粗抽出物にサイトライシンが含まれている場合、赤血球はヘモグロビンを溶解して放出します。415nmにおける吸光度を読み取る。
- 以下の式を使用して、溶血率を計算します。
% 溶血 = ((粗抽出物-AAlsever緩衝液)/(AH2O-AAlsever)) x 100
注:粗抽出物、AAlever緩衝液、およびAH2Oは、それぞれ、粗抽出物を有する赤血球の吸光度、アルセバー溶液の吸光度、および蒸留水の吸光度に対応する。 - 各凍結および融解サイクルの前後に、粗抽出物からの総タンパク質50μgで溶血試験を行う。
- 100%溶血活性に達するために必要な凍結および融解サイクルの数を決定する。
- 赤血球の50%(HU 50)に溶血を生じる抽出物の量を計算する。表 3に記載されているのと同じプロトコルに従い、イソギンチャク粗抽出物の量を増やし、適切なソフトウェア(例えば、原産地、 材料表)を使用してシグモイド調整してプロットを設計します。
ホスホリパーゼアッセイ
- 1つの鶏卵を蒸留水で1%SDSで洗う。
- 無菌条件下で卵黄を卵白から分離する。
- 50 mL の 0.86% NaCl 溶液を調製し、0.22 μm フィルターでろ過します。次いで、溶液Aを調製する:12 mLの卵黄および36 mLの0.86%NaCl溶液を加える。
- 溶液Bを調製する:50mLの緩衝液(50mM Tris、pH 7.5)に300mgのアガロースを混合し、0.22μmのフィルターでろ過する。沸騰するまで溶液を電子レンジで加熱する。43-45°Cに達するまで暖かい水で冷やしてください。
- 溶液Cを調製する:10mMCaCl2を準備し 、0.22μmフィルターでろ過する。
- 溶液D:1mLの蒸留水に10mgのローダミン6Gを調製する。
- 滅菌条件(層流フード)下で、溶液Bに500 μLの溶液AおよびCを加え、溶液Dに100 μLを加え、混合し、25 mLを各ペトリ皿(90 x 15 mm)に注ぐ。
- 溶液が滅菌条件(30分)で固化するのを待つ。
- 細い管で井戸(直径約2〜3mm)を作ります。
- 合計20 μLのリン酸緩衝液(陰性対照)を1つのウェルに、20 μLの決定されたホスホリパーゼ(陽性対照)を別のウェルに加える。
- 異なる量の粗抽出タンパク質(5、15、25、35、45μg)を残りのウェルに入れ、それぞれ最終容量20μLにする。
- 寒天がすべてのサンプルを吸着するのを待ちます(30分)。
- 37°Cで20時間インキュベートする。
- ウェルの周囲にハローが形成される場合、これはホスホリパーゼ活性を示す。バーニアノギスで形成されたハローを測定します。
注: 実験は 3 連で実行します (9.1 ~ 9.14 の手順)。
結果
イソギンチャクの粗抽出物を得るために使用されたプロトコールの代表的な結果は、2つの技術(攪拌および凍結融解のサイクル)を組み合わせることで、線虫嚢胞の効率的な排出が得られ、タンパク質の総量は500mg(8mg / mL)であったことを示した(図3)。
粗抽出物のタンパク質の複雑さは、SDS-PAGE電気泳動により、10 kDaから250 kDaを超えるものを観察する?...
ディスカッション
科学と産業のさまざまな分野での応用を持つ新しい化合物に対する高い需要は、毒の研究につながっています。Venomは、新しい分子ツールを生成するためのテンプレートとして機能する分子の豊富なソースを表します。しかし、これらの毒の複雑さは、それらを取得し、研究するための様々な方法の実装と組み合わせを必要とします。
ここでは、凍結乾燥標本から始めて...
開示事項
著者らは、この論文の出版に関して競合する利害関係はないと宣言している。
謝辞
この研究は、Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT) の支援を受け、助成金番号はIT200819でした。著者らは、この原稿の英語の文法をチェックしたTom Musselman, Rock Paper Editing, LLCに認めている。サマンタ・ヒメネス(CICESE、エンセナダ)とフアン・マヌエル・バルボサ・カスティージョ(UNAMフィシオロギア・セルラー研究所)の技術支援。また、羊の血を手に入れてくれたアウグスト・セザール・リザラゾ・チャパロ博士(CEPIPSA)にも感謝します。ICAT-UNAMのホセ・サニガー・ブレサ博士の研究室のビデオ録画施設に特に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Corning | 430766 | |
| 2-Bromophenol blue | Sigma | B75808 | |
| 2-mercaptoetanol | Sigma-Aldrich | M6250-100ML | |
| 50 mL conical centrifuge tubes | Corning | 430828 | |
| Acetic Acid Glacial | J.T. Baker | 9515-03 | |
| Acrylamide | Promega | V3115 | |
| Agarose | Promega | V3125 | |
| Bisacrylamide | Promega | V3143 | |
| Bovine Serum Albumin Fraction V | Sigma | A3059-100G | |
| Bradford Protein Assays | Bio-Rad | 5000006 | |
| Calcium chloride | Sigma-Aldrich | C3306 | |
| Cell culture plates 96 well, V-bottom | Corning | 3894 | |
| Centrifuge | Eppendorf | 5804R | |
| Centrifuge tubes | Corning | CLS430829 | |
| ChemiDoc MP system | Bio-Rad | 1708280 | |
| Citric acid | Sigma-Aldrich | 251275 | |
| Clear flat.bottom 96-Well Plates | Thermo Scientific | 3855 | |
| Coomassie Brilliant Blue G-250 | Bio-Rad | #1610406 | |
| Coomassie brilliant blue R-250 | Bio-Rad | 1610400 | |
| Dextrose | J.T. Baker | 1916-01 | |
| Ductless Enclosure | Labconco | Vertical | https://imagej.nih.gov/ij ImageJ 1.53c |
| Gel Doc EZ | Bio Rad. | Gel Documentation System | |
| Glycerol | Sigma-Aldrich | G5516-4L | |
| Hemocytometer | Marienfeld | 650030 | |
| ImageJ (Software) | NIH, USA | Version 1.53c | |
| Incubator 211 | Labnet | I5211 DS | |
| Methanol | J.T. Baker | 9049-03 | |
| Mini-PROTEAN tetra cell | Bio-Rad | 1658000EDU | |
| Na2HPO4 | J.T. Baker | 3824-01 | |
| NaCl | J.T. Baker | 3624-01 | |
| NaH2PO4.H2O | J.T. Baker | 3818-05 | |
| Origin software | version 9 | To design the plot with sigmoidal adjustments | |
| Petridish | Falcon | 351007 | |
| Pipetman kit | Gilson | F167380 | |
| Precast mini gel | BioRad | 1658004 | |
| Prestained Protein Ladder | Thermo Scientific | 26620 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | |
| Rhodamine 6G | Sigma-Aldrich | 252433 | |
| SDS | Sigma-Aldrich | L4509 | |
| Sodium citrate dihydrate | JT Baker | 3646-01 | |
| Spectrophotometer | THERMO SCIENTIFIC | G10S UV-VIS | |
| Tris Base | Sigma-Aldrich | 77-86-1 | |
| Volt Power Supply | Hoefer | PS300B |
参考文献
- Frazão, B., Vasconcelos, V., Antunes, A. Sea anemone (Cnidaria, Anthozoa, Actiniaria) toxins: an overview. Marine Drugs. 10 (8), 1812-1851 (2012).
- Jayathilake, J. M. N. J., Gunathilake, K. V. K. Cnidarian toxins: recent evidences for potential therapeutic uses. The European Zoological Journal. 87 (1), 708-713 (2020).
- Ramírez-Carreto, S., Miranda-Zaragoza, B., Rodríguez-Almazán, C. Actinoporins: From the structure and function to the generation of biotechnological and therapeutic tools. Biomolecules. 10 (4), 539 (2020).
- Fautin, D. G. Structural diversity, systematics, and evolution of cnidae. Toxicon. Official Journal of the International Society on Toxinology. 54 (8), 1054-1064 (2009).
- Moran, Y., et al. Analysis of soluble protein contents from the nematocysts of a model sea anemone sheds light on venom evolution. Marine Biotechnology. 15 (3), 329-339 (2013).
- Moran, Y., et al. Neurotoxin localization to ectodermal gland cells uncovers an alternative mechanism of venom delivery in sea anemones. Proceedings of the Royal Society B: Biological Sciences. 279 (1732), 1351-1358 (2012).
- Grabski, A. C. Advances in preparation of biological extracts for protein purification. Methods in Enzymology. 463, 285-303 (2009).
- Bulati, M., et al. Partially purified extracts of sea anemone Anemonia viridis affect the growth and viability of selected tumour cell lines. BioMed Research International. 2016, 3849897 (2016).
- Orts, D. J. B., et al. Biochemical and electrophysiological characterization of two sea anemone type 1 potassium toxins from a geographically distant population of Bunodosoma caissarum. Marine Drugs. 11 (3), 655-679 (2013).
- Hader, D., Erzinger, G. . Bioassays: Advanced Methods and Applications. , (2017).
- Anderluh, G., Macek, P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria). Toxicon: Official Journal of the International Society on Toxinology. 40 (2), 111-124 (2002).
- Nevalainen, T. J., et al. Phospholipase A2 in cnidaria. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 139 (4), 731-735 (2004).
- Razpotnik, A., et al. A new phospholipase A2 isolated from the sea anemone Urticina crassicornis - its primary structure and phylogenetic classification. The FEBS Journal. 277 (12), 2641-2653 (2010).
- Dennis, E. A., Cao, J., Hsu, Y. -. H., Magrioti, V., Kokotos, G. Phospholipase A2 enzymes: Physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chemical Reviews. 111 (10), 6130-6185 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Kwon, Y. -. C., Jewett, M. C. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Scientific Reports. 5, 8663 (2015).
- Eno, A. E., Konya, R. S., Ibu, J. O. Biological properties of a venom extract from the sea anemone, Bunodosoma cavernata. Toxicon: Official Journal of the International Society on Toxinology. 36 (12), 2013-2020 (1998).
- Morales-Landa, J. L., et al. Antimicrobial, antiprotozoal, and toxic activities of Cnidarian extracts from the Mexican Caribbean Sea. Pharmaceutical Biology. 45 (1), 37-43 (2007).
- Sánchez-Rodríguez, J., Cruz-Vazquez, K. Isolation and biological characterization of neurotoxic compounds from the sea anemone Lebrunia danae (Duchassaing and Michelotti, 1860). Archives of Toxicology. 80 (7), 436-441 (2006).
- de Oliveira, J. S., et al. Caissarolysin I (Bcs I), a new hemolytic toxin from the Brazilian sea anemone Bunodosoma caissarum: purification and biological characterization. Biochimica Et Biophysica Acta. 1760 (3), 453-461 (2006).
- Norton, R. S., et al. Purification and characterisation of proteins with cardiac stimulatory and haemolytic activity from the anemone Actinia tenebrosa. Toxicon: Official Journal of the International Society on Toxinology. 28 (1), 29-41 (1990).
- Gondran, M., Eckeli, A. L., Migues, P. V., Gabilan, N. H., Rodrigues, A. L. S. The crude extract from the sea anemone, Bunodosoma caissarum elicits convulsions in mice: possible involvement of the glutamatergic system. Toxicon: Official Journal of the International Society on Toxinology. 40 (12), 1667-1674 (2002).
- Dion, A. S., Pomenti, A. A. Ammoniacal silver staining of proteins: mechanism of glutaraldehyde enhancement. Analytical Biochemistry. 129 (2), 490-496 (1983).
- Ramírez-Carreto, S., et al. Identification of a pore-forming protein from sea anemone Anthopleura dowii Verrill (1869) venom by mass spectrometry. The Journal of Venomous Animals and Toxins Including Tropical Diseases. 25, 147418 (2019).
- Nelson, G. J. Studies on the lipids of sheep red blood cells. I. Lipid composition in low and high potassium red cells. Lipids. 2 (1), 64-71 (1967).
- Ramírez-Carreto, S., et al. Transcriptomic and proteomic analysis of the tentacles and mucus of Anthopleura dowii Verrill, 1869. Marine Drugs. 17 (8), 436 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved