A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי פעילות המוליטית ופוספוליפאזה בתמציות גולמיות מתוך שושנות ים על ידי מאמרים ביו-אסים פשוטים
In This Article
Summary
כאן נתאר פרוטוקול להשגת תמצית ארס גולמית משכת ים וזיהוי פעילותה ההמוליטית והפוספוליפאזית.
Abstract
הרכב ארס שושנת הים כולל מולקולות פוליפפטידיות ולא חלבוניות. לרכיבים ציטוליטיים יש פוטנציאל ביו-טכנולוגי וביו-רפואי גבוה לתכנון כלים מולקולריים חדשים. ארס שושנת הים מאתר בתאים בלוטותיים מאקטודרם וממבנים תת-תאיים הנקראים נמטוציסטים, ששניהם מופצים בכל גוף שושנת הים. מאפיין זה מרמז על אתגרים מכיוון שיש למסתתר את התאים והנמטוציסטים כדי לשחרר את מרכיבי הארס עם מולקולות אחרות שאינן רעילות. לכן, ראשית, הארס מופק מתמצית גולמית (תערובת של מולקולות שונות ומגוונות ופסולת רקמות). השלב הבא הוא לזהות פוליפפטידים עם פעילות ביולוגית ספציפית. כאן, אנו מתארים אסטרטגיה יעילה להשגת תמצית גולמית של שושנת ים ובדיקה ביולוגית לזיהוי נוכחותם של ציטוליזינים. הצעד הראשון כולל טכניקות זולות ופשוטות (מחזור ערבוב והפשרה בהקפאה) לשחרור ציטוליסינים. השגנו את הפעילות הציטוטוליטית והחלבון הגבוהים ביותר (כ-500 מ"ג חלבון מ-20 גרם של משקל יבש). לאחר מכן, המורכבות הפוליפפטידית של התמצית נותחה על ידי ג'ל SDS-PAGE לאיתור חלבונים עם משקל מולקולרי בין 10 kDa ל-250 kDa. בבדיקה ההמוליטית השתמשנו בתאי דם אדומים של כבשים וקבענו HU50 (11.1 ± 0.3 מיקרוגרם/מ"ל). לעומת זאת, נוכחותם של פוספוליפאזות בתמצית הגולמית נקבעה באמצעות חלמון ביצה כמצע בתווך מוצק עם אגרוז. באופן כללי, מחקר זה משתמש בפרוטוקול יעיל וזול כדי להכין את התמצית הגולמית ומיישם בדיקות ביולוגיות הניתנות לשכפול כדי לזהות ציטוטוליזין, מולקולות בעלות תחומי עניין ביו-טכנולוגיים וביו-רפואיים.
Introduction
בעלי חיים ימיים הם מקור עשיר של תרכובות פעילות ביולוגית. בעשורים האחרונים, הרכב ארס שושנת הים משך תשומת לב מדעית מכיוון שהוא כולל מגוון של פוליפפטידים עם המוליטית, ציטוטוקסית, אנזימטית (פוספוליפאז, פרוטאז, צ'יטינאז), ופעילות נוירוטוקסית והשפעות מעכבות על פעילות פרוטאוליטית1. בנוסף, פוליפפטידים אלה הם מקורות פוטנציאליים לפיתוח כלים מולקולריים בשימוש ביו-טכנולוגי וטיפולי 2,3.
ישנם דיווחים מעטים על ארס שושנת ים ומרכיביו המולקולריים בשל המורכבות של קבלת הארס, אפילו בידוד ואפיון של רעלים. שיטות החילוץ ששימשו בדו"חות כללו תזה וריקון תוכן של תאים הקשורים ואינם קשורים לייצור הארס1.
מאפיין מסוים בכל הקנידריאנים הוא היעדר מערכת לייצור ושחרור של הארס המרוכז באזור אנטומי יחיד. במקום זאת, הנמטוציסטים הם מבנים ששומרים על הארס 4,5. סוגים אחרים של תאים, הנקראים תאי בלוטת האפידרמיס, מפרישים גם הם רעלים ומופצים גם הם בכל הגוף של שושנות הים6.
האתגר הראשון והמכריע ביותר בהשגת הארס הוא יצירת תמצית עם מניפולציה מספקת בתהליכים הבאים, ללא השתקה או פירוק של חלבונים מתכלים. לאחר מכן, התאים חייבים להיות lysed, ואת הרכיבים - במקרה זה, פוליפפטידים חייבים להיות מופקים ביעילות ובמהירות, הימנעות פרוטאוליזה הידרוליזה תוך ביטול רכיבים תאיים אחרים7.
שיטות שונות משמשות להשגת תמצית גולמית של שושנת ים; חלקם כרוכים בהקרבת האורגניזם בעוד שאחרים מאפשרים לו להישמר בחיים. שיטות המרמזות על שימוש בכל גופו של האורגניזם מאפשרות שחרור של רוב הרעלים מהארס8, בהשוואה לשיטות השומרות על אורגניזמים בחיים, אשר מוציאות רק כמה מרכיבים של הארס9. הכנת תמצית דורשת הערכת נוכחות ועוצמה של חומר בעל עניין באמצעות ביואסאי ספציפי, הכולל אסטרטגיות לבחון את ההשפעות הפרמקולוגיות על ידי שיטות in vivo או in vitro 10.
ארס שושנת ים מכיל פוליפפטידים ציטוטיים, רעלנים יוצרי נקבוביות (PFTs)11, ופוספוליפאזות12; מולקולות אלה הן מודלים בחקר האינטראקציה בין חלבונים לשומנים, כלים מולקולריים בטיפול בסרטן וביוסנסורים המבוססים על ננו-נקבוביות3. הסיווג של שושנת ים PFTs מתבצע על פי גודלם או משקלם המולקולרי, מ 5 kDa עד 80 kDa. ה-20 kDa PFT, הנחקר והידוע ביותר כאקטינופורינים11, מעניין במיוחד את הפוטנציאל הביו-רפואי שלו בפיתוח כלים מולקולריים ליישומים אפשריים כביו-סנסורים אנטי-סרטניים, אנטי-מיקרוביאליים ומבוססי ננו-נקבוביות. ציטוליסין נוסף, כולל פוספוליפאזות, במיוחד פוספוליפאז A2 (PLA2)13, משחרר חומצת שומן עקב הידרוליזה פוספוליפידים, ומערער את יציבות קרום התא. בשל מנגנון פעולה זה, PLA2 מבטיח להיות מודל חיוני למחקר ויישומים במחלות דלקתיות. הוא יכול לשמש מודל למחקרים על התנהגות השומנים בקרום התא14.
כאן אנו מתארים פרוטוקול יעיל להשגת התמצית הגסה משכנת הים Anthopleura dowii Verrill, 1869, ולזיהוי המוליסינים ופוספוליפאזות. שניהם רעלנים רלוונטיים שיכולים לשמש כתבנית לתכנון כלים מולקולריים חדשים.
Protocol
שושנות הים נאספו על פי הנחיות הוועדה הלאומית לחקלאות ימית, דיג ומזון של הממשלה הפדרלית של מקסיקו (מספר היתר PPF / DGOPTA 07332.250810.4060). ועדת הביואתיקה של המכון לביוטכנולוגיה, האוניברסיטה האוטונומית הלאומית של מקסיקו אישרה את כל הניסויים עם שושנות ים. דגימת דם הכבשים נרכשה במרכז להוראה מעשית ומחקר בייצור ובריאות בעלי חיים (CEPIPSA, האוניברסיטה האוטונומית הלאומית של מקסיקו).
1. איסוף אורגניזמים
- לאסוף שושנת ים A. dowii.
הערה: כאן, האורגניזמים נאספו בתקופות של גאות ושפל באזור הבין-יבשתי מול חופי אנסנדה באחה, קליפורניה, מקסיקו (איור 1A,B). - העבירו את האורגניזמים למעבדה במיכלים עם מי ים (איור 1C).
- במעבדה, לנקות את האורגניזמים עם מים מזוקקים ביד כדי להסיר את חלקיקי המצע הגדולים הדבקים בגוף.
- מיד להקפיא את האורגניזמים ב -80 מעלות צלזיוס במקפיא אולטרה במשך 72 שעות.
- הניחו את האורגניזמים במשקפיים מיוחדים לייבוש בהקפאה, עם תנאי ליופיליזציה של -20 מעלות צלזיוס, 0.015 psi, במשך 48 שעות.
- אחסנו את האורגניזמים הלופיליים בטמפרטורה של -20 מעלות צלזיוס עד לשימוש.
2. הידרציה של רקמות
- שחזרו 20 גרם משקל יבש של אורגניזמים ליופיליים עם 60 מ"ל (1/3 w/v) של 50 mM מאגר נתרן פוספט, pH 7.5, וטבליית קוקטייל מעכבת אחת (טבלת חומרים).
- בממערבל מגנטי, מערבבים את הדגימה באופן רציף במהירות של כ-800 סל"ד, 4 מעלות צלזיוס, למשך 12 שעות.
3. שחרור רעלנים
- כדי לגרום לתזה של תאים ולהפרשת נמטוציסטים, הקפיאו את הדגימה בטמפרטורה של -20 מעלות צלזיוס למשך 12 שעות, ולאחר מכן הניחו את המיכל במים בטמפרטורת החדר (RT) עד שהוא מפשיר עד 90%. חזור על הליך זה שלוש פעמים.
הערה: המדגם אינו מפשיר 100%; חיוני לשמור על הדגימה בטמפרטורה של כ-4 מעלות צלזיוס כדי למנוע פירוק חלבונים. - התבונן בנמטוציסט המשוחרר תחת מיקרוסקופ קונפוקלי. קח 10 μL של הדגימה על שקופית והנח מעליה כיסוי. התבונן תחת מיקרוסקופ קונפוקלי בהגדלה של פי 100 ופי 60. כאן לא היה צורך בצבע.
- לעבד את התמונות שצולמו במיקרוסקופ הקונפוקלי בתוכנת ImageJ (גרסה 1.53c, ויין ראסבנד, המכונים הלאומיים לבריאות, ארה"ב, https://imagej.nih.gov/ij).
- אם הצינורית בתוך הנמטוציסט מתפרקת ונמצאת בחוץ, הנמטוציסטים משוחררים; לאחר מכן, המשך עם השלב הבא. אחרת, רק לבצע עוד מחזור אחד של הקפאה-הפשרה.
- כדי להבהיר את התמצית, צנטריפוגה הדגימה ב 25,400 x g במשך 40 דקות, 4 מעלות צלזיוס, לשחזר את supernatant, צנטריפוגה זה שוב. חזור על שלב זה 3-4 פעמים.
- משחזרים את הסופרנאטנט ומשליכים את הכדור. התמצית הסופרנטנטית או הגולמית מכילה את מרכיבי הארס (רעלנים) ומולקולות תאים אחרות, כגון שומנים, פחמימות וחומצות גרעין.
4. כמות החלבון הכולל
- קבע את ריכוז החלבון של התמצית הגולמית באמצעות ערכת בדיקה צבעונית מסחרית של ברדפורד15 (טבלת חומרים).
- דיללו את מגיב הצבע (חלק אחד של צבע עם ארבעה חלקים של מים מזוקקים).
- הכינו אלבומין בסרום בקר (BSA) תמיסת שבר V (טבלת חומרים) בריכוז של 1 מ"ג/מ"ל במאגר פוספט (50 mM נתרן פוספט, pH 7.5).
- הכן את הפתרונות המפורטים בטבלה 1 במשולש.
- מערבבים במרץ כל תמיסה בשייקר במשך 4 שניות.
- דגירה של הדגימות במשך 5 דקות ב- RT, מבלי לרעוד.
- מדידת ספיגה (AU) ב-595 ננומטר.
- התווה את הממוצעים של ספיגות BSA לדוגמה (AU לעומת ריכוז חלבונים), וקבע את המשוואה של הגרף (משוואה 1).
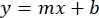 משוואה 1
משוואה 1
כאשר y הוא הספיגה, m הוא השיפוע של הקו, x הוא ריכוז החלבון, ו-b הוא יירוט y. כדי לחשב את ריכוז התמצית הגולמית, פתור עבור x באופן הבא: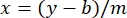 משוואה 2
משוואה 2
5. קביעת סיבוכיות ארס פוליפפטידי
- להרכיב את מיכל הזכוכית לאלקטרופורזה של ג'ל אנכי על פי המדריך.
- להכין תערובת אקרילאמיד (30%): 29.2 גרם של אקרילאמיד, 0.8 גרם של bis-acrylamide, נפח סופי של 100 מ"ל. סנן את התמיסה באמצעות ממברנה של 0.45 מיקרומטר. אחסנו את התמיסה בבקבוק כהה בטמפרטורה של 4 מעלות צלזיוס. לאחר מכן, הכינו את התערובת לג'ל הפותח (טבלה 2).
- ג'ל SDS-PAGE מורכב מג'ל רזולוציה וג'ל ערימה. הכן את הג'לים בהתאם לנפחי התמיסה המוגדרים בטבלה 2. במהלך ההכנה, הקפידו לשמור על כל תערובת ב-4 מעלות צלזיוס כדי להפחית את זמן הפילמור.
הערה: נפח כל תערובת משתנה בהתאם למותג הציוד המשמש; עבור פרוטוקול זה, הנפחים תואמים את ההכנה של 15% ג'ל acrylamide, 0.75 מ"מ עובי, עבור תא אלקטרופורזה אנכי (טבלת חומרים). - לאחר שהאקרילמיד עבר פולימריזציה, כ-10 דקות, הוסיפו את התערובת של ג'ל הערימה.
- מכינים את התערובת לג'ל הערימה, מוסיפים אותה מיד לצלחות הזכוכית ומניחים מסרק כדי ליצור את הבארות להעמסת הדגימות.
- לאחר פולימריזציה של ג'ל הערימה (כ-15 דקות), הסירו את המסרק והניחו את מיכל הזכוכית בתא לאלקטרופורזה אנכית.
- מקם 200 מ"ל של חיץ אלקטרודות (0.25 M Tris, 0.192 M גליצין, 0.1% SDS) בתא אלקטרופורזה.
- נתחו את התמצית הגולמית: ערבבו 30 מיקרוגרם של תמצית גולמית עם 5 μL של מאגר העמסת חלבון (25% גליצרול, 15% נתרן דודציל סולפט, 25% 2-מרקפטואתנול, 0.125 mM Tris pH 7, ברומופנול כחול 0.1 מ"ג/מ"ל) כדי לנטרל חלבונים. הכרך הסופי חייב להיות <50 μL.
- מחממים ב-90 מעלות צלזיוס למשך 5 דקות, קרירים וצנטריפוגות במשך 3 שניות ב-1,400 x גרם.
- טען את הדגימות בבארות של ג'ל הערימה. טען סולם משקל מולקולרי סטנדרטי.
- הפעל אלקטרופורזה ב 25 mA קבוע במשך שעה 1 30 דקות.
- הסר את מיכלי הזכוכית מתא האלקטרופורזה כדי להמשיך עם הכתמת חלבוני הג'ל.
6. צביעת חלבון
- יש לשטוף את הג'ל ב-50 מ"ל של מים מזוקקים כדי להסיר פסולת מאלקטרודת החיץ.
- השליכו את המים.
- כדי למנוע את הדיפוזיה של חלבוני הג'ל, להוסיף את תמיסת הקיבעון (60 מ"ל של אתנול, 20 מ"ל של חומצה אצטית, ו 20 מ"ל של מים מזוקקים, נפח סופי 100 מ"ל). דגירה ב-RT למשך 40 דקות עם רעידות ב-80 סל"ד. תדקדק את הפתרון.
- מוסיפים את תמיסת הקישור החלבון (15 מ"ל של אתנול, 0.25 מ"ל של גלוטראלדהיד, 50 מ"ל של מים מזוקקים, נפח סופי 65.25 מ"ל), ודגירה למשך 30 דקות ב-RT עם רעידות ב-80 סל"ד. הסר את הפתרון.
- לשטוף את הג'ל עם 100 מ"ל של מים מזוקקים במשך 5 דקות, ולהסיר את המים. חזור על הליך זה ארבע פעמים.
- בצע צביעת חלבון עם 50 מ"ל של תמיסה מסוננת כחולה מבריקה של Coomassie R-250 (40% מתנול, 10% חומצה אצטית, 50% מים מזוקקים, 0.1% צבע, נפח סופי 100 מ"ל), תוך ערבוב ב-60 סל"ד במתנד סיבובי במעבדה ב-RT למשך 15 דקות.
- לשחזר את הפתרון, אשר ניתן להשתמש בו כדי להכתים ג'לים אחרים.
- כדי לחסל את הצבע העודף, להוסיף תמיסה destaining (40 מ"ל של מתנול, 10 מ"ל של חומצה אצטית, 50 מ"ל של מים מזוקקים). יש להמשיך לערבב (80 סל"ד) ב-RT עד שהפסים (חלבונים מוכתמים) ידמיינו.
- שמור את הג'ל ב 50 מ"ל של מים מזוקקים וסרוק את התמונה במערכת תיעוד ג'ל.
7. הכינו תמיסת תאי דם אדומים
- לחלץ 1 מ"ל של דם מן הווריד jugular של כבשה.
- מוציאים את המחט מהמזרק ומנקזים מיד את הדם לצינורית עם 50 מ"ל של תמיסת Alsever (0.002 M חומצת לימון, 0.07 M NaCl, 0.1 M דקסטרוז ו-0.027 M נתרן ציטראט כחומר נוגד קרישה, pH 7.4).
- לאט לאט להפוך את הפתרון שלוש פעמים.
- יש לשמור על 4 מעלות צלזיוס להעברה למעבדה.
- צנטריפוגה ב 804 x g במשך 5 דקות ב 4 ° C ולהשליך את supernatant.
- החיזרו את הכדור ב-30 מ"ל של תמיסת Alsever. הוסיפו את התמיסה על ידי החלקתו לאורך הקירות הפנימיים של הצינור, ובאמצעות פיפטה מפלסטיק פסטר, החיזרו באיטיות את התאים. צנטריפוגה שוב ב 804 x g במשך 5 דקות, 4 מעלות צלזיוס. חזור על הליך זה עד שיובהר הסופרנטנט.
- הוסף 15 מ"ל של תמיסת Alsever; החזירו את הכדור באיטיות עם פיפטה מפלסטיק פסטר.
- שמור על הנפח הסופי של תמיסת Alsever כדי להשיג ריכוז של 2 x 106 תאים / מ"ל, בערך. לאחר מכן, השתמש בתא נויבאואר או בהמוציטומטר כדי לספור את התאים.
הערה: ספירת האריתרוציטים בשקופית ההמקיטומטר (נויבאואר משופר). השקופית היא שקופית של 30 מ"מ x 70 מ"מ x 4 מ"מ. במרכז יש שתי לוחות רגל כסופים (איור 2A) (רשת עליונה ואחת תחתונה), כל אחד בגודל 3 מ"מ x 3 מ"מ, ושני ערוצים בצידי הרשת. ספירת תאים נמצאת בפינה ובריבועים המרכזיים (ריבועים אדומים באיור 2B). הריכוז האופטימלי של תאים לספירה צריך להיות בסדר גודל של 106 תאים. לתיבה המרכזית שטח פנים של 0.1 ס"מ2, שווה ערך ל-0.0001 מ"ל. - מקם כיסוי מעל השקופית.
- מקם 10 μL של הדגימה בין השקופית לבין הכיסוי והמתן עד שהדגימה תתפרק.
- במיקרוסקופ אופטי (הגדלה 60x), בצע את הספירה בתיבה המרובעת הראשונה. ספרו רק את התאים ברשת המרכזית ואת אלה שנוגעים בשוליים העליונים או השמאליים של התיבה.
- קביעת ריכוז התאים באמצעות המשוואה הבאה:
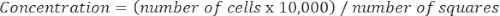 משוואה 3
משוואה 3
אם המדגם מרוכז מאוד ונדרש דילול, השתמש במשוואה הבאה: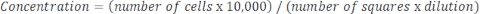 משוואה 4
משוואה 4
הערה: בעת נטילת תמיסת אריתרוציטים לבדיקת ההמוליזה, הומוגני לאט לאט את התמיסה עם פיפטה פסטר פלסטית. - בצע את השלבים במשולש כדי להפחית את השגיאה.
8. בדיקת המוליזה
- הכינו את תערובות התמיסה (בטריפליקטים) המצוינות בטבלה 3 בצלחות חרוטיות של 96 בארות.
הערה: מערבבים את האריתרוציטים באיטיות כדי לשמור על תרחיף הומוגני. - דגירה במשך שעה אחת ב 37 מעלות צלזיוס, ללא רעד.
- צנטריפוגה את הצלחת ב 804 x g במשך 5 דקות ב 4 ° C.
- שחזרו את הסופרנאטנט בצלחת נוספת של 96 בארות עם תחתית שטוחה.
- אם התמצית הגסה מכילה ציטוליסינים, אריתרוציטים ישקרו וישחררו המוגלובין. קרא את הספיגה ב 415 ננומטר.
- חשב את אחוז ההמוליזה, באמצעות המשוואה הבאה:
% המוליזה = ((תמצית Acrude-AAlsever buffer) / (AH2O-AAlsever)) x 100
הערה: תמצית Acrude, חיץ AAlsever ו- AH2O מתאימים לספיגת אריתרוציטים עם התמצית הגולמית, ספיגת תמיסת Alsever וספיגת מים מזוקקים, בהתאמה. - בצע בדיקת המוליזה לפני ואחרי כל מחזור הקפאה והפשרה עם 50 מיקרוגרם של חלבון כולל מהתמצית הגולמית.
- קבעו את מספר מחזורי ההקפאה וההפשרה הנדרשים כדי להגיע ל-100% פעילות המוליטית.
- חישוב כמות התמצית המייצרת המוליזה ב -50% מהאריתרוציטים (HU50); בצע את אותו פרוטוקול המתואר בטבלה 3, הגדל את כמות התמצית הגולמית של שושנת הים, ועצב את החלקה עם התאמות סיגמואידליות באמצעות תוכנה מתאימה (לדוגמה, מקור, טבלת חומרים).
9. בדיקת פוספוליפאזה
- יש לשטוף ביצת עוף אחת עם 1% SDS במים מזוקקים.
- הפרד את החלמון מהחלבון ביצה בתנאים סטריליים.
- הכן 50 מ"ל של תמיסת NaCl של 0.86%, וסנן דרך מסנן של 0.22 מיקרומטר. לאחר מכן, הכינו את תמיסה א': הוסיפו 12 מ"ל של חלמון ביצה ו-36 מ"ל של תמיסת NaCl של 0.86%.
- הכן פתרון B: ערבבו 300 מ"ג של אגרוז ב-50 מ"ל של חיץ (50 mM Tris, pH 7.5), סנן דרך מסנן של 0.22 מיקרומטר. מחממים את התמיסה במיקרוגל עד להרתחה. התקררו במים חמים כדי להגיע ל-43-45 מעלות צלזיוס.
- הכן פתרון C: הכן 10 mM CaCl2 וסנן אותו עם מסנן 0.22 מיקרומטר.
- הכן תמיסה D: 10 מ"ג של רודמין 6G ב 1 מ"ל של מים מזוקקים.
- בתנאים סטריליים (מכסה המנוע של זרימה למינרית), מוסיפים 500 μL של תמיסות A ו-C לתמיסה B ו-100 μL של תמיסה D, מערבבים ושופכים 25 מ"ל לכל צלחת פטרי (90 x 15 מ"מ).
- המתן עד שהתמיסה תתמצק בתנאים סטריליים (30 דקות).
- הכינו בארות (בקוטר של כ-2-3 מ"מ) עם צינור דק.
- הוסיפו סך של 20 μL של מאגר פוספט (בקרה שלילית) בבאר אחת ו-20 μL של פוספוליפאזה (שליטה חיובית) בבאר אחרת.
- מקם כמויות שונות של חלבון התמצית הגולמית, 5, 15, 25, 35, 45 מיקרוגרם, בבארות הנותרות, כל אחת בנפח סופי של 20 מיקרול.
- המתן עד שהאגר יסיר את כל הדגימות (30 דקות).
- דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 20 שעות.
- אם נוצרת הילה סביב הבאר, הדבר מצביע על פעילות פוספוליפאזה. מדוד את ההילה שנוצרה עם קליפר ורנייה.
הערה: בצע את הניסוי במשולש (שלבים בין 9.1-9.14).
תוצאות
התוצאות המייצגות של הפרוטוקול ששימש להשגת התמצית הגולמית של שושנת הים הראו כי שילוב של שתי טכניקות (תסיסה ומחזורים של הקפאה והפשרה) יצר פריקה יעילה של נמטוציסטים, וכמות החלבון הכוללת הייתה 500 מ"ג (8 מ"ג/מ"ל) (איור 3).
ניתן היה לראות את מורכבות החלבון של התמצית הגו...
Discussion
הביקוש הגבוה לתרכובות חדשות עם יישומים בתחומים שונים של מדע ותעשייה הוביל לחקר הארס. ארס מייצג מקור עשיר של מולקולות המשמש כתבנית ליצירת כלים מולקולריים חדשים. עם זאת, המורכבות של ארסים אלה דורשת יישום ושילוב של שיטות שונות כדי להשיג וללמוד אותם.
כאן, אנו מראים שיטה להשגת ונ...
Disclosures
המחברים מצהירים כי אין להם עניין מתחרה ביחס לפרסום מאמר זה.
Acknowledgements
עבודה זו נתמכה על ידי Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT), עם מספר מענק IT200819. המחברים מודים לטום מוסלמן, עריכת נייר רוק, LLC, על בדיקת הדקדוק האנגלי של כתב יד זה; והסיוע הטכני של סמנטה חימנס (CICESE, אנסנדה) וחואן מנואל ברבוסה קסטילו (המכון לפיסולי, UNAM). אנו מודים גם לד"ר אוגוסטו סזאר ליזאראזו צ'פארו (CEPIPSA) על השגת דם כבשים. אנו מודים במיוחד לד"ר חוסה סניגר בלזה, ICAT-UNAM, על המתקנים במעבדה שלו להקלטת הווידאו.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Corning | 430766 | |
| 2-Bromophenol blue | Sigma | B75808 | |
| 2-mercaptoetanol | Sigma-Aldrich | M6250-100ML | |
| 50 mL conical centrifuge tubes | Corning | 430828 | |
| Acetic Acid Glacial | J.T. Baker | 9515-03 | |
| Acrylamide | Promega | V3115 | |
| Agarose | Promega | V3125 | |
| Bisacrylamide | Promega | V3143 | |
| Bovine Serum Albumin Fraction V | Sigma | A3059-100G | |
| Bradford Protein Assays | Bio-Rad | 5000006 | |
| Calcium chloride | Sigma-Aldrich | C3306 | |
| Cell culture plates 96 well, V-bottom | Corning | 3894 | |
| Centrifuge | Eppendorf | 5804R | |
| Centrifuge tubes | Corning | CLS430829 | |
| ChemiDoc MP system | Bio-Rad | 1708280 | |
| Citric acid | Sigma-Aldrich | 251275 | |
| Clear flat.bottom 96-Well Plates | Thermo Scientific | 3855 | |
| Coomassie Brilliant Blue G-250 | Bio-Rad | #1610406 | |
| Coomassie brilliant blue R-250 | Bio-Rad | 1610400 | |
| Dextrose | J.T. Baker | 1916-01 | |
| Ductless Enclosure | Labconco | Vertical | https://imagej.nih.gov/ij ImageJ 1.53c |
| Gel Doc EZ | Bio Rad. | Gel Documentation System | |
| Glycerol | Sigma-Aldrich | G5516-4L | |
| Hemocytometer | Marienfeld | 650030 | |
| ImageJ (Software) | NIH, USA | Version 1.53c | |
| Incubator 211 | Labnet | I5211 DS | |
| Methanol | J.T. Baker | 9049-03 | |
| Mini-PROTEAN tetra cell | Bio-Rad | 1658000EDU | |
| Na2HPO4 | J.T. Baker | 3824-01 | |
| NaCl | J.T. Baker | 3624-01 | |
| NaH2PO4.H2O | J.T. Baker | 3818-05 | |
| Origin software | version 9 | To design the plot with sigmoidal adjustments | |
| Petridish | Falcon | 351007 | |
| Pipetman kit | Gilson | F167380 | |
| Precast mini gel | BioRad | 1658004 | |
| Prestained Protein Ladder | Thermo Scientific | 26620 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | |
| Rhodamine 6G | Sigma-Aldrich | 252433 | |
| SDS | Sigma-Aldrich | L4509 | |
| Sodium citrate dihydrate | JT Baker | 3646-01 | |
| Spectrophotometer | THERMO SCIENTIFIC | G10S UV-VIS | |
| Tris Base | Sigma-Aldrich | 77-86-1 | |
| Volt Power Supply | Hoefer | PS300B |
References
- Frazão, B., Vasconcelos, V., Antunes, A. Sea anemone (Cnidaria, Anthozoa, Actiniaria) toxins: an overview. Marine Drugs. 10 (8), 1812-1851 (2012).
- Jayathilake, J. M. N. J., Gunathilake, K. V. K. Cnidarian toxins: recent evidences for potential therapeutic uses. The European Zoological Journal. 87 (1), 708-713 (2020).
- Ramírez-Carreto, S., Miranda-Zaragoza, B., Rodríguez-Almazán, C. Actinoporins: From the structure and function to the generation of biotechnological and therapeutic tools. Biomolecules. 10 (4), 539 (2020).
- Fautin, D. G. Structural diversity, systematics, and evolution of cnidae. Toxicon. Official Journal of the International Society on Toxinology. 54 (8), 1054-1064 (2009).
- Moran, Y., et al. Analysis of soluble protein contents from the nematocysts of a model sea anemone sheds light on venom evolution. Marine Biotechnology. 15 (3), 329-339 (2013).
- Moran, Y., et al. Neurotoxin localization to ectodermal gland cells uncovers an alternative mechanism of venom delivery in sea anemones. Proceedings of the Royal Society B: Biological Sciences. 279 (1732), 1351-1358 (2012).
- Grabski, A. C. Advances in preparation of biological extracts for protein purification. Methods in Enzymology. 463, 285-303 (2009).
- Bulati, M., et al. Partially purified extracts of sea anemone Anemonia viridis affect the growth and viability of selected tumour cell lines. BioMed Research International. 2016, 3849897 (2016).
- Orts, D. J. B., et al. Biochemical and electrophysiological characterization of two sea anemone type 1 potassium toxins from a geographically distant population of Bunodosoma caissarum. Marine Drugs. 11 (3), 655-679 (2013).
- Hader, D., Erzinger, G. . Bioassays: Advanced Methods and Applications. , (2017).
- Anderluh, G., Macek, P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria). Toxicon: Official Journal of the International Society on Toxinology. 40 (2), 111-124 (2002).
- Nevalainen, T. J., et al. Phospholipase A2 in cnidaria. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 139 (4), 731-735 (2004).
- Razpotnik, A., et al. A new phospholipase A2 isolated from the sea anemone Urticina crassicornis - its primary structure and phylogenetic classification. The FEBS Journal. 277 (12), 2641-2653 (2010).
- Dennis, E. A., Cao, J., Hsu, Y. -. H., Magrioti, V., Kokotos, G. Phospholipase A2 enzymes: Physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chemical Reviews. 111 (10), 6130-6185 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Kwon, Y. -. C., Jewett, M. C. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Scientific Reports. 5, 8663 (2015).
- Eno, A. E., Konya, R. S., Ibu, J. O. Biological properties of a venom extract from the sea anemone, Bunodosoma cavernata. Toxicon: Official Journal of the International Society on Toxinology. 36 (12), 2013-2020 (1998).
- Morales-Landa, J. L., et al. Antimicrobial, antiprotozoal, and toxic activities of Cnidarian extracts from the Mexican Caribbean Sea. Pharmaceutical Biology. 45 (1), 37-43 (2007).
- Sánchez-Rodríguez, J., Cruz-Vazquez, K. Isolation and biological characterization of neurotoxic compounds from the sea anemone Lebrunia danae (Duchassaing and Michelotti, 1860). Archives of Toxicology. 80 (7), 436-441 (2006).
- de Oliveira, J. S., et al. Caissarolysin I (Bcs I), a new hemolytic toxin from the Brazilian sea anemone Bunodosoma caissarum: purification and biological characterization. Biochimica Et Biophysica Acta. 1760 (3), 453-461 (2006).
- Norton, R. S., et al. Purification and characterisation of proteins with cardiac stimulatory and haemolytic activity from the anemone Actinia tenebrosa. Toxicon: Official Journal of the International Society on Toxinology. 28 (1), 29-41 (1990).
- Gondran, M., Eckeli, A. L., Migues, P. V., Gabilan, N. H., Rodrigues, A. L. S. The crude extract from the sea anemone, Bunodosoma caissarum elicits convulsions in mice: possible involvement of the glutamatergic system. Toxicon: Official Journal of the International Society on Toxinology. 40 (12), 1667-1674 (2002).
- Dion, A. S., Pomenti, A. A. Ammoniacal silver staining of proteins: mechanism of glutaraldehyde enhancement. Analytical Biochemistry. 129 (2), 490-496 (1983).
- Ramírez-Carreto, S., et al. Identification of a pore-forming protein from sea anemone Anthopleura dowii Verrill (1869) venom by mass spectrometry. The Journal of Venomous Animals and Toxins Including Tropical Diseases. 25, 147418 (2019).
- Nelson, G. J. Studies on the lipids of sheep red blood cells. I. Lipid composition in low and high potassium red cells. Lipids. 2 (1), 64-71 (1967).
- Ramírez-Carreto, S., et al. Transcriptomic and proteomic analysis of the tentacles and mucus of Anthopleura dowii Verrill, 1869. Marine Drugs. 17 (8), 436 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved