JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
간단한 생물 분석법에 의한 바다 아네몬의 조추출물에서 용혈성 및 포스포리파아제 활성의 확인
요약
여기에서, 우리는 바다 말미잘에서 조독 추출물을 얻고 용혈성 및 포스포리파제 활성을 검출하는 프로토콜을 기술한다.
초록
바다 말미네 독 조성물은 폴리펩티드 및 비단백질 분자를 포함한다. 세포 용해 성분은 새로운 분자 도구를 설계하기위한 높은 생명 공학 및 생물 의학적 잠재력을 가지고 있습니다. 바다 말미잘독은 선충류라고 불리는 외배엽 및 하위 세포 구조의 선 세포에 위치하며, 둘 다 바다 말미잘의 몸 전체에 분포합니다. 이 특성은 세포와 선충류가 다른 독성이없는 분자와 함께 독 성분을 방출하기 위해 용해되어야하기 때문에 도전을 의미합니다. 따라서, 먼저, 독은 조추출물(다양하고 다양한 분자와 조직 파편들의 혼합물)로부터 유래된다. 다음 단계는 특정 생체활성을 갖는 폴리펩티드를 검출하는 것이다. 여기에서, 우리는 시탈리신의 존재를 확인하기 위해 바다 말미네 조추출물 및 생물검정을 수득하기 위한 효율적인 전략을 기술한다. 첫 번째 단계는 시세포 분해신을 방출하는 저렴하고 간단한 기술 (교반 및 동결 해동 사이클)을 포함합니다. 우리는 가장 높은 세포 용해 활성과 단백질 (건조 중량 20g에서 단백질 ~ 500mg)을 얻었습니다. 다음으로, 추출물의 폴리펩티드 복잡성을 SDS-PAGE 겔 검출에 의해 분석하였고, 10 kDa 내지 250 kDa 사이의 분자량을 갖는 단백질을 검출하였다. 용혈성 분석에서 우리는 양 적혈구를 사용하고 HU50 (11.1 ± 0.3 μg / mL)을 측정했습니다. 대조적으로, 조 추출물에서 포스포리파아제의 존재는 아가로스를 갖는 고체 배지에서 기질로서 달걀 노른자를 사용하여 결정되었다. 전반적으로,이 연구는 효율적이고 저렴한 프로토콜을 사용하여 조 추출물을 준비하고 복제 가능한 생물 분석을 적용하여 세포 분해물, 생명 공학 및 생물 의학 관심사를 가진 분자를 확인합니다.
서문
해양 동물은 생물학적 활성 화합물의 풍부한 공급원입니다. 최근 수십 년 동안, 바다 말미잘독의 조성은 용혈성, 세포독성, 효소적(포스포리파제, 프로테아제, 키티나제) 및 단백질 분해 활성에 대한 신경독성 활성 및 억제 효과를 갖는 다양한 폴리펩티드를 포함하기 때문에 과학적인 관심을 끌었다1. 또한, 이들 폴리펩티드는 생명공학 및 치료적 용도2,3에서 분자 도구의 개발을 위한 잠재적 공급원이다.
바다 말미잘독과 그 분자 성분에 대한 보고는 거의 없는데, 이는 독을 얻는 복잡성, 심지어 독소의 분리 및 특성화로 인한 것이다. 보고서에 사용 된 추출 방법은 독 생산과 관련이 있고 관련이없는 세포의 내용물을 용해시키고 비우는 것을 포함했습니다1.
모든 cnidarians의 특별한 특징은 단일 해부학 적 영역에 집중 된 독의 생산 및 방출을위한 시스템이 없다는 것입니다. 대신, 선충류는 독 4,5를 유지하는 구조입니다. 표피선 세포라고 불리는 다른 유형의 세포도 독소를 분비하며 바다 말미잘6의 몸 전체에 분포합니다.
독을 얻는 데있어 첫 번째이자 가장 중요한 도전은 불안정한 단백질의 불활성화 또는 분해없이 후속 과정에서 충분한 조작을 가진 추출물을 생성하는 것입니다. 다음에, 세포는 용해되어야 하고, 성분-이 경우, 폴리펩티드는 효율적이고 신속하게 추출되어야 하며, 단백질 분해 및 가수분해를 피하면서 다른 세포 성분(7)을 제거해야 한다.
바다 말미잘의 조추출물을 얻기 위해 상이한 방법이 사용된다; 일부는 유기체를 희생시키는 것을 포함하고 다른 일부는 유기체가 살아 있도록 허용합니다. 유기체의 전신의 사용을 암시하는 방법은 독9의 일부 구성 요소 만 추출하는 유기체를 살아 있게 유지하는 방법과 비교하여 독8에서 대부분의 독소를 방출 할 수 있습니다. 추출물의 제조는 생체내 또는 시험관내 방법(10)에 의해 약리학적 효과를 관찰하기 위한 전략을 포함하는 특정 생물검정을 통해 관심있는 물질의 존재 및 효능을 평가하는 것을 필요로 한다.
바다 말미네 독은 세포용해성 폴리펩티드, 기공형성 독소(PFTs)11, 및 포스포리파아제12를 함유하고; 이들 분자는 단백질-지질 상호작용, 암 치료의 분자 도구 및 나노기공3에 기초한 바이오센서 연구의 모델이다. 바다 말미네 PFTs의 분류는 5 kDa 내지 80 kDa의 크기 또는 분자량에 따라 수행된다. 가장 많이 연구되고 악티노포린11로 알려진 20kDa PFT는 항암, 항균 및 나노 기공 기반 바이오 센서와 같은 가능한 응용을위한 분자 도구 개발에서 생물 의학적 잠재력에 특히 관심이 있습니다. 포스포리파아제, 구체적으로는 포스포리파제 A2(PLA2)13을 포함하는 또 다른 시톨리신은 지방산을 방출하고 인지질을 가수분해하여 세포막을 불안정하게 만든다. 이러한 작용 메카니즘으로 인해, PLA2는 염증성 질환에서의 연구 및 응용을 위한 필수적인 모델이 될 것을 약속한다. 이는 세포막(14)에서의 지질 거동을 연구하기 위한 모델로서 작용할 수 있다.
여기에서, 우리는 바다 말미잘로부터 조추출물을 수득하기 위한 효율적인 프로토콜을 기술한다 Anthopleura dowii Verrill, 1869, 및 검출 용혈 및 포스포리파아제. 둘 다 새로운 분자 도구를 설계하기위한 주형으로 사용될 수있는 관련 독소입니다.
프로토콜
바다 말미잘은 멕시코 연방 정부의 양식, 수산 및 식품에 대한 국가위원회의 지침에 따라 수집되었습니다 (허가 번호 PPF / DGOPTA 07332.250810.4060). 멕시코 국립 자치 대학 생명 공학 연구소의 생명 윤리위원회는 바다 말미잘을 이용한 모든 실험을 승인했습니다. 양 혈액 샘플은 동물 생산 및 건강 실무 교육 및 연구 센터 (CEPIPSA, 멕시코 국립 자치 대학)에서 구입했습니다.
1. 유기체 수집
- 바다 말미잘을 수집 A. dowii.
참고: 여기에서, 유기체는 멕시코주 캘리포니아주 엔세나다 바하 해안의 조간대 지역에서 썰물 기간 동안 수집되었다(그림 1A,B). - 생물을 바닷물이 있는 용기에 있는 실험실로 운반합니다(그림 1C).
- 실험실에서는 손으로 증류수로 유기체를 청소하여 신체에 부착되는 큰 기질 입자를 제거하십시오.
- 유기체를 즉시 -80°C에서 72시간 동안 울트라 냉동고에서 동결시킨다.
- 생물을 동결 건조를위한 특수 안경에 넣고 동결 건조 조건을 -20 °C, 0.015 psi, 48 시간 동안 두십시오.
- 동결건조된 유기체를 사용 전까지 -20°C에서 보관한다.
2. 조직 수분 공급
- 동결건조된 유기체의 건조 중량 20g을 50mM 인산나트륨 완충액 60mL(1/3w/v), pH 7.5 및 1억제제 칵테일 정제(표 of Materials)로 재구성한다.
- 자기 교반기에서, 샘플을 ∼800 rpm, 4°C, 12 h 동안 연속적으로 교반한다.
3. 독소 방출
- 세포 용해 및 선충류 배출을 유도하기 위해, 샘플을 -20°C에서 12시간 동안 동결시킨 다음, 용기를 90%까지 해동될 때까지 실온(RT)의 물에 넣는다. 이 절차를 세 번 반복하십시오.
참고: 샘플은 100% 해동하지 않습니다. 단백질 분해를 방지하기 위해 샘플을 ~ 4 °C로 유지하는 것이 중요합니다. - 공초점 현미경으로 배출 된 선충류를 관찰하십시오. 10 μL의 샘플을 슬라이드에 가져 와서 그 위에 커버 슬립을 놓습니다. 공초점 현미경으로 100x 및 60x 배율로 관찰하십시오. 여기에는 염료가 필요하지 않았습니다.
- ImageJ 소프트웨어(버전 1.53c, Wayne Rasband, National Institutes of Health, USA, https://imagej.nih.gov/ij)에서 공초점 현미경으로 캡처한 이미지를 처리합니다.
- 선충 낭종 내부의 세뇨관이 풀리고 밖에 있으면 선충류가 배출됩니다. 그런 다음 다음 단계를 계속하십시오. 그렇지 않으면 동결 - 해동 사이클을 한 번만 더 수행하십시오.
- 추출물을 명확히 하기 위해, 샘플을 25,400 x g 에서 40분 동안, 4°C에서 원심분리하고, 상층액을 회수하고, 이를 다시 원심분리한다. 이 단계를 3-4 번 반복하십시오.
- 상청액을 회수하고 펠렛을 버린다. 상청액 또는 조 추출물은 독 성분(독소) 및 다른 세포 분자, 예컨대 지질, 탄수화물 및 핵산을 함유한다.
4. 총 단백질의 정량
- 상용 브래드포드 비색 분석15 키트를 사용하여 조 추출물의 단백질 농도를 결정한다 (표 of Materials).
- 염료 시약 (염료의 한 부분을 증류수의 네 부분으로 희석)을 희석하십시오.
- 소 혈청 알부민 (BSA) 분획 V (물질 표) 용액을 인산염 완충액 (50 mM 인산나트륨, pH 7.5)에서 1 mg / mL 농도로 준비하십시오.
- 표 1에 열거된 용액을 삼중으로 준비한다.
- 각 용액을 4 초 동안 쉐이커에 격렬하게 혼합하십시오.
- 샘플을 흔들지 않고 RT에서 5분 동안 인큐베이션한다.
- 595 nm에서 흡광도(AU)를 측정합니다.
- 시료의 평균인 BSA 흡광도(AU 대 단백질 농도)를 플로팅하고, 그래프의 방정식을 결정한다(수학식 1).
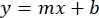 수학식 1
수학식 1
여기서 y는 흡광도, m은 선의 기울기, x는 단백질 농도, b는 y-절편입니다. 조 추출물 농도를 계산하려면 x에 대해 다음과 같이 해결하십시오.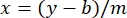 수학식 2
수학식 2
5. 폴리펩티드 독의 복잡성 결정
- 설명서에 따라 수직 겔 전기 영동을위한 유리 용기를 조립하십시오.
- 아크릴아미드 믹스 (30%)를 준비한다: 아크릴아미드 29.2 g, 비스아크릴아미드 0.8 g, 최종 부피 100 mL. 용액을 0.45 μm 멤브레인을 사용하여 여과한다. 용액을 4°C의 어두운 병에 보관한다. 이어서, 용해성 겔을 위한 혼합물을 준비한다(표 2).
- SDS-PAGE 젤은 분해능 겔과 스태킹 젤로 구성됩니다. 표 2에 정의된 용액 부피에 따라 겔을 준비한다. 준비 동안, 중합 시간을 감소시키기 위해 각각의 혼합을 4°C에서 유지하도록 보장한다.
참고 : 각 혼합물의 부피는 사용 된 장비의 브랜드에 따라 다릅니다. 이 프로토콜에 대해, 부피는 수직 전기영동 챔버에 대한 0.75 mm 두께의 15% 아크릴아미드 겔의 제조에 상응한다(표 재료). - 아크릴 아미드가 중합 된 후, ∼10 분, 스태킹 겔의 혼합물을 첨가한다.
- 스태킹 겔을위한 혼합물을 준비하고 즉시 유리 판에 넣고 빗을 배치하여 샘플을로드하기위한 웰을 형성하십시오.
- 스태킹 겔이 중합되면 (~ 15 분), 빗을 제거하고 유리 용기를 수직 전기 영동을위한 챔버에 놓습니다.
- 200 mL의 전극 완충액(0.25 M 트리스, 0.192 M 글리신, 0.1% SDS)을 전기영동 챔버에 넣는다.
- 조추출물 분석: 조추출물 30μg을 단백질 로딩 완충액 5μL(25% 글리세롤, 15% 도데실 설페이트 나트륨, 25% 2-메르캅토에탄올, 0.125mM 트리스 pH 7, 브로모페놀 블루 0.1mg/mL)와 혼합하여 단백질을 변성시킵니다. 최종 부피는 <50 μL이어야 한다.
- 90°C에서 5분 동안 가열하고, 냉각하고, 1,400 x g에서 3초 동안 원심분리한다.
- 샘플을 스태킹 젤의 웰에로드하십시오. 표준 분자량 사다리를 로드합니다.
- 1 h 30 분 동안 25 mA 상수에서 전기영동을 실행한다.
- 전기영동 챔버로부터 유리 용기를 제거하여 겔 단백질의 염색을 진행한다.
6. 단백질 염색
- 겔을 증류수 50 mL에 헹구어 완충 전극으로부터 이물질을 제거한다.
- 물을 버리십시오.
- 겔 단백질의 확산을 피하려면 고정 용액 (에탄올 60 mL, 아세트산 20 mL, 증류수 20 mL, 최종 부피 100 mL)을 첨가하십시오. RT에서 40분 동안 인큐베이션하고 80 rpm에서 진탕한다. 해결책을 데칸트하십시오.
- 단백질 가교 용액(에탄올 15 mL, 글루타르알데히드 0.25 mL, 증류수 50 mL, 최종 부피 65.25 mL)을 첨가하고, 80 rpm에서 진탕하면서 RT에서 30분 동안 인큐베이션한다. 솔루션을 제거합니다.
- 겔을 증류수 100 mL로 5분 동안 세척하고, 물을 제거하였다. 이 절차를 네 번 반복하십시오.
- 쿠마시 브릴리언트 블루 R-250 여과액 50 mL(40% 메탄올, 10% 아세트산, 50% 증류수, 0.1% 염료, 최종 부피 100mL)로 단백질 염색을 수행하고, RT의 실험실 회전 발진기에서 60rpm으로 15분 동안 교반한다.
- 다른 젤을 염색하는 데 사용할 수있는 용액을 회수하십시오.
- 과도한 염료를 제거하려면 탈지 용액 (메탄올 40 mL, 아세트산 10 mL, 증류수 50 mL)을 첨가하십시오. 밴드(염색된 단백질)가 시각화될 때까지 RT에서 교반(80rpm)을 유지하십시오.
- 젤을 증류수 50mL에 보관하고 Gel 문서화 시스템에서 이미지를 스캔합니다.
7. 적혈구 용액 준비
- 양의 경정맥에서 1 mL의 혈액을 추출하십시오.
- 주사기에서 바늘을 제거하고 즉시 50 mL의 Alsever 용액 (항응고제로서 0.002 M 시트르산, 0.07 M NaCl, 0.1 M 덱스트로스 및 0.027 M 시트르산 나트륨)이있는 튜브로 혈액을 배출하십시오.
- 천천히 용액을 세 번 뒤집습니다.
- 실험실로 옮기기 위해 4 °C에서 유지하십시오.
- 4°C에서 5분 동안 804 x g 에서 원심분리하고 상층액을 버린다.
- 펠렛을 30 mL의 Alsever 용액에 재현탁시킨다. 튜브의 내벽을 따라 용액을 밀어 넣고 파스퇴르 플라스틱 피펫을 사용하여 천천히 세포를 재현탁하십시오. 다시 804 x g 에서 5분 동안, 4°C에서 원심분리한다. 상청액이 명확해질 때까지이 과정을 반복하십시오.
- 알세버 용액 15 mL를 첨가하는 단계; 파스퇴르 플라스틱 피펫으로 펠렛을 천천히 재현탁하십시오.
- Alsever 용액의 최종 부피를 유지하여 대략 2 x 106 cells/mL의 농도를 달성하십시오. 그런 다음 Neubauer 챔버 또는 혈구 측정기를 사용하여 세포를 계수하십시오.
참고: 혈소세포계 슬라이드의 적혈구를 세십시오 (Neubauer 개선). 슬라이드는 30mm x 70mm x 4mm 슬라이드입니다. 중앙에는 두 개의 은색 풋플레이트(그림 2A)(위쪽 격자 하나와 아래쪽 격자 하나), 각각 3mm x 3mm, 그리드 측면에 두 개의 채널이 있습니다. 셀 계수는 모서리와 가운데 사각형에 있습니다(그림 2B의 빨간색 사각형). 계수를위한 세포의 최적 농도는 10 6 세포의 순서가되어야합니다. 중앙 박스의 표면적은 0.1cm2이며, 이는 0.0001mL에 해당한다. - 슬라이드 위에 커버슬립을 놓습니다.
- 샘플 10 μL를 슬라이드와 커버슬립 사이에 놓고 샘플이 지급될 때까지 기다립니다.
- 광학 현미경 (배율 60x)에서 첫 번째 사각형 상자에서 카운트를 수행하십시오. 가운데 격자선에 있는 셀과 상자의 위쪽 또는 왼쪽 여백에 닿는 셀만 계산합니다.
- 다음 방정식을 사용하여 세포 농도를 결정합니다.
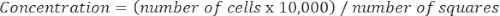 수학식 3
수학식 3
샘플이 매우 농축되고 희석이 필요한 경우 다음 방정식을 사용하십시오.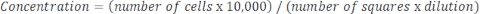 수학식 4
수학식 4
참고 : 용혈 테스트를 위해 적혈구 용액을 복용 할 때 플라스틱 파스퇴르 피펫으로 용액을 천천히 균질화하십시오. - 오류를 줄이기 위해 세 배의 단계를 수행하십시오.
8. 용혈 분석
- 표 3에 표시된 용액 혼합물(삼중)을 원뿔형 96-웰 플레이트에서 준비한다.
참고: 적혈구를 천천히 혼합하여 균질한 현탁액을 유지하십시오. - 진탕 없이 37°C에서 1시간 동안 인큐베이션한다.
- 플레이트를 4°C에서 5분 동안 804 x g 에서 원심분리한다.
- 평평한 바닥을 가진 다른 96-웰 플레이트에서 상청액을 회수하십시오.
- 조 추출물에 세포 분해신이 포함되어 있으면 적혈구가 용해되어 헤모글로빈을 방출합니다. 415nm에서 흡광도를 읽습니다.
- 다음 방정식을 사용하여 용혈 백분율을 계산합니다.
% 용혈 = ((조추출물-AAlsever 완충액)/(AH2O-AAlsever)) x 100
참고: 조추출물, AAlsever 완충액 및AH2O는 각각 조추출물을 사용한 적혈구의 흡광도, 알세버 용액의 흡광도 및 증류수의 흡광도에 해당합니다. - 조추출물로부터 총 단백질 50 μg으로 각각의 동결 및 해동 주기 전후에 용혈 시험을 수행한다.
- 100% 용혈 활동에 도달하는 데 필요한 동결 및 해동 주기의 수를 결정합니다.
- 적혈구의 50%에서 용혈을 생성하는 추출물의 양을 계산한다(HU50); 표 3에 기재된 동일한 프로토콜에 따라, 바다 말미네 조추출물의 양을 증가시키고, 적절한 소프트웨어(예를 들어, 기원, 재료 표)를 사용하여 시그모이드 조정으로 플롯을 설계한다.
9. 포스포리파아제 분석
- 닭고기 달걀 1개를 증류수에 1% SDS로 씻으십시오.
- 멸균 조건에서 달걀 노른자와 달걀 흰자를 분리하십시오.
- 50 mL의 0.86% NaCl 용액을 준비하고, 0.22 μm 필터를 통해 여과한다. 그런 다음 용액 A를 준비하십시오 : 달걀 노른자 12 mL와 0.86 % NaCl 용액 36 mL를 첨가하십시오.
- 용액 B를 준비하십시오: 50 mL의 완충액 (50 mM 트리스, pH 7.5)에 아가로스 300 mg을 혼합하고, 0.22 μm 필터를 통해 여과한다. 끓을 때까지 전자 레인지에서 용액을 가열하십시오. 따뜻한 물에서 식혀 43-45 ° C에 도달하십시오.
- 용액 C 준비: 10 mM CaCl2를 준비하고0.22 μm 필터로 여과한다.
- 용액 D를 준비하십시오 : 증류수 1mL에 로다민 6G 10mg을 준비하십시오.
- 멸균 조건(층류 후드)에서 용액 A 및 C 500μL를 용액 B와 용액 D 100μL에 넣고 혼합한 다음 25mL를 각 페트리 접시(90 x 15mm)에 붓습니다.
- 용액이 멸균 조건 (30 분) 하에서 응고될 때까지 기다리십시오.
- 얇은 튜브로 우물 (~ 2-3mm 직경)을 만드십시오.
- 한 웰에 총 20 μL의 인산염 완충액 (음성 대조군)을 첨가하고 20 μL의 결정된 포스포리파아제 (양성 대조군)를 다른 웰에 첨가한다.
- 상이한 양의 조추출물 단백질, 5, 15, 25, 35, 45 μg을 나머지 웰에 넣고, 각각 20 μL의 최종 부피로 둔다.
- 한천이 모든 샘플을 흡착 할 때까지 기다리십시오 (30 분).
- 37°C에서 20시간 동안 인큐베이션한다.
- 후광이 우물 주위에 형성되면, 이것은 포스포리파아제 활성을 나타낸다. 버니어 캘리퍼로 형성된 후광을 측정하십시오.
참고: 실험을 세 배로 수행합니다(9.1-9.14의 단계).
결과
바다 말미잘의 조추출물을 얻기 위해 사용된 프로토콜의 대표적인 결과는 두 가지 기술(동결 및 해동의 교반 및 순환)을 결합하면 선충종을 효율적으로 배출할 수 있었으며 총 단백질 양은 500mg(8mg/mL)이었다(그림 3).
조 추출물의 단백질 복잡성은 SDS-PAGE 전기영동을 통해 10 kDa 및 250 kDa 초과로부터 관찰될 수 있었다. 또한, 시톨리신은 15 kDa 및 20 kDa의 분자?...
토론
과학 및 산업의 다른 분야에서 응용 프로그램과 새로운 화합물에 대한 높은 수요는 독의 연구로 이어졌다. Venom은 새로운 분자 도구를 생성하기위한 주형 역할을하는 풍부한 분자 공급원을 나타냅니다. 그러나 이러한 독의 복잡성은 그것들을 얻고 연구하기 위해 다양한 방법의 구현과 조합을 필요로합니다.
여기에서, 우리는 동결건조된 표본으로 시작하여 다른 바다 말미잘?...
공개
저자들은 이 논문의 출판과 관련하여 경쟁적인 이해관계가 없다고 선언한다.
감사의 말
이 작품은 Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT)에 의해 지원되었으며, 보조금 번호 IT200819가 있습니다. 저자는이 원고의 영어 문법을 확인하기 위해 Tom Musselman, Rock Paper Editing, LLC에게 인정합니다. Samanta Jiménez (CICESE, Ensenada)와 Juan Manuel Barbosa Castillo (Instituto de Fisiología Celular, UNAM)의 기술 지원. 우리는 또한 양의 피를 얻은 Augusto César Lizarazo Chaparro (CEPIPSA) 박사에게 감사드립니다. 우리는 특히 ICAT-UNAM의 José Saniger Blesa박사에게 비디오 녹화를 위한 실험실의 시설에 대해 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL conical centrifuge tube | Corning | 430766 | |
| 2-Bromophenol blue | Sigma | B75808 | |
| 2-mercaptoetanol | Sigma-Aldrich | M6250-100ML | |
| 50 mL conical centrifuge tubes | Corning | 430828 | |
| Acetic Acid Glacial | J.T. Baker | 9515-03 | |
| Acrylamide | Promega | V3115 | |
| Agarose | Promega | V3125 | |
| Bisacrylamide | Promega | V3143 | |
| Bovine Serum Albumin Fraction V | Sigma | A3059-100G | |
| Bradford Protein Assays | Bio-Rad | 5000006 | |
| Calcium chloride | Sigma-Aldrich | C3306 | |
| Cell culture plates 96 well, V-bottom | Corning | 3894 | |
| Centrifuge | Eppendorf | 5804R | |
| Centrifuge tubes | Corning | CLS430829 | |
| ChemiDoc MP system | Bio-Rad | 1708280 | |
| Citric acid | Sigma-Aldrich | 251275 | |
| Clear flat.bottom 96-Well Plates | Thermo Scientific | 3855 | |
| Coomassie Brilliant Blue G-250 | Bio-Rad | #1610406 | |
| Coomassie brilliant blue R-250 | Bio-Rad | 1610400 | |
| Dextrose | J.T. Baker | 1916-01 | |
| Ductless Enclosure | Labconco | Vertical | https://imagej.nih.gov/ij ImageJ 1.53c |
| Gel Doc EZ | Bio Rad. | Gel Documentation System | |
| Glycerol | Sigma-Aldrich | G5516-4L | |
| Hemocytometer | Marienfeld | 650030 | |
| ImageJ (Software) | NIH, USA | Version 1.53c | |
| Incubator 211 | Labnet | I5211 DS | |
| Methanol | J.T. Baker | 9049-03 | |
| Mini-PROTEAN tetra cell | Bio-Rad | 1658000EDU | |
| Na2HPO4 | J.T. Baker | 3824-01 | |
| NaCl | J.T. Baker | 3624-01 | |
| NaH2PO4.H2O | J.T. Baker | 3818-05 | |
| Origin software | version 9 | To design the plot with sigmoidal adjustments | |
| Petridish | Falcon | 351007 | |
| Pipetman kit | Gilson | F167380 | |
| Precast mini gel | BioRad | 1658004 | |
| Prestained Protein Ladder | Thermo Scientific | 26620 | |
| Protease Inhibitor Cocktail | Roche | 11836153001 | |
| Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | |
| Rhodamine 6G | Sigma-Aldrich | 252433 | |
| SDS | Sigma-Aldrich | L4509 | |
| Sodium citrate dihydrate | JT Baker | 3646-01 | |
| Spectrophotometer | THERMO SCIENTIFIC | G10S UV-VIS | |
| Tris Base | Sigma-Aldrich | 77-86-1 | |
| Volt Power Supply | Hoefer | PS300B |
참고문헌
- Frazão, B., Vasconcelos, V., Antunes, A. Sea anemone (Cnidaria, Anthozoa, Actiniaria) toxins: an overview. Marine Drugs. 10 (8), 1812-1851 (2012).
- Jayathilake, J. M. N. J., Gunathilake, K. V. K. Cnidarian toxins: recent evidences for potential therapeutic uses. The European Zoological Journal. 87 (1), 708-713 (2020).
- Ramírez-Carreto, S., Miranda-Zaragoza, B., Rodríguez-Almazán, C. Actinoporins: From the structure and function to the generation of biotechnological and therapeutic tools. Biomolecules. 10 (4), 539 (2020).
- Fautin, D. G. Structural diversity, systematics, and evolution of cnidae. Toxicon. Official Journal of the International Society on Toxinology. 54 (8), 1054-1064 (2009).
- Moran, Y., et al. Analysis of soluble protein contents from the nematocysts of a model sea anemone sheds light on venom evolution. Marine Biotechnology. 15 (3), 329-339 (2013).
- Moran, Y., et al. Neurotoxin localization to ectodermal gland cells uncovers an alternative mechanism of venom delivery in sea anemones. Proceedings of the Royal Society B: Biological Sciences. 279 (1732), 1351-1358 (2012).
- Grabski, A. C. Advances in preparation of biological extracts for protein purification. Methods in Enzymology. 463, 285-303 (2009).
- Bulati, M., et al. Partially purified extracts of sea anemone Anemonia viridis affect the growth and viability of selected tumour cell lines. BioMed Research International. 2016, 3849897 (2016).
- Orts, D. J. B., et al. Biochemical and electrophysiological characterization of two sea anemone type 1 potassium toxins from a geographically distant population of Bunodosoma caissarum. Marine Drugs. 11 (3), 655-679 (2013).
- Hader, D., Erzinger, G. . Bioassays: Advanced Methods and Applications. , (2017).
- Anderluh, G., Macek, P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria). Toxicon: Official Journal of the International Society on Toxinology. 40 (2), 111-124 (2002).
- Nevalainen, T. J., et al. Phospholipase A2 in cnidaria. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 139 (4), 731-735 (2004).
- Razpotnik, A., et al. A new phospholipase A2 isolated from the sea anemone Urticina crassicornis - its primary structure and phylogenetic classification. The FEBS Journal. 277 (12), 2641-2653 (2010).
- Dennis, E. A., Cao, J., Hsu, Y. -. H., Magrioti, V., Kokotos, G. Phospholipase A2 enzymes: Physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chemical Reviews. 111 (10), 6130-6185 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Kwon, Y. -. C., Jewett, M. C. High-throughput preparation methods of crude extract for robust cell-free protein synthesis. Scientific Reports. 5, 8663 (2015).
- Eno, A. E., Konya, R. S., Ibu, J. O. Biological properties of a venom extract from the sea anemone, Bunodosoma cavernata. Toxicon: Official Journal of the International Society on Toxinology. 36 (12), 2013-2020 (1998).
- Morales-Landa, J. L., et al. Antimicrobial, antiprotozoal, and toxic activities of Cnidarian extracts from the Mexican Caribbean Sea. Pharmaceutical Biology. 45 (1), 37-43 (2007).
- Sánchez-Rodríguez, J., Cruz-Vazquez, K. Isolation and biological characterization of neurotoxic compounds from the sea anemone Lebrunia danae (Duchassaing and Michelotti, 1860). Archives of Toxicology. 80 (7), 436-441 (2006).
- de Oliveira, J. S., et al. Caissarolysin I (Bcs I), a new hemolytic toxin from the Brazilian sea anemone Bunodosoma caissarum: purification and biological characterization. Biochimica Et Biophysica Acta. 1760 (3), 453-461 (2006).
- Norton, R. S., et al. Purification and characterisation of proteins with cardiac stimulatory and haemolytic activity from the anemone Actinia tenebrosa. Toxicon: Official Journal of the International Society on Toxinology. 28 (1), 29-41 (1990).
- Gondran, M., Eckeli, A. L., Migues, P. V., Gabilan, N. H., Rodrigues, A. L. S. The crude extract from the sea anemone, Bunodosoma caissarum elicits convulsions in mice: possible involvement of the glutamatergic system. Toxicon: Official Journal of the International Society on Toxinology. 40 (12), 1667-1674 (2002).
- Dion, A. S., Pomenti, A. A. Ammoniacal silver staining of proteins: mechanism of glutaraldehyde enhancement. Analytical Biochemistry. 129 (2), 490-496 (1983).
- Ramírez-Carreto, S., et al. Identification of a pore-forming protein from sea anemone Anthopleura dowii Verrill (1869) venom by mass spectrometry. The Journal of Venomous Animals and Toxins Including Tropical Diseases. 25, 147418 (2019).
- Nelson, G. J. Studies on the lipids of sheep red blood cells. I. Lipid composition in low and high potassium red cells. Lipids. 2 (1), 64-71 (1967).
- Ramírez-Carreto, S., et al. Transcriptomic and proteomic analysis of the tentacles and mucus of Anthopleura dowii Verrill, 1869. Marine Drugs. 17 (8), 436 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유