需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
自动图像处理确定河流大型无脊椎动物群落大小结构
摘要
本文基于创建适应协议,以使用半自动成像程序扫描,检测,分类和识别与底栖河流大型无脊椎动物相对应的数字化物体。该程序允许在大约1小时内获得大型无脊椎动物群落的个体尺寸分布和尺寸指标。
摘要
体型是一个重要的功能性状,可用作评估自然群落扰动影响的生物指标。群落规模结构响应生物和非生物梯度,包括跨分类群和生态系统的人为扰动。然而,手动测量底栖大型无脊椎动物等小型生物(例如,>500 μm 至几厘米长)非常耗时。为了加快群落规模结构的估计,我们开发了一种协议来半自动测量受保护的河流大型无脊椎动物的个体体型,这是评估淡水生态系统生态状况最常用的生物指标之一。该协议改编自现有的方法,该方法旨在使用专为水样设计的扫描系统扫描海洋中游动物。该协议包括三个主要步骤:(1)扫描河流大型无脊椎动物的子样本(细样本和粗样本量分数)并处理数字化图像以个性化每个图像中的每个检测到的对象;(2)通过人工智能创建、评估和验证学习集,以半自动地将大型无脊椎动物的单个图像与扫描样本中的碎屑和人工制品分开;(3)描绘大型无脊椎动物群落的大小结构。除协议外,这项工作还包括校准结果,并列举了几个挑战和建议,以使该程序适应大型无脊椎动物样品并考虑进一步改进。总体而言,研究结果支持使用所提出的扫描系统对河流大型无脊椎动物进行自动体型测量,并表明其尺寸谱的描述是淡水生态系统快速生物评估的宝贵工具。
引言
底栖大型无脊椎动物被广泛用作确定水体生态状况的生物指标1。大多数描述大型无脊椎动物群落的指数都侧重于分类指标。然而,鼓励使用整合体型的新生物评估工具,为分类学方法提供替代或补充视角2,3。
体型被认为是与其他重要特征(如新陈代谢、生长、呼吸和运动)相关的元特征4.此外,体型可以决定营养位置和相互作用5。群落中个体体型与按大小等级标准化生物量(或丰度)之间的关系定义为尺寸谱6,并遵循随着个体大小在对数尺度上增加而归一化生物量线性减少的一般模式7。这种线性关系的斜率在理论上得到了广泛的研究,跨生态系统的实证研究将其作为群落规模结构的生态指标4。在生物多样性生态系统功能研究中成功使用的群落规模结构的另一个综合指标是群落规模多样性,它表示为大小谱或其类似物的大小类别的香农指数,该指数是根据个体大小分布8计算的。
在淡水生态系统中,不同动物群落的大小结构被用作共济失调指标,以评估生物群落对环境梯度9,10,11和人为扰动12,13,14,15,16的响应。大型无脊椎动物也不例外,它们的大小结构也对环境变化17,18和人为扰动做出反应,例如采矿19,土地利用20,或氮(N)和磷(P)富集20,21,22。然而,测量数百人以描述社区规模结构是一项繁琐且耗时的任务,由于时间不足,通常避免将其作为实验室的常规测量。因此,已经开发了几种半自动或自动成像方法来分类和测量标本23,24,25,26。然而,这些方法中的大多数都侧重于分类学分类,而不是生物体的个体大小,并且尚未准备好用于所有种类的大型无脊椎动物。在海洋浮游生物生态学中,扫描图像分析系统已被广泛用于确定浮游动物群落的大小和分类组成27,28,29,30,31。该仪器可以在世界各地的几个海洋研究所找到,它用于扫描保存的浮游动物样品以获得整个样品的高分辨率数字图像。本议定书调整了该仪器的使用,以快速自动的方式估计河流中大型无脊椎动物群落的大小范围,而无需投资创建新设备。
该协议包括扫描样品和处理整个图像,以自动获得样品中对象的单个图像(即晕影)。形状、大小和灰度特征的几种测量表征了每个对象,并允许将对象自动分类为类别,然后由专家进行验证。每个生物体的个体大小是使用椭球体生物体积(mm3)计算的,该生物体积来自以像素为单位测量的生物体面积。这允许快速获得样品的尺寸谱。据我们所知,这种扫描成像系统仅用于处理中浮游动物样品,但该设备可能允许处理淡水底栖大型无脊椎动物。
因此,本研究的总体目标是引入一种方法,通过调整以前用于海洋中游生物27,32,33的现有协议,快速获得保存的河流大型无脊椎动物的个体大小。该过程包括使用半自动方法,该方法与扫描设备一起扫描水样和三个开放式软件来处理扫描的图像。本文提出了一种经过调整的协议,用于扫描、检测和识别数字化河流大型无脊椎动物,以自动获取群落规模结构和相关规模指标。还根据从伊比利亚半岛东北部(东北)三个盆地(Ter、Segre-Ebre和Besòs)收集的42张河流大型无脊椎动物样本的扫描图像,对提高效率的程序和准则进行了评估。
这些样品是在100米长的河段收集的,遵循西班牙政府对可涉足河流中底栖河流大型无脊椎动物进行实地取样和实验室分析的协议34。在多栖息地调查后,用苏伯采样器(框架:0.3 m x 0.3 m,目数:250 μm)收集样品。在实验室中,将样品通过5毫米和500μm网清洁和筛分,以获得两个子样品:粗子样品(5毫米目)和精细子样品(500微米目),它们储存在单独的小瓶中并保存在70%乙醇中。将样品分成两个大小的分数可以更好地估计群落大小结构,因为大型生物比小型生物更稀有且更少。否则,扫描样品具有大尺寸分数的偏差表示。
研究方案
注意:此处描述的协议基于Gorsky等人为海洋中浮游动物开发的系统27 。扫描仪(ZooSCAN)、扫描软件(VueScan 9x64 [9.5.09])、图像处理软件(Zooprocess、ImageJ)和自动识别软件(浮游生物标识符)步骤的具体描述可以在之前的参考文献32,33中找到。为了最好地调整底栖大型无脊椎动物相对于中游动物的大小,一旦按照原始协议32,33 创建项目,请将配置文件中的最小尺寸 (minsizeesd_mm) 参数更改为 0.3 毫米,将最大尺寸 (maxsizeesd_mm) 参数更改为 100 毫米。为了帮助遵循协议,这总结在工作图表中(图1)。创建的项目存储在计算机的 C 文件夹中,并组织在以下文件夹中:PID_process、Zooscan_back、Zooscan_check、 Zooscan_config、Zooscan_meta、Zooscan_results和 Zooscan_scan。每个文件夹由多个子文件夹组成,不同的软件应用程序在协议的以下步骤中使用了这些子文件夹。
1. 大型无脊椎动物样本的数字图像采集
- 扫描和处理毛坯
注意:扫描前每天创建两个空白图像,以提取背景扫描,同时在同一天处理扫描的图像。- 打开扫描仪并打开双位置的灯,从顶部和底部投射白光。
注意:扫描中游生物样品时,使用向上的光方向,但由于大型无脊椎动物更不透明,建议将光切换到双位置。 - 清洁并用自来水冲洗扫描托盘。
- 将 110 mL 室温 (RT) 下储存的自来水倒入扫描托盘中,直到玻璃被覆盖。将大框架(24.5 cm x 15.8 cm)放在扫描托盘上的正确位置(角落位于扫描托盘的左上角),并用自来水填充,直到框架的台阶被覆盖,以避免弯月面效应,这会改变扫描的图像。合上扫描仪盖。
注意:在室温下用水以避免冷凝和气泡形成。清洁框架时没有痕迹或液滴,以避免光反射。 - 转到图像处理软件,选择工作项目,然后单击扫描 (转换)背景图像。
- 转到扫描软件,然后单击 预览。确保预览扫描的图像,检查没有线条或斑点,并等待至少30秒,然后再开始另一次扫描。单击 扫描并在第二次扫描前的说明窗口中按 确定 ,将数据从扫描软件发送到图像处理软件。
注:扫描两次以获得将构成空白的两个后台扫描。此步骤每天在开始示例处理之前执行一次,图像存储在 Zooscan_back文件夹中。 - 完成扫描后关闭扫描软件。
- 打开扫描仪并打开双位置的灯,从顶部和底部投射白光。
- 样品制备和扫描
注意:乙醇是一种易燃液体,可能会造成严重的眼睛损伤/刺激。- 填写示例元数据。转到图像处理软件,然后选择 填写示例元数据。输入示例标识,单击" 确定",然后填写元数据。
注意:图元文件是专门为中浮游动物样本创建的,因此它不符合底栖大型无脊椎动物采样方法,但在扫描之前需要填写文件的所有字段,否则会弹出错误标志。 - 将 110 mL 70% 乙醇倒入扫描托盘中,直到玻璃被覆盖,然后将大框架 (24.5 cm x 15.8 cm) 放在扫描托盘左上角。
注意:使用乙醇而不是水,因为大型无脊椎动物保存在乙醇中。在水中,它们在扫描托盘中漂浮和漂移,从而防止图像清晰,从而防止可靠的尺寸测量。乙醇应保存在室温下,以避免冷凝和气泡形成。 - 将大型无脊椎动物样品倒入框架边缘的扫描托盘中,如果需要,用更多的乙醇覆盖框架步骤。
注意:避免添加过多的乙醇,以避免生物体漂浮和漂移。 - 在整个框架区域中均质化样品,将最大的个体放在托盘的中心以进行适当的图像处理,并使用木针沉入漂浮的生物体。
注意:如果子样本在数值上包含超过 1,000 个个体,请将子样本分成两个或多个部分,以尽量减少扫描图像中的接触生物,并分别扫描部分。 - 使用木针将接触的生物和接触框架边缘的生物分开。
注意:此步骤需要 5-20 分钟。触摸生物体被软件视为单个物体;因此,在这些情况下,计算的个体大小与实际的单个生物体不对应,并且可能使群落规模结构的估计产生偏差。可以使用图像处理软件编辑图像以将它们分开,但此附加步骤涉及至少 1.5 小时的重新处理;因此,强烈建议手动分离。 - 要扫描样品,请合上扫描仪盖,转到图像处理软件,选择工作项目,然后单击带有 Zooscan 的 SCAN 样品(用于存档,无处理)。
- 选择示例并按照说明进行操作。
- 转到扫描软件,然后单击 预览。确保预览扫描的图像,检查没有线条或斑点,并在开始另一次扫描之前等待至少 30 秒。
- 至少 30 秒后,单击扫描软件中的 "扫描 "按钮。
注:在扫描软件中按扫描后,在图像处理软件中按OK。请勿按计算机键盘上的任何键,并避免扫描过程中的振动。在Zooscan_scan > _raw文件夹中生成三个文件:(i) 标记的图像文件格式 (.tif) (16 位);(ii) 名为LOG (.txt)的标准文本文件,记录有关扫描参数的信息;以及 (iii) 名为 META (.txt) 的标准文本文件,其中包含有关抽样方法的信息。 - 验证原始扫描是否正确。
注:如果扫描有浅色条纹或其他可见问题,请考虑重复扫描以避免以下步骤中出现问题。
- 填写示例元数据。转到图像处理软件,然后选择 填写示例元数据。输入示例标识,单击" 确定",然后填写元数据。
- 样品回收
- 取下框架并使用装有70%乙醇的挤压瓶将其冲洗在扫描托盘上方,以回收任何附着的大型无脊椎动物。
- 抬起扫描仪的上部,通过扫描检索漏斗从托盘中取出所有生物体和乙醇,放入烧杯中。在扫描仪的上部仍然抬起的情况下,用挤压瓶冲洗托盘以扫除任何剩余的生物。
- 将标本和乙醇从烧杯中穿过500μm网状物,将无脊椎动物保留在网状物中,并将它们储存在装有70%乙醇的小瓶中。
- 在小瓶中回收所有标本后,用自来水清洁托盘。
注意:在样品之间用自来水清洗托盘,以尽量减少乙醇沉淀,这会改变图像处理。用自来水冲洗框架,以避免与乙醇使用相关的潜在损坏。在一天结束时,用自来水清洁托盘并用纸轻轻擦干以避免划伤。
- 图像处理
- 转到图像处理软件,选择"批处理模式下转换和处理图像和 生物",然后选择"转换和处理图像和粒子"(RAW文件夹中的图像)。保留默认设置,然后单击 确定。 正常结束 将出现在进程结束时。
注意:将在 Zooscan_scan > _work文件夹中创建一个PID文件和与扫描图像中所有检测到的对象相对应的小插图(在联合摄影组文件[.jpg]中)。PID文件是存储所有元数据(图元文件),与日志文件关联的技术数据以及包含图像中检测到的所有对象的36个测量变量的表格的单个文件。测量变量对应于灰度、分形维数、形状和大小的不同估计值。可用于尺寸估计的变量是面积以及与物体面积相等的椭圆的长轴和短轴(参见协议的第 3 节)。处理时间取决于图像密度和计算机特性,并且可以在样品之间启动,同时恢复和制备下一个样品。否则,建议在夜间以批处理模式开始每天扫描的样品的处理,并在第二天早上检查图像处理是否正确。 - 使用图像处理软件或通过检查位于 Zooscan_scan > _work中的遮罩图像(以msk1.gif终止)来检查处理后图像中的背景是否从样本图像中适当地减去。如果背景包含饱和区域或许多点,请考虑重复扫描以确保高质量的图像。
注:为避免背景中出现饱和区域,每次用乙醇扫描后,应用自来水冲洗扫描托盘。同样重要的是(1)减少扫描个体的数量(通过分馏样品并以不同的折叠扫描);(2)确保将大型生物放置在扫描托盘的中心;(3)使用清洁、过滤的乙醇;(4)减少样品上的脏污;(5)确保用于扫描的乙醇量充足;(6)确保样品预览和扫描之间的延迟至少为30秒。
- 转到图像处理软件,选择"批处理模式下转换和处理图像和 生物",然后选择"转换和处理图像和粒子"(RAW文件夹中的图像)。保留默认设置,然后单击 确定。 正常结束 将出现在进程结束时。
- 接触生物的分离
注意:当有几个带有接触生物的小插图时,有必要将接触生物的图像与其他生物和/或纤维/碎片分开,以确保正确估计群落大小结构。- 转到图像处理软件以检测具有多个对象的晕影。选择 使用晕影分离 ,然后按 确定。在配置选择窗口中,保留默认设置并单击 确定。
- 在 "与 晕影分离"窗口中,保留默认设置,另外选择 "在晕影上添加轮廓",然后选择要编辑的样本。
- 通过用鼠标画一条线来分隔弹出的每个小插图中的触摸生物(按滚动按钮绘制)。晕影中的分离完成后,单击窗口右上角的 X 按钮,然后按" 是" 处理下一个。按 NO 结束并保存更改。在该过程结束时,如果一切正确,将出现 正常结束 。
- 分离后,对图像进行重新处理,获取更新后的对象数据。转到图像处理软件,单击"处理( 转换)图像(处理一)",然后选择" 从WORK子文件夹中处理的图像中再次处理粒子"。选择样本,然后在" 单个图像处理 "窗口中,保留默认设置,选中" 使用分离蒙版(创建-修改-包含)",然后单击" 确定"。在该过程结束时,如果一切正确,将出现 正常结束 。
- 在 "分离控制 "窗口中,按 "确定" 以在处理之前保存带有轮廓的图像;如果存在以前的映像,则将替换该映像。
- 在"分离控制掩码"窗口中,如果需要,请选择"编辑"以使用鼠标将分离线添加到掩码,以分离之前在使用小插图分离步骤中未出现的接触生物。完成后,结束该过程,然后在"分离掩码控制"窗口中,选择"是"以接受掩码。在该过程结束时,如果一切正确,将出现正常结束。
注意:使用分离掩模重新处理样品非常耗时(每个样品可能需要1.5小时以上)。最好在步骤 1.2.5 中指定所需的时间以避免此额外步骤。
2. 自动识别物体
注意:创建一个学习集以自动预测检测到的对象的身份,从而将生物体与样本中的碎片分开。
- 学习集创建
- 复制图像和与图像关联的 .pid 文件,这些文件将用于创建从 Zooscan_scan > _work 到 PID_process > Unsorted_vignettes_pid的学习集类别。
注意:选择具有高分类群多样性和不同采样地点和/或采样季节的样品子集,以确保样品中生物的最大代表性。 - 在 "PID_process >学习集"文件夹中,创建一个具有新学习集名称(即 yyyymmdd_raw_LS)的子文件夹,并在其中创建与学习集的每个类别(即大型无脊椎动物、碎片、其他无脊椎动物)对应的子文件夹。
注意:为了有效地获得河流大型无脊椎动物样本的群落大小结构,建议仅使用基于三个类别的学习集:大型无脊椎动物、其他无脊椎动物和碎片。该学习集基本上将对应于生物体的物体的小插图与对应于碎片(例如纤维、颗粒或丝状藻类)的小插图分开。 - 转到图像处理软件(仅限高级模式)并选择 提取小插图作为 PLANKTON 标识符(用于训练的未分类小插图)。保留默认选项并选中 添加轮廓 框。
- 转到自动识别软件,单击"学习",PID_process > Learning_set为新学习集创建的子文件夹(步骤 2.1.2)中进行选择,然后按 OK。
- 在打开的窗口的左侧部分(未排序的拇指)中,选择 文件夹未排序vignettes_pid。选择晕影并用鼠标将它们从未排序的拇指拖动到右侧部分"排序的拇指"中相应类别的文件夹,以将每个对象分类到定义的类别中。移动的小插图将标有红色 X。
注意:通过在排序的拇指文件夹中创建子文件夹来手动定义类别,或通过单击软件中的文件夹图标来创建类别。不要同时移动超过 50 个小插图。 - 使用所选对象完成所有类别(每个类别约 300 个对象)后,单击" 创建学习文件 "并使用所需的名称保存它。
注意:学习集将作为 .pid 文件保存在项目的 "PID_process >学习集 "文件夹中。建议创建和测试多个具有不同类别级别(从粗形式到精细形式)的学习集,并且每个类别中对象数量具有不同的平衡。从类别数量较少且每个类别至少 50 个对象的粗略学习集开始,然后增加每个类别中的对象数量和/或创建更精细的学习集。类别应代表其在样本集中的可变性。
- 复制图像和与图像关联的 .pid 文件,这些文件将用于创建从 Zooscan_scan > _work 到 PID_process > Unsorted_vignettes_pid的学习集类别。
- 对学习集的评估
注意:使用随机森林方法和自动识别软件执行两折和五次试验的交叉验证,以获得对象分类结果的混淆矩阵。- 转到自动分类软件,然后单击 数据分析。
- 在 "选择学习文件"中,从"学习集"中选择创建的 学习集文件PID_process >。
- 在"选择方法"中,选择"交叉验证随机林"方法。在"原始变量"中,取消选中位置变量(X、Y、XM、YM、BX、BY 和"高度")。在自定义变量中,仅勾选 ESD。
注意:此方法使用学习集的一个随机部分来识别另一部分(两折),并重复五次以确保其在统计上是稳健的。 - 单击" 开始分析",然后将结果保存为 Analysis_name.txt " PID_process >预测"文件夹中。成功完成分析后,退出数据分析。
- 转到" PID_process >预测"文件夹,然后单击交叉验证文件。将弹出一个窗口,其中包含真实分类(行)与自动分类(列)的混淆矩阵。
注意:召回率是属于自动被充分识别的组的生物的百分比,而 1 精度是被算法分类为未识别组(组中的污染)的生物的百分比。召回率应高于70%,污染(1精度)应低于20%。 - 如果创建了多个学习集,并且需要获得每个学习集的召回率和 1 精度,请重复步骤 2.1-2.5。
注意:如果创建了多个学习集,请选择感兴趣的组(即大型无脊椎动物)的召回率最高(良好识别)和精度(低污染)的学习集,以测试下一步中一组样本的自动预测。
- 大型无脊椎动物鉴定预测
注意:使用选定的学习集,使用具有随机森林算法的自动识别软件来预测样本子集中所有对象的身份。- 转到自动识别软件,然后单击 数据分析。
- 在 "选择学习文件"中,从"学习集"中选择必须用于预测 PID_process >学习集 文件。
- 在 "选择示例文件"中,从 PID_results 文件夹中选择要预测的示例(PID 文件)。
注意:最多同时处理 20 个 .pid 文件,以避免与内存问题相关的错误。如果同时处理太多.pid文件,则该过程将显示正确的结束,但可能无法很好地处理,并且在使用图像处理软件处理时,后续步骤可能会出现错误。 - 在"选择方法"中,选择"随机森林"方法。勾选保存每个样品的详细结果。在"原始变量"中,取消选中位置变量(X、Y、XM、YM、BX、BY 和"高度")。在自定义变量中,仅勾选 ESD。
- 单击" 开始分析",然后将结果另存为 Analysis_name.txt " PID_process >预测"文件夹中。
- 手动验证
注意:专家手动验证上一步中的预测,以将错误分类的对象重新分类为正确的类别。- 将要验证 的Analysis_sample_dat1.txt 文件从 "PID_process >预测 "文件夹复制到 "PID_process > Pid_results"文件夹。
- 转到图像处理软件,然后选择根据 预测或验证提取文件夹中的小插图。然后,选择使用 "pid_results"文件夹中的预测文件。保留默认设置,然后按 确定。
- 该软件创建一个名为 sample_yyyymmdd_hhmm_to_validate 的文件夹,其中包含 PID_process >已排序小插图文件夹中的预测对象。
- 转到"PID_process >已排序的小插图"文件夹,然后将文件夹复制到sample_yyyymmdd_ hhmm_to_validate。将文件夹名称替换为_validated_to验证。
- 要手动验证自动分类,请打开文件夹 sample_yyyymmdd_ hhmm_validated,并查看每个子文件夹(类别)中的所有穿插画,以确定是否存在错误分类的对象。当一个对象分类错误时,使用鼠标将晕影拖动到正确的文件夹(类别)。
- 转到图像处理软件,然后 从排序的小插图中选择加载标识。保留默认设置,然后选择要处理 yyyymmdd_hhmm_name_validated。
- 转到 PID_process > Pid_results > Dat1_validated,其中已创建一个名为 Id_from_sorted_vignettes_yyyymmdd_hhmm.txt 的文件,并为每个已验证的示例 (sample_tot_1_dat1.txt) 创建一个.txt文件。
注意:这些.txt文件包含一个显示预测的新列,称为pred_valid_Id_yyyymmdd_hhmm,它指定每个对象的专家分类(即,经过验证的分类)。此时,在审定期间,可以创建新的类别(例如,更精细的分类类别)。但是,请将原始类别的名称保留在新名称中(例如,macroinvertebrate_chironomidae)。这允许在计算召回率和精度时追溯原始类别,并轻松对所有大型无脊椎动物进行分组以计算群落大小结构参数(即大小谱和大小多样性)。该文本文件提供与每个对象相关的数据,包括用于获取每个生物体的椭圆体体积作为个体体型度量的短轴和长轴。此外,表的最后两列包含每个对象(行)的预测和验证类别,允许按类别计算样本子集上学习集的召回率和精度。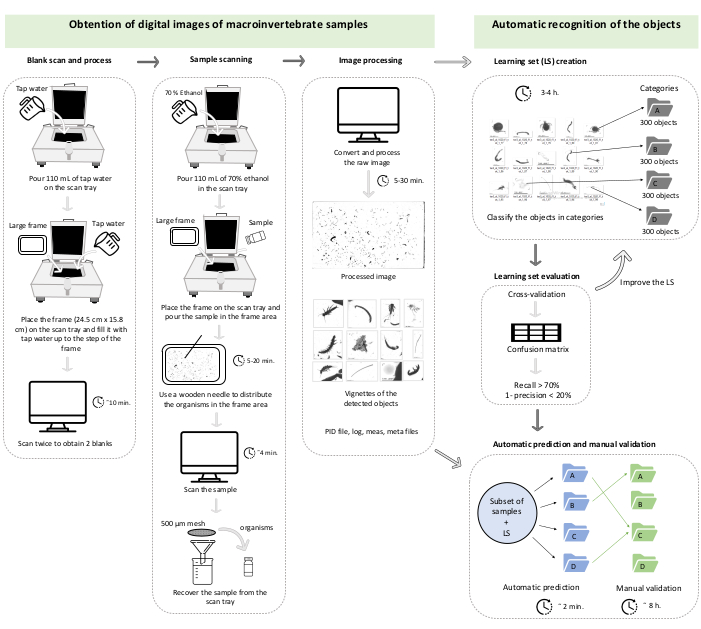
图 1:代表协议第 1 节和第 2 节的工作图。时间是说明性的,可能会根据计算机、要处理的小插图的丰富程度以及学习集的类别数量而变化。这种情况对应于在一组 42 个子样本(总共 47,473 个小插图)上验证三个类别的学习集。请点击此处查看此图的大图。
3. 计算个体尺寸分布、尺寸谱和尺寸指标
注意:本节中提到的计算是使用 Matlab 执行的(请参阅作为补充文件 1 的脚本)。
- 个体尺寸分布
- Id_from_sorted_vignettes_YYYYMMDD_HHHH.txt文件的最后一列包含对象的已验证分类。仅选择分类为大型无脊椎动物的物体,以描述它们在样品中的个体大小分布。
注意:个体体型对应于大型无脊椎动物的椭球体体积。系统以像素为单位提供测量值。 - 将矢量与两次扫描的大小测量值连接起来,因为每个分数都有不同的子采样指数。在串联之前,通过复制大小向量与相应的子样本分馏的次数一样多来校正分馏。
注意:如果扫描对应于样品的一小部分(即粗或细),则需要执行此步骤。 - 从与生物体具有相同像素面积的椭圆体的大 (M) 轴和小轴 (m) 计算椭球体体积。在计算椭球体积之前,使用以下转换因子 (cf) 将长轴 (M) 和短轴 (m) 从像素转换为毫米 (mm):
1 像素 = 2,400 dpi
1 英寸 = 25.4 毫米
cf = 25.4/2400
椭圆体体积(椭圆体积,单位为mm 3)对应于: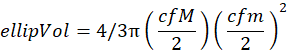
- 描述对数2 刻度上单个大小分布的概率密度函数。
- Id_from_sorted_vignettes_YYYYMMDD_HHHH.txt文件的最后一列包含对象的已验证分类。仅选择分类为大型无脊椎动物的物体,以描述它们在样品中的个体大小分布。
- 尺寸多样性
- 按照Quintana等人(2008)8计算尺寸多样性(Sd),如García-Comas et al. (2016)35:
其中 p x(x) 是大小为 x 的概率密度函数,x 表示对数2(椭圆卷)。因此,该度量是香农多样性指数,适用于连续度量,例如社区中的个体规模分布。
- 按照Quintana等人(2008)8计算尺寸多样性(Sd),如García-Comas et al. (2016)35:
- 标准化生物体积尺寸谱 (NBSS)
- 定义NBSS的大小等级,将光谱的下限确定为样品中大型无脊椎动物大小分布的0.01分位数,并通过以2为基数的几何尺度创建大小等级,直到包含样品中最大的生物。
注意: 尺寸类宽度随尺寸增加,以考虑与较大尺寸相关的更大可变性。这里分析的大型无脊椎动物群落的NBSS有14个大小等级(表1)。 - 通过将每个尺寸类别的总生物体积除以尺寸类宽度来获得标准化生物体积。
- 定义NBSS的大小等级,将光谱的下限确定为样品中大型无脊椎动物大小分布的0.01分位数,并通过以2为基数的几何尺度创建大小等级,直到包含样品中最大的生物。
- 尺寸谱斜率
- 计算NBSS的线性斜率。
注意:斜率 (μ) 是根据大于模式的大小等级中的对数 2(尺寸等级中点)和对数2(归一化生物量)之间的关系计算的,忽略任何空的(在本研究中,尺寸等级从 3 到 14)。
- 计算NBSS的线性斜率。
| 尺寸等级限制(mm3) | 尺寸等级中点(mm3) |
| 0,1236 | 0,1855 |
| 0,2473 | 0,3709 |
| 0,4946 | 0,7418 |
| 0,9891 | 1,4837 |
| 1,9783 | 1,4837 |
| 3,9560 | 5,9348 |
| 7,9131 | 11,8696 |
| 15,8261 | 23,7392 |
| 31,6522 | 47,4783 |
| 63,3044 | 94,9567 |
| 126,6089 | 189,9133 |
| 253,2178 | 379,8267 |
| 506,4300 | 7597,7000 |
| 1012,9000 | 15193,0000 |
| 2025,7000 |
表1:标准化生物量尺寸谱(NBSS)的大小等级。 该表还显示了生物体的 15 个大小等级限制和大小等级中点。
结果
大型无脊椎动物样品的数字图像采集
扫描细微差别:扫描托盘中的乙醇沉积
在测试系统的大型无脊椎动物时,有几次扫描质量很差。背景中的黑暗饱和区域阻碍了图像的正常处理和大型无脊椎动物个体大小的测量(图2)。背景中出现饱和区域或高度像素化的图像有几个原因:(1)扫描托盘上存在太多生物;(2)样品中存在脏污;(3)样品预览与?...
讨论
Gorsky等人2010年描述的河流大型无脊椎动物方法的调整允许在估计淡水大型无脊椎动物的群落规模结构时具有很高的分类准确性。结果表明,该方案可以将估计样品中个体大小结构的时间减少到约1小时。因此,拟议的协议旨在促进常规使用大型无脊椎动物大小光谱作为快速和综合生物指标,以评估淡水生态系统中扰动的影响。大型无脊椎动物的体型谱已经被用作评估沿海泻湖生态状况的成功指标
披露声明
作者声明没有潜在的竞争利益。
致谢
这项工作得到了西班牙科学、创新和大学部的支持(批准号RTI2018-095363-B-I00)。我们感谢CERM-UVic-UCC成员Èlia Bretxa,Anna Costarrosa,Laia Jiménez,María Isabel González,Marta Jutglar,Francesc Llach和Núria Sellarès在大型无脊椎动物现场采样和实验室分类方面的工作,以及David Albesa在样品扫描方面的合作。最后,我们感谢Josep Maria Gili和海洋科学研究所(ICM-CSIC)使用实验室设施和扫描仪设备。
材料
| Name | Company | Catalog Number | Comments |
| Beaker | Labbox | Other containers could be used | |
| Dionized water | Icopresa | 8420239600123 | To dilute the ethanol |
| Funnel | Vitlab | 41094 | |
| Glass vials 8 ml | Labbox | SVSN-C10-195 | 1 vial/subsample |
| ImageJ Software | Free access | Version 4.41o/ Image processing software | |
| Large frame | Hydroptic | Provided by ZooScan | 24.5 cm x 15.8 cm |
| Monalcol 96 (Ethanol 96) | Montplet | 1050JE001 | |
| Plankton Identifier Software | Free access | Version 1.2.6/ Automatic identification software | |
| Sieve | Cisa | 26852.2 | Nominal aperture 500µ and nominal aperture 0,5 cm |
| Tweezers | Bondline | B5SA | Stainless, anti-magnetic, anti-acid |
| VueScan 9 x 64 (9.5.09) Software | Hydroptic | Version 9.0.51/ Sacn software | |
| Wooden needle | Any plastic or wood needle can be used | ||
| Zooprocess Software | Free access | Version 7.14/Image processing software | |
| ZooScan | Hydroptic | 54 | Version III/ Scanner |
参考文献
- Birk, S., et al. Three hundred ways to assess Europe's surface waters: An almost complete overview of biological methods to implement the Water Framework Directive. Ecological Indicators. 18, 31-41 (2012).
- Basset, A., Sangiorgio, F., Pinna, M. Monitoring with benthic macroinvertebrates: advantages and disadvantages of body size descriptors. Aquatic Conservation: Marine and Freshwater Ecosystems. 14, S43-S58 (2004).
- Reyjol, Y., et al. Assessing the ecological status in the context of the European Water Framework Directive: Where do we go now. Science of the Total Environment. 497-498, 332-344 (2014).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology & Evolution. 20 (7), 402-409 (2005).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: Some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology & Evolution. 22 (6), 323-330 (2007).
- Quintana, X. D., et al. A nonparametric method for the measurement of size diversity with emphasis on data standardization. Limnology and Oceanography - Methods. 6 (1), 75-86 (2008).
- Blanchard, J. L., Heneghan, R. F., Everett, J. D., Trebilco, R., Richardson, A. J. From bacteria to whales: Using functional size spectra to model marine ecosystems. Trends in Ecology & Evolution. 32 (3), 174-186 (2017).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: Universal indicators of ecological status. Biology Letters. 6 (4), 434-437 (2010).
- Emmrich, M., et al. Geographical patterns in the body-size structure of European lake fish assemblages along abiotic and biotic gradients. Journal of Biogeography. 41 (12), 2221-2233 (2014).
- Arranz, I., Brucet, S., Bartrons, M., García-Comas, C., Benejam, L. Fish size spectra are affected by nutrient concentration and relative abundance of non-native species across streams on the NE Iberian Peninsula. Science of the Total Environment. 795, 148792 (2021).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L. l., Brucet, S. Normalized abundance spectra of the fish community reflect hydropeaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Benejam, L. l., Tobes, I., Brucet, S., Miranda, R. Size spectra and other size-related variables of river fish communities: systematic changes along the altitudinal gradient on pristine Andean streams. Ecological Indicators. 90, 366-378 (2018).
- Sutton, I. A., Jones, N. E. Measures of fish community size structure as indicators for stream monitoring programs. Canadian Journal of Fisheries and Aquatic Sciences. 77 (5), 824-835 (2019).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59, 155-167 (2014).
- Townsend, C. R., Thompson, R. M., Hildrew, A. G., Raffaelli, D. G., Edmonds-Brown, R. Body size in streams: Macroinvertebrate community size composition along natural and human-induced environmental gradients. In Body Size: The Structure and Function of Aquatic Ecosystems. , (2007).
- Gjoni, V., et al. Patterns of functional diversity of macroinvertebrates across three aquatic ecosystem types, NE Mediterranean. Mediterranean Marine Science. 20 (4), 703-717 (2019).
- Pomeranz, J. P. F., Warburton, H. J., Harding, J. S. Anthropogenic mining alters macroinvertebrate size spectra in streams. Freshwater Biology. 64 (1), 81-92 (2019).
- García-Girón, J., et al. Anthropogenic land-use impacts on the size structure of macroinvertebrate assemblages are jointly modulated by local conditions and spatial processes. Environmental Research. 204, 112055 (2022).
- Demi, L. M., Benstead, J. P., Rosemond, A. D., Maerz, J. C. Experimental N and P additions alter stream macroinvertebrate community composition via taxon-level responses to shifts in detrital resource stoichiometry. Functional Ecology. 33 (5), 855-867 (2019).
- Basset, A., et al. A benthic macroinvertebrate size spectra index for implementing the Water Framework Directive in coastal lagoons in Mediterranean and Black Sea ecoregions. Ecological Indicators. 12 (1), 72-83 (2012).
- Ärje, J., et al. Automatic image-based identification and biomass estimation of invertebrates. Methods in Ecology and Evolution. 11 (8), 922-931 (2020).
- Raitoharju, J., et al. Benchmark database for fine-grained image classification of benthic macroinvertebrates. Image and Vision Computing. 78, 73-83 (2018).
- Lytle, D. A., et al. Automated processing and identification of benthic invertebrate samples. Journal of the North American Benthological Society. 29 (3), 867-874 (2010).
- Serna, J. P., Fernández, D. S., Vélez, F. J., Aguirre, N. J. An image processing method for recognition of four aquatic macroinvertebrates genera in freshwater environments in the Andean region of Colombia. Environmental Monitoring and Assessment. 192, 617 (2020).
- Gorsky, G., et al. Digital zooplankton image analysis using the ZooScan integrated system. Journal of Plankton Research. 32 (3), 285-303 (2010).
- Marcolin, C. R., Schultes, S., Jackson, G. A., Lopes, R. M. Plankton and seston size spectra estimated by the LOPC and ZooScan in the Abrolhos Bank ecosystem (SE Atlantic). Continental Shelf Research. 70, 74-87 (2013).
- Silva, N., Marcolin, C. R., Schwamborn, R. Using image analysis to assess the contributions of plankton and particles to tropical coastal ecosystems. Estuarine, Coast and Shelf Science. 219, 252-261 (2019).
- Vandromme, P., et al. Assessing biases in computing size spectra of automatically classified zooplankton from imaging systems: A case study with the ZooScan integrated system. Methods in Oceanography. 1-2, 3-21 (2012).
- Naito, A., et al. Surface zooplankton size and taxonomic composition in Bowdoin Fjord, north-western Greenland: A comparison of ZooScan, OPC and microscopic analyses. Polar Science. 19, 120-129 (2019).
- . Zooprocess/Plankton Identifier protocol for computer assisted zooplankton sorting Available from: https://manualzz.com/doc/43116355/zooprocess—plankton-identifier-protocol-for (2013)
- Protocolo de muestreo y laboratorio de fauna bentónica de invertebrados en ríos vadeables. CÓDIGO: ML-Rv-I-2013. Ministerio de Agricultura, Alimentación y Medio Ambiente Available from: https://www.miteco.gob.es/es/agua/temas/estado-y-calidad-de-las-aguas/ML-Rv-I-2013_Muestreo%20y%20laboratorio_Fauna%20bent%C3%B3nica%20de%20de%20invertebrado_%20R%C3%Ados%20vadeables_24_05_2013_tcm30-175284.pdf (2013)
- García-Comas, C., et al. Prey size diversity hinders biomass trophic transfer and predator size diversity promotes it in planktonic communities. Proceedings of the Royal Society Biological Sciences. 283 (1824), 20152129 (2016).
- García-Comas, C., et al. Mesozooplankton size structure in response to environmental conditions in the East China Sea: How much does size spectra theory fit empirical data of a dynamic coastal area. Progress in Oceanography. 121, 141-157 (2014).
- Marquina, D., Buczek, M., Ronquist, F., Lukasik, P. The effect of ethanol concentration on the morphological and molecular preservation of insects for biodiversity studies. PeerJ. 9, 10799 (2021).
- Bell, J. L., Hopcroft, R. R. Assessment of ZooImage as a tool for the classification of zooplankton. Journal of Plankton Research. 30 (12), 1351-1367 (2008).
- Colas, F., et al. The ZooCAM, a new in-flow imaging system for fast onboard counting, sizing and classification of fish eggs and metazooplankton. Progress in Oceanography. 166, 54-65 (2018).
- Bachiller, E., Fernandes, J. A., Irigoien, X. Improving semiautomated zooplankton classification using an internal control and different imaging devices. Limnology and Oceanography Methods. 10 (1), 1-9 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。