需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微生物和化学刺激诱导的中性粒细胞胞外陷阱的形态学和组成分析
摘要
这里介绍的是用于体外中性粒细胞细胞 外 陷阱(NET)的诱导和分析方案。对DNA,cathelicidin(LL37)和酶活性的定量产生了数据,这些数据显示了在类似受控条件下由微生物和化学刺激诱导的NET的组成和形态的变化。
摘要
中性粒细胞通过采用多种机制(例如中性粒细胞细胞外陷阱(NET)的形成)作为先天免疫反应的第一道细胞防御线。本研究使用标准化的 体外 方法分析了微生物和化学刺激诱导的NETs的形态和组成变化,用于人体细胞的NET诱导和表征。这里描述的程序允许分析NET形态(裂解或非裂解)和组成(DNA-蛋白质结构和酶活性),以及可溶性因子或细胞接触对这些特征的影响。此外,可以修改此处描述的技术以评估外源性可溶性因子或细胞接触对NET组成的影响。
应用的技术包括使用双密度梯度(1.079-1.098 g/mL)从人外周血纯化多形核细胞,保证最佳纯度和活力(≥95%),如Wright染色,台盼蓝排除和流式细胞术(包括FSC与SSC分析和7AAD染色)所示。通过微生物(铜绿假单胞菌、金黄色葡萄球菌和 白色念珠菌)和化学(醋酸佛波肉豆蔻酸酯,HOCl)刺激诱导NET形成,NET的特征是DNA-DAPI染色,抗菌肽cathelicidin(LL37)的免疫染色以及酶活性(中性粒细胞弹性蛋白酶,组织蛋白酶G和髓过氧化物酶)的定量。通过荧光显微镜获取图像并使用ImageJ进行分析。
引言
中性粒细胞是血液中最丰富的白细胞,在通过多种机制清除致病剂的过程中起着至关重要的作用,包括释放由DNA和几种核,细胞质和颗粒抗菌蛋白组成的大染色质结构1,2。描述中性粒细胞这种抗菌作用的直接前因是由Takei等人于1996年提出的。这些作者报告了一种不同于中性粒细胞凋亡和坏死性凋亡的新死亡形式,表现出表现出核破裂的形态变化,然后从核质溢出到细胞质中,并且膜通透性从与佛波肉豆蔻酸酯(PMA)孵育3小时后增加2,3。然而,直到2004年才使用术语"中性粒细胞细胞外陷阱(NET)"4。
在细菌、真菌5、病毒6 和寄生虫感染等各种条件下观察到 NET 形成,用于中和、杀死和防止微生物传播7。其他研究表明,它也可以通过无菌刺激在非致病条件下发生,例如细胞因子、尿酸单钠或胆固醇晶体、自身抗体、免疫复合物和活化的血小板7.脂多糖(LPS),白细胞介素-8(IL-8)和PMA是最早被描述为NET诱导剂的 体外 刺激,并且在两种急性炎症模型中 证明了体内 NET参与致病过程:实验性痢疾和自发性人阑尾炎4。DNA是必不可少的NET成分。其适当的结构和组成对于通过向捕获的微生物提供高局部浓度的抗菌分子来隔离和杀死微生物是必要的,正如分解NET及其杀微生物特性的简短脱氧核糖核酸酶(DNase)处理所证明的那样4。除 DNA 外,NET 还包括附着蛋白,例如组蛋白、中性粒细胞弹性蛋白酶 (NE)、组织蛋白酶 G (CG)、蛋白酶 3、乳铁蛋白、明胶酶、髓过氧化物酶 (MPO) 和抗菌肽 (AMP),例如阳离子促炎肽 cathelicidin LL-37 等8,9。这种聚集体可以形成直径达50nm的较大螺纹。这些因素可以破坏微生物毒力因子或病原体细胞膜的完整性;此外,AMPs可以稳定NET衍生的DNA,防止细菌核酸酶降解10。
调控NET形成的具体机制尚未完全明确。导致NET释放的最佳特征途径是通过ERK信号传导,这导致NADPH氧化酶活化和活性氧(ROS)产生,以及触发MPO途径激活的细胞内钙增加。这反过来将过氧化氢转化为次氯酸,通过氧化激活NE 11,12。NE负责降解细胞骨架的肌动蛋白丝以阻断吞噬作用,并将它们转移到细胞核中,通过蛋白水解切割和PAD4脱氨进行处理,PAD4驱动染色质纤维脱敏,染色质纤维与颗粒和细胞质蛋白结合,然后细胞外释放7。这些蛋白酶包括从藜红细胞颗粒的azurosome复合物释放的蛋白酶和其他蛋白酶(例如组织蛋白酶G13)。
根据中性粒细胞的形态变化,NET分为两种类型:导致细胞死亡的自杀性或溶解性NET形成4,以及由核或线粒体DNA囊泡释放介导的活细胞产生的重要或非溶解NET形成,具有吞噬能力的无核细胞质体的残余14,15。通常,由线粒体DNA组成的NETs呈现细长的纤维14 形态,而由核DNA结构的NET具有云状外观3。然而,目前尚不清楚中性粒细胞如何选择其DNA起源。与先前将NET的规范途径描述为需要几个小时的研究相反,重要途径在5-60分钟内迅速激活15。
尽管取得了这些进展,但NET的组成因刺激措施而异;例如,铜绿假单胞菌的不同粘液和非粘液菌株诱导含有33种常见蛋白质和多达50种可变蛋白质的NETs的形成7。因此,有必要使允许在研究小组中产生客观结论的技术同质化。本文描述了一种具有各种技术的协议,可以比较和评估由不同微生物诱导的NET的组成,结构和形态:金黄色葡萄球菌(革兰氏阳性细菌),铜绿假单胞菌(革兰氏阴性细菌)和白色念珠菌(真菌),以及来自健康个体的人中性粒细胞中的化学刺激(PMA,HOCl)。代表性结果表明,NETs的异质性取决于其在可比体外条件下的诱导刺激,其特征在于DNA-DAPI染色,LL37免疫染色和酶活性定量(NE,CG和MPO)。
研究方案
血液样本是在知情同意后从临床健康受试者那里作为捐赠获得的。所有实验均在瓦哈卡自治大学"贝尼托·华雷斯"生物化学科学学院人类研究伦理委员会的许可下进行。
注意:研究中的纳入标准是性别和年龄模糊不清,根据参与者在采集血液样本前对问卷的回答,临床健康。进行血液学分析以确定细胞计数并排除感染或贫血,以及C反应蛋白测试以排除供体中的炎症。
1.外周血采集,获取红细胞和白细胞包
- 在装有1.8 mg/mLK2·的试管中静脉穿刺收集10 mL外周血EDTA作为抗凝剂(见 材料表)来自临床健康个体在获得知情同意后。然后,进行标准的血液生物测定和C反应蛋白测试以排除感染或炎症,确保样品的质量。
- 将外周血样品以82 x g 离心15分钟以除去富含血小板的血浆,然后以630 x g 第二次离心5分钟。丢弃剩余的血浆以获得红细胞和白细胞包。
- 用 1x Dulbecco 的磷酸盐缓冲盐水 (DPBS) 以 1:1 的比例 (v/v) 稀释。
2. 使用双密度梯度的多形核中性粒细胞(PMN)纯化
注意:收集血液后立即进行中性粒细胞纯化,因为它们的 体外 寿命有限,约为8小时。
- 按顺序将以下内容放入无菌 10 mL 玻璃管(见材料表)中:1 mL 1.098 g/mL 密度溶液、1 mL 1.079 g/mL 密度溶液(参见材料表),然后 4 mL 稀释的红细胞和白细胞包装。倒在壁上,不要破坏层之间的表面张力,以防止它们混合。
- 在4°C下以320× g 离心20分钟,避免加速/减速,以使离心机的高力不会干扰梯度。
- 通过移液吸出对应于粒细胞的相(图1A),并转移到另一个无菌的10 mL玻璃管中。用4mL的1x DPBS在300× g 下在4°C下洗涤10分钟。
- 弃去上清液并用渗透休克处理细胞以去除剩余的红细胞。在4°C下加入4mL的0.2%盐溶液2分钟,并在4°C下以300× g 离心10分钟。 弃去上清液。然后在4°C下加入4mL等渗溶液(0.65%盐水)5分钟以恢复膜完整性,并在4°C下以300× g 离心10分钟。
注意:0.2%盐水溶液是一种低渗培养基,相对于RBC细胞内培养基的溶质浓度较低。与低渗剂接触会使水扩散到红细胞中,导致红细胞肿胀和溶血。显微镜观察证实了从上清液中去除红细胞。 - 除去上清液。将细胞重悬于4mL的1x DPBS中以除去细胞碎片,然后在4°C下以300× g 离心10分钟。 最后,将细胞沉淀重悬于2 mL冷汉克平衡盐溶液(HBSS)缓冲液中。
3. 中性粒细胞形态和活力(图1B)
- 台盼蓝排除试验
- 将 5 μL 细胞悬液稀释在 20 μL 0.4% 台盼蓝(1:5 比例)中。计数Neubauer室中的细胞并使用排除测试确定细胞活力。将保持膜完整性而不透化染料的细胞视为存活细胞。
- 将 5 μL 细胞悬液安装在载玻片上;干燥并用赖特的污渍染色15秒。立即用磷酸盐缓冲液pH 6.4固定样品30秒。用足够的蒸馏水洗涤,并在光学显微镜(100x)下观察形态。
- 7AAD染色和流式细胞术分析
- 将 1 x 105 个细胞加入流式细胞术管中,并在 100 μL FACS 缓冲液(1x DPBS、0.1% 叠氮化钠和 10% 自体去补体血浆)中用 1 μL 7AAD 染色 4 °C 在黑暗中 15 分钟。
- 用 500 μL FACS 缓冲液以 300 x g 洗涤 10 分钟。用500μL2%多聚甲醛固定细胞,并储存在4°C直至在流式细胞仪中进行分析。
- 对于死细胞对照,用200μL4%多聚甲醛固定1 x 105 细胞30分钟,并在4°C下用500μL 1x PBS在300× g 下洗涤10分钟。 抽出上清液并丢弃。然后在4°C下加入200μL的0.1%Triton X-1001小时。 用 500 μL 1x PBS 洗涤,并按照步骤 3.2.1 用 7AAD 染色。
- 使用流式细胞仪(参见 材料表),进行FSC与SSC分析以分析细胞纯度,并进行SSC与7AAD染色以分析细胞活力。在多形核设置(FSC,400-490和SSC,300-320)中,以中等流量(1,000个细胞/秒)读取100 μL摄取体积中的3 x 104 个事件。
- 分析流式细胞仪软件中捕获的数据(参见 材料表),并通过点图和直方图确定多形核群体中7AAD的纯度和阳性细胞的百分比。
4. 微生物的CFSE染色
- 在 1.5 mL 微管中加入 1 x 108 细菌或 1 x 106 真菌假菌丝,并用溶解在 1x PBS 中的 200 μL 5 μM 羧基荧光素琥珀酰亚胺酯 (CFSE) 染色。混合几秒钟,并在37°C下在黑暗中孵育10分钟。
- 通过加入 500 μL 去补体血浆停止反应,并以 620 x g 离心假菌丝 10 分钟或以 1,800 x g 离心细菌 10 分钟。
- 弃去上清液,用1mL的1x PBS离心洗涤沉淀,如步骤4.2所示。最后,将微生物重悬于 250 μL 的 1x PBS 中。
- 在 1.5 mL 的微管中制备 50 μL 等分试样,其中包含 2 x 107 细菌 (MOI: 100) 或 2 x 105 假菌丝 (MOI:1) 以进行净诱导。
5. 净感应
- 将 10 mm x 10 mm 无菌玻璃盖玻片置于 24 孔板中,并在室温下用 10 μL 0.001% 聚-L-赖氨酸覆盖 1 小时。用 100 μL 1x PBS 洗涤两次,风干,并用紫外线照射 15 分钟。
- 用补充有10%自体血浆的RPMI 1640培养基替换步骤2.5中嗜中性粒细胞悬浮液的HBSS溶液。向 24 孔板(步骤 5.1)中加入 350 μL 该细胞悬液,最终浓度为 2 x 105 个中性粒细胞/孔。
- 通过在37°C下用5%CO2孵育20分钟,使细胞粘附在孔的底部。
- 添加刺激物以诱导 50 μL 中的 NET 形成:微生物刺激革兰氏阳性细菌金 黄色 葡萄球菌 (ATCC 25923)、革兰氏阴性细菌铜 绿假 单胞菌 (ATCC 10145) 在 MOI 100 和白色念 珠 菌假菌丝 (ATCC 10231) 在 MOI:1;生化刺激-PMA(200 nM)和HOCl(4.5 mM),以及无刺激(50μLHBSS)的控制。
- 获得每孔 400 μL 的最终体积。在平板摇床上以140rpm混合30秒,并在37°C和5%CO2下孵育4小时。
6. 通过荧光显微镜可视化NETs。
- 脱氧核糖核酸和 LL37 免疫染色
- NET诱导后,小心移液从孔中除去上清液,并用300μL4%多聚甲醛固定细胞30分钟。
- 用 200 μL 1x PBS 洗涤细胞而不离心,并加入 200 μL 封闭缓冲液(1x PBS 中的 10% 去补体血浆)30 分钟。
- 对于 LL-37 染色,用 200 μL 0.2% Triton X-100 在 1x PBS 中透化细胞 10 分钟,以使抗体进入细胞。用 1x PBS 仔细清洗 2 次,以去除多余的洗涤剂。
- 将盖玻片安装在载玻片上(每个载玻片上有四个盖玻片)。DNA用2μLDAPI染色细胞(参见 材料表),密封盖玻片,并储存在-20°C,直到通过共聚焦荧光显微镜进行分析。
- 荧光图像的采集和分析
- 拍摄NET图像以量化其成分,并使用共聚焦荧光显微镜中的相应滤光片(参见 材料表)使用计算机软件获取图像。
注意:考虑用DAPI(蓝色)染色DNA,在360nm处显示激发,在460nm处发射。微生物用CFSE(绿色)染色,其激发波长为492nm,发射波长为521nm。LL37肽用抗LL37 Alexa Fluor 594抗体(红色)标记,其激发波长为594 nm,发射波长为614 nm。 - 校准显微镜。在正常光线开启的情况下,使用微分干涉对比 (DIC) 放置载玻片和焦点。选择 "实时 "以将图像投影到监视器上。
- 关灯并选择荧光染料对应的通道。例如,为 DAPI 选择滤光片 365 nm/blue,为 Alexa 594 选择滤光片 43 HE DsRed,或为 CFSE 选择滤光片 38 HE GFP。
- 使用LL37的同种型对照抗体以及DAPI和CFSE的未染色细胞调整设置。设置相同的曝光时间、电压、对比度和镜头设置,以在相同条件下拍摄所有图像。
注意:在本研究中,曝光时间、电压和对比度分别设置为1.0 ms、4.0 V和0.0,物镜为40倍。可以调整这些值,以便为样品提供最佳图像捕获。 - 选择" 捕捉 "以捕获图像。每孔保存五张图像(四个极端和中心),以及DNA/LL37/CFSE的共定位(合并)。
- 使用每种颜色的独立图像将三类像素定义为背景,并使用图像J软件分析每个区域的平均灰度信号值。
- 拍摄NET图像以量化其成分,并使用共聚焦荧光显微镜中的相应滤光片(参见 材料表)使用计算机软件获取图像。
7. 酶活性定量
- 在 96 孔板中,在含有 1 x 10 5 个中性粒细胞的 HBSS 中加入 90 μL 细胞悬液以进行 NET 诱导,并在 37 °C 和5 % CO2 下孵育 20 分钟。
- 立即加入10μL相应的刺激物(浓度如步骤5.4),并在37°C下用5%CO2孵育4小时。
- 弃去上清液并用100μLHBSS洗涤细胞。用1U / mL的DNase在37°C下处理10分钟,以促进DNA-蛋白质结构的释放,并以1,800× g 离心10分钟。
- 回收上清液并使用比色反应评估上清液中的酶活性,如White等人先前描述的那样17。
- 在相同的实验条件下确定中性粒细胞中NE,CG和MPO的最大酶活性,而无需添加任何NET诱导刺激。然后,将细胞样品在-70°C冷冻,并在37°C的水浴中解冻,产生温度冲击,有利于细胞裂解释放细胞内蛋白质。以1,800× g 离心10分钟并回收上清液。
- 在96孔板的每个孔中加入50μL上清液,然后如步骤7.7所示加入50μL每种底物。
- 加入 0.5 M N-甲氧基琥珀酰基-Ala-Ala-Pro-Val-p-硝基苯胺作为 NE 的底物,加入 1 mM 的 N-琥珀酰基-Ala-Ala-Pro-Phe-p-p-硝基苯胺用于 CG。在室温下孵育3小时。对于MPO,加入1.6mM的3,3',5,5'-四甲基联苯胺(TMB),并在室温下孵育30分钟。
- 孵育后,加入 50 μL 用于 MPO 的终止溶液 (0.5 M H2SO4),并使用分光光度计测量 NE 和 CG 在 405 nm 处的吸光度以及 MPO 的 450 nm 处的吸光度。
- 将获得的值与相应的校准曲线进行比较,并显示每个条件相对于最大酶活性(100%)的结果。
8. 统计分析
- 分析每个独立实验(n = 10)的测量数据一式三份,并通过比较置信水平为95%的组进行方差分析以进行统计分析。
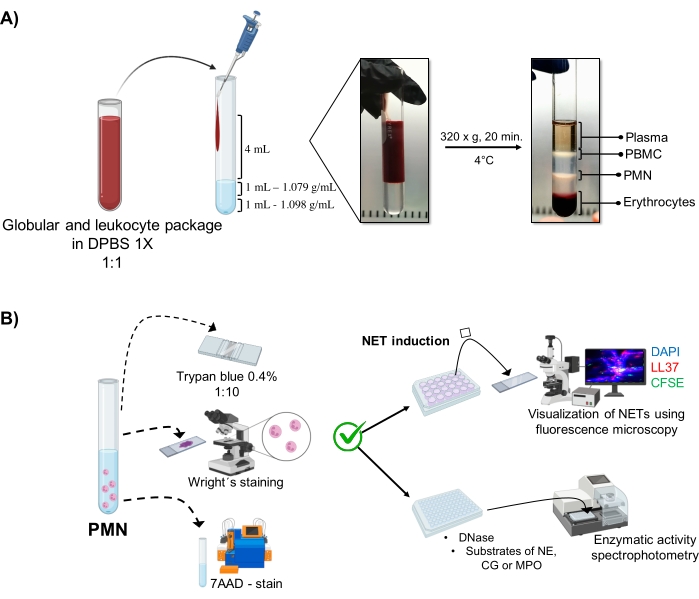
图 1:PMN 纯化和 NET 诱导方案。 (A)从外周血中取出血浆以获得红细胞和白细胞包,并用1x DPBS以1:1(v / v)稀释。然后,沿壁向双密度梯度管中加入4mL稀释液,并在4°C下以320×g离心20分钟,获得不同细胞层的分离并回收对应于PMN的细胞层。(B)对纯化的细胞进行计数,并通过Wright染色分析其形态。通过台盼蓝排除和使用流式细胞术的7AAD染色来确定活力。一旦验证了最佳的中性粒细胞纯度和活力,通过在 24 孔板中添加微生物(金黄色葡萄球菌、铜绿假单胞菌和白色念珠菌)或化学物质(PMA、HOCl)诱导 NET 形成,通过荧光显微镜使用 DAPI-DNA、抗 LL37 Alexa Fluor 594 和微生物 CFSE 染色进行分析。对于酶定量,在96孔板中诱导NETs3小时并用DNase处理,然后为每种酶添加底物:NE,CG和MPO;通过分光光度法量化颜色变化。DPBS = 杜尔贝克的磷酸盐缓冲盐水;PBMC = 外周血单核细胞;PMN = 多形核中性粒细胞;NE = 中性粒细胞弹性蛋白酶;CG = 组织蛋白酶 G;MPO = 髓过氧化物酶;PMA = 肉豆蔻酸佛波酸酯;HOCl = 次氯酸。请点击此处查看此图的大图。
结果
中性粒细胞的纯度和活力
动态细胞相在试管中通过双密度梯度纯化可视化。在这些层中,对应于粒细胞的层高于1.079 g/mL密度层,与外周血单核细胞(PBMC)和红细胞的阶段不同(图1A)。通过观察与成熟中性粒细胞对应的线状细丝连接的分段细胞核的细胞,通过Wright染色验证纯化细胞的形态(图2A)。由于中性粒细胞的半衰期缩短,活力?...
讨论
必须获得高纯度的活中性粒细胞群以诱导NET的释放,因为这些细胞的 离体 寿命有限,平均为8小时,必须在这段时间内进行所有实验。为此,理想的方法是双密度梯度,通过分离对外源性刺激更敏感的非活化细胞来优化纯化时间,与Ficoll-Histopaque梯度或葡聚糖沉降技术相比17。双密度梯度法的另一个优点是,与依赖于细胞表面抗原(例如中性粒细胞中的CD16hi )的高...
披露声明
提交人声明他们没有利益冲突。
致谢
这项工作得到了CONACyT的基础科学资助(#285480)和瓦哈卡自治大学贝尼托·华雷斯大学生物化学科学学院临床免疫学研究系的支持。A.A.A,S.A.S.L.和W.J.R.R.分别拥有CONACyT编号#799779,#660793和#827788的博士奖学金。
材料
| Name | Company | Catalog Number | Comments |
| 24 Well plate for cell culture | Corning | 3526 | |
| 7-aminoactinomycin D (7-AAD) | BD Pharmingen | 51-668981E | |
| 96 Well plate for cell culture | Costar | 3596 | Flat bottom |
| Agitator | CRM Globe | CRM-OS1 | |
| Antibody LL37 | Santa Cruz Biotechnology | sc-166770 | |
| Blood collection tubes | BD VACUTAINER | 368171 | K2 EDTA 7.2 mg |
| Carboxyfluorescein succinimidyl ester (CFSE) | Sigma-Aldrich | 21878 | |
| Centrifuge | Hettich | 1406-01 | |
| Coverslip | Madesa | M03-CUB-22X22 | 22 mm x 22 mm |
| Dulbecco´s phosphate-buffered saline (DPBS) | Caisson | 1201022 | |
| Falcon tubes 50 mL | CORNING | 430829 | |
| Flow Cytometry Tubes | Miltenyi Biotec | 5 mL - Without caps | |
| FlowJo Software | BD Biosciences | Analyze flow cytometry data | |
| Fluorescence microscope | DM 2000 | LEICA | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057 | |
| Incubator | NUAIRE | UN-4750 | |
| MACSQuant Analyzer | Miltenyi Biotec | Flow cytometer | |
| Microplate reader photometer | Clarkson Laboratory - CL | ||
| Microtubes 1.5 mL | Zhejiang Runlab Tech | 35200N | wire snap |
| Minitab Software | Minitab | Statistical analysis | |
| Needles | BD VACUTAINER | 301746 | Diameter 1.34 mm |
| Optical microscope | VELAB | VE-B50 | |
| Percoll | GE Healthcare | 17-0891-01 | Solution for density gradient |
| Phosphate Buffered Saline (10x) | Caisson | PBL07-500ML | |
| Pyrex culture tubes | CORNING | CLS982025 | N°9820 |
| RPMI 1640 1x | Corning | 10-104-CV | contains Glutagro |
| Slides | Madesa | PDI257550 | 22 mm x 75 mm |
| Trypan Blue solution 0.4% | SIGMA | T8154-100ML |
参考文献
- De Buhr, N., Maren, K. B. How neutrophil extracellular traps become visible. Journal of Immunology Research. 2016, 4604713 (2016).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Takei, H., Araki, A., Watanabe, H., Ichinose, A., Sendo, F. Rapid killing of human neutrophils by the potent activator phorbol 12-myristate 13-acetate (PMA) accompanied by changes different from typical apoptosis or necrosis. Journal of Leukocyte Biology. 59 (2), 229-240 (1996).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. eLife. 6, 24437 (2017).
- Schultz, B. M., Acevedo, O. A., Kalergis, A. M., Bueno, S. M. Role of extracellular trap release during bacterial and viral infection. Frontiers in Microbiology. 13, 798853 (2022).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nature Reviews Immunology. 18 (2), 134-147 (2018).
- Delgado-Rizo, V., et al. Neutrophil extracellular traps and its implications in inflammation: An overview. Frontiers in Immunology. 8, 81 (2017).
- Petretto, A., et al. Neutrophil extracellular traps (NET) induced by different stimuli: A comparative proteomic analysis. PLoS One. 14 (7), 0218946 (2019).
- Neumann, A., et al. Novel role of the antimicrobial peptide LL-37 in the protection of neutrophil extracellular traps against degradation by bacterial nucleases. Journal of Innate Immunity. 6 (6), 860-868 (2014).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Sabbatini, M., Magnelli, V., Renò, F. NETosis in wound healing: When enough Is enough. Cells. 10 (3), 494 (2021).
- Metzler, K. D., Goosmann, C., Lubojemska, A., Zychlinsky, A., Papayannopoulos, V. A myeloperoxidase-containing complex regulates neutrophil elastase release and actin dynamics during NETosis. Cell Reports. 8 (3), 883-896 (2014).
- Clark, S. R., et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nature Medicine. 13 (4), 463-469 (2007).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. Journal of Immunology. 185 (12), 7413-7425 (2010).
- Sosa, S. A., et al. Structural differences of neutrophil extracellular traps induced by biochemical and microbiologic stimuli under healthy and autoimmune milieus. Immunologic Research. 69 (3), 264-274 (2021).
- White, P. C., et al. Characterization, quantification, and visualization of neutrophil extracellular traps. Methods in Molecular Biology. 1537, 481-497 (2017).
- Boeltz, S., et al. To NET or not to NET: current opinions and state of the science regarding the formation of neutrophil extracellular traps. Cell Death and Differentiation. 26 (3), 395-408 (2019).
- Yousefi, S., Mihalache, C., Kozlowski, E., Schmid, I., Simon, H. U. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps. Cell Death and Differentiation. 16 (11), 1438-1444 (2009).
- Brinkmann, V., Zychlinsky, A. Neutrophil extracellular traps: is immunity the second function of chromatin. The Journal of Cell Biology. 198 (5), 773-783 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。