Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikrobiyal ve Kimyasal Uyaranlar Tarafından İndüklenen Nötrofil Hücre Dışı Tuzakların Morfolojik ve Bileşimsel Analizi
Bu Makalede
Özet
Burada in vitro nötrofil hücre dışı tuzakların (NET'ler) indüksiyonu ve analizi için bir protokol sunulmaktadır. DNA, katelisidin (LL37) ve enzim aktivitesinin nicelleştirilmesi, benzer kontrollü koşullar altında mikrobiyal ve kimyasal uyaranlar tarafından indüklenen NET'lerin bileşimindeki ve morfolojisindeki değişkenliği gösteren veriler vermiştir.
Özet
Nötrofiller, nötrofil hücre dışı tuzakların (NET'ler) oluşumu gibi çeşitli mekanizmalar kullanarak doğuştan gelen bir bağışıklık tepkisinde hücresel savunmanın ilk hattı olarak işlev görür. Bu çalışma, mikrobiyal ve kimyasal uyaranların neden olduğu NET'lerdeki morfolojik ve bileşimsel değişiklikleri, NET indüksiyonu ve insan hücreleri ile karakterizasyonu için standartlaştırılmış in vitro metodolojiler kullanarak analiz etmektedir. Burada açıklanan prosedürler, NET morfolojisinin (litik veya litik olmayan) ve kompozisyonun (DNA-protein yapıları ve enzimatik aktivite) analizine ve çözünür faktörlerin veya hücresel temasın bu özellikler üzerindeki etkisine izin verir. Ek olarak, burada açıklanan teknikler, eksojen çözünür faktörlerin veya hücresel temasın NET bileşimi üzerindeki etkisini değerlendirmek için değiştirilebilir.
Uygulanan teknikler, polimorfonükleer hücrelerin çift yoğunluklu bir gradyan (1.079-1.098 g / mL) kullanılarak insan periferik kanından saflaştırılmasını, Wright'ın boyanması, tripan mavisi dışlaması ve FSC'ye karşı SSC analizi ve 7AAD boyama dahil olmak üzere akış sitometrisi ile gösterildiği gibi optimum saflık ve canlılığı (≥% 95) garanti etmeyi içerir. NET oluşumu mikrobiyal (Pseudomonas aeruginosa, Staphylococcus aureus ve Candida albicans) ve kimyasal (forbol miristat asetat, HOCl) uyaranlarla indüklenir ve NET'ler DNA-DAPI boyaması, antimikrobiyal peptid katelisidin (LL37) için immün boyama ve enzimatik aktivitenin (nötrofil elastaz, kathepsin G ve miyeloperoksidaz) nicelleştirilmesi ile karakterize edilir. Görüntüler floresan mikroskopi ile elde edilir ve ImageJ ile analiz edilir.
Giriş
Nötrofiller, kan dolaşımındaki en bol lökositlerdir ve patojenik ajanların, DNA ve birkaç nükleer, sitoplazmik ve granüler antibakteriyel proteinden oluşan büyük kromatin yapılarının salınması da dahil olmak üzere çeşitli mekanizmalarla temizlenmesi sırasında önemli bir rol oynarlar 1,2. Nötrofillerin bu antimikrobiyal rolünü tanımlayan doğrudan öncül, 1996 yılında Takei ve ark.3 tarafından yapılmıştır. Bu yazarlar, nötrofillerde apoptoz ve nekroptozdan farklı yeni bir ölüm şekli bildirmiş, nükleer rüptür sergileyen morfolojik değişiklikler göstermiş, bunu nükleoplazmadan sitoplazmaya dökülmeyi ve forbol miristat asetat (PMA) ile 3 saatlik inkübasyondan membran geçirgenliğinde bir artış göstermiştir 2,3. Bununla birlikte, 2004 yılına kadar "nötrofil hücre dışı tuzaklar (NET'ler)" teriminin kullanıldığı4.
NET oluşumu, mikrobiyal yayılımı nötralize etmek, öldürmek ve önlemek için bakteriyel, fungal5, viral6 ve paraziter enfeksiyonlar gibi çeşitli koşullarda gözlenmiştir7. Diğer çalışmalar, patojenik olmayan koşullarda, sitokinler, monosodyum ürik asit veya kolesterol kristalleri, otoantikorlar, bağışıklık kompleksleri ve aktif trombositler gibi steril uyaranlarla da ortaya çıkabileceğini göstermektedir7. Lipopolisakkarit (LPS), interlökin-8 (IL-8) ve PMA, NET indükleyicileri olarak tanımlanan ilk in vitro uyaranlar arasındaydı ve patojenik süreçlerdeki in vivo NET katılımı iki akut inflamasyon modelinde gösterilmiştir: deneysel dizanteri ve spontan insan apandisiti4. DNA önemli bir NET bileşenidir. Uygun yapısı ve bileşimi, NET'leri ve mikrobisidal özelliklerini parçalayan kısa bir deoksiribonükleaz (DNaz) tedavisi ile gösterildiği gibi, yakalanan mikroplara karşı yüksek bir lokal antimikrobiyal molekül konsantrasyonu sağlayarak mikroorganizmaların tutulması ve öldürülmesi için gereklidir4. DNA'nın yanı sıra, NET'ler histonlar, nötrofil elastaz (NE), kathepsin G (CG), proteinaz 3, laktoferrin, jelatinaz, miyeloperoksidaz (MPO) ve katyonik pro-inflamatuar peptid katelisidin LL-37 gibi antimikrobiyal peptitler (AMP'ler) gibi bağlı proteinleri içerir 8,9. Bu tür agregalar, 50 nm'ye kadar çaplara sahip daha büyük dişler oluşturabilir. Bu faktörler mikrobiyal virülans faktörlerini veya patojen hücre zarının bütünlüğünü bozabilir; Ek olarak, AMP'ler NET kaynaklı DNA'yı bakteriyel nükleazlar tarafından bozulmaya karşı stabilize edebilir10.
NET oluşumunu düzenleyen spesifik mekanizmalar henüz tam olarak açıklığa kavuşturulmamıştır. NET salınımına yol açan en iyi karakterize yol, NADPH oksidaz aktivasyonu ve reaktif oksijen türleri (ROS) üretiminin yanı sıra MPO yolunun aktivasyonunu tetikleyen hücre içi kalsiyumun artmasına yol açan ERK sinyallemesidir. Bu da hidrojen peroksiti hipokloröz aside dönüştürür ve NE'yi oksidasyon11,12 ile aktive eder. NE, fagositozu bloke etmek için sitoiskeletin aktin filamentlerinin parçalanmasından ve granül ve sitoplazmik proteinlerle ilişkili kromatin liflerinin duyarsızlaştırılmasını sağlayan ve daha sonra hücre dışı olarak salınan PAD4 ile proteolitik bölünme ve deaminasyon ile işlenmek üzere çekirdeğe taşınmasından sorumludur7. Bu proteazlar, azurofil granüllerinin azurozom kompleksinden ve kathepsin G13 gibi diğer proteazlardan salınanları içerir.
Nötrofillerdeki morfolojik değişikliklere bağlı olarak, NET'ler iki tipte sınıflandırılır: hücre ölümüne yol açan intihar veya litik NET oluşumu4 ve nükleer veya mitokondriyal DNA'nın veziküler salınımının aracılık ettiği canlı hücreler tarafından üretilen hayati veya litik olmayan NET oluşumu, fagositik kapasiteye sahip bir anüklee sitoplastın kalıntısı14,15. Genel olarak, mitokondriyal DNA'dan oluşan NET'ler uzatılmış bir lif14 morfolojisi sunarken, nükleer DNA'dan yapılandırılmış olanlar bulut benzeri bir görünüme sahiptir3. Bununla birlikte, nötrofilin DNA kökenini nasıl seçtiği bilinmemektedir. NET'lerin kanonik yollarını birkaç saat gerektirdiğini tanımlayan önceki çalışmaların aksine, hayati yol sadece 5-60 dakika15'te hızla aktive edilir.
Bu ilerlemelere rağmen, NET bileşimi uyarana bağlı olarak değişir; Örneğin, P. aeruginosa'nın farklı mukoid ve mukoid olmayan suşları, 33 ortak protein ve 50'ye kadar değişken proteiniçeren NET'lerin oluşumunu indükler. Bu nedenle, araştırma gruplarında nesnel sonuçların üretilmesine izin veren teknikleri homojenize etmek gerekir. Bu yazıda, farklı mikroorganizmalarla indüklenen NET'lerin bileşiminin, yapısının ve morfolojisinin karşılaştırılmasına ve değerlendirilmesine olanak tanıyan çeşitli tekniklerle bir protokol açıklanmaktadır: Staphylococcus aureus (gram-pozitif bakteri), Pseudomonas aeruginosa (gram-negatif bakteri) ve Candida albicans (mantar) ve sağlıklı bireylerden gelen insan nötrofillerinde kimyasal uyaranlar (PMA, HOCl). Temsili sonuçlar, DNA-DAPI boyaması, LL37 için immün boyama ve enzimatik aktivitenin (NE, CG ve MPO) nicelleştirilmesi ile karakterize edilen karşılaştırılabilir in vitro koşullar altında indükleyici uyaranlarına bağlı olarak NET'lerin heterojenliğini göstermektedir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Kan örnekleri, bilgilendirilmiş onam sonrası klinik olarak sağlıklı katılımcılardan bağış olarak alındı. Tüm deneyler, Oaxaca'nın Universidad Autónoma 'Benito Juárez' Biyokimyasal Bilimler Fakültesi İnsan Araştırmaları Etik Kurulu'nun izniyle gerçekleştirildi.
NOT: Çalışmaya dahil edilme kriterleri cinsiyet ve yaş belirsizdi ve kan örneği almadan önce bir ankete verilen katılımcı yanıtlarına göre klinik olarak sağlıklıydı. Hücre sayısını belirlemek ve enfeksiyonları veya anemiyi dışlamak için hematolojik bir analizin yanı sıra donördeki iltihabı dışlamak için C-reaktif protein testi yapıldı.
1. Periferik kan alımı ve eritrosit ve lökosit paketinin elde edilmesi
- 1.8 mg / mL K2 · olan tüplerde venipunktur ile 10 mL periferik kan toplayın Bilgilendirilmiş onam alındıktan sonra klinik olarak sağlıklı bireylerden antikoagülan olarak EDTA (bakınız Materyal Tablosu). Daha sonra, enfeksiyonu veya iltihabı dışlamak için standart kan biyometrisi ve C-reaktif protein testi yapın ve numunenin kalitesini sağlayın.
- Trombosit bakımından zengin plazmayı çıkarmak için periferik kan örneğini 15 dakika boyunca 82 x g'de santrifüjleyin, ardından 5 dakika boyunca 630 x g'de ikinci bir santrifüjleme yapın. Eritrosit ve lökosit paketini elde etmek için kalan plazmayı atın.
- 1x Dulbecco'nun fosfat tamponlu salini (DPBS) ile 1: 1 oranında (v / v) seyreltin.
2. Çift yoğunluklu bir gradyan kullanarak polimorfonükleer nötrofil (PMN) saflaştırma
NOT: Kan toplandıktan hemen sonra nötrofil saflaştırması yapın, çünkü yaklaşık 8 saatlik sınırlı bir in vitro ömre sahiptirler.
- Aşağıdakileri steril 10 mL'lik bir cam tüpe koyun (bakınız Malzeme Tablosu): 1 mL 1.098 g/mL yoğunluk çözeltisi, 1 mL 1.079 g/mL yoğunluk çözeltisi (bakınız Malzeme Tablosu) ve daha sonra seyreltilmiş eritrosit ve lökosit ambalajının 4 mL'si. Karışmalarını önlemek için katmanlar arasındaki yüzey gerilimini kırmadan duvarların üzerine dökün.
- 4 °C'de 20 dakika boyunca 320 x g'de santrifüj, santrifüjün yüksek kuvvetlerinin gradyanı rahatsız etmemesi için hızlanma / yavaşlamayı önler.
- Granülositlere karşılık gelen fazı (Şekil 1A) pipetle aspire edin ve başka bir steril 10 mL cam tüpe aktarın. 4 °C'de 10 dakika boyunca 300 x g'de 4 mL 1x DPBS ile yıkayın.
- Süpernatantı atın ve kalan eritrositleri çıkarmak için hücreleri ozmotik şokla tedavi edin. 4 °C'de 2 dakika boyunca 4 mL% 0.2 tuzlu su çözeltisi ekleyin ve 4 ° C'de 10 dakika boyunca 300 x g'de santrifüj yapın. Süper natantı atın. Ardından, membran bütünlüğünü geri kazanmak için 4 °C'de 5 dakika boyunca 4 mL izotonik çözelti (% 0.65 salin) ekleyin ve 4 ° C'de 10 dakika boyunca 300 x g'de santrifüj yapın.
NOT: % 0.2 salin çözeltisi, RBC hücre içi ortamınkine göre daha düşük çözünen konsantrasyona sahip hipotonik bir ortamdır. Hipotonik ortam ile temas, suyun RBC'ye yayılmasına izin vererek şişmelerine ve hemolizlerine yol açar. RBC'nin süpernatanttan çıkarılması, mikroskobik gözlemle doğrulandı. - Süper natantı çıkarın. Hücresel kalıntıları gidermek için hücreleri 4 mL'lik 1x DPBS'de yeniden askıya alın ve ardından 4 ° C'de 10 dakika boyunca 300 x g'de santrifüj yapın. Son olarak, hücre peletini 2 mL soğuk Hank'in dengeli tuz çözeltisi (HBSS) tamponunda yeniden askıya alın.
3. Nötrofil morfolojisi ve canlılığı (Şekil 1B)
- Tripan mavisi dışlama testi
- Hücre süspansiyonunun 5 μL'sini% 0.4 tripan mavisi (1: 5 oranında) 20 μL'de seyreltin. Bir Neubauer odasındaki hücreleri sayın ve bir dışlama testi kullanarak hücre canlılığını belirleyin. Boyayı geçirgenleştirmeden zarlarının bütünlüğünü koruyan hücreleri canlı olarak düşünün.
- Bir slayta hücre süspansiyonunun 5 μL'sini monte edin; 15 sn boyunca Wright'ın lekesiyle kurutun ve lekeleyin. Numuneyi derhal 30 sn için fosfat tamponu pH 6.4 ile sabitleyin. Yeterli damıtılmış suyla yıkayın ve morfolojiyi optik mikroskop altında (100x) gözlemleyin.
- 7AAD boyama ve akış sitometrisi analizi
- Sitometri tüplerini akıtmak için 1 x 105 hücre ekleyin ve karanlıkta 4 ° C'de 15 dakika boyunca 100 μL FACS tamponunda (1x DPBS,% 0.1 sodyum azid ve% 10 otolog dekompleman plazma) 1 μL 7AAD ile boyayın.
- 10 dakika boyunca 300 x g'de 500 μL FACS tamponu ile yıkayın. Hücreleri 500 μL% 2 paraformaldehit ile sabitleyin ve akış sitometresinde analiz edilene kadar 4 ° C'de saklayın.
- Ölü hücre kontrolü için, 1 x 105 hücreyi 30 dakika boyunca 200 μL% 4 paraformaldehit ile sabitleyin ve 4 ° C'de 10 dakika boyunca 300 x g'de 500 μL 1x PBS ile yıkayın. Süpernatantı çıkarın ve atın. Ardından, 4 °C'de 1 saat boyunca 200 μL %0,1 Triton X-100 ekleyin. 500 μL 1x PBS ile yıkayın ve adım 3.2.1'de olduğu gibi 7AAD ile lekeleyin.
- Bir akış sitometresi kullanarak (bkz. Malzeme Tablosu), hücre saflığını analiz etmek için FSC'ye karşı SSC analizi ve hücre canlılığını analiz etmek için SSC'ye karşı 7AAD boyama işlemini gerçekleştirin. Polimorfonükleer ortamlarda (FSC, 400-490 ve SSC, 300-320) orta akışta (1.000 hücre/sn) 100 μL alım hacminde 3 x 104 olayı okuyun.
- Akış sitometresi yazılımında yakalanan verileri analiz edin (bkz. Malzeme Tablosu) ve nokta grafikleri ve histogramlar aracılığıyla sunulan polimorfonükleer popülasyondaki 7AAD için saflık ve pozitif hücrelerin yüzdesini belirleyin.
4. Mikroorganizmaların CFSE boyanması
- 1.5 mL mikrotüplere 1 x 108 bakteri veya 1 x 106 mantar psödohipha ekleyin ve 1x PBS'de çözünmüş 200 μL 5 μM karboksifloresein süksinimidil ester (CFSE) ile lekeleyin. Birkaç saniye karıştırın ve karanlıkta 10 dakika boyunca 37 ° C'de inkübe edin.
- 500 μL dekompleman plazma ekleyerek reaksiyonu durdurun ve psödohifalar için 10 dakika boyunca 620 x g'de veya bakteriler için 10 dakika boyunca 1.800 x g'de santrifüj yapın.
- Süpernatantları atın ve peletleri adım 4.2'de olduğu gibi santrifüjleme ile 1 mL 1x PBS ile yıkayın. Son olarak, mikroorganizmaları 250 μL 1x PBS'de yeniden askıya alın.
- NET indüksiyonu için 2 x 107 bakteri (MOI: 100) veya 2 x 10 5 psödohifaj (MOI: 1) ile 1,5 mL'lik mikrotüplerde50 μL alikotlar hazırlayın.
5. NET indüksiyonu
- 10 mm x 10 mm steril cam kapakları 24 delikli bir plakaya yerleştirin ve oda sıcaklığında 1 saat boyunca 10 μL% 0,001 poli-L-lizin ile örtün. 100 μL 1x PBS ile iki kez yıkayın, hava ile kurutun ve 15 dakika boyunca UV ışığıyla ışınlayın.
- Adım 2.5'teki nötrofil süspansiyonunun HBSS çözeltisini,% 10 otolog plazma ile desteklenmiş RPMI 1640 ortamı ile değiştirin. 24 delikli plakaya (adım 5.1), 2 x 10 5 nötrofil / kuyunun son konsantrasyonu için bu hücre süspansiyonunun350 μL'sini ekleyin.
- % 5 CO 2 ile 37 ° C'de 20 dakika inkübe ederek hücrelerin kuyucukların dibine yapışmasına izinverin.
- 50 μL'de NET oluşumunu indüklemek için uyaranları ekleyin: mikrobiyal uyaranlar-gram-pozitif bakteri S. aureus (ATCC 25923), MOI 100'de gram-negatif bakteri P. aeruginosa (ATCC 10145) ve MOI: 1'de C. albicans'ın (ATCC 10231) psödohifası; biyokimyasal uyaranlar-PMA (200 nM) ve HOCl (4.5 mM) ve uyaran yokluğunda kontrol (HBSS'nin 50 μL'si).
- Kuyu başına 400 μL'lik bir son hacim elde edin. 30 s için 140 rpm'de bir plaka çalkalayıcı üzerinde karıştırın ve 37 ° C'de ve% 5 CO2'de 4 saat boyunca inkübe edin.
6. NET'lerin floresan mikroskopisi ile görselleştirilmesi
- DNA ve LL37 immün boyama
- NET indüksiyonundan sonra, süpernatantları dikkatlice pipetleyerek kuyucuklardan çıkarın ve hücreleri 30 dakika boyunca 300 μL% 4 paraformaldehit ile sabitleyin.
- Hücreleri santrifüj yapmadan 200 μL 1x PBS ile yıkayın ve 30 dakika boyunca 200 μL bloke edici tampon (1x PBS'de% 10 dekompleman plazma) ekleyin.
- LL-37 boyası için, antikorun hücrelere girmesine izin vermek için hücreleri 1x PBS'de 10 dakika boyunca 200 μL% 0.2 Triton X-100 ile geçirgenleştirin. Fazla deterjanı çıkarmak için 1x PBS ile 2x'i dikkatlice yıkayın.
- Kapak fişlerini cam slaytlara monte edin (her slaytta dört kapak kayması). DNA, hücreleri 2 μL DAPI ile boyar ( bakınız Malzeme Tablosu), kapak kapaklarını kapatır ve konfokal floresan mikroskobu ile analizlerine kadar -20 ° C'de saklar.
- Floresan görüntülerin elde edilmesi ve analizi
- Bileşenlerini ölçmek için NET görüntülerini alın ve görüntüleri bilgisayarın yazılımıyla elde etmek için konfokal floresan mikroskobunda karşılık gelen filtreleri kullanın (bkz.
NOT: DNA'nın DAPI (mavi renk) ile boyandığını, 360 nm'de uyarılma ve 460 nm'de emisyon gösterdiğini düşünün. Mikroorganizmalar, 492 nm uyarım ve 521 nm emisyona sahip CFSE (yeşil renk) ile boyanır. LL37 peptidi, 594 nm uyarım ve 614 nm emisyona sahip anti-LL37 Alexa Fluor 594 antikoru (kırmızı renk) ile etiketlenmiştir. - Mikroskobu kalibre edin. Slaytı yerleştirin ve normal ışık açıkken diferansiyel girişim kontrastını (DIC) kullanarak odaklanın. Görüntüyü monitöre yansıtmak için Canlı'yı seçin.
- Işığı kapatın ve florokroma karşılık gelen kanalı seçin. Örneğin, DAPI için 365 nm/mavi filtreyi, Alexa 594 için 43 HE DsRed'i veya CFSE için 38 HE GFP'yi seçin.
- LL37 için izotip kontrol antikoru ve DAPI ve CFSE için lekesiz hücreler ile ayarları yapın. Tüm görüntüleri aynı koşullar altında yakalamak için aynı pozlama süresini, voltajı, kontrastı ve lens ayarlarını yapın.
NOT: Bu çalışmada, maruz kalma süresi, voltaj ve kontrast sırasıyla 1.0 ms, 4.0 V ve 0.0 olarak 40x hedefi ile ayarlanmıştır. Bu değerler, numuneler için en iyi görüntü yakalamayı kolaylaştırmak üzere ayarlanabilir. - Görüntüyü yakalamak için Tuttur'u seçin. Kuyu başına beş görüntüyü (dört uç nokta ve merkez) ve DNA / LL37 / CFSE'nin kolokalizasyonunu (birleşmesini) kaydedin.
- Her rengin bağımsız görüntüleriyle üç piksel sınıfını arka plan olarak tanımlayın ve Image J yazılımıyla alan başına Ortalama Gri Sinyal değerini analiz edin.
- Bileşenlerini ölçmek için NET görüntülerini alın ve görüntüleri bilgisayarın yazılımıyla elde etmek için konfokal floresan mikroskobunda karşılık gelen filtreleri kullanın (bkz.
7. Enzimatik aktivite ölçümü
- 96 delikli bir plakada, NET indüksiyonu için 1 x 10 5 nötrofil içeren HBSS'ye 90 μL hücre süspansiyonu ekleyin ve 37 ° C'de ve%5 CO 2'de20 dakika boyunca inkübe edin.
- Hemen, karşılık gelen uyaranlardan 10 μL ekleyin (adım 5.4'teki gibi konsantrasyon) ve% 5 CO2 ile 37 ° C'de 4 saat boyunca inkübe edin.
- Süpernatantları atın ve hücreleri 100 μL HBSS ile yıkayın. DNA-protein yapılarının salınımını desteklemek için 37 ° C'de 10 dakika boyunca 1 U / mL DNaz ile tedavi edin ve 10 dakika boyunca 1.800 x g'de santrifüj yapın.
- Süpernatantları geri kazanın ve daha önce White ve ark.17 tarafından tanımlandığı gibi kolorimetrik reaksiyonlar kullanarak süpernatanttaki enzim aktivitesini değerlendirin.
- NET indüksiyonu için herhangi bir uyaran eklemeden aynı deneysel koşullar altında nötrofillerde NE, CG ve MPO'nun maksimum enzim aktivitesini belirleyin. Daha sonra, hücre örneğini -70 ° C'de dondurun ve bir su banyosunda 37 ° C'de çözün, hücre içi proteinlerin hücre lizisi ile salınmasını desteklemek için bir sıcaklık şoku oluşturun. 10 dakika boyunca 1.800 x g'de santrifüj yapın ve süpernatantları geri kazanın.
- 96 delikli plakalarda her bir kuyucuğa 50 μL süpernatant ekleyin ve ardından adım 7.7'de belirtildiği gibi her bir substrattan 50 μL ekleyin.
- NE için substrat olarak 0,5 M N-metoksisüksinil-Ala-Ala-Pro-Val-p-nitro anilin ve CG için 1 mM N-süksinil-Ala-Ala-Pro-Phe-p-nitroanilit ekleyin. Oda sıcaklığında 3 saat kuluçkaya yatırın. MPO için, 1,6 mM 3,3', 5,5'-tetrametilbenzidin (TMB) ekleyin ve oda sıcaklığında 30 dakika inkübe edin.
- Kuluçka sonrası, MPO için durdurma çözeltisinin 50 μL'sini (0,5 MH2S04) ekleyin ve bir spektrofotometre kullanarak NE ve CG için 405 nm ve MPO için 450 nm'de absorbansı ölçün.
- Elde edilen değerleri ilgili kalibrasyon eğrileriyle karşılaştırın ve her koşulun maksimum enzim aktivitesine (% 100) göre sonuçlarını gösterin.
8. İstatistiksel analiz
- Her bağımsız deney için ölçüm verilerini üçlü olarak analiz edin (n = 10) ve% 95 güven seviyesine sahip grupları karşılaştırarak istatistiksel analiz için bir ANOVA gerçekleştirin.
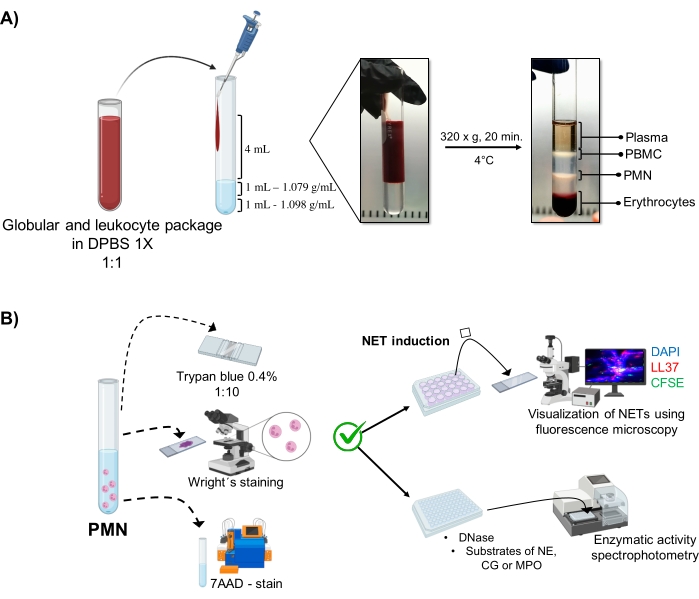
Şekil 1: PMN saflaştırma ve NET indüksiyon protokolü. (A) Eritrosit ve lökosit paketini elde etmek için periferik kandan plazma çıkarıldı ve 1x DPBS ile 1:1 (v / v) seyreltildi. Daha sonra, seyreltmenin 4 mL'si duvar boyunca çift yoğunluklu gradyan tüpe eklendi ve 4 ° C'de 20 dakika boyunca 320 x g'de santrifüj edildi, farklı hücre katmanlarının ayrılması sağlandı ve PMN'ye karşılık gelenin geri kazanılması sağlandı. (B) Saflaştırılmış hücreler sayıldı ve morfolojileri Wright'ın boyaması ile analiz edildi. Canlılık, tripan mavisi dışlama ve akım sitometrisi kullanılarak 7AAD boyama ile belirlendi. Optimal nötrofil saflığı ve canlılığı doğrulandıktan sonra, DAPI-DNA, anti-LL37 Alexa Fluor 594 ve mikroorganizma-CFSE boyama ile floresan mikroskobu ile analiz için 24 delikli plakalara mikroplar (S. aureus, P. aeruginosa ve C. albicans) veya kimyasallar (PMA, HOCl) eklenerek NET oluşumu indüklendi. Enzim niceliği için, NET'ler 3 saat boyunca 96 delikli plakalarda indüklendi ve DNaz ile muamele edildi, ardından her enzim için substratların eklenmesiyle takip edildi: NE, CG ve MPO; renk değişiklikleri spektrofotometri ile ölçüldü. DPBS = Dulbecco'nun fosfat tamponlu salini; PBMC = Periferik kan mononükleer hücreleri; PMN = Polimorfonükleer nötrofiller; NE = Nötrofil elastaz; CG = Cathepsin G; MPO = Miyeloperoksidaz; PMA = Phorbol miristat asetat; HOCl = Hipokloröz asit. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Nötrofillerin saflığı ve yaşayabilirliği
Dinamik hücresel fazlar, çift yoğunluklu gradyan saflaştırmasından tüpte görselleştirilir. Bu tabakalar içinde, granülositlere karşılık gelen tabaka, periferik kan mononükleositlerinin (PBMC'ler) ve eritrositlerin fazlarından ayırt edilen 1.079 g / mL yoğunluk tabakasının üzerindedir (Şekil 1A). Saflaştırılmış hücrelerin morfolojisi, olgun nötrofillere karşılık gelen iplik benzeri filamentlerle...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
NET'lerin salınımını indüklemek için oldukça saf bir canlı nötrofil popülasyonu elde edilmelidir, çünkü bu hücreler ortalama 8 saatlik sınırlı bir ex vivo ömre sahiptir, bu da tüm deneylerin yapılması gereken bir süredir. Bu amaçla, ideal metodoloji, Ficoll-Histopaque gradyanı veya Dextran sedimantasyon tekniklerinin aksine, eksojen stimülasyona daha duyarlı aktive olmayan hücreleri izole ederek saflaştırma süresini optimize etmek için çift yoğunluklu gradyandır
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma, CONACyT'den bir temel bilim hibesi (#285480) ve Universidad Autónoma 'Benito Juárez' de Oaxaca Biyokimyasal Bilimler Fakültesi Klinik İmmünoloji Araştırma Bölümü tarafından desteklenmiştir. A.A.A, S.A.S.L ve W.J.R.R., sırasıyla #799779, #660793 ve #827788 CONACyT numaralarının doktora burslarına sahiptir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 Well plate for cell culture | Corning | 3526 | |
| 7-aminoactinomycin D (7-AAD) | BD Pharmingen | 51-668981E | |
| 96 Well plate for cell culture | Costar | 3596 | Flat bottom |
| Agitator | CRM Globe | CRM-OS1 | |
| Antibody LL37 | Santa Cruz Biotechnology | sc-166770 | |
| Blood collection tubes | BD VACUTAINER | 368171 | K2 EDTA 7.2 mg |
| Carboxyfluorescein succinimidyl ester (CFSE) | Sigma-Aldrich | 21878 | |
| Centrifuge | Hettich | 1406-01 | |
| Coverslip | Madesa | M03-CUB-22X22 | 22 mm x 22 mm |
| Dulbecco´s phosphate-buffered saline (DPBS) | Caisson | 1201022 | |
| Falcon tubes 50 mL | CORNING | 430829 | |
| Flow Cytometry Tubes | Miltenyi Biotec | 5 mL - Without caps | |
| FlowJo Software | BD Biosciences | Analyze flow cytometry data | |
| Fluorescence microscope | DM 2000 | LEICA | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057 | |
| Incubator | NUAIRE | UN-4750 | |
| MACSQuant Analyzer | Miltenyi Biotec | Flow cytometer | |
| Microplate reader photometer | Clarkson Laboratory - CL | ||
| Microtubes 1.5 mL | Zhejiang Runlab Tech | 35200N | wire snap |
| Minitab Software | Minitab | Statistical analysis | |
| Needles | BD VACUTAINER | 301746 | Diameter 1.34 mm |
| Optical microscope | VELAB | VE-B50 | |
| Percoll | GE Healthcare | 17-0891-01 | Solution for density gradient |
| Phosphate Buffered Saline (10x) | Caisson | PBL07-500ML | |
| Pyrex culture tubes | CORNING | CLS982025 | N°9820 |
| RPMI 1640 1x | Corning | 10-104-CV | contains Glutagro |
| Slides | Madesa | PDI257550 | 22 mm x 75 mm |
| Trypan Blue solution 0.4% | SIGMA | T8154-100ML |
Referanslar
- De Buhr, N., Maren, K. B. How neutrophil extracellular traps become visible. Journal of Immunology Research. 2016, 4604713(2016).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Takei, H., Araki, A., Watanabe, H., Ichinose, A., Sendo, F. Rapid killing of human neutrophils by the potent activator phorbol 12-myristate 13-acetate (PMA) accompanied by changes different from typical apoptosis or necrosis. Journal of Leukocyte Biology. 59 (2), 229-240 (1996).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. eLife. 6, 24437(2017).
- Schultz, B. M., Acevedo, O. A., Kalergis, A. M., Bueno, S. M. Role of extracellular trap release during bacterial and viral infection. Frontiers in Microbiology. 13, 798853(2022).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nature Reviews Immunology. 18 (2), 134-147 (2018).
- Delgado-Rizo, V., et al. Neutrophil extracellular traps and its implications in inflammation: An overview. Frontiers in Immunology. 8, 81(2017).
- Petretto, A., et al. Neutrophil extracellular traps (NET) induced by different stimuli: A comparative proteomic analysis. PLoS One. 14 (7), 0218946(2019).
- Neumann, A., et al. Novel role of the antimicrobial peptide LL-37 in the protection of neutrophil extracellular traps against degradation by bacterial nucleases. Journal of Innate Immunity. 6 (6), 860-868 (2014).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Sabbatini, M., Magnelli, V., Renò, F. NETosis in wound healing: When enough Is enough. Cells. 10 (3), 494(2021).
- Metzler, K. D., Goosmann, C., Lubojemska, A., Zychlinsky, A., Papayannopoulos, V. A myeloperoxidase-containing complex regulates neutrophil elastase release and actin dynamics during NETosis. Cell Reports. 8 (3), 883-896 (2014).
- Clark, S. R., et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nature Medicine. 13 (4), 463-469 (2007).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. Journal of Immunology. 185 (12), 7413-7425 (2010).
- Sosa, S. A., et al. Structural differences of neutrophil extracellular traps induced by biochemical and microbiologic stimuli under healthy and autoimmune milieus. Immunologic Research. 69 (3), 264-274 (2021).
- White, P. C., et al. Characterization, quantification, and visualization of neutrophil extracellular traps. Methods in Molecular Biology. 1537, 481-497 (2017).
- Boeltz, S., et al. To NET or not to NET: current opinions and state of the science regarding the formation of neutrophil extracellular traps. Cell Death and Differentiation. 26 (3), 395-408 (2019).
- Yousefi, S., Mihalache, C., Kozlowski, E., Schmid, I., Simon, H. U. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps. Cell Death and Differentiation. 16 (11), 1438-1444 (2009).
- Brinkmann, V., Zychlinsky, A. Neutrophil extracellular traps: is immunity the second function of chromatin. The Journal of Cell Biology. 198 (5), 773-783 (2012).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır