A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח מורפולוגי וקומפוזיציוני של מלכודות נויטרופיליות חוץ-תאיות המושרות על ידי גירויים מיקרוביאליים וכימיים
In This Article
Summary
מוצג כאן פרוטוקול לאינדוקציה וניתוח של מלכודות חוץ-תאיות נויטרופיליות במבחנה (NETs). כימות של דנ"א, קתליצידין (LL37) ופעילות אנזים הניב נתונים המראים את השונות בהרכב ובמורפולוגיה של NETs המושרים על ידי גירויים מיקרוביאליים וכימיים בתנאים מבוקרים דומים.
Abstract
נויטרופילים מתפקדים כקו ההגנה התאי הראשון בתגובה חיסונית מולדת על ידי הפעלת מנגנונים מגוונים, כגון היווצרות מלכודות נויטרופיליות חוץ-תאיות (NETs). מחקר זה מנתח את השינויים המורפולוגיים והקומפוזיציוניים ב-NETs המושרים על-ידי גירויים מיקרוביאליים וכימיים תוך שימוש במתודולוגיות סטנדרטיות במבחנה להשראת NET ואפיון עם תאים אנושיים. ההליכים המתוארים כאן מאפשרים ניתוח של מורפולוגיה NET (ליטית או לא ליטית) והרכב (מבנים של חלבון DNA ופעילות אנזימטית), ואת ההשפעה של גורמים מסיסים או מגע תאי על מאפיינים אלה. בנוסף, ניתן לשנות את הטכניקות המתוארות כאן כדי להעריך את ההשפעה של גורמים מסיסים אקסוגניים או מגע תאי על הרכב NET.
הטכניקות המיושמות כוללות טיהור של תאים פולימורפונוקליאריים מדם היקפי אנושי באמצעות שיפוע בצפיפות כפולה (1.079-1.098 גרם/מ"ל), מה שמבטיח טוהר וכדאיות אופטימליים (≥ 95%) כפי שהוכח על ידי הכתמה, הרחקת טריפן כחול וציטומטריה של זרימה, כולל ניתוח FSC לעומת SSC וצביעת 7AAD. היווצרות NET מושרית באמצעות גירויים מיקרוביאליים (Pseudomonas aeruginosa, Staphylococcus aureus ו-Candida albicans) וכימיים (phorbol myristate acetate, HOCl), וה-NETs מאופיינים בהכתמת DNA-DAPI, אימונוסטינינג לפפטיד האנטי-מיקרוביאלי קתליצידין (LL37), וכימות הפעילות האנזימטית (נויטרופיל אלסטאז, קתפסין G ומיאלופרוקסידאז). התמונות נרכשות באמצעות מיקרוסקופיה פלואורסצנטית ומנותחות באמצעות ImageJ.
Introduction
נויטרופילים הם הלויקוציטים הנפוצים ביותר בזרם הדם, הממלאים תפקיד חיוני במהלך פינוי סוכנים פתוגניים על ידי מספר מנגנונים, כולל שחרור מבני כרומטין גדולים המורכבים מ- DNA ומספר חלבונים אנטיבקטריאליים גרעיניים, ציטופלסמיים וגרגירים 1,2. ההקדמה הישירה המתארת את התפקיד האנטי-מיקרוביאלי הזה של נויטרופילים נעשתה על ידי Takei et al.3 בשנת 1996. מחברים אלה דיווחו על צורה חדשה של מוות שונה מאפופטוזיס ונקרופטוזיס בנויטרופילים, הראו שינויים מורפולוגיים המציגים קרע גרעיני, ולאחר מכן נשפך מתוך הנוקלאופלזמה לתוך הציטופלסמה, ועלייה בחדירות הממברנה מ-3 שעות של דגירה עם phorbol myristate אצטט (PMA)2,3. עם זאת, רק בשנת 2004 נעשה שימוש במונח "מלכודות נויטרופיליות חוץ-תאיות (NETs)"4.
היווצרות NET נצפתה במצבים שונים, כגון חיידקים חיידקיים, פטרייתיים5, ויראליים6 וזיהומים טפיליים, לנטרול, הרג ומניעת הפצה מיקרוביאלית7. מחקרים אחרים מראים כי זה יכול להתרחש גם בתנאים לא פתוגניים על ידי גירויים סטריליים, כגון ציטוקינים, חומצת שתן מונוסודיום או גבישי כולסטרול, נוגדנים עצמיים, קומפלקסים חיסוניים, וטסיות מופעלות7. ליפופוליסכריד (LPS), אינטרלוקין-8 (IL-8) ו-PMA היו בין הגירויים הראשונים במבחנה שתוארו כמשרי NET, ומעורבות in vivo NET בתהליכים פתוגניים הודגמה בשני מודלים של דלקת חריפה: דיזנטריה ניסיונית ודלקת התוספתן האנושית הספונטנית4. דנ"א הוא מרכיב NET חיוני. המבנה וההרכב המתאימים שלו נחוצים לריצוף והרג של מיקרואורגניזמים על ידי העברת ריכוז מקומי גבוה של מולקולות אנטי-מיקרוביאליות לעבר המיקרובים שנתפסו, כפי שמודגם על ידי טיפול קצר בדאוקסיריבונוקלאז (DNase) המפרק את ה-NETs ואת תכונותיהם המיקרו-ביצידליות4. מלבד דנ"א, NETs מורכבים מחלבונים מחוברים כגון היסטונים, נויטרופיל אלסטאז (NE), קתפסין G (CG), פרוטאינאז 3, לקטופרין, ג'לטינאז, מיאלופרוקסידאז (MPO) ופפטידים אנטי-מיקרוביאליים (AMPs) כגון הפפטיד הקטיוני מרובה הדלקת קתליצידין LL-37 בין היתר 8,9. אגרגטים כאלה עשויים ליצור חוטים גדולים יותר עם קטרים של עד 50 ננומטר. גורמים אלה יכולים לשבש את גורמי האלימות המיקרוביאלית או את שלמות קרום התא הפתוגן; בנוסף, ה-AMPs יכולים לייצב את הדנ"א שמקורו ב-NET מפני פירוק על-ידי נוקלאזות חיידקיות10.
המנגנונים הספציפיים המסדירים את היווצרות NET טרם הובהרו במלואם. המסלול המאופיין בצורה הטובה ביותר המוביל לשחרור NET הוא באמצעות איתות ERK, מה שמוביל להפעלת NADPH אוקסידאז ולייצור חמצן תגובתי (ROS), כמו גם לסידן תוך תאי מוגבר המפעיל הפעלה של מסלול MPO. זה בתורו הופך מי חמצן לחומצה היפוכלורית, ומפעיל את NE על ידי חמצון11,12. NE אחראי להשפלת חוטי האקטין של השלד הציטוסקולרי כדי לחסום פאגוציטוזה ולהעביר אותם לגרעין לצורך עיבוד על ידי ביקוע פרוטאוליטי ופירוק על ידי PAD4 המניעים את הדה-סנסיטיזציה של סיבי הכרומטין, המתקשרים לחלבונים גרגירים וציטופלסמיים, ולאחר מכן משתחררים באופן חוץ-תאי7. פרוטאזות אלה כוללות את אלה המשתחררות מקומפלקס האזורוזומים של גרגירי האזורופיל ופרוטאזות אחרות כגון קתפסין G13.
בהתאם לשינויים המורפולוגיים בנויטרופילים, NETs מסווגים לשני סוגים: היווצרות NET אובדנית או ליטית המובילה למוות תאי4, והיווצרות NET חיונית או לא ליטית המיוצרת על ידי תאים בני קיימא המתווכים על ידי שחרור שלפוחית של דנ"א גרעיני או מיטוכונדריאלי, עם שריד של ציטופלסט אנוקליע עם יכולת פאגוציטית14,15. באופן כללי, NETs המורכבים מדנ"א מיטוכונדריאלי מציגים מורפולוגיה של סיב14 מוארך, ואילו אלה המובנים מדנ"א גרעיני הם בעלי מראה דמוי ענן3. עם זאת, לא ידוע כיצד הנויטרופיל בוחר את מקור הדנ"א שלו. בניגוד למחקרים קודמים שתיארו את המסלולים הקנוניים של NETs ככאלה שדורשים מספר שעות, המסלול החיוני מופעל במהירות תוך 5-60 דקות15 דקות בלבד.
למרות ההתקדמות הזו, הרכב ה-NET משתנה בהתאם לגירוי; לדוגמה, זנים שונים של רירית ולא רירית של P. aeruginosa גורמים להיווצרות NETs המכילים 33 חלבונים נפוצים ועד 50 חלבונים משתנים7. לכן, יש צורך הומוגניות טכניקות המאפשרות הדור של מסקנות אובייקטיביות בקבוצות מחקר. מאמר זה מתאר פרוטוקול עם טכניקות שונות המאפשרות השוואה והערכה של הרכב, מבנה ומורפולוגיה של NETs המושרים עם מיקרואורגניזמים שונים: סטפילוקוקוס אאורוס (חיידק גראם חיובי), Pseudomonas aeruginosa (חיידק גראם שלילי) וקנדידה אלביקנס (פטרייה), כמו גם גירויים כימיים (PMA, HOCl) בנויטרופילים אנושיים מאנשים בריאים. התוצאות המייצגות מדגימות את ההטרוגניות של NETs בהתאם לגירוי הגורם שלהם בתנאים מקבילים במבחנה, המאופיינים בהכתמת DNA-DAPI, אימונוסטינינג עבור LL37 וכימות של פעילות אנזימטית (NE, CG ו- MPO).
Protocol
דגימות הדם התקבלו כתרומות ממשתתפים בריאים מבחינה קלינית לאחר הסכמה מדעת. כל הניסויים בוצעו באישור ועדת האתיקה של המחקר האנושי של הפקולטה למדעי הביוכימיה, אוניברסיטת אוטונומה 'בניטו חוארס' מאואחאקה.
הערה: קריטריוני ההכללה במחקר היו מין וגיל לא ברורים, ובריאים מבחינה קלינית על פי תשובות המשתתפים לשאלון לפני נטילת דגימת דם. ניתוח המטולוגי בוצע כדי לקבוע את ספירת התאים ולשלול זיהומים או אנמיה, כמו גם את בדיקת חלבון C-reactive כדי לשלול דלקת אצל התורם.
1. איסוף דם היקפי וקבלת חבילת אריתרוציטים ולויקוציטים
- לאסוף 10 מ"ל של דם היקפי על ידי venipuncture בצינורות עם 1.8 מ"ג / מ"ל של K2 · EDTA כנוגד קרישה (ראו טבלת חומרים) מאנשים בריאים מבחינה קלינית לאחר קבלת הסכמה מדעת. לאחר מכן, בצע ביומטריה סטנדרטית של הדם ובדיקת חלבון מגיב C כדי לשלול זיהום או דלקת, ולהבטיח את איכות הדגימה.
- צנטריפוגה דגימת הדם ההיקפית ב 82 x גרם במשך 15 דקות כדי להסיר את הפלזמה העשירה בטסיות, ולאחר מכן צנטריפוגה שנייה ב 630 x גרם במשך 5 דקות. להשליך את הפלזמה הנותרת כדי לקבל את אריתרוציטים וחבילת לויקוציטים.
- דללו אותו ביחס של 1:1 (v/v) עם תמיסת מלח (DPBS) של 1x Dulbecco.
2. טיהור נויטרופיל פולימורפונוקליארי (PMN) באמצעות גרדיאנט בצפיפות כפולה
הערה: יש לבצע טיהור נויטרופילים מיד לאחר איסוף הדם, מכיוון שאורך החיים שלהם במבחנה מוגבל של כ-8 שעות.
- הפקד את הדברים הבאים בצינור זכוכית סטרילי של 10 מ"ל (ראה טבלת חומרים) לפי הסדר: 1 מ"ל של תמיסת צפיפות של 1.098 גרם/מ"ל, 1 מ"ל של תמיסת צפיפות של 1.079 גרם/מ"ל (ראה טבלת חומרים), ולאחר מכן 4 מ"ל של אריתרוציטים מדולל וחבילת לויקוציטים. יוצקים על הקירות מבלי לשבור את מתח הפנים בין השכבות כדי למנוע מהם להתערבב.
- צנטריפוגה ב 320 x גרם במשך 20 דקות ב 4 מעלות צלזיוס, הימנעות תאוצה / האטה כך הכוחות הגבוהים של צנטריפוגה לא להפריע את השיפוע.
- שאפו את השלב המתאים לגרנולוציטים (איור 1A) על ידי פיפטציה, והעבירו לצינור זכוכית סטרילי אחר בגודל 10 מ"ל. לשטוף עם 4 מ"ל של 1x DPBS ב 300 x גרם במשך 10 דקות ב 4 מעלות צלזיוס.
- להשליך את supernatant ולטפל בתאים עם הלם אוסמוטי כדי להסיר את אריתרוציטים הנותרים. הוסף 4 מ"ל של תמיסת מלח 0.2% למשך 2 דקות ב-4 מעלות צלזיוס, וצנטריפוגה ב-300 x גרם למשך 10 דקות ב-4 מעלות צלזיוס. השליכו את הסופר-נטנט. לאחר מכן הוסיפו 4 מ"ל של התמיסה האיזוטונית (0.65% מלוחים) למשך 5 דקות ב-4 מעלות צלזיוס כדי להחזיר את שלמות הממברנה, וצנטריפוגה ב-300 x גרם למשך 10 דקות ב-4 מעלות צלזיוס.
הערה: תמיסת מלח של 0.2% היא מדיום היפוטוני, עם ריכוז מומסים נמוך יותר ביחס לזה של המדיום התוך-תאי RBC. מגע עם hypotonicmedium מאפשר למים להתפזר לתוך RBC, מה שמוביל לנפיחות שלהם המוליזה. הסרה זו של RBC מהסופרנטנט אושרה על ידי תצפית מיקרוסקופית. - הסר את הסופרנטנט. יש לתלות את התאים ב-4 מ"ל של 1x DPBS כדי להסיר פסולת תאית, ולאחר מכן צנטריפוגה ב-300 x גרם למשך 10 דקות ב-4 מעלות צלזיוס. לבסוף, החזירו את כדור התא ל-2 מ"ל של חיץ תמיסת המלח המאוזנת (HBSS) של האנק.
3. מורפולוגיה וכדאיות של נויטרופילים (איור 1B)
- מבחן אי הכללה כחול טריפאן
- יש לדלל 5 μL מתרחיף התא ב-20 μL של 0.4% טריפאן כחול (יחס של 1:5). ספרו את התאים בתא נויבאואר וקבעו את כדאיות התא באמצעות מבחן אי-הכללה. שקול את התאים השומרים על שלמות הממברנה שלהם מבלי לחדור את הצבע כמו קיימא.
- הר 5 μL של ההשעיה התא על מגלשה; יבש ומוכתם בכתם של רייט במשך 15 שניות. מיד לתקן את הדגימה עם חיץ פוספט pH 6.4 עבור 30 שניות. לשטוף עם מספיק מים מזוקקים ולבחון את המורפולוגיה תחת מיקרוסקופ אופטי (100x).
- 7AAD-צביעה וניתוח ציטומטריה של זרימה
- הוסף 1 x 105 תאים כדי להזרים צינורות ציטומטריה, ולהכתים עם 1 μL של 7AAD ב 100 μL של חיץ FACS (1x DPBS, 0.1% נתרן אזיד, ו 10% פלזמה אוטולוגית) במשך 15 דקות ב 4 °C בחושך.
- יש לשטוף עם 500 μL של מאגר FACS בגודל 300 x גרם למשך 10 דקות. לתקן את התאים עם 500 μL של 2% paraformaldehyde, ולאחסן ב 4 מעלות צלזיוס עד הניתוח שלהם ציטומטר זרימה.
- לבקרת תאים מתים, לתקן 1 x 105 תאים עם 200 μL של 4% paraformaldehyde במשך 30 דקות, ולשטוף עם 500 μL של 1x PBS ב 300 x g במשך 10 דקות ב 4 °C. יש לשלוף את הסופר-נטנט ולהשליך. לאחר מכן להוסיף 200 μL של 0.1% טריטון X-100 במשך 1 שעה ב 4 °C (60 °F). יש לכבס ב-500 מיקרו-ליטר של PBS 1x ולהכתים עם 7AAD כמו בשלב 3.2.1.
- באמצעות ציטומטר זרימה (ראה טבלת חומרים), בצע ניתוח FSC לעומת SSC כדי לנתח את טוהר התא ו- SSC לעומת צביעת 7AAD כדי לנתח את כדאיות התא. קרא 3 x 104 אירועים ב 100 μL של נפח ספיגה בזרימה בינונית (1,000 תאים / s) בהגדרות polymorphonuclear (FSC, 400-490 ו- SSC, 300-320).
- לנתח את הנתונים שנלכדו בתוכנת ציטומטר זרימה (ראה טבלת חומרים), ולקבוע את אחוז הטוהר והתאים החיוביים עבור 7AAD באוכלוסייה הפולימורפונוקליארית, המוצגים באמצעות חלקות נקודות והיסטוגרמות.
4. מכתים CFSE של מיקרואורגניזמים
- הוסף 1 x 108 חיידקים או 1 x 106 פסאודוהיפאה פטרייתית במיקרו-צינוריות של 1.5 מ"ל, והכתים עם 200 μL של 5 μM carboxyfluorescein succinimidyl ester (CFSE) מומס ב 1x PBS. מערבבים במשך כמה שניות, ודוגרים בטמפרטורה של 37 מעלות צלזיוס למשך 10 דקות בחושך.
- עצור את התגובה על ידי הוספת 500 μL של פלזמה dedelimeed, וצנטריפוגה ב 620 x g במשך 10 דקות עבור pseudohyphae או ב 1,800 x גרם עבור 10 דקות עבור חיידקים.
- השליכו את הסופרנאטנטים ושטפו את הכדורים עם 1 מ"ל של PBS 1x עם צנטריפוגה כמו בשלב 4.2. לבסוף, להשעות את המיקרואורגניזמים ב 250 μL של 1x PBS.
- הכן 50 μL aliquots במיקרו-צינוריות של 1.5 מ"ל עם 2 x 107 חיידקים (MOI: 100) או 2 x 105 pseudohyphae (MOI:1) עבור אינדוקציה NET.
5. אינדוקציה נטו
- מניחים כיסויי זכוכית סטריליים בגודל 10 מ"מ x 10 מ"מ בצלחת של 24 בארות ומכסים ב-10 μL של 0.001% פולי-L-ליזין למשך שעה אחת בטמפרטורת החדר. יש לשטוף פעמיים עם 100 μL של 1x PBS, לייבש באוויר ולהקרין אור UV למשך 15 דקות.
- החלף את תמיסת HBSS של מתלה הנויטרופילים בשלב 2.5 במדיום RPMI 1640 בתוספת 10% פלזמה אוטולוגית. לצלחת 24 הבאר (שלב 5.1), הוסף 350 μL של תרחיף תאים זה, לריכוז סופי של 2 x 105 נויטרופילים / באר.
- אפשרו לתאים להיצמד לתחתית הבארות על ידי דגירה למשך 20 דקות בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2.
- הוסף את הגירויים כדי לגרום להיווצרות NET ב-50 μL: גירויים מיקרוביאליים-גרם-חיוביים חיידק S. aureus (ATCC 25923), חיידק גראם-שלילי P. aeruginosa (ATCC 10145) ב-MOI 100, ופסאודוהיפאה של C. albicans (ATCC 10231) ב-MOI:1; גירויים ביוכימיים - PMA (200 ננומטר) ו- HOCl (4.5 מ"מ), ושליטה עם גירוי נעדר (50 μL של HBSS).
- השג נפח סופי של 400 μL לכל באר. מערבבים על שייקר צלחת ב-140 סל"ד במשך 30 שניות, ודוגרים במשך 4 שעות ב-37 מעלות צלזיוס ו-5% CO2.
6. הדמיה של NETs על ידי מיקרוסקופיה פלואורסצנטית
- דנ"א ו-LL37 אימונוסטינינג
- לאחר אינדוקציה NET, הסר את supernatants מן הבארות על ידי pipetting בזהירות, ולתקן את התאים עם 300 μL של 4% paraformaldehyde במשך 30 דקות.
- שטפו את התאים עם 200 μL של 1x PBS ללא צנטריפוגה, והוסיפו 200 μL של חיץ חוסם (10% פלזמה decomplemented ב 1x PBS) במשך 30 דקות.
- עבור כתם LL-37, יש לחדור לתאים עם 200 μL של 0.2% Triton X-100 ב-PBS אחד למשך 10 דקות כדי לאפשר לנוגדן להיכנס לתאים. יש לשטוף 2x בזהירות עם PBS אחד כדי להסיר את עודפי חומר הניקוי.
- הרכב את הכיסויים על שקופיות זכוכית (ארבעה כיסויים בכל שקופית). הדנ"א מכתים את התאים ב-2 μL של DAPI (ראו טבלת חומרים), אוטמים את הכיסויים ומאחסנים בטמפרטורה של -20 מעלות צלזיוס עד לניתוחם על ידי מיקרוסקופיה פלואורסצנטית קונפוקלית.
- רכישה וניתוח של תמונות פלואורסצנטיות
- צלם תמונות NET כדי לכמת את הרכיבים שלהן, והשתמש במסננים המתאימים במיקרוסקופ הפלואורסצנטי הקונפוקלי (ראה טבלת חומרים) כדי לרכוש את התמונות באמצעות תוכנת המחשב.
הערה: קחו בחשבון שהדנ"א מוכתם ב-DAPI (צבע כחול), מראה עירור ב-360 ננומטר ופליטה ב-460 ננומטר. מיקרואורגניזמים מוכתמים עם CFSE (צבע ירוק), אשר יש עירור של 492 ננומטר פליטה של 521 ננומטר. הפפטיד LL37 מסומן בנוגדן אנטי-LL37 Alexa Fluor 594 (צבע אדום), בעל עירור של 594 ננומטר ופליטה של 614 ננומטר. - כייל את המיקרוסקופ. מקם את ההחלקה והתמקד באמצעות ניגודיות הפרעה דיפרנציאלית (DIC) עם אור רגיל דולק. בחר שידור חי כדי להקרין את התמונה על הצג.
- כבה את האור ובחר את הערוץ המתאים לפלואורוכרום. לדוגמה, בחר מסנן 365 ננומטר/כחול עבור DAPI, 43 HE DsRed עבור Alexa 594, או 38 HE GFP עבור CFSE.
- התאם את ההגדרות עם נוגדן בקרת האיזוטיפ עבור LL37 ותאים לא מוכתמים עבור DAPI ו- CFSE. קבעו את אותן הגדרות זמן חשיפה, מתח, ניגודיות ועדשה כדי לצלם את כל התמונות באותם תנאים.
הערה: במחקר זה, זמן החשיפה, המתח והניגודיות נקבעו על 1.0 אלפיות השנייה, 4.0 V ו-0.0, בהתאמה, עם מטרה של פי 40. ניתן להתאים ערכים אלה כדי להקל על לכידת התמונה הטובה ביותר עבור הדגימות. - בחרו ' הצמד' כדי ללכוד את התמונה. שמור חמש תמונות (ארבעה קצוות והמרכז) לכל באר, ושל קולוקליזציה (מיזוג) של DNA/LL37/CFSE.
- הגדר את שלוש מחלקות הפיקסלים כרקע עם התמונות העצמאיות של כל צבע ונתח את ערך האות האפור הממוצע לכל אזור באמצעות תוכנת Image J.
- צלם תמונות NET כדי לכמת את הרכיבים שלהן, והשתמש במסננים המתאימים במיקרוסקופ הפלואורסצנטי הקונפוקלי (ראה טבלת חומרים) כדי לרכוש את התמונות באמצעות תוכנת המחשב.
7. כימות פעילות אנזימטית
- בצלחת של 96 בארות, יש להוסיף 90 μL של תרחיף תאים ב-HBSS המכיל 1 x 10 5 נויטרופילים עבור אינדוקציה NET, ולדגור במשך 20 דקות בטמפרטורה של 37 מעלות צלזיוסו-5 % CO2.
- מיד, להוסיף 10 μL של הגירויים המתאימים (ריכוז כמו בשלב 5.4) ולדגור במשך 4 שעות ב 37 מעלות צלזיוס עם 5% CO2.
- השליכו את הסופרנאטנטים ושטפו את התאים עם 100 μL של HBSS. טפל עם 1 U / mL של DNase במשך 10 דקות ב 37 °C כדי להעדיף שחרור של מבנים DNA חלבון, צנטריפוגה ב 1,800 x גרם במשך 10 דקות.
- לשחזר את supernatants ולהעריך את פעילות האנזים supernatant באמצעות תגובות colorimetric כפי שתואר קודם לכן על ידי White et al.17.
- קבע את הפעילות האנזימית המרבית של NE, CG ו- MPO בנויטרופילים באותם תנאי ניסוי מבלי להוסיף גירויים כלשהם להשראת NET. לאחר מכן, להקפיא את דגימת התא ב -70 °C (70 °F) ולהפשיר ב 37 °C באמבט מים, יצירת הלם טמפרטורה לטובת שחרור של חלבונים intracell על ידי תזה התא. צנטריפוגה ב 1,800 x גרם במשך 10 דקות ולשחזר את supernatants.
- הוסף 50 μL של supernatant לכל באר ב 96-באר, ולאחר מכן להוסיף 50 μL של כל מצע כפי שמצוין בשלב 7.7.
- הוסף 0.5 M של N-מתוקסיסוצ'יניל-Ala-Ala-Pro-Val-p-nitro aniline כמצע עבור NE, ו-1 mM של N-succinyl-Ala-Ala-Pro-Phe-p-nitroanilide עבור CG. דגירה במשך 3 שעות בטמפרטורת החדר. עבור MPO, יש להוסיף 1.6 mM של 3,3', 5,5'-טטרה-מתיל-בנזידין (TMB) ולדגור במשך 30 דקות בטמפרטורת החדר.
- לאחר הדגירה, הוסף 50 μL מתמיסת העצירה (0.5 M H2SO4) עבור MPO ומדוד את הספיגה ב-405 ננומטר עבור NE ו-CG ו-450 ננומטר עבור MPO, באמצעות ספקטרופוטומטר.
- השווה את הערכים המתקבלים עם עקומות הכיול המתאימות והצג את התוצאות של כל מצב ביחס לפעילות האנזים המרבית (100%).
8. ניתוח סטטיסטי
- נתח את נתוני המדידה במשולש עבור כל ניסוי בלתי תלוי (n = 10) ובצע ANOVA לניתוח סטטיסטי על ידי השוואת קבוצות עם רמת ביטחון של 95%.
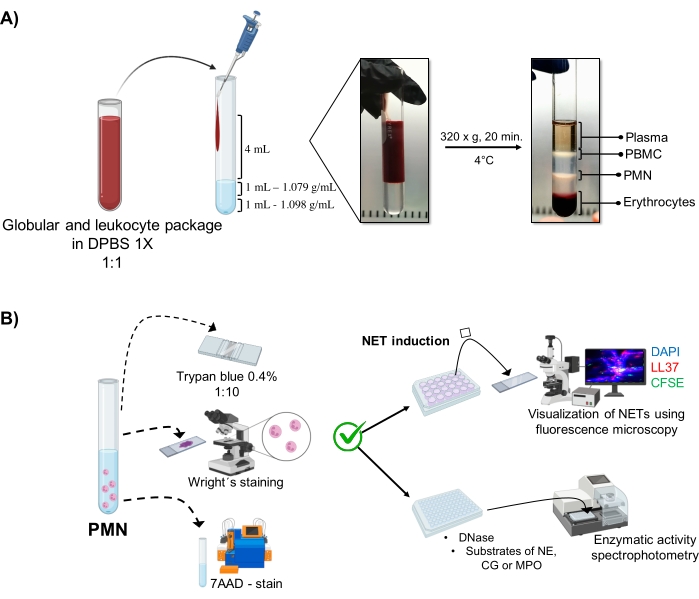
איור 1: טיהור PMN ופרוטוקול אינדוקציה NET. (A) פלזמה הוסרה מהדם ההיקפי כדי לקבל את חבילת אריתרוציטים ולויקוציטים ודוללה 1:1 (v/v) עם 1x DPBS. לאחר מכן, 4 מ"ל של הדילול נוספו לאורך הקיר לצינור השיפוע בצפיפות כפולה, וצנטריפוגה ב 320 x g במשך 20 דקות ב 4 מעלות צלזיוס, קבלת הפרדה של שכבות תאים שונות ושחזור אחד המתאים PMN. (B) התאים המטוהרים נספרו, והמורפולוגיה שלהם נותחה על ידי הכתם של רייט. הכדאיות נקבעה על ידי הרחקת טריפן כחול וצביעת 7AAD באמצעות ציטומטריה של זרימה. לאחר אימות הטוהר והכדאיות האופטימליים של נויטרופילים, היווצרות NET הושרה על ידי הוספת מיקרובים (S. aureus, P. aeruginosa ו- C. albicans) או כימיקלים (PMA, HOCl) בלוחות של 24 בארות לניתוח על ידי מיקרוסקופיה פלואורסצנטית עם DAPI-DNA, אנטי-LL37 Alexa Fluor 594, וכתמי מיקרואורגניזם-CFSE. לצורך כימות אנזימים, NETs הושרו בצלחות של 96 בארות במשך 3 שעות וטופלו ב-DNase, ולאחר מכן הוסיפו סובסטרטים לכל אנזים: NE, CG ו-MPO; שינויי צבע כומתו על ידי ספקטרופוטומטריה. DPBS = תמיסת המלח של דולבקו; PBMC = תאי דם חד-גרעיניים היקפיים; PMN = נויטרופילים פולימורפונוקליאריים; NE = נויטרופיל אלסטאז; CG = קתפסין G; MPO = מיאלופרוקסידאז; PMA = Phorbol myristate אצטט; HOCl = חומצה היפוכלורית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאות
טוהר וכדאיות של נויטרופילים
השלבים התאיים הדינמיים מוצגים בצינור מטיהור הדרגתי בצפיפות כפולה. בתוך השכבות האלה, השכבה המתאימה לגרנולוציטים נמצאת מעל שכבת הצפיפות של 1.079 גרם/מ"ל, בשונה מהשלבים של מונונוקלוציטים בדם היקפי (PBMCs) ואריתרוציטים (איור 1A). המורפולוגיה ש?...
Discussion
יש להשיג אוכלוסייה טהורה ביותר של נויטרופילים בני קיימא כדי לגרום לשחרור של NETs מכיוון שלתאים אלה יש אורך חיים מוגבל של 8 שעות בממוצע, תקופה שבה יש לבצע את כל הניסויים. לשם כך, המתודולוגיה האידיאלית היא שיפוע הצפיפות הכפולה כדי לייעל את זמן הטיהור על ידי בידוד תאים לא פעילים המגיבים יות?...
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי מענק מדע בסיסי (#285480) מ- CONACyT ועל ידי המחלקה למחקר אימונולוגיה קלינית של הפקולטה למדעים ביוכימיים, אוניברסיטת אוטונומה 'בניטו חוארס' דה אואחאקה. ל-A.A.A, S.A.S.L ו-W.J.R.R. יש מלגות דוקטורט של מספרי CONACyT #799779, #660793 ו-#827788, בהתאמה.
Materials
| Name | Company | Catalog Number | Comments |
| 24 Well plate for cell culture | Corning | 3526 | |
| 7-aminoactinomycin D (7-AAD) | BD Pharmingen | 51-668981E | |
| 96 Well plate for cell culture | Costar | 3596 | Flat bottom |
| Agitator | CRM Globe | CRM-OS1 | |
| Antibody LL37 | Santa Cruz Biotechnology | sc-166770 | |
| Blood collection tubes | BD VACUTAINER | 368171 | K2 EDTA 7.2 mg |
| Carboxyfluorescein succinimidyl ester (CFSE) | Sigma-Aldrich | 21878 | |
| Centrifuge | Hettich | 1406-01 | |
| Coverslip | Madesa | M03-CUB-22X22 | 22 mm x 22 mm |
| Dulbecco´s phosphate-buffered saline (DPBS) | Caisson | 1201022 | |
| Falcon tubes 50 mL | CORNING | 430829 | |
| Flow Cytometry Tubes | Miltenyi Biotec | 5 mL - Without caps | |
| FlowJo Software | BD Biosciences | Analyze flow cytometry data | |
| Fluorescence microscope | DM 2000 | LEICA | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057 | |
| Incubator | NUAIRE | UN-4750 | |
| MACSQuant Analyzer | Miltenyi Biotec | Flow cytometer | |
| Microplate reader photometer | Clarkson Laboratory - CL | ||
| Microtubes 1.5 mL | Zhejiang Runlab Tech | 35200N | wire snap |
| Minitab Software | Minitab | Statistical analysis | |
| Needles | BD VACUTAINER | 301746 | Diameter 1.34 mm |
| Optical microscope | VELAB | VE-B50 | |
| Percoll | GE Healthcare | 17-0891-01 | Solution for density gradient |
| Phosphate Buffered Saline (10x) | Caisson | PBL07-500ML | |
| Pyrex culture tubes | CORNING | CLS982025 | N°9820 |
| RPMI 1640 1x | Corning | 10-104-CV | contains Glutagro |
| Slides | Madesa | PDI257550 | 22 mm x 75 mm |
| Trypan Blue solution 0.4% | SIGMA | T8154-100ML |
References
- De Buhr, N., Maren, K. B. How neutrophil extracellular traps become visible. Journal of Immunology Research. 2016, 4604713 (2016).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Takei, H., Araki, A., Watanabe, H., Ichinose, A., Sendo, F. Rapid killing of human neutrophils by the potent activator phorbol 12-myristate 13-acetate (PMA) accompanied by changes different from typical apoptosis or necrosis. Journal of Leukocyte Biology. 59 (2), 229-240 (1996).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. eLife. 6, 24437 (2017).
- Schultz, B. M., Acevedo, O. A., Kalergis, A. M., Bueno, S. M. Role of extracellular trap release during bacterial and viral infection. Frontiers in Microbiology. 13, 798853 (2022).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nature Reviews Immunology. 18 (2), 134-147 (2018).
- Delgado-Rizo, V., et al. Neutrophil extracellular traps and its implications in inflammation: An overview. Frontiers in Immunology. 8, 81 (2017).
- Petretto, A., et al. Neutrophil extracellular traps (NET) induced by different stimuli: A comparative proteomic analysis. PLoS One. 14 (7), 0218946 (2019).
- Neumann, A., et al. Novel role of the antimicrobial peptide LL-37 in the protection of neutrophil extracellular traps against degradation by bacterial nucleases. Journal of Innate Immunity. 6 (6), 860-868 (2014).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Sabbatini, M., Magnelli, V., Renò, F. NETosis in wound healing: When enough Is enough. Cells. 10 (3), 494 (2021).
- Metzler, K. D., Goosmann, C., Lubojemska, A., Zychlinsky, A., Papayannopoulos, V. A myeloperoxidase-containing complex regulates neutrophil elastase release and actin dynamics during NETosis. Cell Reports. 8 (3), 883-896 (2014).
- Clark, S. R., et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nature Medicine. 13 (4), 463-469 (2007).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. Journal of Immunology. 185 (12), 7413-7425 (2010).
- Sosa, S. A., et al. Structural differences of neutrophil extracellular traps induced by biochemical and microbiologic stimuli under healthy and autoimmune milieus. Immunologic Research. 69 (3), 264-274 (2021).
- White, P. C., et al. Characterization, quantification, and visualization of neutrophil extracellular traps. Methods in Molecular Biology. 1537, 481-497 (2017).
- Boeltz, S., et al. To NET or not to NET: current opinions and state of the science regarding the formation of neutrophil extracellular traps. Cell Death and Differentiation. 26 (3), 395-408 (2019).
- Yousefi, S., Mihalache, C., Kozlowski, E., Schmid, I., Simon, H. U. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps. Cell Death and Differentiation. 16 (11), 1438-1444 (2009).
- Brinkmann, V., Zychlinsky, A. Neutrophil extracellular traps: is immunity the second function of chromatin. The Journal of Cell Biology. 198 (5), 773-783 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved