JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미생물 및 화학적 자극에 의해 유도 된 호중구 세포 외 트랩의 형태 학적 및 조성 분석
요약
여기에 제시된 것은 시험관 내 호중구 세포 외 트랩 (NET)의 유도 및 분석을위한 프로토콜입니다. DNA, 카텔리시딘(LL37) 및 효소 활성의 정량화는 유사한 통제 조건에서 미생물 및 화학적 자극에 의해 유도된 NET의 구성 및 형태의 가변성을 보여주는 데이터를 산출했습니다.
초록
호중구는 호중구 세포 외 트랩 (NET) 형성과 같은 다양한 메커니즘을 사용하여 선천성 면역 반응에서 세포 방어의 첫 번째 라인으로 기능합니다. 이 연구는 인간 세포를 사용한 NET 유도 및 특성화를 위한 표준화된 시험관 내 방법론을 사용하여 미생물 및 화학적 자극에 의해 유도된 NET의 형태학적 및 조성적 변화를 분석합니다. 여기에 설명된 절차를 통해 NET 형태(용균 또는 비용균) 및 조성(DNA-단백질 구조 및 효소 활성)을 분석하고 이러한 특성에 대한 가용성 인자 또는 세포 접촉의 영향을 분석할 수 있습니다. 부가적으로, 여기에 기술된 기술은 NET 조성물에 대한 외인성 가용성 인자 또는 세포 접촉의 효과를 평가하기 위해 변형될 수 있다.
응용 기술에는 이중 밀도 구배(1.079-1.098g/mL)를 사용하여 인간 말초 혈액에서 다형핵 세포를 정제하는 것이 포함되며, Wright의 염색, 트립판 블루 배제 및 FSC 대 SSC 분석 및 7AAD 염색을 포함한 유세포분석에서 입증된 최적의 순도와 생존력(≥ 95%)을 보장합니다. NET 형성은 미생물 (녹농균, 황색 포도상 구균 및 칸 디다 알비 칸스) 및 화학적 (포볼 미리 스테이트 아세테이트, HOCl) 자극으로 유도되며, NETs는 DNA-DAPI 염색, 항균 펩티드 카텔리시딘 (LL37)에 대한 면역 염색 및 효소 활성의 정량화 (호중구 엘라스타제, 카텝신 G 및 미엘로 퍼 옥시다제)를 특징으로합니다. 이미지는 형광 현미경을 통해 획득되고 ImageJ로 분석됩니다.
서문
호중구는 혈류에서 가장 풍부한 백혈구로, DNA와 여러 핵, 세포질 및 과립 항균 단백질로 구성된 큰 염색질 구조의 방출을 포함하여 여러 메커니즘에 의해 병원성 물질을 제거하는 동안 필수적인 역할을 합니다1,2. 호중구의 이러한 항균 역할을 설명하는 직접적인 선행은 1996 년 Takei et al.3에 의해 만들어졌습니다. 이 저자들은 호중구의 세포 사멸 및 괴사와는 다른 새로운 형태의 사망을보고했으며, 핵 파열을 나타내는 형태 학적 변화를 보인 후 핵질에서 세포질로 유출되고 포볼 미리 스테이트 아세테이트 (PMA)로 배양 3 시간에서 막 투과성이 증가했다고보고했습니다.2,3. 그러나 2004 년이 되어서야 "호중구 세포 외 트랩 (NET)"이라는 용어가 사용되었습니다4.
NET 형성은 박테리아, 곰팡이5, 바이러스6 및 기생충 감염과 같은 다양한 조건에서 미생물 전파를 중화, 사멸 및 방지하기 위해관찰되었습니다7. 다른 연구에 따르면 사이토 카인, 요산 나트륨 또는 콜레스테롤 결정,자가 항체, 면역 복합체 및 활성화 된 혈소판과 같은 멸균 자극에 의해 비 병원성 조건에서도 발생할 수 있습니다7. 지질 다당류 (LPS), 인터루킨 -8 (IL-8) 및 PMA는 NET 유도제로 기술 된 최초의 시험관 내 자극 중 하나였으며, 병원성 과정에서의 생체 내 NET 관여는 급성 염증의 두 가지 모델에서 입증되었습니다 : 실험적 이질 및 자발적인 인간 맹장염4. DNA는 필수적인 NET 구성 요소입니다. NETs 및 그살균 특성을 분해하는 간단한 데옥시리보뉴클레아제(DNase) 처리에 의해 입증된 바와 같이, 포획된 미생물을 향해 높은 국소 농도의 항균 분자를 전달함으로써 미생물의 격리 및 사멸에 적절한 구조 및 조성이 필요합니다4. DNA 외에도 NET은 히스톤, 호중구 엘라스타제(NE), 카텝신 G(CG), 프로테이나제 3, 락토페린, 젤라티나제, 미엘로퍼옥시다제(MPO) 및 양이온성 전염증성 펩타이드 카텔리시딘 LL-37과 같은 항균 펩타이드(AMP)와 같은 부착 단백질로 구성됩니다. 이러한 응집체는 직경이 최대 50 nm 인 더 큰 나사를 형성 할 수 있습니다. 이러한 요인은 미생물 독성 인자 또는 병원체 세포막의 완전성을 파괴 할 수 있습니다. 추가적으로, AMP는 박테리아 뉴클레아제(10)에 의한 분해에 대해 NET-유래 DNA를 안정화시킬 수 있다.
NET 형성을 조절하는 특정 메커니즘은 아직 완전히 명확하지 않습니다. NET 방출로 이어지는 가장 잘 특성화된 경로는 NADPH 산화효소 활성화 및 활성 산소 종(ROS) 생성뿐만 아니라 MPO 경로의 활성화를 유발하는 세포 내 칼슘 증가로 이어지는 ERK 신호 전달을 통한 것입니다. 이것은 차례로 과산화수소를 차아염소산으로 변환하여 산화11,12에 의해 NE를 활성화시킵니다. NE는 세포 골격의 액틴 필라멘트를 분해하여 식균 작용을 차단하고 과립 및 세포질 단백질과 결합하는 염색질 섬유의 탈감작을 유도하는 PAD4에 의한 단백질 분해 절단 및 탈 아미노에 의한 처리를 위해 핵으로 전위시킨 다음 세포 외로 방출됩니다7. 이들 프로테아제는 아주로필 과립 및 다른 프로테아제, 예컨대 카텝신 G13의 아주로좀 복합체로부터 방출된 것을 포함한다.
호중구의 형태 학적 변화에 따라 NET은 세포 사멸을 유도하는 자살 또는 용해성 NET 형성4과 핵 또는 미토콘드리아 DNA의 소포 방출에 의해 매개되는 생존 세포에 의해 생성 된 필수 또는 비 용해성 NET 형성의 두 가지 유형으로 분류됩니다14,15. 일반적으로, 미토콘드리아 DNA로 구성된 NET은 길쭉한 섬유14 형태를 나타내는 반면, 핵 DNA로 구성된 NET은 구름과같은 외관3을 갖는다. 그러나 호중구가 DNA 기원을 선택하는 방법은 알려져 있지 않습니다. NET의 표준 경로가 몇 시간이 필요하다고 설명한 이전 연구와 달리 중요한 경로는 단 5-60분 만에 빠르게 활성화됩니다15.
이러한 발전에도 불구하고 NET 구성은 자극에 따라 다릅니다. 예를 들어, 녹농균의 상이한 점액질 및 비 점액 균주는 33 개의 공통 단백질과 최대 50 개의 가변 단백질7을 포함하는 NET의 형성을 유도합니다. 따라서 연구 그룹에서 객관적인 결론을 도출 할 수있는 기술을 균질화해야합니다. 이 논문은 황색포도상구균(그람 양성균), 녹농균(그람 음성 박테리아), 칸디다 알비칸스(곰팡이)와 같은 다양한 미생물로 유도된 NET의 구성, 구조 및 형태를 비교하고 평가할 수 있는 다양한 기술을 사용한 프로토콜과 건강한 개인의 인간 호중구에 대한 화학적 자극(PMA, HOCl)을 설명합니다. 대표적인 결과는 DNA-DAPI 염색, LL37에 대한 면역염색 및 효소 활성(NE, CG 및 MPO)의 정량화를 특징으로 하는 유사한 시험관 내 조건에서 유도 자극에 따라 NET의 이질성을 입증합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
혈액 샘플은 정보에 입각 한 동의 후 임상 적으로 건강한 참가자로부터 기증으로 획득되었습니다. 모든 실험은 오악 사카의 Universidad Autónoma 'Benito Juárez'생화학 학부의 인간 연구 윤리위원회의 허가를 받아 수행되었습니다.
참고: 연구의 포함 기준은 성별과 연령이 불분명했으며 혈액 샘플을 채취하기 전에 설문지에 대한 참가자 응답에 따라 임상적으로 건강했습니다. 세포 수를 결정하고 감염이나 빈혈을 배제하기 위해 혈액 학적 분석과 기증자의 염증을 배제하기위한 C 반응성 단백질 검사가 수행되었습니다.
1. 말초 혈액 수집 및 적혈구 및 백혈구 패키지 획득
- 1.8 mg/mL의 K2· EDTA는 사전 동의를 얻은 후 임상적으로 건강한 개인으로부터 항응고제( 재료 표 참조)로 사용됩니다. 그런 다음 표준 혈액 생체 측정 및 C 반응성 단백질 검사를 수행하여 감염이나 염증을 배제하여 샘플의 품질을 보장합니다.
- 말초 혈액 샘플을 82 x g에서 15분 동안 원 심분리하여 혈소판이 풍부한 혈장을 제거한 다음, 630 x g에서 5분 동안 두 번째 원심분리합니다. 나머지 혈장을 버리고 적혈구 및 백혈구 패키지를 얻습니다.
- 1x Dulbecco의 인산염 완충 식염수(DPBS)로 1:1 비율(v/v)로 희석합니다.
2. 이중 밀도 구배를 이용한 다형핵 호중구(PMN) 정제
참고: 혈액이 채취된 직후 호중구 정제를 수행하는데, 이는 혈액이 약 8시간의 시험관 내 수명이 제한되어 있기 때문입니다.
- 멸균된 10mL 유리관(재료 표 참조)에 1.098g/mL 밀도 용액 1mL, 밀도 1.079g/mL 용액 1mL(재료 표 참조) 및 희석된 적혈구 및 백혈구 패키지 4mL를 순서대로 증착합니다. 층 사이의 표면 장력을 깨지 않고 벽 위에 부어 섞이지 않도록하십시오.
- 원심분리기의 높은 힘이 기울기를 방해하지 않도록 가속/감속을 피하면서 4°C에서 20분 동안 320 x g 로 원심분리합니다.
- 과립구에 해당하는 상(그림 1A)을 피펫팅으로 흡인하고 다른 멸균 10mL 유리관으로 옮깁니다. 4 mL의 1x DPBS를 300 x g 로 4°C에서 10분 동안 세척합니다.
- 상청액을 버리고 세포를 삼투압 쇼크로 처리하여 나머지 적혈구를 제거합니다. 4 mL의 0.2 % 식염수를 4 °C에서 2 분 동안 첨가하고, 4 °C에서 10 분 동안 300 x g 에서 원심 분리한다. 상청액을 폐기하십시오. 그런 다음 막 무결성을 복원하기 위해 4 ° C에서 5 분 동안 등장 용액 (0.65 % 식염수) 4mL를 추가하고 4 ° C에서 10 분 동안 300 x g 에서 원심 분리합니다.
참고: 0.2% 식염수는 저장성 배지이며 RBC 세포 내 배지에 비해 용질 농도가 낮습니다. 저장성 배지와 접촉하면 물이 적혈구로 확산되어 부종과 용혈이 발생합니다. 이를 상청액으로부터 RBC의 제거는 현미경 관찰에 의해 확인하였다. - 상청액을 제거하십시오. 세포를 4mL의 1x DPBS에 재현탁하여 세포 파편을 제거한 다음 300 x g 에서 4°C에서 10분 동안 원심분리합니다. 마지막으로 콜드 행크 균형 염 용액(HBSS) 버퍼 2mL에 세포 펠릿을 재현탁합니다.
3. 호중구 형태 및 생존력 (그림 1B)
- 트리판 블루 배제 테스트
- 5 μL의 세포 현탁액을 20 μL의 0.4% 트리판 블루(1:5 비율)로 희석한다. Neubauer 챔버에서 세포를 계수하고 배제 테스트를 사용하여 세포 생존율을 결정합니다. 염료를 생존 가능한 것으로 투과시키지 않고 막의 무결성을 유지하는 세포를 고려하십시오.
- 5 μL의 세포 현탁액을 슬라이드에 장착하고; 15 초 동안 Wright의 얼룩으로 건조하고 얼룩지게하십시오. 즉시 인산염 완충액 pH 6.4로 샘플을 30초 동안 고정합니다. 충분한 증류수로 세척하고 광학 현미경(×100)으로 형태를 관찰합니다.
- 7AAD 염색 및 유세포 분석
- 1 x 105 세포를 유세포 분석 튜브에 추가하고 100 μL의 FACS 완충액 (1x DPBS, 0.1 % 나트륨 아 지드 및 10 %자가 탈보 혈장)에 1 μL의 7AAD로 염색하여 어두운 곳에서 4 ° C에서 15 분 동안 염색합니다.
- 300 x g 에서 500 μL의 FACS 버퍼로 10 분 동안 세척하십시오. 세포를 500 μL의 2% 파라포름알데히드로 고정하고, 이들이 분석될 때까지 4°C에서 유세포분석기에 보관한다.
- 죽은 세포 대조군의 경우, 200μL의 4% 파라포름알데히드로 1 x 105 세포를 30분 동안 고정하고, 4°C에서 10분 동안 300 x g 에서 1x PBS 500μL로 세척한다. 상청액을 꺼내 버립니다. 그런 다음 200 μL의 0.1% 트리톤 X-100을 4°C에서 1시간 동안 첨가합니다. 500μL의 1x PBS로 세척하고 3.2.1단계에서와 같이 7AAD로 염색합니다.
- 유세포분석기( 재료 표 참조)를 사용하여 FSC 대 SSC 분석을 수행하여 세포 순도를 분석하고 SSC 대 7AAD 염색을 수행하여 세포 생존율을 분석합니다. 다형핵 설정(FSC, 400-490 및 SSC, 300-320)에서 배지 유량(1,000 cells/s)에서 100μL의 흡수량으로 3 x 104 이벤트를 읽습니다.
- 유세포분석기 소프트웨어( 재료 표 참조)에서 캡처된 데이터를 분석하고 점도 및 히스토그램을 통해 제시된 다형핵 집단에서 7AAD에 대한 순도 및 양성 세포의 백분율을 결정합니다.
4. 미생물의 CFSE 염색
- 1.5mL 마이크로튜브에 1 x 108 박테리아 또는 1 x 106 진균 유사균사를 추가하고 1x PBS에 용해된 5μM 카르복시플루오레세인 숙신이미딜 에스테르(CFSE) 200μL로 염색합니다. 몇 초 동안 혼합하고, 암실에서 10분 동안 37°C에서 배양한다.
- 500μL의 디보워드된 혈장을 추가하여 반응을 중지하고, 유사 균사의 경우 620 x g에서 10 분 동안 또는 박테리아의 경우 1,800 x g에서 10분 동안 원심분리합니다.
- 상청액을 버리고 단계 4.2에서와 같이 원심분리를 통해 1x PBS 1mL로 펠릿을 세척합니다. 마지막으로, 미생물을 250 μL의 1x PBS에 재현탁시킨다.
- NET 유도를 위해 2 x 107 박테리아(MOI: 100) 또는 2 x 105 유사 균사(MOI:1)가 있는 1.5mL의 마이크로튜브에 50μL 분취량을 준비합니다.
5. 그물 유도
- 10mm x 10mm 멸균 유리 커버슬립을 24웰 플레이트에 넣고 실온에서 1시간 동안 0.001% 폴리-L-라이신 10μL로 덮습니다. 100μL의 1x PBS로 두 번 세척하고 자연 건조시킨 다음 15분 동안 자외선을 조사합니다.
- 단계 2.5에서 호중구 현탁액의 HBSS 용액을 10% 자가 혈장이 보충된 RPMI 1640 배지로 대체한다. 24-웰 플레이트(단계 5.1)에, 최종 농도 2 x 105 호중구/웰에 대해 이 세포 현탁액 350 μL를 첨가한다.
- 세포가 5%CO2와 함께 37°C에서 20분 동안 인큐베이션함으로써 웰의 바닥에 부착되도록 한다.
- 50 μL에서 NET 형성을 유도하기 위해 자극을 추가합니다 : 미생물 자극 - 그람 양성 박테리아 S. 아우 레 우스 (ATCC 25923), MOI 100에서 그람 음성 박테리아 P. 녹농 균 (ATCC 10145) 및 MOI : 1에서 C. 알비 칸스 (ATCC 10231)의 의사 균사; 생화학적 자극-PMA (200 nM) 및 HOCl (4.5 mM), 및 자극이 없는 대조군 (50 μL의 HBSS).
- 웰당 400μL의 최종 부피를 얻습니다. 플레이트 쉐이커 상에서 140 rpm에서 30 초 동안 혼합하고, 37°C 및 5%CO2에서 4 h 동안 인큐베이션한다.
6. 형광 현미경에 의한 NET의 시각화
- DNA 및 LL37 면역염색
- NET 유도 후, 조심스럽게 피펫팅하여 웰에서 상청액을 제거하고, 세포를 300μL의 4% 파라포름알데히드로 30분 동안 고정한다.
- 원심분리 없이 200μL의 1x PBS로 세포를 세척하고, 200μL의 차단 완충액(1x PBS에서 10% 탈보체된 혈장)을 30분 동안 추가합니다.
- LL-37 염색의 경우, 항체가 세포에 들어갈 수 있도록 1x PBS에서 10분 동안 0.2% 트리톤 X-100 200μL로 세포를 투과화합니다. 여분의 세제를 제거하기 위해 2x PBS로 1x 조심스럽게 씻으십시오.
- 커버 슬립을 유리 슬라이드에 장착합니다(각 슬라이드에 4개의 커버슬립). DNA는 2 μL의 DAPI( 재료 표 참조)로 세포를 염색하고, 커버슬립을 밀봉하고, 컨포칼 형광 현미경으로 분석할 때까지 -20°C에서 보관합니다.
- 형광 이미지의 획득 및 분석
- NET 이미지를 가져와 구성 요소를 정량화하고 컨포칼 형광 현미경( 재료 표 참조)에서 해당 필터를 사용하여 컴퓨터 소프트웨어로 이미지를 획득합니다.
참고: DNA가 DAPI(파란색)로 염색되어 360nm에서 여기를, 460nm에서 방출을 나타낸다고 가정합니다. 미생물은 492nm의 여기와 521nm의 방출을 갖는 CFSE (녹색)로 염색됩니다. LL37 펩타이드는 항 -LL37 Alexa Fluor 594 항체 (붉은 색)로 표지되어 있으며, 여기는 594nm이고 방출은 614nm입니다. - 현미경을 보정합니다. 슬라이드를 놓고 일반 조명이 켜진 상태에서 DIC(미분 간섭 대비)를 사용하여 초점을 맞춥니다. Live(라이브 )를 선택하여 모니터에 이미지를 투사합니다.
- 조명을 끄고 형광 색소 해당 채널을 선택하십시오. 예를 들어 DAPI의 경우 필터 365nm/파란색, Alexa 594의 경우 43 HE DsRed 또는 CFSE의 경우 38 HE GFP 필터를 선택합니다.
- LL37에 대한 이소형 제어 항체와 DAPI 및 CFSE에 대한 염색되지 않은 세포로 설정을 조정합니다. 동일한 노출 시간, 전압, 대비 및 렌즈 설정을 지정하여 동일한 조건에서 모든 이미지를 캡처합니다.
참고: 이 연구에서는 노출 시간, 전압 및 대비를 1.0x 대물렌즈로 각각 4.0ms, 0.0V 및 40으로 설정했습니다. 이러한 값은 샘플에 대한 최상의 이미지 캡처를 용이하게 하기 위해 조정될 수 있습니다. - 스냅을 선택하여 이미지를 캡처합니다. 웰당 5개의 이미지(4개의 극단 및 중앙)와 DNA/LL37/CFSE의 공동 국소화(병합)를 저장합니다.
- 세 가지 픽셀 클래스를 각 색상의 독립적인 이미지로 배경으로 정의하고 Image J 소프트웨어로 면적당 평균 회색 신호 값을 분석합니다.
- NET 이미지를 가져와 구성 요소를 정량화하고 컨포칼 형광 현미경( 재료 표 참조)에서 해당 필터를 사용하여 컴퓨터 소프트웨어로 이미지를 획득합니다.
7. 효소 활성 정량화
- 96-웰 플레이트에서, NET 유도를 위해 1 x 10 5 호중구를 함유하는 HBSS 중 90 μL의 세포 현탁액을 추가하고, 37°C 및5 %CO2에서 20분 동안 인큐베이션한다.
- 즉시, 상응하는 자극 (단계 5.4에서와 같은 농도) 10 μL를 첨가하고, 5%CO2로 37°C에서 4시간 동안 인큐베이션한다.
- 상청액을 버리고 100 μL의 HBSS로 세포를 세척한다. DNA-단백질 구조의 방출을 위해 37°C에서 10분 동안 1U/mL의 DNase로 처리하고 1,800 x g 에서 10분 동안 원심분리합니다.
- 상청액을 회수하고, White et al.17에 의해 이전에 기술된 바와 같이 비색 반응을 사용하여 상청액에서의 효소 활성을 평가한다.
- NET 유도를 위한 자극을 추가하지 않고 동일한 실험 조건에서 호중구에서 NE, CG 및 MPO의 최대 효소 활성을 결정합니다. 이어서, 세포 샘플을 -70°C에서 동결시키고 수조에서 37°C에서 해동하여, 온도 충격을 발생시켜 세포 용해에 의한 세포내 단백질의 방출을 유리하게 한다. 1,800 x g 에서 10분 동안 원심분리하고 상청액을 회수한다.
- 96웰 플레이트의 각 웰에 50μL의 상청액을 추가한 다음, 단계 7.7에 표시된 대로 각 기질 50μL를 추가합니다.
- NE에 대한 기질로서 0.5m의 N-메톡시숙시닐-알라-알라-프로-발-p-니트로 아닐린을 첨가하고, CG에 대해 1mM의 N-숙시닐-알라-알라-프로-페-p-니트로아닐리드를 첨가한다. 실온에서 3 시간 동안 배양하십시오. MPO의 경우 1.6mM의 3,3',5,5'-테트라메틸벤지딘(TMB)을 추가하고 실온에서 30분 동안 배양합니다.
- 인큐베이션 후, MPO에 대한 정지 용액 (0.5 MH2SO4) 50 μL를 첨가하고, 분광 광도계를 사용하여 NE 및 CG의 경우 405 nm, MPO의 경우 450 nm에서 흡광도를 측정하였다.
- 얻은 값을 해당 검량선과 비교하고 최대 효소 활성(100%)을 기준으로 각 조건의 결과를 표시합니다.
8. 통계 분석
- 각 독립 실험(n=10)에 대해 측정 데이터를 삼중으로 분석하고 95% 신뢰 수준으로 그룹을 비교하여 통계 분석을 위한 분산 분석을 수행합니다.
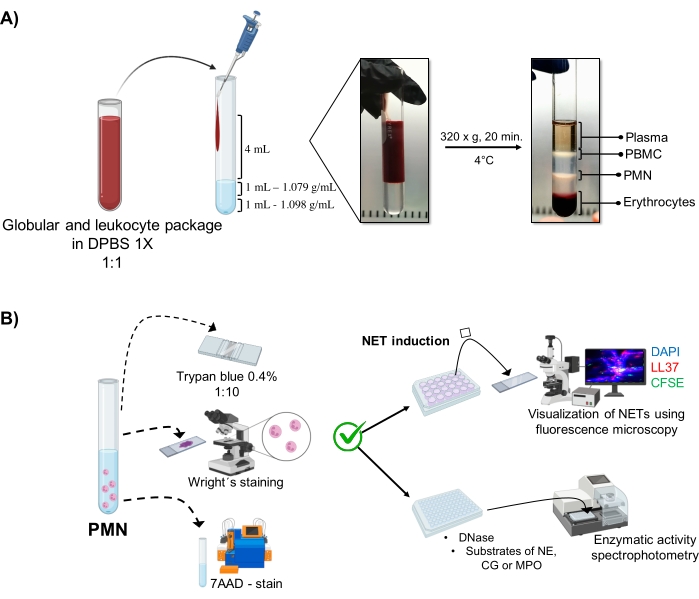
그림 1: PMN 정제 및 NET 유도 프로토콜. (A) 혈장을 말초 혈액에서 제거하여 적혈구 및 백혈구 패키지를 얻고 1x DPBS로 1:1(v/v)로 희석했습니다. 이어서, 희석액 4 mL를 벽을 따라 이중 밀도 구배 튜브에 첨가하고, 4°C에서 20분 동안 320 x g에서 원심분리하여, 상이한 세포층의 분리를 얻고, PMN에 상응하는 것을 회수하였다. (B) 정제된 세포를 계수하고, 그들의 형태를 라이트의 염색에 의해 분석하였다. 생존율은 트리판 블루 배제 및 유동 세포분석을 사용한 7AAD 염색에 의해 결정하였다. 최적의 호중구 순도와 생존력이 확인되면 DAPI-DNA, 항-LL37 Alexa Fluor 594 및 미생물-CFSE 염색을 사용한 형광 현미경으로 분석하기 위해 24웰 플레이트에 미생물(S. 아우레우스, P. 녹농균 및 C. 알비칸스) 또는 화학물질(PMA, HOCl)을 추가하여 NET 형성을 유도했습니다. 효소 정량화를 위해 NET을 96웰 플레이트에서 3시간 동안 유도하고 DNase로 처리한 후 각 효소에 대한 기질인 NE, CG 및 MPO를 첨가했습니다. 색 변화는 분광 광도법에 의해 정량화되었다. DPBS = 둘베코 인산완충식염수; PBMC = 말초 혈액 단핵 세포; PMN = 다형핵 호중구; NE = 호중구 엘라스타제; CG = 카텝신 G; MPO = 미엘로퍼옥시다아제; PMA = 포볼 미리스테이트 아세테이트; HOCl = 하이포아염소산. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
호중구의 순도와 생존력
동적 세포 단계는 이중 밀도 그래디언트 정제에서 튜브에서 시각화됩니다. 이 층 내에서 과립구에 해당하는 층은 말초 혈액 단핵구(PBMC) 및 적혈구의 위상과 구별되는 1.079g/mL 밀도 층 위에 있습니다(그림 1A). 정제된 세포의 형태는 성숙한 호중구에 해당하는 실 모양의 필라멘트로 연결된 분절된 핵을 가진 세포를 관찰함으로써 Wright의 ...
Access restricted. Please log in or start a trial to view this content.
토론
NET의 방출을 유도하기 위해서는 매우 순수한 생존 가능한 호중구 집단을 얻어야 하는데, 이는 이러한 세포가 모든 실험을 수행해야 하는 기간인 평균 8시간의 제한된 생체외 수명을 갖기 때문입니다. 이를 위해, 이상적인 방법론은 Ficoll-Histopaque 구배 또는 덱스트란 침강 기술(17)과 대조적으로, 외인성 자극에 더 반응하는 비활성화된 세포를 단리함으로써 정제 시간을 최적...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
이 연구는 CONACyT의 기초 과학 보조금 (# 285480)과 오악 사카 대학교 생화학 과학 학부의 임상 면역학 연구과, Universidad Autónoma 'Benito Juárez'de Oaxaca의 지원을 받았습니다. A.A.A, S.A.S.L 및 W.J.R.R.은 각각 CONACyT 번호 #799779, #660793 및 #827788의 박사 펠로우십을 보유하고 있습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 24 Well plate for cell culture | Corning | 3526 | |
| 7-aminoactinomycin D (7-AAD) | BD Pharmingen | 51-668981E | |
| 96 Well plate for cell culture | Costar | 3596 | Flat bottom |
| Agitator | CRM Globe | CRM-OS1 | |
| Antibody LL37 | Santa Cruz Biotechnology | sc-166770 | |
| Blood collection tubes | BD VACUTAINER | 368171 | K2 EDTA 7.2 mg |
| Carboxyfluorescein succinimidyl ester (CFSE) | Sigma-Aldrich | 21878 | |
| Centrifuge | Hettich | 1406-01 | |
| Coverslip | Madesa | M03-CUB-22X22 | 22 mm x 22 mm |
| Dulbecco´s phosphate-buffered saline (DPBS) | Caisson | 1201022 | |
| Falcon tubes 50 mL | CORNING | 430829 | |
| Flow Cytometry Tubes | Miltenyi Biotec | 5 mL - Without caps | |
| FlowJo Software | BD Biosciences | Analyze flow cytometry data | |
| Fluorescence microscope | DM 2000 | LEICA | |
| Fluoroshield with DAPI | Sigma-Aldrich | F6057 | |
| Incubator | NUAIRE | UN-4750 | |
| MACSQuant Analyzer | Miltenyi Biotec | Flow cytometer | |
| Microplate reader photometer | Clarkson Laboratory - CL | ||
| Microtubes 1.5 mL | Zhejiang Runlab Tech | 35200N | wire snap |
| Minitab Software | Minitab | Statistical analysis | |
| Needles | BD VACUTAINER | 301746 | Diameter 1.34 mm |
| Optical microscope | VELAB | VE-B50 | |
| Percoll | GE Healthcare | 17-0891-01 | Solution for density gradient |
| Phosphate Buffered Saline (10x) | Caisson | PBL07-500ML | |
| Pyrex culture tubes | CORNING | CLS982025 | N°9820 |
| RPMI 1640 1x | Corning | 10-104-CV | contains Glutagro |
| Slides | Madesa | PDI257550 | 22 mm x 75 mm |
| Trypan Blue solution 0.4% | SIGMA | T8154-100ML |
참고문헌
- De Buhr, N., Maren, K. B. How neutrophil extracellular traps become visible. Journal of Immunology Research. 2016, 4604713(2016).
- Karlsson, A., Nixon, J. B., McPhail, L. C. Phorbol myristate acetate induces neutrophil NADPH-oxidase activity by two separate signal transduction pathways: dependent or independent of phosphatidylinositol 3-kinase. Journal of Leukocyte Biology. 67 (3), 396-404 (2000).
- Takei, H., Araki, A., Watanabe, H., Ichinose, A., Sendo, F. Rapid killing of human neutrophils by the potent activator phorbol 12-myristate 13-acetate (PMA) accompanied by changes different from typical apoptosis or necrosis. Journal of Leukocyte Biology. 59 (2), 229-240 (1996).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. eLife. 6, 24437(2017).
- Schultz, B. M., Acevedo, O. A., Kalergis, A. M., Bueno, S. M. Role of extracellular trap release during bacterial and viral infection. Frontiers in Microbiology. 13, 798853(2022).
- Papayannopoulos, V. Neutrophil extracellular traps in immunity and disease. Nature Reviews Immunology. 18 (2), 134-147 (2018).
- Delgado-Rizo, V., et al. Neutrophil extracellular traps and its implications in inflammation: An overview. Frontiers in Immunology. 8, 81(2017).
- Petretto, A., et al. Neutrophil extracellular traps (NET) induced by different stimuli: A comparative proteomic analysis. PLoS One. 14 (7), 0218946(2019).
- Neumann, A., et al. Novel role of the antimicrobial peptide LL-37 in the protection of neutrophil extracellular traps against degradation by bacterial nucleases. Journal of Innate Immunity. 6 (6), 860-868 (2014).
- Hakkim, A., et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation. Nature Chemical Biology. 7 (2), 75-77 (2011).
- Sabbatini, M., Magnelli, V., Renò, F. NETosis in wound healing: When enough Is enough. Cells. 10 (3), 494(2021).
- Metzler, K. D., Goosmann, C., Lubojemska, A., Zychlinsky, A., Papayannopoulos, V. A myeloperoxidase-containing complex regulates neutrophil elastase release and actin dynamics during NETosis. Cell Reports. 8 (3), 883-896 (2014).
- Clark, S. R., et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nature Medicine. 13 (4), 463-469 (2007).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. Journal of Immunology. 185 (12), 7413-7425 (2010).
- Sosa, S. A., et al. Structural differences of neutrophil extracellular traps induced by biochemical and microbiologic stimuli under healthy and autoimmune milieus. Immunologic Research. 69 (3), 264-274 (2021).
- White, P. C., et al. Characterization, quantification, and visualization of neutrophil extracellular traps. Methods in Molecular Biology. 1537, 481-497 (2017).
- Boeltz, S., et al. To NET or not to NET: current opinions and state of the science regarding the formation of neutrophil extracellular traps. Cell Death and Differentiation. 26 (3), 395-408 (2019).
- Yousefi, S., Mihalache, C., Kozlowski, E., Schmid, I., Simon, H. U. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps. Cell Death and Differentiation. 16 (11), 1438-1444 (2009).
- Brinkmann, V., Zychlinsky, A. Neutrophil extracellular traps: is immunity the second function of chromatin. The Journal of Cell Biology. 198 (5), 773-783 (2012).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유