Method Article
人诱导多能干细胞分化为具有成熟免疫表型的脑微血管内皮细胞样细胞
摘要
在这里,我们描述了一种协议,即扩展内皮细胞培养方法(EECM),该方法允许多能干细胞分化为脑微血管内皮细胞(BMEC)样细胞。这些细胞表现出内皮细胞粘附分子表达,因此是适合在体外研究免疫细胞相互作用的人血脑屏障模型。
摘要
血脑屏障(BBB)功能障碍是影响中枢神经系统(CNS)的许多神经退行性和神经炎症性疾病的病理标志。由于获得与疾病相关的BBB样本的机会有限,BBB功能障碍是否是疾病发展的病因,还是神经炎症或神经退行性过程的结果,仍然没有得到很好的理解。因此,人类诱导多能干细胞(hiPSCs)为建立来自健康供体和患者的体 外 BBB模型提供了新的机会,从而研究个体患者的疾病特异性BBB特征。已经建立了几种分化方案,用于从hiPSC衍生脑微血管内皮细胞(BMEC)样细胞。对于正确选择相应的BMEC分化方案,必须考虑特定的研究问题。在这里,我们描述了扩展内皮细胞培养方法(EECM),该方法经过优化以将hiPSC分化为具有成熟免疫表型的BMEC样细胞,从而可以研究免疫细胞 - BBB相互作用。在该协议中,hiPSCs首先通过激活Wnt/β-连环蛋白信号分化为内皮祖细胞(EPC)。然后将含有平滑肌样细胞(SMLC)的培养物依次传代以提高内皮细胞(ECs)的纯度并诱导BBB特异性特性。EECM-BMEC与这些SMLC或来自SMLC的条件培养基共培养允许EC粘附分子的可重复,组成和细胞因子调节表达。重要的是,EECM-BMEC样细胞建立了与原代人BMEC相当的屏障特性,并且由于它们表达所有EC粘附分子,EECM-BMEC样细胞与其他hiPSC衍生 的体外 BBB模型不同。因此,EECM-BMEC样细胞是研究BBB水平疾病过程潜在影响的首选模型,以个性化方式影响免疫细胞相互作用。
引言
中枢神经系统 (CNS) 中的神经血管单位 (NVU) 由高度特化的微血管内皮细胞 (EC)、嵌入内皮基底膜的周细胞以及实质基底膜和星形胶质细胞末端足1 组成。在NVU中,脑微血管内皮细胞(BMEC)是形成血脑屏障(BBB)的关键组成部分。与外周器官中的微血管EC相比,BMEC形成复杂且连续的紧密连接,并且具有极低的胞内活性,这使得BBB能够抑制水溶性分子自由细胞旁扩散到CNS。BMEC对特定流入转运蛋白和外排泵的表达确保了分别从CNS2摄取和输出营养物质和有害分子。此外,BBB通过表达对免疫细胞转运到CNS3至关重要的低水平内皮粘附分子来严格控制免疫细胞进入CNS。在生理条件下,BMEC表面粘附分子的表达水平较低,如细胞间粘附分子-1(ICAM-1)和血管细胞粘附分子-1(VCAM-1),但这些水平在某些神经系统疾病中增加2。BBB的形态和功能分解见于许多神经系统疾病,例如中风4,多发性硬化症(MS)5和几种神经退行性疾病6,7,8。在生理和病理条件下详细研究BMEC的细胞和分子特征是确定靶向BBB的新型治疗策略的一种方法。
直到最近,初级或永生的人类和啮齿动物BMEC被用来研究BBB。然而,基于BBB动物模型的结论是否容易适用于人类BBB尚不清楚,因为几种重要分子(包括粘附分子和溶质载体蛋白)的表达在人类和啮齿动物之间有所不同9,10。尽管像hCMEC/D3这样的人类BMEC系表达适当水平的粘附分子11,但这些永生化的BMEC通常没有复杂的紧密连接和强大的阻隔特性12。初级人类BMEC可用于研究屏障功能13,但并非所有研究人员都可以获得。此外,患者的原发性BMEC可能难以获得,因为它们必须通过仅在特定临床条件下进行的脑活检或手术来收集。
干细胞技术的最新进展允许分化各种人类细胞类型,这些细胞来自人类诱导多能干细胞(hiPSC)等干细胞来源。hiPSC衍生的模型使我们能够使用患者来源的样本建立病理生理模型。可以将几种hiPSC来源的细胞类型组合在一起,以建立更好地模拟生理条件的自体共培养物或类器官。几种广泛使用的方案 14,15,16,17,18,19 可用于区分 hiPSC 衍生的 BMEC 样细胞,这些细胞具有强大的扩散屏障特性,具有 BBB 特异性转运蛋白和外排泵的表达,并且可用于研究小分子的细胞旁扩散、分子转运机制和药物输送到大脑 20,21.然而,先前的研究表明,广泛使用的hiPSC衍生的BMEC样细胞缺乏关键内皮粘附分子的表达,包括VCAM-1,选择素和ICAM-2,它们负责介导免疫细胞与BBB22之间的相互作用。此外,据报道,先前的hiPSC衍生的BMEC在转录水平上显示出混合的内皮和上皮特征23。因此,我们开发了扩展内皮细胞培养方法(EECM),这是一种新颖的方案,允许将hiPSC分化为BMEC样细胞,这些细胞在形态,屏障特征和内皮粘附分子表达方面类似于原代人BMEC。该协议描述了将hiPSCs区分为显示成熟免疫表型的BMEC样细胞的详细方法学程序。
研究方案
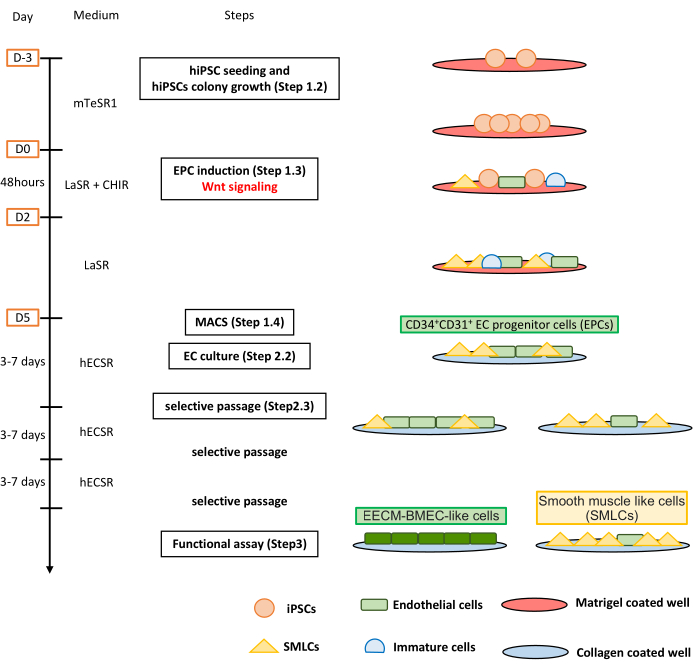
图 1:协议概述。 该手稿介绍了将hiPSC分化为EECM-BMEC样细胞的分步方案。正确的方案描述了每一步的细胞群。 请点击此处查看此图的大图。
hiPSC系HPS1006由RIKEN BRC通过日本MEXT/AMED的国家生物资源项目提供。
1. 诱导hiPSC分化为内皮祖细胞(EPC)
- 细胞外基质(ECM)包被的板和试剂
- 通过将 2.5 mg 基质凝胶等分到 50 mL 离心管中以在 -20 °C 下储存长达 6 个月来制备基底膜基质包被的 12 孔板。将 30 mL 冷 Dulbecco 的改良 Eagle 培养基/营养混合物 F-12 (DMEM/F12) 加入管中,该混合物已保存在冰箱 (4 °C) 中。通过移液轻轻混合直至凝胶解冻,然后将 500 μL 溶液添加到 12 孔板的每个孔中。将板置于培养箱(37°C,5%CO2)中至少1小时。
注意:基底膜基质凝胶对温度敏感,应按照制造商的等分试样和板包衣说明进行处理。细胞外基质蛋白的浓度可以在批次之间变化。为确保准确性,应在质量证书表上使用批号参考特定批次的确切浓度。例如,如果确切浓度为 10.0 mg/mL,则使用 250 μL 凝胶,总共 2.5 mg。 - 通过将ROCK抑制剂溶解在无菌水中至10mM的浓度来制备rho激酶(ROCK)抑制剂储备溶液(表1)。将储备溶液分装在 100-200 μL 体积中,并储存在 -20 °C 以避免冻融循环。
- 通过将5gL-抗坏血酸溶解在50mL无菌水中并储存在-20°C,制备100mg / mL的L-抗坏血酸储备溶液(表1)。将 6.25 mL 谷氨酰胺和 305 μL L-抗坏血酸储备溶液加入 500 mL 高级 DMEM/F12 中,制成LaSR 培养基 24 (表 1)。在2-8°C下储存长达2周。
- 通过将CHIR99021溶解在未稀释的二甲基亚砜(DMSO)中至终浓度为10mM来制备CHIR99021溶液(表1)。将溶液等分到 100-200 μL 体积中以避免冻融循环,并在 -20 °C 下储存长达 1 年。将储备溶液的工作等分试样在4°C下储存长达1个月。
- 通过将 50 mL 热灭活胎牛血清加入 450 mL DMEM/F12 来制备 DMEM/F12-10 培养基。将培养基在2-8°C下储存长达1个月(表1)。
- 通过将 33.3 mL 的 7.5% 牛血清白蛋白 (BSA) 添加到 467 mL Dulbecco 的磷酸盐缓冲盐水 (PBS) 中来制备流动缓冲液-1(表 1)。在2-8°C下储存长达6个月。
- 通过将 2.5 mg 基质凝胶等分到 50 mL 离心管中以在 -20 °C 下储存长达 6 个月来制备基底膜基质包被的 12 孔板。将 30 mL 冷 Dulbecco 的改良 Eagle 培养基/营养混合物 F-12 (DMEM/F12) 加入管中,该混合物已保存在冰箱 (4 °C) 中。通过移液轻轻混合直至凝胶解冻,然后将 500 μL 溶液添加到 12 孔板的每个孔中。将板置于培养箱(37°C,5%CO2)中至少1小时。
- 接种单一化的hiPSCs并扩增EPC分化(第-3天至第-1天)
- 当 6 孔板中的 hiPSC 集落未显示自发分化且具有适当的传代密度(通常约为 80% 汇合度(2.5-3.5 x 106 细胞 )时,开始分化。在显微镜下仔细监测自发分化的细胞,以确保是否需要多次传代来消除未分化的细胞。有关细胞培养基和细胞外基质的信息,请参阅步骤1.4.15下面提供的注释。
- 吸出培养基并向孔中加入1mL解离试剂,并在37°C下孵育5-7分钟。 通过将解离试剂溶液轻轻移液在孔表面上两到三次来解离和奇异化细胞。
- 将分离的细胞转移到含有 4 mL hiPSC 维持培养基的 15 mL 管中,并彻底重悬细胞。保留 10 μL 等分试样用于细胞计数。
- 通过在20-25°C下以200× g 离心5分钟来沉淀细胞。 计数细胞并计算所需体积,以在基底膜基质包被的12孔板中达到适当的hiPSC密度(每孔75-400 x 103 )(步骤1.1.1)。
- 从孔中吸出涂层溶液,并向每个孔中加入 1 mL 含有 10 μM ROCK 抑制剂的 hiPSC 培养基(1:1,000 稀释)。离心后,吸出上清液并将沉淀解离在 1 mL hiPSC 培养基中。
- 将步骤1.2.4中测定的所需体积的hiPSC添加到12孔板的每个孔中。两到四个 12 孔板可能足以区分 hiPSC 克隆。请参阅步骤1.2.4以确定接种细胞所需的板数。
- 将板放入培养箱(37°C,5%CO2)中。通过在培养箱中轻轻地来回滑动板,然后左右滑动细胞,均匀分布细胞。
- 第二天(即第 -2 天),用 2 mL 缺乏 ROCK 抑制剂的 hiPSC 维持培养基交换培养基。第二天(第 -1 天),用 2 mL 新鲜 hiPSC 维持培养基交换培养基。
- 用糖原合酶激酶 3 (GSK-3) 抑制剂 CHIR99021 诱导 EPC(第 0 天至第 5 天)
- 在第 0 天,用含有 8 μM CHIR99021 的 2 mL LaSR 培养基替换每个孔中的 hiPSC 维持培养基。
- 在第 1 天,吸出培养基并加入 2 mL 含有 8 μM CHIR99021 的新鲜 LaSR 培养基。
- 在第 2、3 和 4 天,用 2 mL 缺乏 CHIR99021 的新鲜 LaSR 培养基替换培养基。
- 磁性活化细胞分选 (MACS) 纯化 CD31+ 工程总承包(第5天)
- 在第5天,吸出培养基,然后向每个孔中加入1mL解离试剂,然后在37°C孵育6-8分钟。
- 用微量移液器解离并奇异化细胞,并通过 40 μm 细胞过滤器,将悬浮液过滤到含有 10 mL DMEM/F12-10 培养基的 50 mL 管中。将从两个以上的 12 孔板收集的细胞悬液过滤到至少两个 50 mL 管中。
- 通过添加 DMEM/F12-10 培养基(最多 50 mL)来停止消化反应。彻底移液并保留 10 μL 用于细胞计数。通过在20-25°C下以200× g 离心5分钟来沉淀细胞。
- 除去上清液后,加入 10 mL DMEM/F12-10 培养基,并将细胞悬液转移到新鲜的 15 mL 管中。通过在20-25°C下以200× g 离心5分钟来沉淀细胞。
- 吸出上清液并以每 100 μL 缓冲液 1.0 x 10 7个细胞的 密度重悬到流动缓冲液-1 中。
- 以1:100的比例加入FcR封闭试剂并孵育5分钟,然后加入1:200稀释的异硫氰酸荧光素(FITC)标记的CD31抗体。将悬浮液在20-25°C的黑暗中孵育30分钟。
- 加入 10 mL 流动缓冲液-1,保留 10 μL 悬浮液用于流式细胞术分析,以确定 CD31+ 细胞的分数(图 2)。
- 通过在20-25°C下以200× g 离心5分钟来沉淀细胞。 然后,除去上清液并重悬至每 100 μL 流动缓冲液-1 溶液 1.0 x 107 个细胞的密度。加入 FITC选择混合物(每100 μL细胞悬液5 μL)。通过移液充分混合,并在20-25°C下在黑暗中孵育15分钟。
- 每100μL细胞悬液加入5μL磁性纳米颗粒,移液良好,并在20-25°C下在黑暗中孵育10分钟。
- 将细胞悬液转移到 5 mL 流式细胞术管中,并加入流动缓冲液-1 以获得 2.5 mL 的总体积。将流式细胞术管放入磁铁中5分钟。
- 在连续运动中,反转磁铁并倒出含有未用FITC-CD31抗体标记的细胞的细胞悬液。将磁铁和管子保持在倒置位置2-3秒,然后除去剩余的液体。在将管子恢复到直立位置之前,吸出管子边缘的任何液滴。
- 从磁铁中拿起流式细胞术管,加入 2.5 mL 流动缓冲液-1 以洗涤剩余的 CD31+ 细胞。通过轻轻上下移液细胞两到三次来重悬细胞。将流管放入磁铁中5分钟。
- 重复步骤1.4.11-1.4.12三次,然后再次重复步骤1.4.11,总共洗涤四次。
- 从磁体上取管,并向管中加入指定量的合适培养基(例如,用于扩展EC培养的人内皮无血清培养基[hECSR]或用于冷冻的冷冻培养基)以重悬纯化的CD31 + 细胞。保留两个 10 μL 等分试样的悬浮液,一个用于细胞计数,另一个用于进行流式细胞术分析,以评估 MACS 后样品中 CD31+ 细胞的纯度(图 2)。如果不能立即使用流式细胞仪,请将等分试样储存在4°C直至分析。
- 如果后续步骤(通过步骤 2)无法立即执行,此时冻结 CD31+ EPC。对于 EPC 的扩展和选择性传代,请继续执行步骤 2。
注意:玻连蛋白25 包被的 12 孔板和更稳定的 hiPSC 维持培养基 (mTeSR plus) 可用于代替基底膜基质包被板和 hiPSC 维持培养基 (mTeSR1)。要制备玻连蛋白包被的 12 孔板,用稀释缓冲液稀释玻连蛋白至终浓度 10 μg/mL,然后将 500 μL 稀释溶液转移到 12 孔板的每个孔中。将板在20-25°C下放置至少1小时。单一化的hiPSCs的接种密度与基底膜基质包被板的接种密度相当。改变培养基或基质组成可能会影响hiPSCs的增殖和自发分化,这通常需要1-2周才能适应新的培养条件。如果使用更稳定的hiPSC维持培养基进行hiPSC维持,则该培养基可用于EPC分化,而不是hiPSC维持培养基。在这种情况下,应在-2天更换更稳定的hiPSC维持培养基以去除ROCK抑制剂,并且可以跳过-1天的交换。
2. 扩展内皮细胞培养法(EECM)分化脑微血管内皮细胞样细胞(BMEC样细胞)和平滑肌样细胞(SMLC)
- 胶原包衣板和试剂的制备
- 通过将 5 mg 结晶 IV 型胶原蛋白溶解在 5 mL 无菌水中来制备胶原蛋白包被的 6 孔板。在4°C孵育过夜,然后等分并储存在-20°C。 在无菌水中以 1:100 的比例稀释胶原蛋白 IV 以产生 10 μg/mL 溶液,并向 6 孔板的每个孔中加入 1 mL 的 10 μg/mL 胶原蛋白 IV 溶液。将板在37°C孵育至少30分钟。 板可以在37°C下储存长达1周。
- 通过将 500 μg FGF 溶解在 5 mL Dulbecco 的 PBS 中来制备人成纤维细胞生长因子 2 (FGF2) 的储备溶液,加入 7.5% BSA 至终浓度为 0.1%,并将储备溶液等分到 20-200 μL 体积中。这些可以在-20°C下储存长达3个月(表1)。储备溶液可在4°C下储存长达1个月;避免冻融循环。通过将 2 mL B-27 补充剂和 20 μL FGF2 加入 98 mL hECSR 培养基中来制备 hECSR 培养基(表 1)。hECSR培养基可在2-8°C下储存长达2周。
- 通过将 15 mL 胎牛血清、5 mL DMSO 和 25 μL ROCK 抑制剂溶液添加到 30 mL hECSR 培养基中,为 EPC、EECM-BMEC 样细胞和 SMLC 制备冷冻培养基(表 1)。冷冻培养基可在2-8°C下储存长达2周。
- 用于扩展内皮细胞培养的接种 EPC
- 从 6 孔板中去除胶原蛋白溶液。然后,将 1.0-2.0 x 105 个纯化的 CD31+ EPC 转移到含有 5 μM ROCK 抑制剂(1:2,000 稀释)的 2 mL hECSR 培养基中。将板放入培养箱(37°C,5%CO2)中。通过轻轻地来回滑动板,然后左右滑动来均匀分布细胞。
- 第二天,取出含有 ROCK 抑制剂的 hECSR 培养基,并加入 2 mL 不含 ROCK 抑制剂的新鲜 hECSR 培养基。每隔一天更换一次hECSR培养基,直到达到100%汇合。
注意:如果在周末无法维持正常的喂食时间表,则可以在一周的最后一个工作日的晚上更换培养基,并在周末后的清晨再次更换培养基。
- 选择性传代以纯化EECM-BMEC样细胞和SMLC
- 从含有EC和非EC群体混合物的6孔板中取出hECSR培养基。向每个孔中加入 1 mL 解离试剂。
- 在显微镜下仔细监测细胞形态。当 EC(但不是非 EC)看起来明亮而圆润时(通常在 2-5 分钟内),通过敲击板的边缘将它们拆下。大多数非EC仍然附着在板上。
- 使用微量移液器收集分离的 EC,注意避免重新挂起非 EC。将 EC 转移到每 1 mL 解离试剂中含有 4 mL DMEM/F12-10 的 15 mL 或 50 mL 离心管中。
- 向含有剩余附着的非EC的孔中加入2 mL hECSR培养基以建立SMLC。 将板放入培养箱中。
- 将EC悬浮液移入离心管中以充分混合,并保留10μL悬浮液用于细胞计数。将剩余的细胞在20-25°C下以200× g 离心5分钟。 从沉淀中取出上清液,每 1.0-2.0 x 105 EC 加入 2 mL hECSR 培养基。
- 从新的6孔板中取出胶原蛋白IV溶液后,向每个孔中加入2mLEC悬浮液,然后在37°C下用5%CO2孵育。为了均匀分布板中的细胞,请在培养箱架上轻轻地来回和左右移动细胞。
- 每隔一天更换一次 hECSR 培养基,直到 EC 达到 100% 汇合度。
- 重复步骤2.3.1-2.3.7,直到获得纯EC单层。如果无法执行以下步骤,请冻结 CD31+ EC(请参阅步骤 2.4.2)。要分析 EC 函数,请继续执行步骤 3。
注意:通常,需要两次或三次选择性传代才能获得适合功能分析的近纯EC培养物,我们将这些细胞视为EECM-BMEC样细胞。在超过五或六次传代后,细胞增殖通常会减慢,尽管该变量取决于hiPSC系。 - 要培养 SMLC,请每隔一天更换一次 hECSR 培养基。要收集SMLC条件培养基(CM),请在每次更换培养基时将收集的培养基通过0.22μm过滤器。CM可用于上调EECM-BMEC样细胞的VCAM-1表达。池化 SMLC-CM,直到 SMLC 达到 100% 汇合。
- EPC、EECM-BMEC 样细胞和 SMLC 冷冻保存和解冻
- 为了冷冻EPC,在最后一次MACS洗涤(步骤1.4.13)之后,将EPC重悬于冷冻培养基而不是hECSR培养基中,密度为1.0-2.0 x 106 个细胞/ mL。将 1 mL 的细胞悬液分配到冷冻管中。将冷冻管放入受控速率冷冻装置中,并快速将其转移到-80°C。 对于长期储存,冷冻后24至48小时将管子移至液氮罐中。
- 为了冷冻EECM-BMEC样细胞和SMLC,从孔中取出培养基后,加入解离试剂(1mL /孔)并将板在37°C下用5%CO2 孵育直至细胞分离(EECM-BMEC样细胞和SMLC分别为5-7分钟和20-30分钟)。将细胞收集在 15 mL 或 50 mL 离心管中,每 1 mL 解离试剂含有 4 mL DMEM/F12-10。
- 彻底移液以混合并保留 10 μL 细胞悬液用于细胞计数。通过在20-25°C下以200× g 离心5分钟来沉淀细胞。 除去上清液,将细胞彻底重悬于冷冻培养基中,密度为1.0-2.0 x 106 个细胞/mL。将 1 mL 细胞悬液分配到新鲜的冷冻管中。
- 将冷冻管置于受控速率冷冻装置中,并立即将其转移到-80°C。 对于长期储存,可以在冷冻后24至48小时将管转移到液氮罐中。
- 对于解冻EPC,EECM-BMEC样细胞和SMLC,将冷冻管小瓶卷在双手之间或在37°C水浴中孵育,直到细胞几乎完全解冻。加入 500 μL DMEM/F12-10,将细胞悬液轻轻转移到含有 4 mL DMEM/F12-10 培养基的 15 mL 管中。通过加入1mL DMEM / F12-10洗涤冷冻管一次,然后在20-25°C下以200× g 离心细胞5分钟。
- 吸出上清液并将沉淀重悬于含有 5 μM ROCK 抑制剂(1:2,000 稀释度)的 2 mL hECSR 培养基中,对于 EPC,密度为 1.0-2.0 x 10 5 个细胞/2 mL,对于 EECM-BMEC 样细胞和 SMLC,密度为每 2 mL 2.0-3.0 x 105 个细胞。 吸出胶原蛋白溶液后,将细胞悬液分布在胶原蛋白包被的 6 孔板的孔中。
- 在37°C,5%CO2 的培养箱架子上轻轻地来回移动板,然后左右移动板,以使细胞均匀分布在孔中。
- 第二天,将培养基与缺乏ROCK抑制剂的新鲜hECSR培养基交换。每隔一天更换一次 hECSR 培养基,直到达到 100% 汇合度。然后,进行EPC的选择性传代(见步骤2.3)和EECM-BMEC样细胞的功能分析(见步骤3)。在进行分子表征和功能测定之前,EECM-BMEC样细胞应100%汇合,这通常在解冻后2-3天实现。
3. EECM-BMEC样细胞和SMLC的验证
- 小分子示踪剂的渗透性测定
- 通过测量荧光素钠渗透性来评估EECM-BMEC样细胞屏障完整性,如Nishihara等人26所述。在过滤器插件上接种EECM-BMEC样细胞以形成完整的单层并测量荧光素钠的渗透性。
- 免疫荧光染色以评估关键分子。
- 对于免疫荧光染色以监测单层或 SMLC 中 EECM-BMEC 样细胞的连接分子、粘附分子或细胞骨架蛋白的表达,请使用腔室载玻片、96 孔板或带插入过滤器的膜。评估具有或不具有炎性细胞因子刺激的细胞表面粘附分子的EECM-BMEC样细胞表达,如Nishihara等人所述26。
- 流式细胞术分析EECM-BMEC样细胞上细胞表面粘附分子的表达
- 使用流式细胞术评估参与免疫细胞迁移到CNS的细胞表面粘附分子的半定量表达,包括ICAM-1,ICAM-2,VCAM-1,P-选择素,E-选择素,CD99和血小板内皮细胞粘附分子-1(PECAM-1),如Nishihara等人所述26。在存在和不存在炎性细胞因子的情况下,用SMLC条件培养基培养EECM-BMEC样细胞16-18小时。
- 静态条件下的免疫细胞粘附测定,以评估功能粘附分子的表达
- 使用Nishihara等人描述的方法26 来确定EECM-BMEC样细胞的细胞表面粘附分子是否具有功能。
- 简而言之,将EECM-BMEC样细胞接种到5.5 x 104 / cm2 的腔室载玻片上并生长至汇合。大约24小时后,在存在或不存在促炎细胞因子的情况下将培养基更换为SMLC条件培养基,并将EECM-BMEC样细胞再孵育16小时。
- 在实验当天,用T细胞洗涤缓冲液(表1)解冻冷冻保存的免疫细胞(例如T细胞或外周血单核细胞[PBMC]),并在T细胞培养基中用荧光染料(例如细胞追踪染料)标记(表1)。免疫细胞培养基的优化应根据所研究的特定类型的免疫细胞进行定制。
- 在 16 孔室载玻片中,将 2 x 104 Th1 细胞添加到 EECM-BMEC 样细胞中。具体来说,当使用效应T细胞(例如Th1细胞)时,已经观察到与PBMC相比,它们对EECM-BMEC样细胞表现出更大的附着(Nishihara等人[2022])。因此,与纯效应T细胞相比,添加到EECM-BMEC样细胞中的PBMC数量需要更高。
- 将免疫细胞与单层EECM-BMEC样细胞在迁移测定培养基中孵育30分钟(表1)。30分钟后,轻轻清洗载玻片,浸入含有Dulbecco的PBS的罐子中两次,随后用2.5%戊二醛溶液在4°C下固定2小时。
- 固定后,将载玻片浸入装有Dulbecco的PBS的罐子中清洗载玻片两次,并用盖玻片安装。随后在载玻片上获取单层中心的荧光显微镜图像,以计数附着在EECM-BMEC样细胞单层上的免疫细胞。
结果
渗透性测定
通过在15、30、45和60分钟测量从下室收集的培养基的荧光强度来计算荧光素钠的渗透性。在每个时间点总共采样 150 μL 培养基,并用 hECSR 培养基替换缺失的 150 μL 体积。使用荧光板读数器读取荧光强度(485 nm激发/530 nm发射),并使用先前描述的公式18 计算正确的信号,间隙体积和渗透率(表2)。建议确认荧光素钠的荧光强度是否随时间增加。一次测定应使用多个过滤器(至少一式三份),以确保可重复性。对于健康的对照来源的EECM-BMEC样细胞,荧光素钠(376 Da)渗透率应低于0.3 x 10-3 cm / min。为了确认汇合的EECM-BMEC样细胞单层的形成,应在该测定之后对通透性测定中使用的每个过滤器的EECM-BMEC样细胞的连接蛋白进行免疫荧光染色。
免疫荧光染色
EECM-BMEC样细胞连接分子(包括claudin-5,occludin和VE-钙粘蛋白1)的免疫荧光染色用于评估细胞形态以及连续和成熟连接的存在(图4)。将滤芯膜上的EECM-BMEC样细胞单层用冷甲醇(-20°C)固定20秒,用封闭缓冲液封闭(表1),然后与一抗和二抗一起孵育。EECM-BMEC样细胞表现出纺锤状形状和锯齿形连接,这两者都是BMECs的特征形态特征27。用促炎细胞因子刺激接种在腔室载玻片上的EECM-BMEC样细胞,例如肿瘤坏死因子-α(TNF-α)和干扰素-γ(INF-γ)(0.1ng/mL TNF-α + 2 IU/mL IFN-γ)稀释在SMLC衍生的条件培养基中,上调粘附分子的表达,例如ICAM-1和VCAM-128 (图5)。平滑肌细胞标志物的代表性图像,包括α-平滑肌肌肌动蛋白(SMA)、钙钙蛋白和平滑肌蛋白22-Alpha(SM22a)29,如图 6所示。接种在腔室载玻片上的SMLC用4%多聚甲醛固定10分钟,用封闭缓冲液封闭,然后与一抗和二抗一起孵育。
流式细胞术分析EECM-BMEC样细胞的细胞表面粘附分子表达
内皮粘附分子在EECM-BMEC样细胞上的细胞表面表达的代表性结果如图 7所示。用促炎细胞因子(如TNF-α和INF-γ)刺激,上调几种粘附分子的细胞表面表达,包括ICAM-1,VCAM-1和P-选择素。用SMLC条件培养基培养EECM-BMEC样细胞可增强内皮VCAM-1细胞表面表达。诱导VCAM-1细胞表面表达的效果可能因SMLC条件培养基批次而异。建议在区分 SMLC 时储存从 SMLC 中收获的几批来自同一 hiPSC 来源的条件培养基,以验证哪批诱导 VCAM-1 的适当表达。
静态条件下的免疫细胞粘附测定
附着免疫细胞的数量与EECM-BMEC样细胞表面功能粘附分子的表达水平相关。炎性细胞因子的刺激上调了内皮粘附分子的表达,并促进了粘附在EECM-BMEC样细胞单层上的免疫细胞数量的增加(图8)。目前的实验证明了粘附分子在EECM-BMEC样细胞上的功能,使该模型适用于研究免疫细胞 - EC相互作用。

图 2:CD31+ EC的纯化。 在(步骤1.4.7)和之后(步骤1.4.14)MACS之前和之后(步骤1.4.14)来自EC散射门控和FITC标记的CD31染色的代表性流式细胞术数据的点图。MACS提高了人群中CD31 + EPC的纯度。缩写:SSC = 侧散;FSC = 前向散射;FITC = 异硫氰酸荧光素;MACS = 磁性激活细胞分选。 请点击此处查看此图的大图。
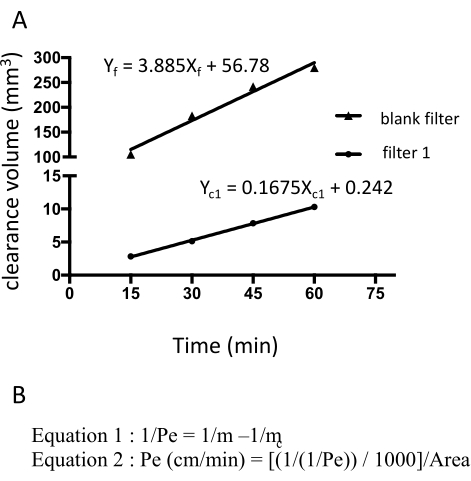
图 3:根据荧光素钠的原始荧光强度计算的 EECM-BMEC-单层通透性 (10-3 cm/min)。间隙体积的线性斜率是使用每个过滤器的线性回归计算的(图3A)。荧光素钠的渗透性使用两个公式计算(图3B)。(A) 使用过滤器 1 (mc1) 和空白过滤器 (mf) 的线性回归计算间隙体积随时间的线性斜率。m c1 和 m f 分别是 Xc1 和 X f 的系数。(B)使用mc和mf(公式1)计算荧光素渗透率(Pe)的公式。Pe单位使用过滤器的表面积进行转换(公式2)。请点击此处查看此图的大图。

图4:EECM-BMEC样细胞显示成熟的细胞连接。 在插入过滤器膜上生长的 EECM-BMEC 样细胞中对 claudin-5、occludin 或 VE-钙粘蛋白(红色)进行免疫荧光染色。使用4′,6-二脒基-2-苯基吲哚(DAPI)(蓝色)对细胞核进行染色。在用于渗透率测定的完全相同的滤光片插入物上进行染色。比例尺 = 50 μm。 请点击此处查看此图的大图。
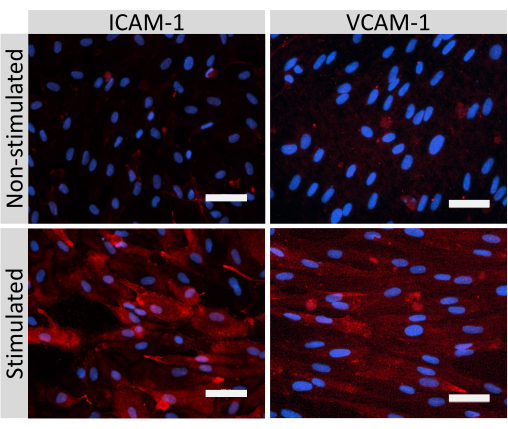
图5:EECM-BMEC样细胞内皮粘附分子的表达。 在SMLC衍生的CM存在下,对在过滤器插入物膜上生长的EECM-BMEC样细胞进行免疫荧光染色。 对于未刺激和1 ng / mL TNF-α + 20 IU / mL IFN-γ刺激的EECM-BMEC样细胞,显示了ICAM-1或VCAM-1(红色)的免疫染色。细胞核用DAPI(蓝色)染色。比例尺 = 50 μm。 请点击此处查看此图的大图。

图 6:SMLC 的表征。 图中显示了α平滑肌肌动蛋白 (SMA)、钙钙蛋白或平滑肌蛋白 22-Alpha (SM22a)(红色)对在腔室载玻片上生长的 SMLC 的免疫细胞化学。细胞核用DAPI(蓝色)染色。比例尺 = 50 μm。 请点击此处查看此图的大图。
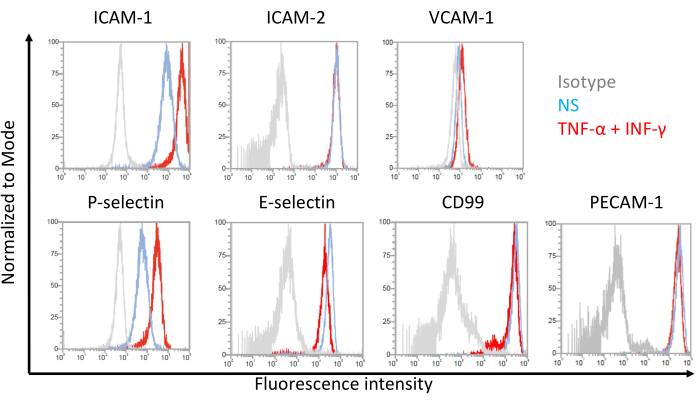
图7:EECM-BMEC样细胞上粘附分子的内皮细胞表面表达。 显示了EC-BMEC样细胞上EC表面粘附分子表达的流式细胞术分析结果。使用SMLC衍生的条件培养基培养EECM-BMEC样细胞。直方图叠加的蓝线、红线和灰线分别显示非刺激 (NS) 条件、1 ng/mL TNF-α + 20 IU/mL IFN-γ 刺激条件和同种型对照。评估内皮粘附分子的细胞表面表达,包括细胞间粘附分子1(ICAM-1),ICAM-2,血管细胞粘附分子1(VCAM-1),P-选择素,E-选择素,CD99和血小板内皮细胞粘附分子-1(PECAM-1)。 请点击此处查看此图的大图。
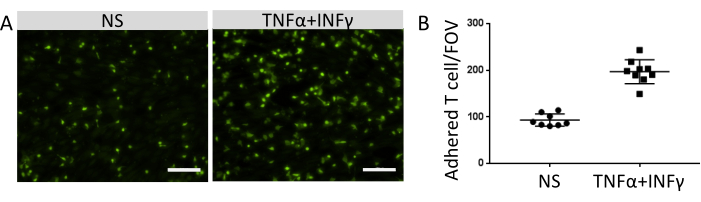
图8:免疫细胞在EECM-BMEC样细胞上的粘附 。 (A)非刺激(NS)和0.1 ng / mL TNF-α + 2 IU / mL IFN-γ刺激(TNF-α + IFN-γ)EECM-BMEC样细胞单层上的荧光标记贴壁免疫细胞的图像。图像对应于孔的中心。比例尺= 50μm。 (B)NS和TNF-α + IFN-γ刺激的EECM-BMEC样细胞单层上荧光标记的免疫细胞的数量。使用FIJI软件自动计数贴壁免疫细胞/视野(FOV)。点表示附着的 T 细胞的数量。条形图显示平均值,误差线显示八次试验的标准偏差(SD)。 请点击此处查看此图的大图。
表1:测定的特定试剂的详细信息。 描述了每种特定试剂的名称和确切的成分量。 请按此下载此表格。
表2:用于Pe计算的荧光板读数器的原始数据示例。粗体数字是酶标仪测量的荧光素钠的原始荧光强度。为了准确分析数据,有必要从原始值中删除背景信号,并考虑因对底腔采样而导致的任何信号损失,然后对信号进行校正。例如,减去背景后,15 分钟样品表现出 100 个相对荧光单位 (RFU) 的信号,30 分钟样品表现出 150 个 RFU 的信号。30 分钟时的校正信号为 (150 RFU + 15 分钟 [100 RFU x 150 μL/1,500 μL]) 时的缺失值),即 150 RFU + 10 RFU = 160 RFU。间隙体积 = (1,500 x [S B,t])/(S T,60 分钟),其中 1,500 是底部腔室的体积 (1,500 μL),SB,t 是时间 t 处的校正信号,S T,60 min 是60 分钟时顶部腔室的信号。 请按此下载此表格。
讨论
关键点和故障排除
在开始EPC分化之前,研究人员应确保hiPSC培养物中没有发生自发细胞分化事件。没有自发分化的细胞和使用纯hiPSC集落对于获得可重复的结果至关重要。-3 天的 hiPSC 接种密度对于在 MACS 后获得高纯度的 CD31+ EPC 非常重要。每个hiPSC系和每个传代的接种密度可能需要优化。根据 hiPSC 系和传代数,接种密度范围为 75 x 10 3 至 400 x 103 hiPSC,每孔 12 孔板 (20-100 x 103/cm2)。hiPSCs的最小密度检查点是第2天的细胞密度。hiPSC 最迟应在第 2 天达到 100% 汇合度。如果 hiPSC 在第 2 天没有汇合,则 MACS 后 CD31+ EPC 的纯度通常会非常低。在这种情况下,可以增加hiPSC接种密度。如果大量分化细胞在第3天至第5天左右从平板上分离,则初始hiPSC接种密度可能会降低。根据我们的经验,7-8 μM CHIR99021 是此处使用的 hiPSC 系的最佳浓度,但可能需要针对可能对抑制剂处理做出不同反应的其他 hiPSC 系优化浓度。CD31+EPC的纯度应在MACS前后确认。在继续MACS之前,预分选的细胞混合物应为>10%CD31+细胞。CD31+ 细胞百分比为 <6% 通常会导致 MACS 后 EPC <80%。在这种情况下,需要优化初始接种密度和/或CHIR99021浓度。
为了成功选择性传代和生成纯EC单层,CD31 + EPC的MACS后纯度至关重要。如果MACS后的纯度为<90%,建议再洗涤一两次(步骤1.4.11-1.4.12)。理想情况下,MACS后的纯度应为>95%。胶原蛋白包被平板上的EPC接种密度应根据hiPSC线进行优化,以在3-7天内达到100%的汇合度。等到 EC 100% 融合通常会导致成功的选择性通过。然而,即使对于 100% 融合的 EC,一些 hiPSC 线路的 SMLC 也会提前分离。在这种情况下,较低汇合度(例如,≤80%)的选择性传代可能是有效的。如果一些 SMLC 比 EC 更早分离,则通常无法从混合 EC-SMLC 人群中拯救 EC。在这种情况下,缩短传代EC中解离试剂的活化时间和重复选择性传代可能会有所帮助。使用商业解离试剂而不是胰蛋白酶作为解离试剂有利于选择性传代,因为胰蛋白酶不允许EC和SMLC的单独分离。我们使用小分子示踪剂进行的渗透性测定以及对紧密连接和粘附分子表达水平的测试表明,EPC、EECM-BMEC 样细胞和 SMLC 可以在液氮中储存至少 2 年。
该方法的意义和局限性
该方法通过使用化学GSK-3抑制剂激活Wnt/β-连环蛋白信号传导来区分CD31 + EPCs和hiPSC。通过MACS对CD31 + EPC进行阳性选择后,EPC在确定的内皮培养基中培养,促进分化为混合内皮和SMLC群体。这些具有不同粘附特性的混合群体的选择性传代允许EC与SMLC分离。经过一两次传代后,EECM-BMEC样细胞表现出屏障特性和内皮粘附分子的表达,这些分子概括了原代人BMEC的内皮粘附分子。与SMLC或其上清液共培养可诱导细胞因子诱导的VCAM-1表达。
在体内,BBB通过建立分子的低细胞旁和跨细胞通透性,通过特异性转运蛋白运输营养物质和控制免疫细胞运输到CNS来维持CNS稳态。对于BBB的研究,显示感兴趣的相应分子和功能的合适模型是必不可少的。使用来自患者或健康受试者的指定试剂和样品生产EECM-BMEC样细胞可提供可扩展的人类BBB模型。与其他BBB模型相比,使用EECM-BMEC样细胞的模型的优势在于:1)类似于原代人BMEC的形态和内皮转录组谱30;2)存在成熟的紧密连接;3)理想的阻隔性能;4)内皮粘附分子的稳健表达,包括ICAM-1,ICAM-2,VCAM-1,E-和P-选择素,CD99,黑色素瘤细胞粘附分子(MCAM)和活化的白细胞细胞粘附分子(ALCAM)22。因此,该模型对于研究免疫细胞和BMEC之间的相互作用特别有用。尽管EECM-BMEC样细胞的小分子示踪剂的渗透性高于先前报道的iPSC衍生BMEC样细胞的渗透性14,15,但其屏障特性与原代人BMEC的屏障特性相比确实相当好。这种相似性表明EECM-BMEC样细胞可能是BBB的良好体外模型。当使用该模型研究体内缺乏组成型E-选择素表达的非发炎BBB时,必须考虑生理条件下EECM-BMEC样细胞上的E-选择素表达31。在我们之前的研究中,我们证明了EECM-BMEC样细胞可以表型BBB,正如在MS患者的大脑中观察到的关于破坏的紧密连接。这导致小分子的更高通透性和功能粘附分子的表达增加,介导免疫细胞在BMEC样细胞上的粘附和迁移增加32。此外,我们发现Wnt/β-连环蛋白信号传导的激活可以改善MS衍生的EECM-BMEC样细胞中紧密连接的破坏和VCAM-1表达的增加32。这些结果表明,该模型确实有助于研究BBB在神经免疫疾病(如MS)中的作用。
综上所述,EECM-BMEC样细胞是一种有前途的工具,用于深入了解BBB水平的病理生理机制,并作为开发BBB稳定新治疗靶点的工具。在未来,该模型可以应用于研究更广泛疾病的BBB功能障碍,并可能为新的治疗方法开辟途径。
披露声明
BE获得了Biogen的资助,用于研究Natalizumab在T细胞跨血脑屏障迁移中的扩展剂量,以及CSL Behring的资助,以研究神经系统疾病中血脑屏障功能障碍的分子基础。HN和BE是与EECM-BMEC样细胞相关的临时美国专利申请的发明人(63/084980和63/185815)。
致谢
HN得到了上原纪念基金会,ECTRIMS博士后研究交流奖学金,JSPS在与SNSF(JRPs)联合实施的联合研究计划下的支持。 JPJSJRP20221507和KAKENHI资助号22K15711,JST森林计划(批准号JPMJFR2269,日本),横山临床药理学基金会批准号YRY-2217,金原一郎基金会,成重神经科学研究基金会, 诺华基金会(日本)科学促进基金会和山口大学基金。BE得到了瑞士MS协会和瑞士国家科学基金会(赠款310030_189080和ZLJZ3_214086)以及日本-瑞士战略科学和技术计划(SJSSTP)赠款IZLJZ3_214086的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
参考文献
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372 (2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358 (2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32 (2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679 (2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9 (2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25 (2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118 (2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992 (2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。