Method Article
Дифференцировка индуцированных плюрипотентных стволовых клеток человека в микрососудистые эндотелиальные клетки, подобные клеткам головного мозга, со зрелым иммунным фенотипом
В этой статье
Резюме
Здесь мы описываем протокол, расширенный метод культивирования эндотелиальных клеток (EECM), который позволяет дифференцировать плюрипотентные стволовые клетки в клетки, подобные микрососудистым эндотелиальным клеткам головного мозга (BMEC). Эти клетки демонстрируют экспрессию молекул адгезии эндотелиальных клеток и, таким образом, являются моделью гематоэнцефалического барьера человека, подходящей для изучения взаимодействий иммунных клеток in vitro.
Аннотация
Дисфункция гематоэнцефалического барьера (ГЭБ) является патологическим признаком многих нейродегенеративных и нейровоспалительных заболеваний, поражающих центральную нервную систему (ЦНС). Из-за ограниченного доступа к образцам ГЭБ, связанным с заболеванием, до сих пор не совсем понятно, является ли нарушение функции ГЭБ причиной развития заболевания или, скорее, следствием нейровоспалительного или нейродегенеративного процесса. Таким образом, индуцированные плюрипотентные стволовые клетки человека (ИПСК) предоставляют новую возможность для создания моделей ГЭБ in vitro от здоровых доноров и пациентов и, таким образом, для изучения специфических для заболевания характеристик ГЭБ у отдельных пациентов. Было разработано несколько протоколов дифференцировки для получения микрососудистых эндотелиальных клеток головного мозга (BMEC), подобных клеткам, из hiPSCs. Рассмотрение конкретного вопроса исследования является обязательным для правильного выбора соответствующего протокола дифференциации BMEC. Здесь мы описываем расширенный метод культивирования эндотелиальных клеток (EECM), который оптимизирован для дифференциации hiPSC в BMEC-подобные клетки со зрелым иммунным фенотипом, что позволяет изучать взаимодействия иммунных клеток с ГЭБ. В этом протоколе hiPSC сначала дифференцируются в эндотелиальные клетки-предшественники (EPC) путем активации передачи сигналов Wnt / β-катенина. Полученную культуру, содержащую гладкомышечные клетки (SMLC), затем последовательно пассируют для повышения чистоты эндотелиальных клеток (EC) и индуцирования специфических свойств ГЭБ. Совместное культивирование EECM-BMEC с этими SMLC или кондиционированной средой из SMLC обеспечивает воспроизводимую, конститутивную и регулируемую цитокинами экспрессию молекул адгезии EC. Важно отметить, что EECM-BMEC-подобные клетки устанавливают барьерные свойства, сравнимые с первичными человеческими BMEC, и из-за их экспрессии всех молекул адгезии EC EECM-BMEC-подобные клетки отличаются от других моделей ГЭБ, полученных из hiPSC, in vitro . Таким образом, EECM-BMEC-подобные клетки являются моделью выбора для исследования потенциального воздействия болезненных процессов на уровне ГЭБ с влиянием на взаимодействие иммунных клеток персонализированным образом.
Введение
Сосудисто-нервная единица (НВУ) центральной нервной системы (ЦНС) состоит из высокоспециализированных микрососудистых эндотелиальных клеток (ЭК), перицитов, встроенных в эндотелиальную базальную мембрану, а также паренхиматозной базальной мембраны и концевых стопастроцитов 1. В NVU микрососудистые эндотелиальные клетки головного мозга (BMEC) являются ключевыми компонентами, образующими гематоэнцефалический барьер (ГЭБ). BMEC образуют сложные и непрерывные плотные соединения и обладают чрезвычайно низкой пиноцитотической активностью по сравнению с микрососудистыми ЭК в периферических органах, что позволяет ГЭБ ингибировать свободную парацеллюлярную диффузию водорастворимых молекул в ЦНС. Экспрессия специфических переносчиков притока и отливных насосов BMEC обеспечивает поглощение и экспорт питательных веществ и вредных молекул, соответственно, из ЦНС2. Кроме того, ГЭБ строго контролирует проникновение иммунных клеток в ЦНС, экспрессируя низкие уровни молекул эндотелиальной адгезии, имеющих решающее значение для транспортировки иммунных клеток в ЦНС3. В физиологических условиях уровни экспрессии молекул адгезии на поверхности BMEC, таких как молекула межклеточной адгезии-1 (ICAM-1) и молекула адгезии сосудистых клеток-1 (VCAM-1), являются низкими, но эти уровни увеличиваются при некоторых неврологических расстройствах2. Морфологическое и функциональное нарушение ГЭБ отмечается при многих неврологических заболеваниях, таких как инсульт4, рассеянный склероз (МС)5 и несколько нейродегенеративных заболеваний 6,7,8. Детальное исследование клеточных и молекулярных характеристик BMEC как в физиологических, так и в патологических условиях представляет собой подход к выявлению новых терапевтических стратегий, нацеленных на ГЭБ.
До недавнего времени для изучения ГЭБ использовались первичные или увековеченные BMEC человека и грызунов. Однако неясно, применимы ли выводы, основанные на животных моделях ГЭБ к человеческому ГЭБ, поскольку экспрессия нескольких важных молекул, включая молекулы адгезии и белки-переносчики растворенного вещества, различается у людей и грызунов 9,10. Хотя человеческие линии BMEC, такие как hCMEC / D3, экспрессируют соответствующие уровни молекул адгезии11, эти иммортализированные BMEC обычно не имеют сложных плотных соединений и надежных барьерных свойств12. Первичные человеческие BMEC полезны для изучения барьерных функций13, но они не всегда доступны для всех исследователей. Кроме того, первичные BMEC от пациентов может быть трудно получить, поскольку они должны быть собраны с помощью биопсии головного мозга или операции, которая выполняется только при определенных клинических условиях.
Последние достижения в технологии стволовых клеток позволили дифференцировать различные типы клеток человека, возникающие из источников стволовых клеток, таких как индуцированные плюрипотентные стволовые клетки человека (hiPSCs). Модели, полученные из hiPSC, позволяют нам создавать патофизиологические модели с использованием образцов, полученных от пациентов. Несколько типов клеток, полученных из hiPSC, могут быть объединены для создания аутологичных кокультур или органоидов, которые лучше имитируют физиологические условия. Несколько широко используемых протоколов 14,15,16,17,18,19 могут быть использованы для дифференциации BMEC-подобных клеток, полученных из hiPSC, которые обладают надежными диффузионными барьерными свойствами с экспрессией ГЭБ-специфических транспортеров и оттоковых насосов, и полезны для изучения парацеллюлярной диффузии малых молекул, механизмов молекулярного транспорта и доставки лекарств в мозг 20,21. Тем не менее, предыдущие исследования показали, что широко используемые BMEC-подобные клетки, полученные из hiPSC, не обладают экспрессией ключевых молекул эндотелиальной адгезии, включая VCAM-1, селектины и ICAM-2, которые отвечают за опосредование взаимодействия между иммунными клетками и BBB22. Кроме того, сообщалось, что предыдущие BMEC, полученные из hiPSC, демонстрируют смешанные эндотелиальные и эпителиальные характеристики на уровне транскрипции23. Поэтому мы разработали метод расширенного культивирования эндотелиальных клеток (EECM), новый протокол, который позволяет дифференцировать ИПСК в BMEC-подобные клетки, которые напоминают первичные человеческие BMEC по морфологии, барьерным характеристикам и экспрессии молекул эндотелиальной адгезии. В этом протоколе подробно описаны методологические процедуры дифференциации ИПСК до BMEC-подобных клеток, демонстрирующих зрелый иммунный фенотип.
протокол
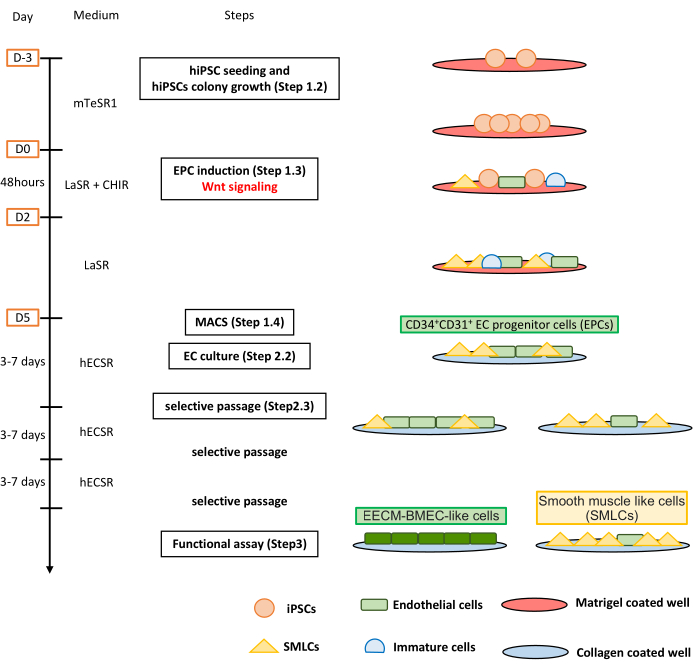
Рисунок 1: Обзор протокола. В рукописи представлен пошаговый протокол дифференцировки ИПСК в EECM-BMEC-подобные клетки. Правильные схемы изображают клеточные популяции на каждом шаге. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Линия hiPSC, HPS1006, была предоставлена RIKEN BRC в рамках Национального проекта по биоресурсам MEXT/AMED, Япония.
1. Индукция дифференцировки hiPSC в эндотелиальные клетки-предшественники (EPC)
- Пластины и реагенты с покрытием из внеклеточного матрикса (ECM)
- Подготовьте 12-луночные пластины с матричным покрытием из базальной мембраны, аликвотируя 2,5 мг матричного геля в центрифужные пробирки объемом 50 мл для хранения при -20 °C до 6 месяцев. Добавьте в пробирку 30 мл холодной модифицированной смеси Eagle F-12 (DMEM/F12) от Dulbecco, которая хранилась в холодильнике (4 °C). Аккуратно перемешайте пипеткой, пока гель не оттает, а затем добавьте по 500 мкл раствора в каждую лунку 12-луночной пластины. Поместите планшет в инкубатор (37 °C, 5% CO2) не менее чем на 1 час.
ПРИМЕЧАНИЕ: Матричный гель базальной мембраны чувствителен к температуре и должен обрабатываться в соответствии с инструкциями производителя по аликвотированию и покрытию пластин. Концентрация белков внеклеточного матрикса может варьироваться между партиями. Для обеспечения точности точная концентрация должна быть указана в листе сертификата качества для конкретной партии, используя номер партии. Например, если точная концентрация составляет 10,0 мг / мл, используйте 250 мкл геля, в общей сложности 2,5 мг. - Приготовьте исходный раствор ингибитора роккиназы (РОК), растворив ингибитор РОК в стерильной воде до концентрации 10 мМ (таблица 1). Аликвотируйте исходный раствор в объемах 100-200 мкл и храните при -20 ° C, чтобы избежать циклов замораживания-оттаивания.
- Сделайте исходный раствор L-аскорбиновой кислоты в дозе 100 мг/мл, растворив 5 г L-аскорбиновой кислоты в 50 мл стерильной воды, и храните при -20 °C (таблица 1). Добавьте 6,25 мл глутамина и 305 мкл исходного раствора L-аскорбиновой кислоты в 500 мл усовершенствованного DMEM/F12, чтобы получить средуLaSR 24 (таблица 1). Хранить при температуре 2-8 °C до 2 недель.
- Приготовьте раствор CHIR99021, растворив CHIR99021 в неразбавленном диметилсульфоксиде (ДМСО) до конечной концентрации 10 мМ (таблица 1). Распределите раствор по объемам 100-200 мкл, чтобы избежать циклов замораживания-оттаивания, и храните при температуре -20 °C до 1 года. Хранить рабочие аликвоты исходного раствора при температуре 4 °C до 1 месяца.
- Приготовьте среду DMEM/F12-10, добавив 50 мл инактивированной теплом фетальной бычьей сыворотки к 450 мл DMEM/F12. Хранить среду при температуре 2-8 °C до 1 месяца (таблица 1).
- Приготовьте буфер потока-1, добавив 33,3 мл 7,5% бычьего сывороточного альбумина (BSA) к 467 мл фосфатно-буферного физиологического раствора Dulbecco (PBS) (таблица 1). Хранить при температуре 2-8 °C до 6 месяцев.
- Подготовьте 12-луночные пластины с матричным покрытием из базальной мембраны, аликвотируя 2,5 мг матричного геля в центрифужные пробирки объемом 50 мл для хранения при -20 °C до 6 месяцев. Добавьте в пробирку 30 мл холодной модифицированной смеси Eagle F-12 (DMEM/F12) от Dulbecco, которая хранилась в холодильнике (4 °C). Аккуратно перемешайте пипеткой, пока гель не оттает, а затем добавьте по 500 мкл раствора в каждую лунку 12-луночной пластины. Поместите планшет в инкубатор (37 °C, 5% CO2) не менее чем на 1 час.
- Посев сингуляризованных ИПСК и экспансия для дифференциации ЭПК (с 3-го по 1-й день)
- Начинают дифференцировку, когда колонии hiPSC в 6-луночной пластине не проявляют спонтанной дифференцировки и имеют соответствующую плотность для прохождения, обычно около 80% слияния (2,5-3,5 x 106 клеток). Внимательно следите за спонтанно дифференцированными клетками под микроскопом, чтобы убедиться, что для устранения недифференцированных клеток требуется несколько проходов. Обратитесь к примечанию, приведенному ниже на шаге 1.4.15 для получения информации о среде для культивирования клеток и внеклеточном матриксе.
- Аспирируют среду, добавляют в лунки 1 мл диссоциативного реагента и выдерживают в течение 5-7 мин при 37 °C. Диссоциируйте и сингуляризируйте клетки, аккуратно пипетируя раствор диссоциативного реагента по поверхностям лунок два или три раза.
- Перенесите отделенные клетки в пробирку объемом 15 мл, содержащую 4 мл поддерживающей среды hiPSC, и тщательно ресуспендируйте клетки. Зарезервируйте аликвоту 10 мкл для подсчета клеток.
- Гранулируют ячейки центрифугированием в течение 5 мин при 200 x g при 20-25 °C. Подсчитайте ячейки и рассчитайте необходимый объем для достижения соответствующей плотности ИПСК (75-400 x 103 на лунку) в 12-луночном планшете с матричным покрытием из базальной мембраны (этап 1.1.1).
- Аспирируйте раствор покрытия из лунок и добавьте в каждую лунку по 1 мл среды hiPSC, содержащей 10 мкМ ингибитора ROCK (разбавление 1:1000). После центрифугирования аспирируют надосадочную жидкость и диссоциируют гранулу в 1 мл среды hiPSC.
- Добавьте требуемый объем hiPSC, определенный на шаге 1.2.4, в каждую скважину 12-луночного планшета. Двух-четырех 12-луночных планшетов может быть достаточно для дифференциации клона hiPSC. Обратитесь к шагу 1.2.4, чтобы определить количество пластин, необходимых для посевных ячеек.
- Поместите планшет в инкубатор (37 °C, 5%CO2). Равномерно распределите ячейки, аккуратно перемещая пластину вперед и назад, а затем из стороны в сторону в инкубаторе.
- На следующий день (т.е. на 2-й день) замените среду на 2 мл поддерживающей среды hiPSC, в которой отсутствует ингибитор ROCK. На следующий день (день -1) замените среду на 2 мл свежей поддерживающей среды hiPSC.
- Индукция ЭПК ингибитором гликогенсинтазкиназы 3 (GSK-3) CHIR99021 (с 0 по 5 день)
- В день 0 замените поддерживающую среду hiPSC в каждой лунке на 2 мл среды LaSR, содержащей 8 мкМ CHIR99021.
- На 1-й день аспирируют среду и добавляют 2 мл свежей среды LaSR, содержащей 8 мкМ CHIR99021.
- На 2-й, 3-й и 4-й дни замените среду 2 мл свежей среды LaSR, в которой отсутствует CHIR99021.
- Магнитно-активируемая сортировка клеток (MACS) для очистки CD31+ EPC (День 5)
- На 5-й день аспирируют среду, а затем добавляют по 1 мл диссоциативного реагента в каждую лунку перед инкубацией в течение 6-8 мин при 37 ° C.
- Диссоциируют и выделяют клетки с помощью микропипетки и пропускают через клеточный фильтр 40 мкм для фильтрации суспензии в пробирку объемом 50 мл, содержащую 10 мл среды DMEM/F12-10. Отфильтруйте клеточную суспензию, собранную из более чем двух 12-луночных планшетов, по крайней мере, в две пробирки по 50 мл.
- Остановите реакцию пищеварения, добавив среду DMEM/F12-10 (до 50 мл). Тщательно проведите пипетку и оставьте 10 мкл для подсчета клеток. Гранулируют ячейки центрифугированием в течение 5 мин при 200 x g при 20-25 °C.
- После удаления надосадочной жидкости добавьте 10 мл среды DMEM/F12-10 и перенесите клеточную суспензию в свежие пробирки объемом 15 мл. Гранулируют ячейки центрифугированием в течение 5 мин при 200 x g при 20-25 °C.
- Аспирируют надосадочную жидкость и ресуспендируют в проточный буфер-1 при плотности 1,0 х10,7 клеток на 100 мкл буфера.
- Добавьте реагент, блокирующий FcR, в соотношении 1:100 и инкубируйте в течение 5 мин, прежде чем добавлять антитело CD31, меченное флуоресцеином изотиоцианатом (FITC), разбавленное 1:200. Выдерживают суспензию в течение 30 мин в темноте при температуре 20-25 °С.
- Добавьте 10 мл проточного буфера-1, зарезервировав 10 мкл суспензии для анализа проточной цитометрии для определения фракции клеток CD31+ (рис. 2).
- Гранулируйте ячейки центрифугированием при 200 x g в течение 5 мин при 20-25 °C. Затем удаляют надосадочную жидкость и ресуспендируют до плотности 1,0 х 10,7 клеток на 100 мкл раствора проточного буфера-1. Добавьте коктейль выбора FITC (5 мкл на 100 мкл клеточной суспензии). Тщательно перемешать пипеткой и выдержать в темноте 15 мин при температуре 20-25 °C.
- Добавьте 5 мкл магнитных наночастиц на 100 мкл клеточной суспензии, хорошо проведите пипетку и инкубируйте в темноте в течение 10 мин при 20-25 °C.
- Перенесите клеточную суспензию в проточную цитометрическую пробирку объемом 5 мл и добавьте буфер потока-1 для достижения общего объема 2,5 мл. Поместите проточную цитометрическую пробирку в магнит на 5 минут.
- При непрерывном движении инвертируйте магнит и сцедите клеточную суспензию, содержащую клетки, которые не были помечены антителом FITC-CD31. Держите магнит и трубку в перевернутом положении в течение 2-3 с, а затем удалите оставшуюся жидкость. Аспирируйте все капли на краю трубки, прежде чем вернуть трубку в вертикальное положение.
- Возьмите проточную цитометрическую пробирку с магнита и добавьте 2,5 мл буфера потока-1, чтобы промыть оставшиеся клетки CD31+ . Ресуспендируйте клетки, осторожно пипетируя клетки вверх и вниз два или три раза. Поместите проточную трубку в магнит на 5 минут.
- Повторите шаги 1.4.11-1.4.12 три раза, а затем шаг 1.4.11 еще раз, чтобы получить в общей сложности четыре стирки.
- Извлеките проточную трубку из магнита и добавьте указанное количество подходящей среды (например, среды без эндотелиальной сыворотки человека [hECSR] для расширенной культуры EC или замораживающей среды для замораживания) в пробирку, чтобы ресуспендировать очищенные клетки CD31+ . Зарезервируйте две аликвоты суспензии по 10 мкл, одну для подсчета клеток, а вторую для проведения проточного цитометрического анализа для оценки чистоты клеток CD31+ в образцах после MACS (рис. 2). Если проточный цитометр недоступен немедленно, храните аликвоту при температуре 4 ° C до анализа.
- Если следующие шаги (через шаг 2) не могут быть выполнены немедленно, заморозьте CD31+ EPC на этом этапе. Для расширения и выборочного прохождения EPC перейдите к шагу 2.
ПРИМЕЧАНИЕ: 12-луночные пластины с25-луночным покрытием Vitronectin и более стабильная среда для обслуживания hiPSC (mTeSR plus) могут использоваться вместо пластин с матричным покрытием базальной мембраны и среды для обслуживания hiPSC (mTeSR1). Чтобы приготовить 12-луночные планшеты, покрытые витронектином, разбавьте витронектин буфером для разбавления до конечной концентрации 10 мкг/мл, а затем перенесите 500 мкл разбавленного раствора в каждую лунку 12-луночных планшетов. Оставьте тарелки при температуре 20-25 °C не менее чем на 1 час. Плотность посева сингуляризованных ИПСК сопоставима с плотностью посева, используемой для пластин с матричным покрытием базальной мембраны. Изменение питательной среды или состава матрицы может повлиять на пролиферацию и спонтанную дифференцировку ИПСК, которым обычно требуется 1-2 недели для адаптации к новым условиям культивирования. Если для обслуживания hiPSC используется более стабильная среда для обслуживания hiPSC, эта среда может быть использована для дифференциации EPC вместо среды для обслуживания hiPSC. В этом случае более стабильную поддерживающую среду hiPSC следует заменить на -2-й день для удаления ингибитора ROCK, а обмен на -1 день можно пропустить.
2. Расширенный метод культивирования эндотелиальных клеток (EECM) для дифференциации микрососудистых эндотелиальных клеток, подобных клеткам головного мозга (BMEC-подобные клетки), и гладкомышечных клеток (SMLC)
- Приготовление пластин и реагентов с коллагеновым покрытием
- Приготовьте 6-луночные планшеты с коллагеновым покрытием, растворив 5 мг кристаллизованного коллагена IV типа в 5 мл стерильной воды. Инкубировать в течение ночи при температуре 4 ° C, а затем аликвотировать и хранить при -20 ° C. Разбавьте аликвоты коллагена IV 1:100 в стерильной воде до получения растворов 10 мкг/мл и добавьте 1 мл 10 мкг/мл растворов коллагена IV в каждую лунку 6-луночных планшетов. Выдерживают пластины не менее 30 мин при 37 °C. Пластины можно хранить при температуре 37 °C до 1 недели.
- Приготовьте исходный раствор фактора роста фибробластов человека 2 (FGF2), растворив 500 мкг FGF в 5 мл PBS Дульбекко, добавьте 7,5% BSA до конечной концентрации 0,1% и аликвотируйте исходный раствор в объемах 20-200 мкл. Их можно хранить при температуре -20 °C до 3 месяцев (таблица 1). Исходные растворы можно хранить при температуре 4 °C до 1 месяца; Избегайте циклов замораживания-оттаивания. Приготовьте среду hECSR, добавив 2 мл добавки B-27 и 20 мкл FGF2 в 98 мл среды hECSR (таблица 1). Среду hECSR можно хранить при температуре 2-8 °C до 2 недель.
- Приготовьте замораживающую среду для EPC, EECM-BMEC-подобных клеток и SMLC, добавив 15 мл эмбриональной бычьей сыворотки, 5 мл ДМСО и 25 мкл раствора ингибитора ROCK к 30 мл среды hECSR (таблица 1). Морозильную среду можно хранить при температуре 2-8 °C до 2 недель.
- Посев EPC для расширенной культуры эндотелиальных клеток
- Удалите раствор коллагена с 6-луночных пластин. Затем переносят 1,0-2,0 x 105 очищенных CD31+ EPC в 2 мл среды hECSR, содержащей 5 мкМ ингибитора ROCK (разведение 1:2,000). Поместите планшет в инкубатор (37 °C, 5%CO2). Равномерно распределите ячейки, аккуратно сдвигая пластины вперед и назад, затем из стороны в сторону.
- На следующий день удалите среду hECSR, содержащую ингибитор ROCK, и добавьте 2 мл свежей среды hECSR без ингибитора ROCK. Меняйте среду hECSR через день до достижения 100% слияния.
ПРИМЕЧАНИЕ: Если регулярный график кормления не может быть поддержан в выходные дни, среду можно заменить вечером последнего рабочего дня недели и снова рано утром после выходных.
- Селективный пассаж для очистки EECM-BMEC-подобных клеток и SMLC
- Удалите среду hECSR из 6-луночных планшетов, содержащих смесь ЭК и не-ЭК. Добавьте по 1 мл диссоциативного реагента в каждую лунку.
- Внимательно следите за морфологией клеток под микроскопом. Когда EC (но не EC) кажутся яркими и круглыми (обычно в течение 2-5 минут), отсоедините их, постучав по краю пластины. Большинство не-EC остаются прикрепленными к пластине.
- Соберите отсоединившиеся ЭК с помощью микропипетки, стараясь избежать повторного суспендирования не-ЭК. Перенесите ЭК в центрифужную пробирку объемом 15 мл или 50 мл, содержащую 4 мл DMEM/F12-10 на 1 мл диссоциативного реагента.
- Добавьте 2 мл среды hECSR в лунки, содержащие оставшиеся прикрепленные не-EC, чтобы получить SMLC. Поместите тарелку в инкубатор.
- Пипеткой нанесите суспензию ЕС в центрифужную пробирку для тщательного перемешивания и оставьте 10 мкл суспензии для подсчета клеток. Центрифугируют оставшиеся ячейки в течение 5 мин при 200 x g при 20-25 °C. Удалите надосадочную жидкость из гранулы и добавьте 2 мл среды hECSR на 1,0-2,0 x 105 ECs.
- После удаления раствора коллагена IV из новой 6-луночной пластины добавляют 2 мл суспензии ЕС в каждую лунку с последующей инкубацией при 37 ° C с 5% CO2. Чтобы равномерно распределить ячейки в тарелке, аккуратно перемещайте ее вперед-назад и из стороны в сторону по полке инкубатора.
- Заменяйте среду hECSR через день, пока EC не достигнут 100% слияния.
- Повторяйте шаги 2.3.1-2.3.7 до тех пор, пока не будет получен чистый монослой EC. Если следующие шаги не могут быть выполнены, заморозьте EC CD31+ (см. этап 2.4.2). Чтобы проанализировать функции EC, перейдите к шагу 3.
ПРИМЕЧАНИЕ: Как правило, для получения почти чистых культур ЭК, пригодных для функционального анализа, требуется два или три селективных пассажа, и мы рассматриваем эти клетки как EECM-BMEC-подобные клетки. После более чем пяти или шести пассажей пролиферация клеток обычно замедляется, хотя эта переменная зависит от линии hiPSC. - Чтобы культивировать SMLC, замените среду hECSR через день. Для сбора среды, кондиционированной SMLC (CM), пропускайте собранную среду через фильтр 0,22 мкм при каждой смене среды. CM может быть использован для повышения экспрессии VCAM-1 EECM-BMEC-подобных клеток. Объединяйте SMLC-CM до тех пор, пока SMLC не достигнут 100% слияния.
- Криоконсервация и размораживание EPC, EECM-BMEC-подобной ячейки и SMLC
- Чтобы заморозить EPC, после окончательной промывки MACS (этап 1.4.13) ресуспендируйте EPC в замораживающей среде, а не в среде hECSR с плотностью 1,0-2,0 x 106 клеток/мл. Распределите 1 мл клеточной суспензии в криотрубы. Поместите криотрубки в устройство для замораживания с контролируемой скоростью и быстро переведите их в температуру -80 °C. Для длительного хранения переместите пробирки в резервуар с жидким азотом через 24-48 ч после замораживания.
- Чтобы заморозить EECM-BMEC-подобные клетки и SMLC, после удаления среды из лунок добавляют диссоциационный реагент (1 мл / лунка) и инкубируют планшет при 37 ° C с 5% CO2 до тех пор, пока клетки не отсоединятся (5-7 мин и 20-30 мин для EECM-BMEC-подобных клеток и SMLC соответственно). Соберите клетки в центрифужную пробирку объемом 15 мл или 50 мл, содержащую 4 мл DMEM/F12-10 на 1 мл диссоциативного реагента.
- Тщательно перемешайте пипеткой и оставьте 10 мкл клеточной суспензии для подсчета клеток. Гранулируйте ячейки центрифугированием при 200 x g в течение 5 мин при 20-25 °C. Удалите надосадочную жидкость и тщательно ресуспендируйте клетки в замораживающей среде до плотности 1,0-2,0 х10,6 клеток/мл. Распределите 1 мл клеточной суспензии в свежие криотрубки.
- Поместите криотрубки в устройство для замораживания с регулируемой скоростью и немедленно переведите их до -80 °C. Для длительного хранения пробирки можно перенести в резервуар с жидким азотом через 24-48 ч после замораживания.
- Для размораживания EPC, EECM-BMEC-подобных клеток и SMLC перекатывают флаконы с криотрубками между руками или инкубируют на водяной бане с температурой 37 °C, пока клетки почти полностью не оттают. Добавьте 500 мкл DMEM/F12-10 и осторожно перенесите клеточную суспензию в пробирку объемом 15 мл, содержащую 4 мл среды DMEM/F12-10. Промойте криотрубку один раз, добавив 1 мл DMEM/F12-10, а затем центрифугируйте ячейки при 200 x g в течение 5 мин при 20-25 °C.
- Аспирируют надосадочную жидкость и ресуспендируют гранулу в 2 мл среды hECSR, содержащей 5 мкМ ингибитора ROCK (разведение 1:2000), до плотности 1,0-2,0 х 10,5 клеток на 2 мл для ЭПК и 2,0-3,0 х 10,5 клеток на 2 мл для EECM-BMEC-подобных клеток и SMLC. Распределите клеточную суспензию между лунками 6-луночных пластин, покрытых коллагеном, после аспирации раствора коллагена.
- Аккуратно перемещайте пластины вперед и назад, затем из стороны в сторону, на полке инкубатора при 37 ° C, 5 % CO2 , чтобы равномерно распределить ячейки в лунках.
- На следующий день замените среду на свежую среду hECSR, в которой отсутствует ингибитор ROCK. Меняйте среду hECSR через день до тех пор, пока не будет достигнуто 100% слияние. Затем приступайте к селективному пассажированию для ЭПК (см. шаг 2.3) и функциональному анализу для ЭЭКМ-BMEC-подобных клеток (см. шаг 3). Перед проведением молекулярной характеристики и функциональных анализов EECM-BMEC-подобные клетки должны быть на 100% сливающимися, что обычно достигается через 2-3 дня после размораживания.
3. Валидация EECM-BMEC-подобных клеток и SMLC
- Анализ проницаемости для низкомолекулярных индикаторов
- Оцените целостность клеточного барьера EECM-BMEC путем измерения проницаемости флуоресцеина натрия, как описано Nishihara et al.26. Засейте EECM-BMEC-подобные клетки на фильтрующих вставках для создания полных монослоев и измерения проницаемости флуоресцеина натрия.
- Иммунофлуоресцентное окрашивание для оценки ключевых молекул.
- Для иммунофлуоресцентного окрашивания для мониторинга экспрессии соединительных молекул, молекул адгезии или цитоскелетных белков EECM-BMEC-подобных клеток в монослоях или SMLC используйте предметные стекла, 96-луночные пластины или мембраны со вставными фильтрами. Оцените экспрессию молекул адгезии клеточной поверхности EECM-BMEC с воспалительной стимуляцией цитокинов или без нее, как описано Nishihara et al.26.
- Проточная цитометрия для анализа экспрессии молекул адгезии клеточной поверхности на EECM-BMEC-подобных клетках
- Используйте проточную цитометрию для оценки полуколичественной экспрессии молекул адгезии клеточной поверхности, участвующих в миграции иммунных клеток в ЦНС, включая ICAM-1, ICAM-2, VCAM-1, P-селектин, E-селектин, CD99 и молекулу адгезии эндотелиальных клеток тромбоцитов-1 (PECAM-1), как описано Nishihara et al.26. Культивируют EECM-BMEC-подобные клетки в SMLC-кондиционированной среде в присутствии и отсутствии воспалительных цитокинов в течение 16-18 ч.
- Анализ адгезии иммунных клеток в статических условиях для оценки экспрессии молекул функциональной адгезии
- Используйте метод, описанный Nishihara et al.26 , чтобы определить, являются ли молекулы адгезии клеточной поверхности клеток, подобных EECM-BMEC, функциональными.
- Вкратце, засейте клетки, подобные EECM-BMEC, на предметное стекло камеры размером 5,5 x 104/см2 и вырастите до слияния. Примерно через 24 ч смените питательную среду на кондиционированную SMLC среду в присутствии или отсутствии провоспалительных цитокинов и инкубируйте EECM-BMEC-подобные клетки в течение дополнительных 16 ч.
- В день эксперимента разморозьте криоконсервированные иммунные клетки (например, Т-клетки или мононуклеарные клетки периферической крови [PBMC]) с помощью буфера для промывки Т-клеток (таблица 1) и метки флуоресцентными красителями (например, клеточными трекерами) в среде Т-клеток (таблица 1). Оптимизация питательной среды для иммунных клеток должна быть адаптирована к конкретному типу изучаемых иммунных клеток.
- В 16-луночном предметном стекле добавьте 2 x 104 клеток Th1 к клеткам, подобным EECM-BMEC. В частности, при работе с эффекторными Т-клетками, такими как клетки Th1, было замечено, что они проявляют большую привязанность к EECM-BMEC-подобным клеткам по сравнению с PBMC (Nishihara. et al. [2022]). Следовательно, количество PBMC, которые должны быть добавлены к EECM-BMEC-подобным клеткам, должно быть выше по сравнению с чистыми эффекторными Т-клетками.
- Инкубируют иммунные клетки с монослоем EECM-BMEC-подобных клеток в течение 30 мин в среде миграционного анализа (табл. 1). Через 30 минут осторожно промойте предметное стекло, дважды погрузив в банку с PBS Дульбекко, а затем закрепите 2,5% раствором глутарового альдегида при 4 ° C в течение 2 часов.
- После фиксации дважды промойте предметное стекло, погрузив его в банку с PBS Дульбекко, и закрепите покровным стеклом. Впоследствии получают флуоресцентные микроскопические изображения центра монослоя на предметных стеклах для подсчета иммунных клеток, прикрепленных к EECM-BMEC-подобным клеточным монослоям.
Результаты
Анализ проницаемости
Проницаемость флуоресцеина натрия рассчитывали путем измерения интенсивности флуоресценции среды, собранной из нижней камеры через 15, 30, 45 и 60 минут. В каждый момент времени отбирается в общей сложности 150 мкл среды, а недостающий объем 150 мкл заменяется средой hECSR. интенсивность флуоресценции считывается с помощью считывателя флуоресцентных пластин (возбуждение 485 нм/излучение 530 нм) и рассчитываются правильные сигналы, объемы зазора и проницаемости с использованием ранее описанной формулы18 (таблица 2). Рекомендуется подтвердить, увеличивается ли интенсивность флуоресценции флуоресцеина натрия с течением времени. Для одного анализа следует использовать несколько фильтров - по крайней мере, в трех экземплярах, чтобы обеспечить воспроизводимость. Для здоровых контрольных клеток, полученных EECM-BMEC, проницаемость флуоресцеина натрия (376 Да) должна быть ниже 0,3 x 10-3 см / мин. Чтобы подтвердить образование сливающегося монослоя EECM-BMEC-подобных клеток, после этого анализа следует провести иммунофлуоресцентное окрашивание соединительных белков EECM-BMEC-подобных клеток каждого фильтра, используемого в анализах проницаемости.
Иммунофлюоресцентное окрашивание
Иммунофлуоресцентное окрашивание молекул клеточных соединений EECM-BMEC, включая клаудин-5, окклюдин и VE-кадгерин1, использовалось для оценки морфологии клеток и наличия непрерывных и зрелых соединений (рис. 4). Монослои EECM-BMEC-подобных клеток на мембранах фильтровальных вставок фиксировали холодным метанолом (-20 °С) в течение 20 с, блокировали блокирующим буфером (табл. 1), а затем инкубировали с первичными и вторичными антителами. EECM-BMEC-подобные клетки демонстрировали веретенообразные формы и зигзагообразные соединения, которые являются характерными морфологическими особенностями BMECs27. Стимуляция EECM-BMEC-подобных клеток, посеянных на предметных стеклах камеры, провоспалительными цитокинами, такими как фактор некроза опухоли-α (TNF-α) и интерферон-γ (INF-γ) (0,1 нг/мл TNF-α + 2 МЕ/мл ИФН-γ), разбавленные в кондиционированной среде, полученной из SMLC, повышала экспрессию молекул адгезии, таких как ICAM-1 и VCAM-128 (рис. 5). На рисунке 6 показаны репрезентативные изображения маркеров гладкомышечных клеток, включая актин α гладких мышц (СМА), кальпонин и белок гладких мышц 22-альфа (SM22a)29. SMLC, высеваемые на предметное стекло камеры, фиксировали 4% параформальдегидом в течение 10 мин, блокировали блокирующим буфером, а затем инкубировали с первичными и вторичными антителами.
Проточный цитометрический анализ экспрессии молекул адгезии клеточной поверхности клетками EECM-BMEC-подобных клеток
Репрезентативные результаты экспрессии молекул эндотелиальной адгезии на клетках, подобных EECM-BMEC, показаны на рисунке 7. Стимуляция провоспалительными цитокинами, такими как TNF-α и INF-γ, повышала экспрессию на клеточной поверхности нескольких молекул адгезии, включая ICAM-1, VCAM-1 и P-селектин. Культивирование EECM-BMEC-подобных клеток с SMLC-кондиционированной средой усиливает экспрессию эндотелиальной клеточной поверхности VCAM-1. Эффект индукции экспрессии клеточной поверхности VCAM-1 может варьироваться между партиями среды, кондиционированной SMLC. Рекомендуется хранить несколько партий кондиционированной среды, собранной из SMLC, полученных из одного и того же источника hiPSC, при дифференциации SMLC, чтобы проверить, какая партия индуцирует соответствующую экспрессию VCAM-1.
Анализ адгезии иммунных клеток в статических условиях
Количество прикрепленных иммунных клеток коррелировало с уровнем экспрессии молекул функциональной адгезии на поверхности EECM-BMEC-подобных клеток. Стимуляция воспалительными цитокинами повышала экспрессию молекул эндотелиальной адгезии и способствовала увеличению числа иммунных клеток, которые прилипали к монослоям EECM-BMEC-подобных клеток (рис. 8). Текущий эксперимент продемонстрировал функциональность молекул адгезии на EECM-BMEC-подобных клетках, что делает эту модель пригодной для изучения взаимодействий иммунных клеток с ЭК.

Рисунок 2: Очистка CD31+ EC. Точечные графики репрезентативных данных проточной цитометрии из рассеянного стробирования EC и меченого FITC окрашивания CD31 клеточных популяций до (этап 1.4.7) и после (этап 1.4.14) MACS. MACS улучшает чистоту CD31+ EPC в популяции. Сокращения: SSC = боковой разброс; FSC = прямой разброс; FITC = изотиоцианат флуоресцеина; MACS = сортировка ячеек с магнитным активом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
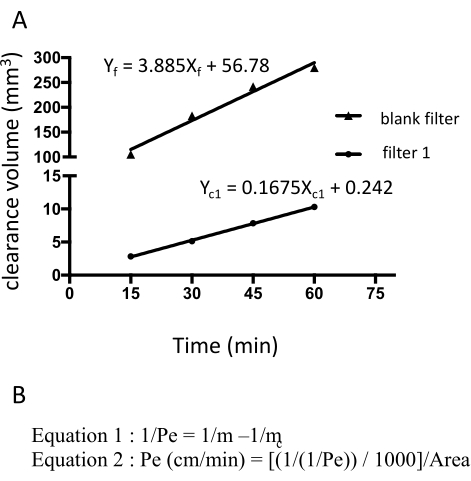
Рисунок 3: Проницаемость монослоя EECM-BMEC (10-3 см/мин), рассчитанная по интенсивности флуоресценции флуоресцеина натрия. Линейный наклон объема зазора рассчитывается с использованием линейной регрессии для каждого фильтра (рис. 3A). Проницаемость флуоресцеина натрия рассчитывается по двум формулам (рис. 3B). А) Линейный наклон объема зазора в зависимости от времени был рассчитан с использованием линейной регрессии для фильтра 1 (mc1) и пустого фильтра (mf). m c1 и m f являются коэффициентами Xc1 и X f соответственно. (B) Формула для расчета проницаемости флуоресцеина (Pe) с использованием mc и mf (формула 1). Единицы ПЭ были преобразованы с использованием площади поверхности фильтра (Формула 2). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: EECM-BMEC-подобные клетки демонстрируют зрелые клеточные соединения. Иммунофлуоресцентное окрашивание клаудина-5, окклюдина или VE-кадгерина (красного) в EECM-BMEC-подобных клетках, выращенных на мембранах вставных фильтров. Ядра окрашивали с помощью 4',6-диамидино-2-фенилиндола (DAPI) (синий). Окрашивание проводилось на тех же фильтрующих вставках, которые использовались для анализов проницаемости. Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
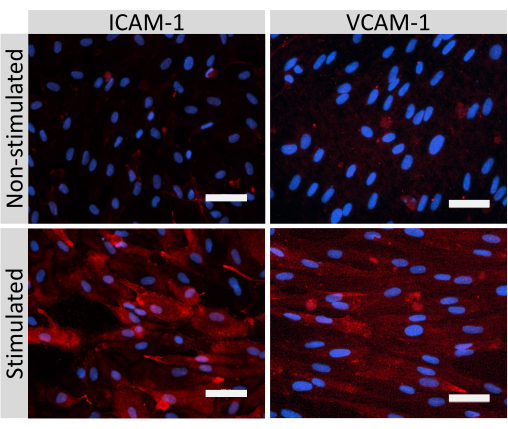
Рисунок 5: Экспрессия молекул эндотелиальной адгезии клетками, подобными EECM-BMEC. Иммунофлуоресцентное окрашивание проводили на EECM-BMEC-подобных клетках, выращенных на мембранах фильтровальных вставок в присутствии SMLC-производных CM. Иммуноокрашивание на ICAM-1 или VCAM-1 (красный) показано для нестимулированных и 1 нг/мл TNF-α + 20 МЕ/мл ИФН-γ стимулированных EECM-BMEC-подобных клеток. Ядра окрашивали DAPI (синий). Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Характеристика SMLC. Показана иммуноцитохимия α-гладкомышечного актина (СМА), кальпонина или гладкомышечного белка 22-альфа (SM22a) (красный) для SMLC, выращенных на камерных предметных стеклах. Ядра окрашивали DAPI (синий). Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
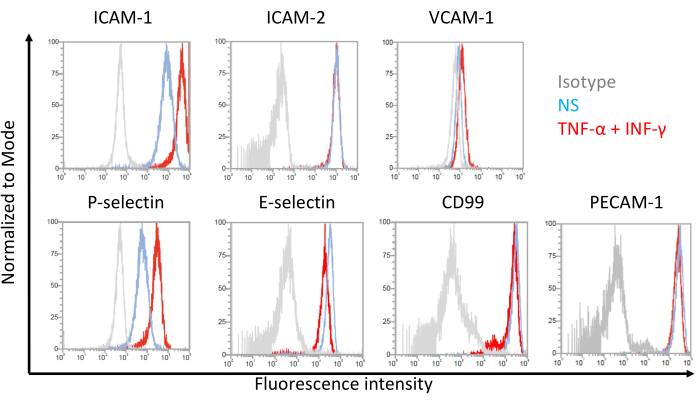
Рисунок 7: Поверхностная экспрессия молекул адгезии на EECM-BMEC-подобных клетках. Приведены результаты проточного цитометрического анализа экспрессии молекулы поверхностной адгезии ЕС на EECM-BMEC-подобных клетках. EECM-BMEC-подобные клетки культивировали с использованием кондиционированной среды, полученной из SMLC. Синие, красные и серые линии наложений гистограммы показывают нестимулированное (NS) состояние, 1 нг/мл TNF-α + 20 МЕ/мл ИФН-γ-стимулированное состояние и контроль изотипа соответственно. Оценивали экспрессию молекул эндотелиальной адгезии на клеточной поверхности, включая молекулу межклеточной адгезии 1 (ICAM-1), ICAM-2, молекулу адгезии сосудистых клеток 1 (VCAM-1), P-селектин, E-селектин, CD99 и молекулу адгезии эндотелиальных клеток тромбоцитов-1 (PECAM-1). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
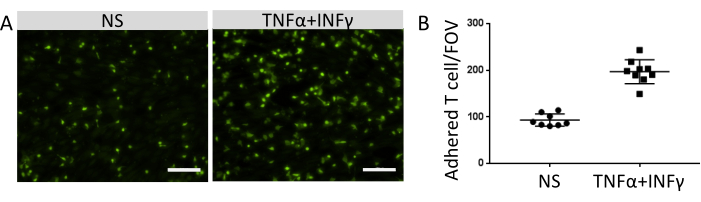
Рисунок 8: Адгезия иммунных клеток к EECM-BMEC-подобным клеткам. (A) Изображения флуоресцентно меченных адгезивных иммунных клеток на нестимулированных (NS) и 0,1 нг/мл TNF-α + 2 МЕ/мл ИФН-γ-стимулированных (TNF-α + ИФН-γ) монослоях EECM-BMEC-подобных клеток. Изображения соответствуют центрам лунок. Масштабная линейка = 50 мкм. (B) Количество флуоресцентно меченных иммунных клеток на монослоях NS и TNF-α + ИФН-γ-стимулированных EECM-BMEC-подобных клеток. Адгезивные иммунные клетки/поля зрения (FOV) автоматически подсчитывались с помощью программного обеспечения FIJI. Точки обозначают количество прикрепленных Т-клеток. Столбцы показывают среднее значение, а столбцы погрешности показывают стандартное отклонение (SD) восьми испытаний. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Подробная информация о конкретных реагентах для анализов. Описано название и точное количество ингредиентов для каждого конкретного реагента. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Пример исходных данных считывателя флуоресцентных пластин для расчета Пэ. Цифры, выделенные жирным шрифтом, представляют собой необработанную интенсивность флуоресценции флуоресцеина натрия, измеренную считывателем пластин. Чтобы точно проанализировать данные, необходимо удалить фоновый сигнал из необработанных значений и учесть любые потери сигнала, возникающие в результате выборки нижней камеры, а затем скорректировать сигнал. Например, после вычитания фона 15-минутный образец демонстрирует сигнал 100 относительных единиц флуоресценции (RFU), а 30-минутный образец демонстрирует сигнал 150 RFU. Скорректированный сигнал через 30 минут равен (150 RFU + пропущенные значения через 15 минут [100 RFU x 150 мкл / 1,500 мкл]), что составляет 150 RFU + 10 RFU = 160 RFU. Объем зазора = (1,500 x [S B,t])/(S T,60 мин), где 1,500 - объем нижней камеры (1,500 мкл), SB,t - скорректированный сигнал в момент времениt, а S T,60 мин - сигнал верхней камеры через60 мин. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Критические точки и устранение неполадок
Прежде чем начать дифференцировку EPC, исследователи должны убедиться, что в культурах hiPSC не произошло спонтанных событий дифференцировки клеток. Отсутствие спонтанно дифференцированных клеток и использование чистых колоний hiPSC имеет решающее значение для получения воспроизводимых результатов. Плотность высева hiPSC в День -3 важна для получения высокой чистоты CD31+ EPC после MACS. Плотность посева для каждой линии hiPSC и каждого прохода может потребовать оптимизации. В зависимости от линии hiPSC и номера прохода плотность посева может варьироваться от 75 x 10 3 до 400 x 10 3 hiPSC на лунку 12-луночной пластины (20-100 x 10 3/см2). Контрольной точкой минимальной плотности ИПСК является плотность клеток на 2-й день. ИПСК должны достичь 100% слияния не позднее 2-го дня. Если ИПСК не сливаются ко 2-му дню, чистота CD31+ EPC после MACS обычно будет довольно низкой. В этом случае плотность высева hiPSC может быть увеличена. Если большое количество дифференцирующих клеток отделяется от планшета в период с 3 по 5 день, начальная плотность посева hiPSC может быть уменьшена. 7-8 мкМ CHIR99021 по нашему опыту является оптимальной концентрацией для используемых здесь линий ИПСК, но концентрацию, возможно, потребуется оптимизировать для других линий ИПСК, которые могут по-разному реагировать на лечение ингибиторами. Чистота CD31+ EPC должна быть подтверждена до и после MACS. Перед продолжением MACS предварительно отсортированная клеточная смесь должна состоять из >10% CD31+ клеток. Процентное содержание клеток CD31+ <6% обычно приводит к <80% EPC после MACS. В этой ситуации необходима оптимизация начальной плотности посева и/или концентрации CHIR99021.
Для успешного селективного пассажирования и генерации чистых монослоев EC критически важна чистота EPC CD31+ после MACS. Если чистота после MACS составляет <90%, рекомендуется одна или две дополнительные промывки (этапы 1.4.11-1.4.12). В идеале чистота после MACS должна составлять >95%. Плотность посева EPC на пластинах с коллагеновым покрытием должна быть оптимизирована в соответствии с линией hiPSC для достижения 100% слияния в течение 3-7 дней. Ожидание, пока EC не будут на 100% сливаться, обычно приводит к успешному выборочному прохождению. Тем не менее, даже для 100% сливающихся EC SMLC некоторых линий hiPSC также отсоединяются на ранней стадии. В этом случае может быть эффективным селективное пассирование при более низком слиянии (например, ≤80%). Если некоторые SMLC отделяются раньше, чем EC, EC часто не могут быть спасены из смешанной популяции EC-SMLC. В этом случае может быть полезно сократить время активации диссоциативного реагента в проходящих ЭК и повторяющихся селективных пассажах. Использование коммерческого диссоциативного реагента, а не трипсина в качестве диссоциативного реагента, полезно для селективного пассажирования, поскольку трипсин не допускает раздельного отделения EC и SMLC. Наши анализы проницаемости с использованием низкомолекулярных индикаторов и тестирование уровней экспрессии молекул плотного соединения и адгезии показывают, что EPC, EECM-BMEC-подобные клетки и SMLC могут храниться в жидком азоте не менее 2 лет.
Значение и ограничения метода
Метод дифференцирует CD31+ EPC от hiPSC за счет использования химических ингибиторов GSK-3 для активации передачи сигналов Wnt / β-катенина. После положительного отбора CD31+ EPC с помощью MACS EPC культивируют в определенной эндотелиальной среде, которая способствует дифференцировке в смешанные эндотелиальные и SMLC-популяции. Селективное пассажирование этих смешанных популяций с различными адгезивными свойствами позволяет отделить ЭК от SMLC. После одного или двух пассажей EECM-BMEC-подобные клетки проявляют барьерные свойства и экспрессию молекул эндотелиальной адгезии, которые повторяют таковые у первичных BMEC человека. Совместное культивирование с SMLC или их надосадочными продуктами индуцирует индуцированную цитокинами экспрессию VCAM-1.
In vivo ГЭБ поддерживает гомеостаз ЦНС, устанавливая низкую парацеллюлярную и трансцеллюлярную проницаемость молекул за счет транспорта питательных веществ через специфические транспортеры и контроля трафика иммунных клеток в ЦНС. Для исследований ГЭБ необходима подходящая модель, отображающая соответствующие молекулы и функции, представляющие интерес. Производство EECM-BMEC-подобных клеток с использованием определенных реагентов и образцов от пациентов или здоровых добровольцев обеспечивает масштабируемую модель ГЭБ человека. Преимущества модели, использующей EECM-BMEC-подобные клетки, по сравнению с другими моделями ГЭБ: 1) морфология и профиль30 эндотелиального транскриптома, напоминающие таковые у первичных BMEC человека; 2) наличие зрелых плотных соединений; 3) желательные барьерные свойства; и 4) устойчивая экспрессия молекул эндотелиальной адгезии, включая ICAM-1, ICAM-2, VCAM-1, E- и P-селектин, CD99, молекулу адгезии клеток меланомы (MCAM) и активированную молекулу адгезии лейкоцитарных клеток (ALCAM)22. Таким образом, эта модель особенно полезна для изучения взаимодействия между иммунными клетками и BMEC. Хотя проницаемость низкомолекулярных индикаторов выше для EECM-BMEC-подобных клеток, чем ранее сообщалось для BMEC-подобных клеток, полученных из iPSC14,15, барьерные свойства довольно хорошо сопоставимы с теми, которые описаны для первичных BMEC человека. Это сходство указывает на то, что EECM-BMEC-подобные клетки, вероятно, являются хорошей моделью ГЭБ in vitro. Экспрессия Е-селектина на EECM-BMEC-подобных клетках в физиологических условиях должна учитываться при использовании этой модели для изучения невоспаленных ГЭБ, у которых отсутствует конститутивная экспрессия Е-селектина in vivo31. В нашем предыдущем исследовании мы продемонстрировали, что EECM-BMEC-подобные клетки могут фенокопировать ГЭБ, как это наблюдается в мозге пациентов с рассеянным склерозом в отношении нарушенных плотных соединений. Это приводит к более высокой проницаемости малых молекул и повышенной экспрессии молекулы функциональной адгезии, опосредуя повышенную адгезию и трансмиграцию иммунных клеток через BMEC-подобные клетки32. Кроме того, мы показали, что активация передачи сигналов Wnt / β-катенина может улучшить нарушение плотных соединений и увеличить экспрессию VCAM-1 в MS-производных EECM-BMEC-подобных клетках32. Эти результаты указывают на то, что модель действительно полезна для изучения роли ГЭБ при нейроиммунологических заболеваниях, таких как рассеянный склероз.
Взятые вместе, EECM-BMEC-подобные клетки являются перспективным инструментом для глубокого понимания патофизиологических механизмов на уровне ГЭБ и в качестве инструмента для разработки новых терапевтических мишеней для стабилизации ГЭБ. В будущем модель может быть применена для изучения дисфункции ГЭБ при более широком спектре заболеваний и может открыть возможности для новых терапевтических подходов.
Раскрытие информации
BE получила грант от Biogen для изучения расширенной дозировки натализумаба при миграции Т-клеток через гематоэнцефалический барьер и грант от CSL Behring для исследования молекулярных основ дисфункции гематоэнцефалического барьера при неврологических расстройствах. HN и BE являются изобретателями предварительных патентных заявок США, связанных с EECM-BMEC-подобными ячейками (63/084980 и 63/185815).
Благодарности
HN был поддержан Мемориальным фондом Уэхары, стипендией ECTRIMS по обмену постдокторскими исследованиями, JSPS в рамках Совместной исследовательской программы, реализуемой совместно с грантом SNSF (JRPs) No JPJSJRP20221507 и грантом KAKENHI No 22K15711, программой JST FOREST (номер гранта JPMJFR2269, Япония), грантом Фонда клинической фармакологии YOKOYAMA No YRY-2217, ФОНДОМ ИЧИРО КАНЕХАРА, Фондом исследований неврологии Наришигэ, Фонд NOVARTIS (Япония) по продвижению науки и ФОНД УНИВЕРСИТЕТА ЯМАГУТИ. BE был поддержан Швейцарским обществом рассеянного склероза и Швейцарским национальным научным фондом (гранты 310030_189080 и ZLJZ3_214086) и грантом Стратегической японо-швейцарской научно-технической программы (SJSSTP) IZLJZ3_214086.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
Ссылки
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372(2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358(2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32(2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679(2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733(2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9(2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25(2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118(2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563(2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992(2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены