Method Article
התמיינות של תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם לתאים דמויי תאי אנדותל מיקרו-וסקולריים במוח עם פנוטיפ חיסוני בוגר
In This Article
Summary
במאמר זה אנו מתארים פרוטוקול, שיטת תרבית תאי אנדותל מורחבת (EECM), המאפשרת התמיינות של תאי גזע פלוריפוטנטיים לתאים דמויי תאי אנדותל מיקרו-וסקולריים במוח (BMEC). תאים אלה מראים ביטוי של מולקולות היצמדות תאי אנדותל ולכן הם מודל מחסום דם-מוח אנושי המתאים לחקר אינטראקציות תאי מערכת החיסון במבחנה.
Abstract
תפקוד לקוי של מחסום דם-מוח (BBB) הוא סימן היכר פתולוגי של מחלות נוירודגנרטיביות ונוירו-דלקתיות רבות המשפיעות על מערכת העצבים המרכזית (CNS). בשל הגישה המוגבלת לדגימות BBB הקשורות למחלה, עדיין לא ברור היטב אם תקלה ב- BBB היא סיבתית להתפתחות המחלה או ליתר דיוק תוצאה של התהליך הנוירו-דלקתי או הנוירודגנרטיבי. תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs) מספקים אפוא הזדמנות חדשה לבסס מודלים של BBB במבחנה מתורמים וחולים בריאים, ובכך לחקור מאפייני BBB ספציפיים למחלה מחולים בודדים. מספר פרוטוקולי התמיינות נקבעו להפקת תאים דמויי תאי אנדותל מיקרו-וסקולריים במוח (BMEC) מתאי גזע גזעיים גזעיים. התחשבות בשאלת המחקר הספציפית היא חובה לבחירה נכונה של פרוטוקול הבידול המתאים של BMEC. במאמר זה אנו מתארים את שיטת תרבית תאי האנדותל המורחבת (EECM), המותאמת להתמיינות hiPSCs לתאים דמויי BMEC עם פנוטיפ חיסוני בוגר, ומאפשרת לחקור אינטראקציות בין תאי מערכת החיסון לתאי BBB. בפרוטוקול זה, hiPSCs מתמיינים תחילה לתאי אב אנדותל (EPCs) על ידי הפעלת איתות Wnt/β-catenin. התרבית המתקבלת, המכילה תאים דמויי שריר חלק (SMLCs), עוברת ברצף כדי להגביר את טוהר תאי האנדותל (ECs) ולגרום לתכונות ספציפיות ל-BBB. תרבות משותפת של EECM-BMECs עם SMLCs אלה או מדיום מותנה מ- SMLCs מאפשרת ביטוי ניתן לשחזור, מכונן ומווסת ציטוקינים של מולקולות הידבקות EC. חשוב לציין, תאים דמויי EECM-BMEC יוצרים תכונות מחסום דומות ל- BMEC אנושיים ראשוניים, ובשל הביטוי שלהם של כל מולקולות ההידבקות של EC, תאים דמויי EECM-BMEC שונים ממודלים אחרים של hiPSC שמקורם ב- BBB במבחנה . תאים דמויי EECM-BMEC הם אפוא המודל המועדף לחקירת ההשפעה הפוטנציאלית של תהליכי מחלה ברמת BBB, עם השפעה על אינטראקציה בין תאי מערכת החיסון באופן מותאם אישית.
Introduction
היחידה הנוירו-וסקולרית (NVU) במערכת העצבים המרכזית (CNS) מורכבת מתאי אנדותל מיקרו-וסקולריים (ECs) המתמחים מאוד, פריציטים המוטבעים בקרום מרתף האנדותל, כמו גם קרום המרתף הפרנכימלי ורגלי הקצה של אסטרוציטים1. בתוך NVU, תאי אנדותל מיקרו-וסקולריים במוח (BMECs) הם מרכיבי המפתח שיוצרים את מחסום הדם-מוח (BBB). BMECs יוצרים צמתים הדוקים מורכבים ומתמשכים ויש להם פעילות פינוציטוטית נמוכה ביותר בהשוואה ל- ECs מיקרו-וסקולריים באיברים היקפיים, המאפשרים ל- BBB לעכב את הדיפוזיה הפארא-תאית החופשית של מולקולות מסיסות במים לתוך מערכת העצבים המרכזית. הביטוי של מובילי זרם ספציפיים ומשאבות efflux על ידי BMECs מבטיח ספיגה וייצוא של חומרים מזינים ומולקולות מזיקות, בהתאמה, מ- CNS2. בנוסף, BBB שולט בקפדנות בכניסת תאי מערכת החיסון למערכת העצבים המרכזית על ידי ביטוי רמות נמוכות של מולקולות היצמדות אנדותל החיוניות לסחר תאי מערכת החיסון לתוך מערכת העצבים המרכזית3. בתנאים פיזיולוגיים, רמות הביטוי של מולקולות הידבקות על פני השטח של BMECs, כגון מולקולת היצמדות בין-תאית -1 (ICAM-1) ומולקולת היצמדות תאי כלי דם -1 (VCAM-1), הן נמוכות, אך רמות אלה עולות בחלק מההפרעות הנוירולוגיות2. התמוטטות מורפולוגית ותפקודית של BBB מדווחת במחלות נוירולוגיות רבות, כגון שבץ4, טרשת נפוצה (MS)5, ומספר מחלות נוירודגנרטיביות 6,7,8. חקירה מפורטת של המאפיינים התאיים והמולקולריים של BMECs בתנאים פיזיולוגיים ופתולוגיים כאחד היא גישה לזיהוי אסטרטגיות טיפוליות חדשות המכוונות ל- BBB.
עד לאחרונה, BMEC אנושיים ראשוניים או מונצחים שימשו לחקר BBB. עם זאת, לא ברור אם מסקנות המבוססות על מודלים של בעלי חיים של BBB ישימות בקלות ל-BBB האנושי, מאחר שהביטוי של מספר מולקולות חשובות, כולל מולקולות הידבקות וחלבונים נשאי מומסים, שונה בין בני אדם למכרסמים 9,10. למרות שקווי BMEC אנושיים כמו hCMEC/D3 מבטאים רמות מתאימות של מולקולות היצמדות11, ל-BMEC המונצחים האלה בדרך כלל אין צמתים הדוקים מורכבים ותכונות מחסום חזקות12. BMECs אנושיים ראשוניים שימושיים לחקר פונקציות מחסום13, אך הם אינם זמינים לכל החוקרים. יתר על כן, BMEC ראשוני מחולים יכול להיות קשה להשיג שכן הם חייבים להיאסף באמצעות ביופסיה המוח או ניתוח המבוצע רק בתנאים קליניים ספציפיים.
ההתקדמות האחרונה בטכנולוגיית תאי גזע אפשרה התמיינות של סוגי תאים אנושיים שונים, הנובעים ממקורות תאי גזע כמו תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs). המודלים הנגזרים מ-hiPSC מאפשרים לנו לבסס מודלים פתופיזיולוגיים באמצעות דגימות שמקורן במטופל. ניתן לשלב מספר סוגי תאים שמקורם ב-hiPSC כדי ליצור תרביות משותפות אוטולוגיות או אורגנואידים המחקים טוב יותר מצבים פיזיולוגיים. מספר פרוטוקולים בשימוש נרחב 14,15,16,17,18,19 עשויים לשמש כדי להבדיל תאים דמויי BMEC שמקורם ב-hiPSC שיש להם תכונות מחסום דיפוזיה חזקות עם ביטוי של טרנספורטרים ספציפיים ל-BBB ומשאבות אפלוקס, והם שימושיים לחקר הדיפוזיה הפארא-תאית של מולקולות קטנות, מנגנוני הובלה מולקולרית והעברת תרופות למוח 20,21. עם זאת, מחקרים קודמים הראו כי תאים דמויי BMEC שמקורם ב-hiPSC בשימוש נרחב חסרים את הביטוי של מולקולות מפתח להידבקות אנדותל, כולל VCAM-1, סלקטין, ו-ICAM-2, אשר אחראיות על תיווך אינטראקציות בין תאי מערכת החיסון לבין BBB22. יתר על כן, דווח על BMEC קודמים שמקורם ב-hiPSC כמציגים מאפייני אנדותל ואפיתל מעורבים ברמת השעתוק23. לכן, פיתחנו את שיטת תרבית תאי האנדותל המורחבת (EECM), פרוטוקול חדשני המאפשר התמיינות של hiPSCs לתאים דמויי BMEC הדומים ל- BMEC אנושיים ראשוניים מבחינת מורפולוגיה, מאפייני מחסום וביטוי מולקולות הידבקות אנדותל. פרוטוקול זה מתאר את ההליכים המתודולוגיים המפורטים להבחנה בין hiPSCs לתאים דמויי BMEC המציגים פנוטיפ חיסוני בוגר.
Protocol
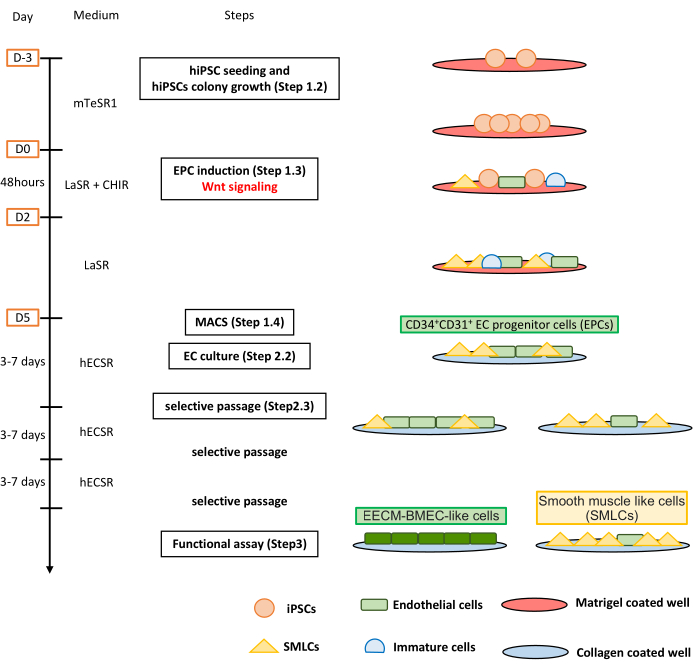
איור 1: סקירה כללית של הפרוטוקול. כתב היד מציג פרוטוקול שלב אחר שלב להבחנה של hiPSCs לתאים דמויי EECM-BMEC. הסכמות הנכונות מתארות את אוכלוסיות התאים בכל שלב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
קו hiPSC, HPS1006, סופק על ידי RIKEN BRC באמצעות פרויקט המשאבים הביולוגיים הלאומי של MEXT/AMED, יפן.
1. השראת התמיינות hiPSC לתאי אב אנדותל (EPC)
- לוחות וריאגנטים מצופים מטריצה חוץ-תאית (ECM)
- הכינו צלחות 12 בארות מצופות ממברנת מרתף על ידי הזרקת 2.5 מ"ג של ג'ל מטריקס לצינורות צנטריפוגות של 50 מ"ל לאחסון ב -20 ° C למשך עד 6 חודשים. הוסיפו לצינור 30 מ"ל של תערובת בינונית/תזונתית F-12 (DMEM/F12) של Eagle's Cold Dulbecco, שנשמרה במקרר (4°C). מערבבים בעדינות על ידי פיפטינג עד שהג'ל מפשיר ואז מוסיפים 500 מיקרוליטר של התמיסה לכל באר של צלחת 12 בארות. מניחים את הצלחת באינקובטור (37°C, 5% CO2) למשך שעה אחת לפחות.
הערה: ג'ל מטריצת קרום המרתף רגיש לטמפרטורה ויש לטפל בו בהתאם להוראות היצרן לציפוי פלטות. הריכוז של חלבוני מטריצה חוץ-תאיים יכול להשתנות בין אצוות. כדי להבטיח דיוק, יש להתייחס לריכוז המדויק בגיליון תעודת האיכות של האצווה הספציפית, באמצעות מספר הלוט. לדוגמה, אם הריכוז המדויק הוא 10.0 מ"ג / מ"ל, להשתמש 250 μL של ג'ל עבור סך של 2.5 מ"ג. - הכינו תמיסת מלאי מעכבי רו-קינאז (ROCK) על ידי המסת מעכב ROCK במים סטריליים לריכוז של 10 מילימטר (טבלה 1). Aliquot את תמיסת המלאי בנפחים של 100-200 μL ואחסנו ב -20 °C כדי למנוע מחזורי הקפאה-הפשרה.
- הכינו תמיסת מלאי של 100 מ"ג/מ"ל של חומצה L-אסקורבית על-ידי המסת 5 גרם חומצה L-אסקורבית ב-50 מ"ל מים סטריליים ואחסנו בטמפרטורה של -20°C (טבלה 1). הוסף 6.25 מ"ל גלוטמין ו- 305 מיקרוליטר של תמיסת מלאי חומצה L-אסקורבית ל- 500 מ"ל של DMEM/F12 מתקדם כדי ליצור מדיום LaSR24 (טבלה 1). יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס למשך עד שבועיים.
- הכן תמיסת CHIR99021 על-ידי המסת CHIR99021 בדימתיל סולפוקסיד לא מדולל (DMSO) לריכוז סופי של 10 מילימטר (טבלה 1). Aliquot את התמיסה לתוך נפחים 100-200 μL כדי למנוע מחזורי הקפאה-הפשרה ולאחסן ב -20 ° C עד 1 שנה. אחסן aliquots עבודה של פתרון המניות ב 4 °C למשך עד חודש אחד.
- הכינו DMEM/F12-10 בינוני על ידי הוספת 50 מ"ל של סרום בקר עוברי מומת בחום ל-450 מ"ל DMEM/F12. אחסנו את המדיום בטמפרטורה של 2-8°C למשך עד חודש אחד (טבלה 1).
- הכינו את חיץ הזרימה-1 על-ידי הוספת 33.3 מ"ל של אלבומין בסרום בקר (BSA) של 7.5% ל-467 מ"ל של מלח חוצץ פוספט (PBS) של דולבקו (טבלה 1). יש לאחסן בטמפרטורה של 2-8°C למשך עד 6 חודשים.
- הכינו צלחות 12 בארות מצופות ממברנת מרתף על ידי הזרקת 2.5 מ"ג של ג'ל מטריקס לצינורות צנטריפוגות של 50 מ"ל לאחסון ב -20 ° C למשך עד 6 חודשים. הוסיפו לצינור 30 מ"ל של תערובת בינונית/תזונתית F-12 (DMEM/F12) של Eagle's Cold Dulbecco, שנשמרה במקרר (4°C). מערבבים בעדינות על ידי פיפטינג עד שהג'ל מפשיר ואז מוסיפים 500 מיקרוליטר של התמיסה לכל באר של צלחת 12 בארות. מניחים את הצלחת באינקובטור (37°C, 5% CO2) למשך שעה אחת לפחות.
- זריעה של hiPSCs ייחודיים והרחבה להתמיינות EPC (יום -3 עד יום -1)
- התחל התמיינות כאשר מושבות hiPSC בלוח 6 בארות אינן מראות התמיינות ספונטנית ויש להן את הצפיפות המתאימה למעבר, בדרך כלל סביב 80% מפגש (2.5-3.5 x 106 תאים). עקוב בזהירות אחר תאים ממוינים באופן ספונטני תחת המיקרוסקופ כדי לוודא אם נדרשים מעברים מרובים כדי לחסל תאים שאינם ממוינים. עיין בהערה המובאת להלן שלב 1.4.15 לקבלת מידע אודות תרבית תאים, מדיום ומטריקס חוץ-תאי.
- שואפים את המדיום ומוסיפים 1 מ"ל של מגיב דיסוציאציה לבארות ודגרים במשך 5-7 דקות ב 37 מעלות צלזיוס. לנתק ולבודד את התאים על ידי פיפטציה של תמיסת מגיב הדיסוציאציה בעדינות על פני השטח של הבארות פעמיים או שלוש.
- מעבירים את התאים המנותקים לצינור של 15 מ"ל המכיל 4 מ"ל של מדיום תחזוקה hiPSC ומשהה מחדש את התאים ביסודיות. שמור aliquot 10 μL לספירת תאים.
- גלולה את התאים על ידי צנטריפוגה במשך 5 דקות ב 200 x גרם ב 20-25 ° C. ספור את התאים וחשב את הנפח הדרוש כדי להשיג צפיפות מתאימה של hiPSCs (75-400 x 10,3 לכל באר) בממברנה מרתף מצופה מטריצה 12 בארות צלחת (שלב 1.1.1).
- שאפו את תמיסת הציפוי מהבארות והוסיפו 1 מ"ל של תווך hiPSC המכיל מעכב סלע 10 מיקרומטר לכל באר (דילול 1:1,000). לאחר הצנטריפוגה, שואפים את הסופרנאטנט ומנתקים את הגלולה ב 1 מ"ל של תווך hiPSC.
- הוסף את הנפח הנדרש של hiPSC, שנקבע בשלב 1.2.4, לכל באר של צלחת 12 בארות. שתיים עד ארבע צלחות בנות 12 בארות עשויות להספיק כדי להבדיל בין שיבוט hiPSC. עיין בשלב 1.2.4 כדי לקבוע את מספר הלוחות הדרושים לזריעת תאים.
- מניחים את הצלחת באינקובטור (37°C, 5% CO2). מפזרים את התאים באופן שווה על ידי החלקת הצלחת בעדינות קדימה ואחורה ואז מצד לצד באינקובטור.
- למחרת (כלומר, יום -2), החליפו את המדיום ב-2 מ"ל של מדיום תחזוקה hiPSC חסר מעכב ROCK. למחרת (יום -1), להחליף את המדיום עם 2 מ"ל של אמצעי תחזוקה hiPSC טרי.
- השראת EPC עם מעכב הגליקוגן סינתאז קינאז 3 (GSK-3) CHIR99021 (יום 0 עד יום 5)
- ביום 0, החלף את מדיום התחזוקה hiPSC בכל באר ב- 2 מ"ל של מדיום LaSR המכיל 8 מיקרומטר CHIR99021.
- ביום הראשון, שאפו את המדיום והוסיפו 2 מ"ל של מדיום LaSR טרי המכיל 8 מיקרומטר CHIR99021.
- בימים 2, 3 ו-4, החלף את המדיום ב-2 מ"ל של מדיום LaSR טרי חסר CHIR99021.
- מיון תאים מופעלים מגנטית (MACS) לטיהור CD31+ EPC (יום 5)
- ביום 5, שואפים את המדיום ולאחר מכן מוסיפים 1 מ"ל של מגיב דיסוציאציה לכל באר, לפני הדגירה במשך 6-8 דקות ב 37 מעלות צלזיוס.
- נתקו וסינגולריזציה של התאים עם מיקרופיפטה ועברו דרך מסננת תאים של 40 מיקרומטר כדי לסנן את התרחיף לתוך צינור 50 מ"ל המכיל 10 מ"ל של מדיום DMEM/F12-10. סנן את תרחיף התא שנאסף מיותר משני לוחות 12 בארות לשני צינורות 50 מ"ל לפחות.
- עצור את תגובת העיכול על ידי הוספת מדיום DMEM/F12-10 (עד 50 מ"ל). פיפטה ביסודיות ולשמור 10 μL לספירת תאים. גלולה את התאים על ידי צנטריפוגה במשך 5 דקות ב 200 x גרם ב 20-25 ° C.
- לאחר הסרת הסופרנטנט, הוסף 10 מ"ל של מדיום DMEM/F12-10 והעבר את תרחיף התא לצינורות טריים של 15 מ"ל. גלולה את התאים על ידי צנטריפוגה במשך 5 דקות ב 200 x גרם ב 20-25 ° C.
- שואפים את הסופרנאטנט ומרחפים מחדש לתוך חיץ זרימה -1 בצפיפות של 1.0 x 107 תאים לכל 100 μL של חיץ.
- הוסף מגיב חוסם FcR ביחס של 1:100 ודגור במשך 5 דקות לפני הוספת נוגדן CD31 עם תווית פלואורסצאין (FITC) המדולל 1:200. לדגור את המתלה במשך 30 דקות בחושך ב 20-25 מעלות צלזיוס.
- הוסף 10 מ"ל של חיץ זרימה-1, ושמור 10 μL של המתלה לניתוח ציטומטריית זרימה כדי לקבוע את החלק של תאי CD31+ (איור 2).
- גלולה את התאים על ידי צנטריפוגה ב 200 x גרם במשך 5 דקות ב 20-25 ° C. לאחר מכן, הסר את supernatant ו resuspend לצפיפות של 1.0 x 107 תאים לכל 100 μL של תמיסת חיץ זרימה -1. הוסף את קוקטייל הבחירה FITC (5 μL לכל 100 μL של תרחיף התא). מערבבים היטב על ידי פיפטינג ודגרים בחושך במשך 15 דקות ב 20-25 מעלות צלזיוס.
- הוסף 5 μL של ננו-חלקיקים מגנטיים לכל 100 μL של תרחיף התא, פיפטה היטב, ודגור בחושך במשך 10 דקות ב 20-25 ° C.
- העבר את מתלה התא לצינור ציטומטריית זרימה של 5 מ"ל והוסף חיץ זרימה-1 כדי להשיג נפח כולל של 2.5 מ"ל. מניחים את ציטומטריית הזרימה במגנט למשך 5 דקות.
- בתנועה רציפה, הפוך את המגנט ונטרל את תרחיף התא המכיל תאים שלא סומנו בנוגדן FITC-CD31. שמור על המגנט והצינור במצב הפוך למשך 2-3 שניות ולאחר מכן הסר את שאריות הנוזלים. שאפו טיפות על קצה הצינור לפני שתחזירו את הצינור למצב זקוף.
- הרימו את ציטומטריית הזרימה מהמגנט והוסיפו 2.5 מ"ל של חיץ זרימה -1 כדי לשטוף את תאי CD31+ הנותרים. השהה מחדש את התאים על ידי פיטום עדין של התאים למעלה ולמטה פעמיים או שלוש. הכניסו את צינור הזרימה למגנט למשך 5 דקות.
- חזור על שלבים 1.4.11-1.4.12 שלוש פעמים ולאחר מכן על שלב 1.4.11 פעם נוספת עבור סך כולל של ארבע כביסות.
- הסר את צינור הזרימה מהמגנט והוסף את הכמות המצוינת של מדיום מתאים (למשל, מדיום ללא סרום אנדותל אנושי [hECSR] לתרבית EC מורחבת או מדיום הקפאה להקפאה) לצינור כדי להשהות מחדש את תאי CD31+ מטוהרים. שמרו שני אליציטוטים של 10 μL של התרחיף, אחד לספירת תאים והשני לביצוע ניתוח ציטומטריית זרימה כדי להעריך את הטוהר של תאי CD31+ בדגימות פוסט-MACS (איור 2). אם ציטומטר זרימה אינו זמין באופן מיידי, לאחסן את aliquot ב 4 °C עד לניתוח.
- אם לא ניתן לבצע את השלבים הבאים (עד שלב 2) באופן מיידי, הקפיא את ה- EPC CD31+ בשלב זה. להרחבה והעברה סלקטיבית של EPC, המשך לשלב 2.
הערה: ניתן להשתמש בלוחות ויטרונקטין25 מצופים 12 בארות ובאמצעי תחזוקת hiPSC יציב יותר (mTeSR plus) במקום לוחות מטריצת ממברנת מרתף ואמצעי תחזוקה hiPSC (mTeSR1). להכנת לוחות 12 בארות מצופות ויטרונקטין, מדללים ויטרונקטין עם חיץ דילול לריכוז סופי של 10 מיקרוגרם/מ"ל ולאחר מכן מעבירים 500 מיקרוליטר של התמיסה המדוללת לכל באר של 12 הלוחות בעלי 12 הקידוחים. השאירו את הצלחות ב 20-25 מעלות צלזיוס לפחות 1 שעות. צפיפות הזריעה של hiPSCs ייחודיים דומה לזו המשמשת ללוחות מטריצת ממברנות מרתף. שינוי מדיום התרבית או הרכב המטריקס עשוי להשפיע על התפשטות והתמיינות ספונטנית של hiPSCs, אשר בדרך כלל דורשים 1-2 שבועות כדי להסתגל לתנאי תרבות חדשים. אם אמצעי תחזוקת hiPSC יציב יותר משמש לתחזוקת hiPSC, ניתן להשתמש בתווך זה לבידול EPC במקום במדיום תחזוקת hiPSC. במקרה זה, יש לשנות את מדיום תחזוקת hiPSC היציב יותר ביום -2 כדי להסיר מעכב ROCK, וניתן לדלג על ההחלפה ביום -1.
2. שיטת תרבית תאי אנדותל מורחבת (EECM) להבחנה בין תאים דמויי תאי אנדותל מיקרו-וסקולריים במוח (תאים דמויי BMEC) לבין תאים דמויי שריר חלק (SMLCs)
- הכנת צלחות וריאגנטים מצופים קולגן
- הכינו צלחות 6 בארות מצופות קולגן על ידי המסת 5 מ"ג קולגן גבישי מסוג IV ב-5 מ"ל מים סטריליים. לדגור לילה ב 4 °C לפני aliquoting ואחסון ב -20 °C. לדלל קולגן IV aliquots 1:100 במים סטריליים כדי לייצר 10 מיקרוגרם / מ"ל תמיסות ולהוסיף 1 מ"ל של 10 מיקרוגרם / מ"ל קולגן IV תמיסות לכל באר של 6 בארות צלחות. לדגור את הצלחות לפחות 30 דקות ב 37 ° C. ניתן לאחסן את הצלחות ב 37 ° C למשך עד שבוע אחד.
- הכן תמיסת מלאי של גורם גדילה פיברובלסטי אנושי 2 (FGF2) על ידי המסת 500 מיקרוגרם של FGF ב -5 מ"ל של PBS של דולבקו, הוסף 7.5% BSA לריכוז סופי של 0.1%, ו aliquot את תמיסת המניות לתוך נפחים 20-200 μL. ניתן לאחסן אותם בטמפרטורה של -20°C למשך עד 3 חודשים (טבלה 1). פתרונות מלאי ניתן לאחסן ב 4 °C עד 1 חודש; הימנעו ממחזורי הקפאה-הפשרה. הכן מדיום hECSR על-ידי הוספת 2 מ"ל של תוסף B-27 ו-20 מיקרוליטר של FGF2 לתוך 98 מ"ל של מדיום hECSR (טבלה 1). ניתן לאחסן את מדיום hECSR בטמפרטורה של 2-8 מעלות צלזיוס למשך עד שבועיים.
- הכינו מדיום הקפאה עבור EPCs, תאים דמויי EECM-BMEC ו-SMLCs על-ידי הוספת 15 מ"ל של נסיוב בקר עוברי, 5 מ"ל של DMSO ו-25 מיקרוליטר של תמיסת מעכבי ROCK ל-30 מ"ל של מדיום hECSR (טבלה 1). ניתן לאחסן את מדיום ההקפאה בטמפרטורה של 2-8 מעלות צלזיוס למשך עד שבועיים.
- זריעת EPC לתרבית תאי אנדותל מורחבת
- הסר את תמיסת הקולגן מלוחות 6 הבארות. לאחר מכן, העבר 1.0-2.0 x 10 5 EPCs CD31+ מטוהרים ב- 2 מ"ל של מדיום hECSR המכיל מעכב ROCK של5 מיקרומטר (דילול 1:2,000). מניחים את הצלחת באינקובטור (37°C, 5% CO2). פזרו את התאים באופן שווה על ידי החלקת הלוחות בעדינות קדימה ואחורה, ואז מצד לצד.
- למחרת, הסר את מדיום hECSR המכיל מעכב ROCK והוסף 2 מ"ל של מדיום hECSR טרי ללא מעכב ROCK. החליפו את מדיום hECSR כל יומיים עד שמגיעים למפגש של 100%.
הערה: אם לא ניתן לשמור על לוח זמנים קבוע להאכלה במהלך סוף שבוע, ניתן להחליף את המדיום בערב של יום העבודה האחרון בשבוע ושוב מוקדם בבוקר לאחר סוף השבוע.
- מעבר סלקטיבי לטיהור תאים דמויי EECM-BMEC ו-SMLCs
- הסר את תווך hECSR מלוחות 6 בארות המכילים תערובת של ECs ואוכלוסיות שאינן EC. הוסף 1 מ"ל של מגיב דיסוציאציה לכל באר.
- עקוב אחר המורפולוגיה של התא בזהירות תחת מיקרוסקופ. כאשר ECs (אך לא ECs) נראים בהירים ועגולים (בדרך כלל תוך 2-5 דקות), נתק אותם על ידי הקשה על קצה הצלחת. רוב הלא-ECs נשארים מחוברים לצלחת.
- אספו את ה-ECs המנותקים באמצעות מיקרופיפטה, תוך הקפדה להימנע מהשעיה מחדש של ה-ECs שאינם ECs. העבר את ECs לצינור צנטריפוגה של 15 מ"ל או 50 מ"ל המכיל 4 מ"ל DMEM/F12-10 לכל 1 מ"ל של מגיב דיסוציאציה.
- הוסף 2 מ"ל של מדיום hECSR לבארות המכילות את שאר המחוברים שאינם ECs כדי להקים SMLCs. מניחים את הצלחת באינקובטור.
- פיפטה מתלה EC בצינור הצנטריפוגה כדי לערבב היטב ולשמור 10 μL של המתלה לספירת תאים. צנטריפוגה את התאים הנותרים במשך 5 דקות ב 200 x גרם ב 20-25 ° C. הסר את supernatant מן הגלולה ולהוסיף 2 מ"ל של hECSR בינוני לכל 1.0-2.0 x 105 ECs.
- עם הסרת תמיסת הקולגן IV מצלחת חדשה בעלת 6 בארות, יש להוסיף 2 מ"ל של תרחיף EC לכל באר, ולאחר מכן דגירה ב-37°C עם 5% CO2. כדי לפזר באופן שווה את התאים בצלחת, הזיזו אותה בעדינות בתנועה קדימה ואחורה ומצד לצד על מדף האינקובטור.
- החלף את מדיום hECSR כל יומיים עד ECs להגיע 100% confluency.
- חזור על שלבים 2.3.1-2.3.7 עד לקבלת שכבה אחידה EC טהורה. אם לא ניתן לבצע את השלבים הבאים, הקפא את CD31+ ECs (ראה שלב 2.4.2). כדי לנתח פונקציות EC, המשך לשלב 3.
הערה: באופן כללי, נדרשים שניים או שלושה מעברים סלקטיביים כדי להשיג תרביות כמעט טהורות של ECs המתאימות לניתוחים פונקציונליים, ואנו מחשיבים תאים אלה כתאים דמויי EECM-BMEC. לאחר יותר מחמישה או שישה מעברים, התפשטות התאים בדרך כלל מואטת, אם כי משתנה זה תלוי בקו hiPSC. - לתרבית SMLCs, החלף את מדיום hECSR כל יומיים. כדי לאסוף מדיום מותנה SMLC (CM), העבר את המדיום שנאסף דרך מסנן של 0.22 מיקרומטר עם כל שינוי בתווך. ניתן להשתמש ב-CM כדי לווסת את ביטוי VCAM-1 של תאים דמויי EECM-BMEC. אחסן את SMLC-CM עד שה-SMLCs יגיעו ל-100% מפגש.
- EPC, תא דמוי EECM-BMEC ושימור והפשרה בהקפאה של SMLC
- כדי להקפיא EPC, לאחר שטיפת MACS הסופית (שלב 1.4.13), השהה מחדש את ה- EPCs בתווך הקפאה במקום בתווך hECSR בצפיפות של 1.0-2.0 x 106 תאים/מ"ל. להפיץ 1 מ"ל של תרחיף התא לתוך cryotubes. הכנס את ה- cryotubes למכשיר הקפאה בקצב מבוקר והעבר אותם במהירות ל -80 ° C. לאחסון לטווח ארוך, העבירו את הצינורות למיכל חנקן נוזלי 24 עד 48 שעות לאחר ההקפאה.
- כדי להקפיא תאים דמויי EECM-BMEC ו-SMLCs, לאחר הסרת התווך מבארות, הוסיפו מגיב דיסוציאציה (1 מ"ל/באר) ודגרו על הצלחת ב-37°C עם 5% CO2 עד שהתאים יתנתקו (5-7 דקות ו-20-30 דקות עבור תאים דמויי EECM-BMEC ו-SMLCs, בהתאמה). לאסוף את התאים בצינור צנטריפוגה 15 מ"ל או 50 מ"ל המכיל 4 מ"ל DMEM/F12-10 לכל 1 מ"ל של מגיב דיסוציאציה.
- פיפטה ביסודיות לערבב ולשמור 10 μL של תרחיף התא לספירת תאים. גלולה את התאים על ידי צנטריפוגה ב 200 x גרם במשך 5 דקות ב 20-25 ° C. הסר את supernatant וביסודיות resuspend את התאים בתווך הקפאה לצפיפות של 1.0-2.0 x 106 תאים / מ"ל. להפיץ 1 מ"ל של תרחיף התא לתוך cryotubes טריים.
- מניחים את ה- cryotubes במכשיר הקפאה בקצב מבוקר ומיד להעביר אותם ל -80 ° C. לאחסון לטווח ארוך, ניתן להעביר את הצינורות למיכל חנקן נוזלי 24 עד 48 שעות לאחר ההקפאה.
- להפשרת EPC, תאים דמויי EECM-BMEC ו-SMLCs, גלגלו בקבוקונים של צינוריות קריו-צינוריות בין הידיים או דגרו באמבט מים של 37 מעלות צלזיוס עד שהתאים מופשרים כמעט לחלוטין. הוסף 500 μL של DMEM/F12-10 והעבר בעדינות את תרחיף התא לצינור 15 מ"ל המכיל 4 מ"ל של DMEM/F12-10 בינוני. שטף את צינור ההקפאה פעם אחת על ידי הוספת 1 מ"ל של DMEM / F12-10 ולאחר מכן צנטריפוגה את התאים ב 200 x גרם במשך 5 דקות ב 20-25 ° C.
- שאפו את הסופרנאטנט והשהו מחדש את הגלולה ב-2 מ"ל של תווך hECSR המכיל מעכב ROCK של 5 מיקרומטר (דילול של 1:2,000) לצפיפות של 1.0-2.0 x 10 5 תאים לכל 2 מ"ל עבור EPC, ו-2.0-3.0 x 105 תאים לכל 2 מ"ל עבור תאים דמויי EECM-BMEC ו-SMLCs. פזרו את תרחיף התאים בין הבארות של לוחות 6 בארות מצופות קולגן לאחר שאיפת תמיסת הקולגן.
- הזיזו בעדינות את הצלחות קדימה ואחורה, ואז מצד לצד, על מדף האינקובטור בטמפרטורה של 37°C, 5% CO2 כדי לפזר באופן שווה את התאים בבארות.
- למחרת, החליפו את המדיום בתווך hECSR טרי חסר מעכב ROCK. החליפו את מדיום hECSR כל יומיים עד להשגת 100% מפגש. לאחר מכן, המשך למעבר סלקטיבי עבור EPC (ראה שלב 2.3) ולניתוחים פונקציונליים עבור תאים דמויי EECM-BMEC (ראה שלב 3). לפני ביצוע אפיון מולקולרי ובדיקות פונקציונליות, תאים דמויי EECM-BMEC צריכים להיות 100% קונפלואנטיים, אשר מושגת בדרך כלל 2-3 ימים לאחר ההפשרה.
3. אימות תאים דמויי EECM-BMEC ו-SMLCs
- בדיקת חדירות עבור נותבי מולקולות קטנות
- הערך את שלמות מחסום התא דמוי EECM-BMEC על ידי מדידת חדירות נתרן פלואורסצאין, כפי שתואר על ידי Nishihara et al.26. זרעו את התאים דמויי EECM-BMEC על תוספות מסנן כדי לפתח חד-שכבות שלמות ולמדוד את החדירות של נתרן פלואורסצאין.
- צביעה אימונופלואורסצנטית להערכת מולקולות מפתח.
- עבור צביעה אימונופלואורסצנטית כדי לפקח על ביטוי של מולקולות צומתיות, מולקולות הידבקות, או חלבונים cytoskeletal של תאים דמויי EECM-BMEC בחד-שכבות או של SMLCs, השתמש שקופיות תא, לוחות 96-באר, או ממברנות עם מסנני החדרה. להעריך את ביטוי התא דמוי EECM-BMEC של מולקולות היצמדות פני התא עם או בלי גירוי ציטוקינים דלקתיים, כפי שתואר על ידי Nishihara et al.26.
- ציטומטריית זרימה לניתוח הביטוי של מולקולות היצמדות פני השטח של התא על תאים דמויי EECM-BMEC
- השתמש בציטומטריית זרימה כדי להעריך את הביטוי הכמותי למחצה של מולקולות היצמדות פני השטח של התא המעורבות בנדידת תאי מערכת החיסון למערכת העצבים המרכזית, כולל ICAM-1, ICAM-2, VCAM-1, P-selectin, E-selectin, CD99 ומולקולת הידבקות תאי אנדותל טסיות-1 (PECAM-1), כפי שתואר על ידי Nishihara et al.26. תרבית תאים דמויי EECM-BMEC עם מדיום מותנה SMLC בנוכחות והיעדר ציטוקינים דלקתיים במשך 16-18 שעות.
- בדיקת הידבקות תאי מערכת החיסון בתנאים סטטיים כדי להעריך את הביטוי של מולקולות הידבקות תפקודיות
- השתמש בשיטה שתוארה על ידי Nishihara et al.26 כדי לקבוע אם מולקולות ההיצמדות פני השטח של התא של תאים דמויי EECM-BMEC הן פונקציונליות.
- בקצרה, זרעו את התאים דמויי EECM-BMEC על שקופית תא בגודל 5.5 x 104/cm2 וגדלו למפגש. כ-24 שעות לאחר מכן, שנו את מדיום התרבית למדיום מותנה SMLC בנוכחות או היעדר ציטוקינים מעודדי דלקת, ודגרו על התאים דמויי EECM-BMEC למשך 16 שעות נוספות.
- ביום הניסוי, הפשירו תאי חיסון שמורים בהקפאה (לדוגמה, תאי T או תאים חד-גרעיניים היקפיים בדם [PBMCs]) באמצעות חיץ שטיפת תאי T (טבלה 1) ותווית עם צבעים פלואורסצנטיים (למשל, צבעי מעקב תאים) בתווך של תאי T (טבלה 1). אופטימיזציה של מדיום התרבית עבור תאי החיסון צריכה להיות מותאמת לסוג הספציפי של תאי החיסון הנחקרים.
- בשקופית של 16 בארות, הוסף 2 x 104 תאי Th1 לתאים דמויי EECM-BMEC. באופן ספציפי, כאשר עובדים עם תאי T משפיעים כגון תאי Th1, נצפה כי הם מפגינים התקשרות גדולה יותר לתאים דמויי EECM-BMEC בהשוואה ל- PBMCs (Nishihara. et al. [2022]). כתוצאה מכך, מספר PBMCs שיתווספו לתאים דמויי EECM-BMEC צריך להיות גבוה יותר בהשוואה לתאי T בעלי אפקט טהור.
- דגרו על תאי מערכת החיסון עם השכבה החד-שכבתית של תאים דמויי EECM-BMEC למשך 30 דקות במדיום בדיקת הגירה (טבלה 1). לאחר 30 דקות, שטפו את המגלשה בעדינות, פעמיים על ידי טבילה בצנצנת המכילה PBS של Dulbecco ולאחר מכן תקנו עם תמיסת גלוטראלדהיד 2.5% בטמפרטורה של 4°C למשך שעתיים.
- לאחר הקיבוע, שטפו את המגלשה פעמיים על ידי טבילה בצנצנת המכילה PBS של Dulbecco והרכיבו עם כיסוי. לאחר מכן לרכוש תמונות מיקרוסקופ פלואורסצנטי של מרכז monolayer על שקופיות לספירת תאים חיסוניים המחוברים monolayers תאים דמויי EECM-BMEC.
תוצאות
בדיקת חדירות
החדירות של נתרן פלואורסצאין חושבה על ידי מדידת עוצמת הפלואורסצנטיות של התווך שנאסף מהחדר התחתון ב -15, 30, 45 ו -60 דקות. סך של 150 μL של תווך נדגם בכל נקודת זמן והנפח החסר של 150 μL מוחלף בתווך hECSR. עוצמת הפלואורסצנטיות נקראת באמצעות קורא לוחות פלואורסצנטי (עירור 485 ננומטר/פליטת 530 ננומטר) והאותות, נפחי הסילוק והחדירות הנכונים מחושבים באמצעות נוסחה18 שתוארה קודם לכן (טבלה 2). מומלץ לאשר אם עוצמת הפלואורסצנטיות של נתרן פלואורסצאין עולה עם הזמן. יש להשתמש במסננים מרובים - לפחות טריפליקטים - לבדיקה אחת כדי להבטיח יכולת שחזור. עבור תאים בריאים דמויי EECM-BMEC שמקורם בבקרה, חדירות הנתרן הפלואורסצאין (376 Da) צריכה להיות מתחת ל-0.3 x 10-3 ס"מ/דקה. כדי לאשר את היווצרותו של חד-שכבה תאית דמוית EECM-BMEC, יש לבצע לאחר בדיקה זו צביעה אימונופלואורסצנטית עבור חלבונים צמתים של התאים דמויי EECM-BMEC של כל מסנן המשמש במבחני החדירות.
צביעה אימונופלואורסצנטית
צביעה אימונופלואורסצנטית של מולקולות צומת תאים דמויות EECM-BMEC, כולל claudin-5, occludin ו-VE-cadherin1, שימשה להערכת מורפולוגיה של תאים ונוכחות של צמתים רציפים ובשלים (איור 4). החד-שכבות של תאים דמויי EECM-BMEC על קרומי תוספות המסנן תוקנו במתנול קר (-20 מעלות צלזיוס) למשך 20 שניות, נחסמו באמצעות חיץ חוסם (טבלה 1), ולאחר מכן הודגרו עם נוגדנים ראשוניים ומשניים. התאים דמויי EECM-BMEC הציגו צורות דמויות ציר וצמתים בצורת זיגזג, שניהם מאפיינים מורפולוגיים אופייניים של BMECs27. גירוי של תאים דמויי EECM-BMEC שנזרעו על שקופיות תאים עם ציטוקינים מעודדי דלקת, כגון גורם נמק גידולי-α (TNF-α) ואינטרפרון-γ (INF-γ) (0.1 ננוגרם/מ"ל TNF-α + 2 IU/mL IFN- γ) מדוללים בתווך מותנה שמקורו ב-SMLC, הגבירו את הביטוי של מולקולות הידבקות, כגון ICAM-1 ו-VCAM-128 (איור 5). תמונות מייצגות של סמנים של תאי שריר חלק, כולל אקטין שריר α חלק (SMA), קלפונין וחלבון שריר חלק 22-אלפא (SM22a)29, מוצגות באיור 6. SMLCs שנזרעו במגלשת התא תוקנו עם 4% פרפורמלדהיד למשך 10 דקות, נחסמו עם חיץ חוסם, ולאחר מכן הודגרו עם נוגדנים ראשוניים ומשניים.
ניתוח ציטומטריית זרימה של ביטוי מולקולות היצמדות פני התא על ידי תאים דמויי EECM-BMEC
תוצאות מייצגות עבור ביטוי פני השטח של התא של מולקולות היצמדות אנדותל בתאים דמויי EECM-BMEC מוצגות באיור 7. גירוי עם ציטוקינים מעודדי דלקת, כמו TNF-α ו-INF-γ, שיפר את ביטוי פני התא של מספר מולקולות הידבקות, כולל ICAM-1, VCAM-1 ו-P-selectin. טיפוח תאים דמויי EECM-BMEC עם ביטוי פני השטח של תאי VCAM-1 אנדותל משופר בינוני מותנה SMLC. ההשפעה של השראת ביטוי פני השטח של תא VCAM-1 עשויה להשתנות בין אצוות של מדיום מותנה SMLC. מומלץ לאחסן מספר אצוות של מדיום מותנה שנקטף מ-SMLCs, שמקורו באותו מקור hiPSC, בעת הבחנה בין SMLCs, על מנת לוודא איזו אצווה גורמת לביטוי המתאים של VCAM-1.
בדיקת הידבקות תאי מערכת החיסון בתנאים סטטיים
מספר תאי החיסון המחוברים היה בקורלציה לרמת הביטוי של מולקולות היצמדות תפקודיות על פני השטח של תאים דמויי EECM-BMEC. גירוי באמצעות ציטוקינים דלקתיים שיפר את הביטוי של מולקולות היצמדות אנדותל וקידם את המספר המוגבר של תאי מערכת החיסון שנצמדו לחד-שכבות תאים דמויי EECM-BMEC (איור 8). הניסוי הנוכחי הדגים את הפונקציונליות של מולקולות היצמדות על תאים דמויי EECM-BMEC, מה שהופך מודל זה מתאים לחקר אינטראקציות בין תאי מערכת החיסון ל-EC.

איור 2: טיהור של CD31+ ECs. תרשימי נקודות של נתוני ציטומטריית זרימה מייצגת מפיזור של ECs וצביעה CD31 המסומנת ב- FITC של אוכלוסיות תאים לפני (שלב 1.4.7) ואחרי (שלב 1.4.14) MACS. MACS משפר את הטוהר של CD31+ EPCs באוכלוסייה. קיצורים: SSC = פיזור צד; FSC = פיזור קדימה; FITC = isothiocyanate fluorescein; MACS = מיון תאים מופעל מגנטי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
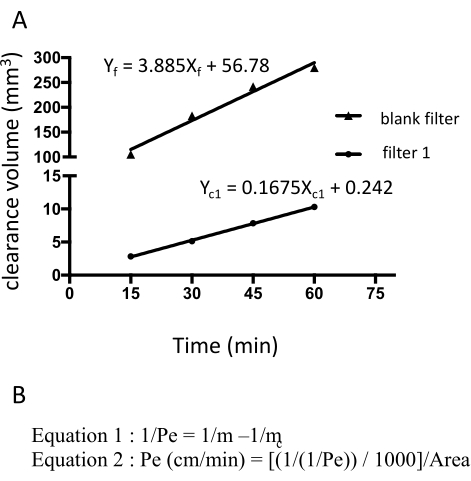
איור 3: חדירות חד-שכבתית EECM-BMEC (10-3 ס"מ/דקה) מחושבת מעוצמת הפלואורסצנטיות הגולמית של נתרן פלואורסצאין. השיפוע הליניארי של נפח הסילוק מחושב באמצעות רגרסיה ליניארית עבור כל מסנן (איור 3A). החדירות של נתרן פלואורסצאין מחושבת באמצעות שתי נוסחאות (איור 3B). (A) השיפוע הליניארי של נפח הפינוי לעומת הזמן חושב באמצעות רגרסיה ליניארית עבור מסנן 1 (mc1) והמסנן הריק (mf). m c1 ו- m f הם מקדמים של Xc1 ו- Xf, בהתאמה. (B) נוסחה לחישוב חדירות פלואורסצאין (Pe) באמצעות mc ו-mf (נוסחה 1). יחידות Pe הומרו באמצעות שטח הפנים של מסנן (פורמולה 2). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: תאים דמויי EECM-BMEC מציגים צמתים תאיים בוגרים. צביעה אימונופלואורסצנטית עבור claudin-5, occludin, או VE-cadherin (אדום) בתאים דמויי EECM-BMEC הגדלים על ממברנות של מסנני החדרה. גרעינים הוכתמו באמצעות 4′,6-diamidino-2-phenylindole (DAPI) (כחול). הצביעה בוצעה בדיוק על אותן תוספות פילטר ששימשו לבדיקות החדירות. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
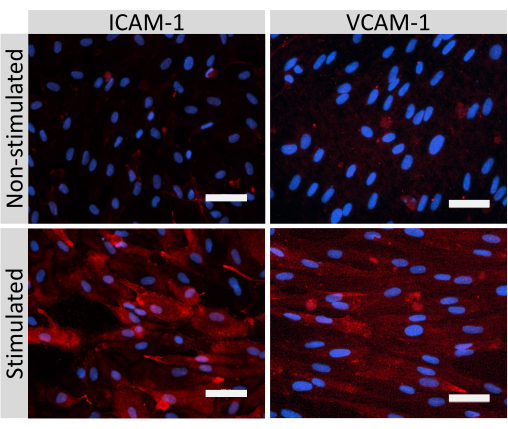
איור 5: ביטוי של מולקולות היצמדות אנדותל על-ידי תאים דמויי EECM-BMEC. צביעה אימונופלואורסצנטית בוצעה על תאים דמויי EECM-BMEC שגדלו על ממברנות של תוספות מסנן בנוכחות CM שמקורו ב-SMLC. צביעה חיסונית עבור ICAM-1 או VCAM-1 (אדום) מוצגת עבור תאים לא מעוררים ו-1 ננוגרם/מ"ל TNF-α + 20 IU/mL IFN- γ תאים דמויי EECM-BMEC מגורה. גרעינים הוכתמו ב-DAPI (כחול). סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: אפיון SMLCs. אימונוציטוכימיה של אקטין שריר α חלק (SMA), קלפונין, או חלבון שריר חלק 22-אלפא (SM22a) (אדום) עבור SMLCs גדל על שקופיות תא מוצג. גרעינים הוכתמו ב-DAPI (כחול). סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
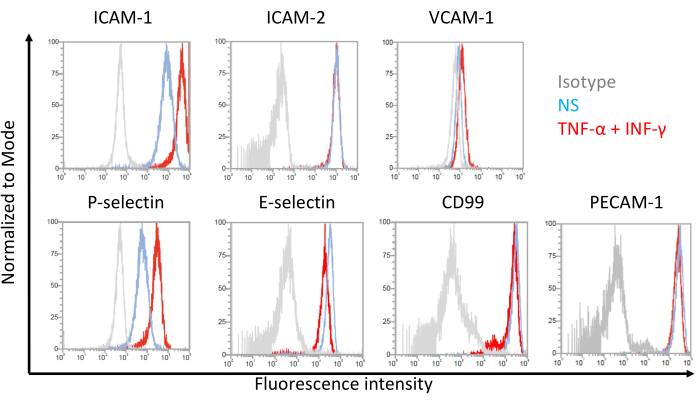
איור 7: ביטוי פני השטח של תאי אנדותל של מולקולות הידבקות בתאים דמויי EECM-BMEC. תוצאות ניתוח ציטומטריית זרימה של ביטוי מולקולות היצמדות פני השטח EC על תאים דמויי EECM-BMEC מוצגות. תאים דמויי EECM-BMEC גודלו בתרבית באמצעות מדיום מותנה שמקורו ב-SMLC. קווים כחולים, אדומים ואפורים של שכבות-העל של ההיסטוגרמה מציגים את המצב הלא-מגורה (NS), 1 ננוגרם/מ"ל TNF-α + 20 IU/מ"ל IFN-γ-stimulated condition, ובקרת איזוטיפ, בהתאמה. הוערך ביטוי פני השטח של מולקולות היצמדות אנדותל, כולל מולקולת היצמדות בין-תאית 1 (ICAM-1), ICAM-2, מולקולת היצמדות תאי כלי דם 1 (VCAM-1), P-selectin, E-selectin, CD99 ומולקולת הידבקות תאי אנדותל טסיות-1 (PECAM-1). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
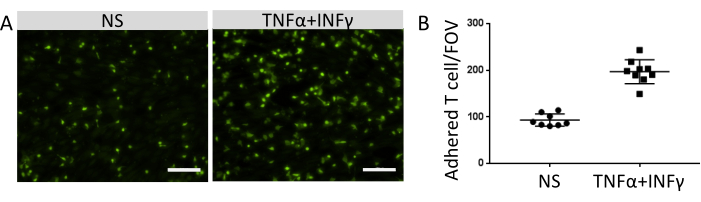
איור 8: הידבקות של תאי מערכת החיסון על תאים דמויי EECM-BMEC. (A) תמונות של תאים חיסוניים דבקים המסומנים באופן פלואורסצנטי על חד-שכבות של תאים לא מגורה (NS) ו-0.1 ננוגרם/מ"ל TNF-α + 2 IU/mL IFN-γ-stimulated (TNF-α + IFN-γ) דמויי EECM-BMEC. התמונות מתאימות למרכזי הבארות. סרגל קנה מידה = 50 מיקרומטר. (B) מספר תאי החיסון המסומנים באופן פלואורסצנטי על חד-שכבות של תאים דמויי NS ו-TNF-α + IFN-γ-stimulated EECM-BMEC. תאים חיסוניים/שדות ראייה נצמדים (FOVs) נספרו אוטומטית באמצעות תוכנת FIJI. נקודות מייצגות את מספר תאי T המחוברים. עמודות מציגות את הערך הממוצע, וסרגלי שגיאה מציגים את סטיית התקן (SD) של שמונה גירסאות ניסיון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: פירוט ריאגנטים ספציפיים למבחנים. השם והכמות המדויקת של המרכיבים עבור כל מגיב ספציפי מתוארים. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: דוגמה לנתונים גולמיים של קורא לוחות פלואורסצנטיים לצורך חישוב Pe. מספרים בכתב מודגש הם עוצמת הפלואורסצנטיות הגולמית של נתרן פלואורסצאין הנמדדת על ידי קורא לוחות. על מנת לנתח במדויק את הנתונים, יש צורך להסיר את אות הרקע מהערכים הגולמיים ולהסביר כל אובדן אות הנובע מדגימת החדר התחתון, ולאחר מכן לתקן את האות. לדוגמה, לאחר חיסור הרקע, הדגימה של 15 דקות מציגה אות של 100 יחידות פלואורסצנטיות יחסיות (RFU), והמדגם של 30 דקות מציג אות של 150 RFU. האות המתוקן ב- 30 דקות הוא (150 RFU + הערכים החסרים ב- 15 דקות [100 RFU x 150 μL / 1,500 μL]), שהוא 150 RFU + 10 RFU = 160 RFU. נפח הסילוק = (1,500 x [S B,t])/(S T,60 min), כאשר 1,500 הוא נפח התא התחתון (1,500 μL), S B,t הוא האות המתוקן בזמן t, ו- S T,60 min הוא האות של התא העליון ב-60 דקות. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
נקודות קריטיות ופתרון בעיות
לפני תחילת התמיינות EPC, החוקרים צריכים לוודא שלא התרחשו אירועי התמיינות תאים ספונטניים בתרביות hiPSC. היעדר תאים ממוינים באופן ספונטני ושימוש במושבות hiPSC טהורות הוא קריטי להשגת תוצאות הניתנות לשחזור. צפיפות הזריעה hiPSC ביום -3 חשובה להשגת טוהר גבוה של CD31+ EPC לאחר MACS. צפיפות הזריעה עבור כל קו hiPSC וכל מעבר עשויה לדרוש אופטימיזציה. בהתאם לקו hiPSC ומספר המעבר, צפיפות הזריעה יכולה לנוע בין 75 x 10 3 עד 400 x 10 3 hiPSCs לכל באר של צלחת 12 בארות (20-100 x 103/cm2). מחסום הצפיפות המינימלי של hiPSCs הוא צפיפות התאים ביום 2. hiPSCs צריך להגיע 100% מפגש עד יום 2 לכל המאוחר. אם hiPSCs אינם נפגשים עד יום 2, הטוהר של CD31+ EPCs לאחר MACS יהיה בדרך כלל נמוך למדי. במקרה זה, ניתן להגדיל את צפיפות הזריעה hiPSC. אם מספר גדול של תאים מתמיינים מתנתקים מהצלחת סביב יום 3 עד יום 5, צפיפות הזריעה הראשונית של hiPSC יכולה להיות מופחתת. 7-8 μM CHIR99021 מניסיוננו הוא הריכוז האופטימלי עבור קווי hiPSC המשמשים כאן, אך ייתכן שיהיה צורך למטב את הריכוז עבור קווי hiPSC אחרים שעשויים להגיב אחרת לטיפול המעכב. יש לאשר את הטוהר של CD31+ EPC לפני ואחרי MACS. לפני שתמשיך MACS, תערובת התאים הממוינת מראש צריכה להיות >10% תאי CD31+. אחוזי תאים CD31+ של <6% בדרך כלל גורמים ל- <80% EPC לאחר MACS. במצב זה יש צורך באופטימיזציה של צפיפות הזריעה הראשונית ו/או ריכוז CHIR99021.
למעבר סלקטיבי מוצלח ויצירה של חד-שכבות EC טהורות, טוהר הפוסט-MACS של CD31+ EPC הוא קריטי. אם הטוהר לאחר MACS הוא <90%, מומלץ לבצע שטיפה אחת או שתיים נוספות (שלבים 1.4.11-1.4.12). באופן אידיאלי, טוהר לאחר MACS צריך להיות >95%. צפיפות הזריעה EPC על לוחות מצופים קולגן צריכה להיות אופטימלית בהתאם לקו hiPSC כדי להשיג 100% מפגש בתוך 3-7 ימים. המתנה עד ECs הם 100% confluent יוביל בדרך כלל מעבר סלקטיבי מוצלח. עם זאת, אפילו עבור ECs 100% מתמזגים, חלק מקווי ה- SMLC של קווי hiPSC גם מתנתקים מוקדם. במקרה זה, מעבר סלקטיבי במפגש נמוך יותר (למשל, ≤80%) עשוי להיות יעיל. אם חלק מה-SMLCs מתנתקים מוקדם יותר מ-ECs, לעתים קרובות לא ניתן להציל את ה-ECs מאוכלוסיית EC-SMLC המעורבת. במקרה זה, קיצור זמן ההפעלה של מגיב הדיסוציאציה ב- ECs עוברי ומעבר סלקטיבי חוזר עשוי להיות מועיל. השימוש בריאגנט דיסוציאציה מסחרי במקום טריפסין כמגיב דיסוציאציה מועיל למעבר סלקטיבי, מכיוון שטריפסין אינו מאפשר ניתוק נפרד של ECs ו- SMLCs. מבחני החדירות שלנו באמצעות נותבי מולקולות קטנות ובדיקות של רמות ביטוי מולקולות צומת והידבקות הדוקות מצביעים על כך שניתן לאחסן EPC, תאים דמויי EECM-BMEC ו- SMLCs בחנקן נוזלי למשך שנתיים לפחות.
משמעויות השיטה ומגבלותיה
השיטה מבדילה בין CD31+ EPCs לבין hiPSCs באמצעות שימוש במעכבי GSK-3 כימיים להפעלת איתות Wnt/β-catenin. לאחר בחירה חיובית של CD31+ EPCs על ידי MACS, EPCs מתורבתים בתווך אנדותל מוגדר המקדם התמיינות לאוכלוסיות אנדותל ו- SMLC מעורבות. מעבר סלקטיבי של אוכלוסיות מעורבות אלה עם תכונות דבק שונות מאפשר הפרדה של ECs מ SMLCs. לאחר מעבר אחד או שניים, תאים דמויי EECM-BMEC מפגינים תכונות מחסום וביטוי של מולקולות היצמדות אנדותל המשחזרות את אלה של BMEC אנושיים ראשוניים. תרבית משותפת עם SMLCs או הסופרנאטנטים שלהם גורמת לביטוי המושרה על ידי ציטוקינים של VCAM-1.
In vivo, BBB שומר על הומאוסטזיס CNS על ידי הקמת חדירות נמוכה פארא-תאית וטרנס-תאית של מולקולות, באמצעות הובלת חומרים מזינים באמצעות טרנספורטרים ספציפיים ובקרת הסחר בתאי מערכת החיסון לתוך מערכת העצבים המרכזית. עבור מחקרים של BBB, מודל מתאים המציג את המולקולות בהתאמה ואת הפונקציות של עניין הוא חיוני. ייצור תאים דמויי EECM-BMEC באמצעות ריאגנטים מוגדרים ודגימות מחולים או נבדקים בריאים מספק מודל BBB אנושי מדרגי. היתרונות של מודל המשתמש בתאים דמויי EECM-BMEC על פני מודלים אחרים של BBB הם: 1) מורפולוגיה ופרופיל שעתוק אנדותל30 הדומה לזה של BMEC אנושיים ראשוניים; 2) נוכחות של צמתים הדוקים בוגרים; 3) תכונות מחסום רצויות; ו-4) הביטוי החזק של מולקולות היצמדות אנדותל, כולל ICAM-1, ICAM-2, VCAM-1, E- ו-P-selectin, CD99, מולקולת היצמדות תאי מלנומה (MCAM), ומולקולת הידבקות תאי לויקוציטים פעילה (ALCAM)22. לכן, מודל זה שימושי במיוחד לחקר אינטראקציות בין תאי מערכת החיסון לבין BMECs. למרות שהחדירות של נותבי מולקולות קטנות גבוהה יותר עבור תאים דמויי EECM-BMEC מאשר זו שדווחה בעבר עבור תאים דמויי BMEC שמקורם ב- iPSC14,15, תכונות המחסום משתוות היטב לאלה שתוארו עבור BMEC אנושיים ראשוניים. דמיון זה מצביע על כך שתאים דמויי EECM-BMEC עשויים להיות מודל טוב במבחנה של BBB. ביטוי E-selectin על תאים דמויי EECM-BMEC בתנאים פיזיולוגיים חייב להילקח בחשבון בעת שימוש במודל זה כדי לחקור BBB לא דלקתי חסר ביטוי E-selectin מכונן in vivo31. במחקר הקודם שלנו, הדגמנו כי תאים דמויי EECM-BMEC יכולים לבצע פנוסקופיה של BBB, כפי שנצפה במוחות של חולי טרשת נפוצה ביחס לצמתים הדוקים משובשים. התוצאה היא חדירות גבוהה יותר של מולקולות קטנות וביטוי מוגבר של מולקולת היצמדות תפקודית, המתווכת את ההיצמדות וההעברה המוגברת של תאי מערכת החיסון על פני תאים דמויי BMEC32. יתר על כן, הראינו כי ההפעלה של איתות Wnt/β-catenin יכולה להקל על ההפרעה של צמתים הדוקים וביטוי מוגבר של VCAM-1 בתאים דמויי EECM-BMEC שמקורם בטרשת נפוצה32. תוצאות אלה מצביעות על כך שהמודל אכן שימושי לחקר תפקידו של BBB במחלות נוירואימונולוגיות, כגון טרשת נפוצה.
יחד, תאים דמויי EECM-BMEC הם כלי מבטיח להבנה מעמיקה של מנגנונים פתופיזיולוגיים ברמת BBB וככלי לפיתוח מטרות טיפוליות חדשות לייצוב BBB. בעתיד, המודל יכול להיות מיושם כדי לחקור תפקוד לקוי של BBB בטווח רחב יותר של מחלות ויכול לפתוח דרכים לגישות טיפוליות חדשניות.
Disclosures
BE קיבלה מענק מחברת ביוג'ן לחקר מינון מורחב של נטליזומאב על נדידת תאי T מעבר למחסום הדם-מוח ומענק מ-CSL Behring כדי לחקור את היסודות המולקולריים של תפקוד לקוי של מחסום דם-מוח בהפרעות נוירולוגיות. HN ו- BE הם ממציאים של בקשות פטנט זמניות בארה"ב הקשורות לתאים דמויי EECM-BMEC (63/084980 ו- 63/185815).
Acknowledgements
HN נתמך על ידי קרן הזיכרון אואהארה, מלגת חילופי מחקר פוסט-דוקטורט של ECTRIMS, JSPS במסגרת תוכנית המחקר המשותפת המיושמת בשיתוף עם SNSF (JRPs) מענק מס 'JPJSJRP20221507 ומענק KAKENHI מס '22K15711, תוכנית יער JST (מספר מענק JPMJFR2269, יפן), קרן YOKOYAMA לפרמקולוגיה קלינית מענק מס 'YRY-2217, קרן איצ'ירו קנהרה, קרן המחקר למדעי המוח Narishige, קרן נוברטיס (יפן) לקידום המדע, וקרן אוניברסיטת ימאגוצ'י. BE נתמך על ידי האגודה השוויצרית לטרשת נפוצה והקרן הלאומית השוויצרית למדע (מענקים 310030_189080 ו- ZLJZ3_214086) ומענק תוכנית המדע והטכנולוגיה האסטרטגית היפנית-שוויצרית (SJSSTP) IZLJZ3_214086.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
References
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372 (2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358 (2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32 (2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679 (2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9 (2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25 (2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118 (2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992 (2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved