Method Article
Diferenciação de Células-Tronco Pluripotentes Induzidas Humanas em Células Semelhantes a Células Endoteliais Microvasculares Cerebrais com Fenótipo Imune Maduro;
Neste Artigo
Resumo
Aqui, descrevemos um protocolo, o método de cultura de células endoteliais estendidas (EECM), que permite a diferenciação de células-tronco pluripotentes em células cerebrais microvasculares semelhantes a células endoteliais (BMEC). Essas células apresentam expressão de moléculas de adesão de células endoteliais e são, portanto, um modelo de barreira hematoencefálica humana adequado para estudar interações de células imunes in vitro.
Resumo
A disfunção da barreira hematoencefálica (BHE) é uma característica patológica de muitas doenças neurodegenerativas e neuroinflamatórias que afetam o sistema nervoso central (SNC). Devido ao acesso limitado a amostras de BBB relacionadas à doença, ainda não é bem compreendido se o mau funcionamento da BHE é causador do desenvolvimento da doença ou se é uma consequência do processo neuroinflamatório ou neurodegenerativo. As células-tronco pluripotentes induzidas humanas (hiPSCs) fornecem, portanto, uma nova oportunidade para estabelecer modelos de BBB in vitro de doadores e pacientes saudáveis e, assim, estudar características BBB específicas da doença de pacientes individuais. Vários protocolos de diferenciação foram estabelecidos para derivar células cerebrais microvasculares semelhantes a células endoteliais (BMEC) de hiPSCs. A consideração da questão específica de pesquisa é mandatória para a correta escolha do respectivo protocolo de diferenciação BMEC. Aqui, descrevemos o método de cultura de células endoteliais estendidas (EECM), que é otimizado para diferenciar hiPSCs em células BMEC-like com um fenótipo imune maduro, permitindo o estudo de interações imune-BBB. Nesse protocolo, as hiPSCs são primeiramente diferenciadas em células progenitoras endoteliais (CPEs) pela ativação da sinalização Wnt/β-catenina. A cultura resultante, que contém células musculares lisas (SMLCs), é então sequencialmente passada para aumentar a pureza das células endoteliais (CEs) e induzir propriedades específicas de BBB. O co-cultivo de EECM-BMECs com esses SMLCs ou meio condicionado de SMLCs permite a expressão reprodutível, constitutiva e regulada por citocinas de moléculas de adesão de CE. É importante ressaltar que as células EECM-BMEC-like estabelecem propriedades de barreira comparáveis às BMECs humanas primárias, e devido à sua expressão de todas as moléculas de adesão EC, as células EECM-BMEC-like são diferentes de outros modelos de BBB in vitro derivados de hiPSC. As células EECM-BMEC-like são, portanto, o modelo de escolha para investigar o impacto potencial dos processos da doença ao nível do BBB, com um impacto na interacção das pilhas imunes de uma forma personalizada.
Introdução
A unidade neurovascular (NVU) no sistema nervoso central (SNC) consiste nas células endoteliais microvasculares (CE) altamente especializadas, pericitos embutidos na membrana basal endotelial, bem como na membrana basal parenquimatosa e na extremidade dos pés dos astrócitos1. Dentro da NVU, as células endoteliais microvasculares cerebrais (BMECs) são os principais componentes que formam a barreira hematoencefálica (BHE). BMECs formam tight junctions complexas e contínuas e têm atividade pinocitótica extremamente baixa em comparação com CE microvasculares em órgãos periféricos, o que permite que a BHE iniba a livre difusão paracelular de moléculas solúveis em água para o SNC. A expressão de transportadores de influxo específicos e bombas de efluxo por BMECs garante a captação e exportação de nutrientes e moléculas nocivas, respectivamente, do SNC2. Além disso, o BBB controla estritamente a entrada de células imunes no SNC, expressando baixos níveis de moléculas de adesão endotelial cruciais para o tráfego de células imunes para o SNC3. Em condições fisiológicas, os níveis de expressão de moléculas de adesão na superfície das BMECs, como a molécula de adesão intercelular-1 (ICAM-1) e a molécula de adesão celular vascular-1 (VCAM-1), são baixos, mas esses níveis aumentam em alguns distúrbios neurológicos2. O colapso morfológico e funcional da BHE é relatado em muitas doenças neurológicas, como acidente vascular cerebral4, esclerose múltipla (EM)5 e várias doenças neurodegenerativas 6,7,8. A investigação detalhada das características celulares e moleculares de BMECs sob condições fisiológicas e patológicas é uma abordagem para identificar novas estratégias terapêuticas que tenham como alvo a BHE.
Até recentemente, BMECs humanos e roedores primários ou imortalizados eram usados para estudar a BHE. No entanto, não está claro se as conclusões baseadas em modelos animais de BHE são prontamente aplicáveis à BBB humana, uma vez que a expressão de várias moléculas importantes, incluindo moléculas de adesão e proteínas carreadoras de solutos, difere entre humanos e roedores 9,10. Embora linhagens humanas de BMEC como hCMEC/D3 expressem níveis apropriados de moléculas de adesão11, essas BMECs imortalizadas geralmente não possuem tight junctions complexas e propriedades de barreira robustas12. BMECs humanas primárias são úteis para estudar funções de barreira13, mas não estão prontamente disponíveis para todos os pesquisadores. Além disso, BMECs primários de pacientes podem ser difíceis de obter, uma vez que devem ser coletados através de uma biópsia cerebral ou cirurgia que só é realizada em condições clínicas específicas.
Avanços recentes na tecnologia de células-tronco têm permitido a diferenciação de vários tipos de células humanas, oriundas de fontes de células-tronco como as células-tronco pluripotentes induzidas humanas (hiPSCs). Os modelos derivados da hiPSC permitem estabelecer modelos fisiopatológicos utilizando amostras derivadas de pacientes. Vários tipos celulares derivados de hiPSC podem ser combinados para estabelecer co-culturas autólogas ou organoides que melhor mimetizam condições fisiológicas. Vários protocolos amplamente utilizados 14,15,16,17,18,19 podem ser usados para diferenciar células BMEC derivadas de hiPSC que apresentam propriedades robustas de barreira à difusão com a expressão de transportadores específicos para BBB e bombas de efluxo e são úteis para estudar a difusão paracelular de pequenas moléculas, mecanismos de transporte molecular e liberação de fármacos para o cérebro 20,21. No entanto, estudos anteriores mostraram que células BMEC-like derivadas de hiPSC amplamente utilizadas não têm a expressão de moléculas-chave de adesão endotelial, incluindo VCAM-1, selectinas e ICAM-2, que são responsáveis por mediar interações entre as células imunes e a BBB22. Além disso, BMECs anteriores derivadas de hiPSC apresentam características endoteliais e epiteliais mistas no nível transcricional23. Portanto, desenvolvemos o método de cultura de células endoteliais estendidas (EECM), um novo protocolo que permite a diferenciação de hiPSCs em células BMEC-like que se assemelham a BMECs humanas primárias em relação à morfologia, características de barreira e expressão de moléculas de adesão endotelial. Este protocolo descreve os procedimentos metodológicos detalhados para diferenciar hiPSCs de células BMEC-like exibindo um fenótipo imune maduro.
Protocolo
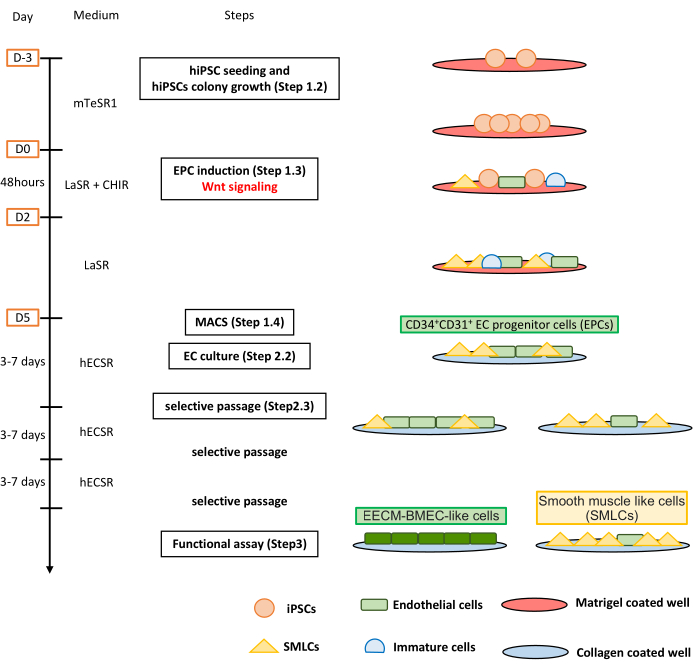
Figura 1: Visão geral do protocolo. O manuscrito apresenta um protocolo passo-a-passo para diferenciar hiPSCs em células EECM-BMEC-like. Os esquemas corretos retratam as populações celulares em cada etapa. Clique aqui para ver uma versão maior desta figura.
A linha hiPSC, HPS1006, foi fornecida pela RIKEN BRC através do National Bio-Resource Project do MEXT/AMED, Japão.
1. Indução da diferenciação de hiPSC em células progenitoras endoteliais (CPEs)
- Placas e reagentes revestidos com matriz extracelular (MEC)
- Preparar placas de 12 poços revestidas com matriz de membrana basal aliquotando 2,5 mg de gel de matriz em tubos de centrífuga de 50 mL para armazenamento a -20 °C por até 6 meses. Adicionar 30 mL da mistura F-12 (DMEM/F12) modificada de Eagle modificada com Dulbecco (DMEM/F12), mantida em geladeira (4 °C), no tubo. Misturar suavemente por pipetagem até que o gel tenha descongelado e, em seguida, adicionar 500 μL da solução a cada poço da placa de 12 poços. Colocar a placa numa incubadora (37 °C, 5% CO2) durante, pelo menos, 1 h.
NOTA: O gel de matriz de membrana basal é sensível à temperatura e deve ser manuseado de acordo com as instruções do fabricante para aliquotação e revestimento de placas. A concentração de proteínas da matriz extracelular pode variar entre os lotes. Para garantir a exactidão, a concentração exacta deve ser referida na ficha de certificado de qualidade do lote específico, utilizando o número do lote. Por exemplo, se a concentração exata for 10,0 mg/mL, use 250 μL de gel para um total de 2,5 mg. - Preparar a solução estoque do inibidor da roquinase (ROCK) dissolvendo o inibidor de ROCK em água estéril até uma concentração de 10 mM (Tabela 1). Aliquot a solução-mãe em volumes de 100-200 μL e armazenar a -20 °C para evitar ciclos de congelamento-descongelamento.
- Completar uma solução-mãe de 100 mg/ml de ácido L-ascórbico dissolvendo 5 g de ácido L-ascórbico em 50 ml de água estéril e conservar a -20 °C (Tabela 1). Adicionar 6,25 mL de glutamina e 305 μL de solução estoque de ácido L-ascórbico em 500 mL de DMEM/F12 avançado para formar um meio LaSR24 (Tabela 1). Conservar a 2-8 °C até 2 semanas.
- Preparar a solução de CHIR99021 dissolvendo CHIR99021 em dimetilsulfóxido não diluído (DMSO) até uma concentração final de 10 mM (Tabela 1). Aliquot a solução em volumes de 100-200 μL para evitar ciclos de congelamento-descongelamento e armazenar a -20 °C por até 1 ano. Conservar alíquotas de trabalho da solução-mãe a 4 °C durante um período máximo de 1 mês.
- Preparar o meio DMEM/F12-10 adicionando 50 mL de soro fetal bovino inativado pelo calor a 450 mL de DMEM/F12. Conservar o meio a 2-8 °C por até 1 mês (Tabela 1).
- Preparar tampão de fluxo-1 adicionando 33,3 mL de albumina de soro bovino (BSA) a 7,5% a 467 mL de solução salina tamponada com fosfato (PBS) de Dulbecco (Tabela 1). Conservar a 2-8 °C até 6 meses.
- Preparar placas de 12 poços revestidas com matriz de membrana basal aliquotando 2,5 mg de gel de matriz em tubos de centrífuga de 50 mL para armazenamento a -20 °C por até 6 meses. Adicionar 30 mL da mistura F-12 (DMEM/F12) modificada de Eagle modificada com Dulbecco (DMEM/F12), mantida em geladeira (4 °C), no tubo. Misturar suavemente por pipetagem até que o gel tenha descongelado e, em seguida, adicionar 500 μL da solução a cada poço da placa de 12 poços. Colocar a placa numa incubadora (37 °C, 5% CO2) durante, pelo menos, 1 h.
- Semeadura de hiPSCs singularizadas e expansão para diferenciação de CPE (Dia -3 ao Dia -1)
- Inicia-se a diferenciação quando as colônias hiPSC em uma placa de 6 poços não apresentam diferenciação espontânea e têm a densidade apropriada para passagem, tipicamente em torno de 80% de confluência (2,5-3,5 x 106 células). Monitore cuidadosamente células espontaneamente diferenciadas sob o microscópio para garantir se múltiplas passagens são necessárias para eliminar células não diferenciadas. Consulte a nota fornecida abaixo passo 1.4.15 para obter informações sobre o meio de cultura celular e a matriz extracelular.
- Aspirar o meio e adicionar 1 mL de reagente de dissociação aos poços e incubar por 5-7 min a 37 °C. Dissociar e singularizar as células pipetando suavemente a solução reagente de dissociação sobre as superfícies dos poços duas ou três vezes.
- Transfira as células destacadas para um tubo de 15 mL contendo 4 mL de meio de manutenção hiPSC e ressuspenda as células completamente. Reserve uma alíquota de 10 μL para contagem celular.
- Pellet as células centrifugando por 5 min a 200 x g a 20-25 °C. Contar as células e calcular o volume necessário para atingir uma densidade adequada de hiPSCs (75-400 x 103 por poço) em uma placa de 12 poços revestida com matriz de membrana basal (passo 1.1.1).
- Aspirar a solução de revestimento dos poços e adicionar 1 mL de meio hiPSC contendo 10 μM de inibidor de ROCK em cada poço (diluição de 1:1.000). Após centrifugação, aspirar o sobrenadante e dissociar o pellet em 1 mL de meio hiPSC.
- Adicionar o volume necessário de hiPSC, determinado no passo 1.2.4, a cada poço da placa de 12 poços. Duas a quatro placas de 12 poços podem ser suficientes para diferenciar um clone de hiPSC. Consulte a etapa 1.2.4 para determinar o número de placas necessárias para a semeadura de células.
- Coloque a placa numa incubadora (37 °C, 5% CO2). Distribua uniformemente as células deslizando suavemente a placa para frente e para trás e, em seguida, de um lado para o outro na incubadora.
- No dia seguinte (ou seja, Dia -2), trocar o meio por 2 mL de meio de manutenção hiPSC sem inibidor de ROCK. No dia seguinte (Dia -1), trocar o meio com 2 mL de meio de manutenção fresco de hiPSC.
- Indução de CPE com o inibidor da glicogênio sintase quinase 3 (GSK-3) CHIR99021 (Dia 0 ao Dia 5)
- No Dia 0, substituir o meio de manutenção hiPSC em cada poço por 2 mL de meio LaSR contendo 8 μM CHIR99021.
- No Dia 1, aspirar o meio e adicionar 2 mL de meio LaSR fresco contendo 8 μM CHIR99021.
- Nos dias 2, 3 e 4, substitua o meio por 2 mL de meio LaSR fresco sem CHIR99021.
- Classificação de células ativadas por magnetismo (MACS) para purificar CD31+ EPCs (Dia 5)
- No dia 5, aspirar o meio e, em seguida, adicionar 1 mL de reagente de dissociação a cada poço, antes de incubar por 6-8 min a 37 °C.
- Dissociar e singularizar as células com uma micropipeta e passar através de um filtro celular de 40 μm para filtrar a suspensão em um tubo de 50 mL contendo 10 mL de meio DMEM/F12-10. Filtrar a suspensão celular coletada de mais de duas placas de 12 poços em pelo menos dois tubos de 50 mL.
- Parar a reação de digestão adicionando meio DMEM/F12-10 (até 50 mL). Pipetar bem e reservar 10 μL para contagem de células. Pellet as células centrifugando por 5 min a 200 x g a 20-25 °C.
- Após a remoção do sobrenadante, adicionar 10 mL de meio DMEM/F12-10 e transferir a suspensão celular para tubos frescos de 15 mL. Pellet as células centrifugando por 5 min a 200 x g a 20-25 °C.
- Aspirar o sobrenadante e ressuspender em tampão de fluxo-1 a uma densidade de 1,0 x 107 células por 100 μL de tampão.
- Adicionar o reagente bloqueador de FcR na proporção de 1:100 e incubar por 5 min antes de adicionar o anticorpo CD31 marcado com isotiocianato de fluoresceína (FITC) diluído 1:200. Incubar a suspensão durante 30 minutos no escuro a 20-25 °C.
- Adicionar 10 mL de tampão de fluxo-1, reservando 10 μL da suspensão para análise por citometria de fluxo para determinação da fração de células CD31+ (Figura 2).
- Pellet as células centrifugando a 200 x g por 5 min a 20-25 °C. Em seguida, remova o sobrenadante e ressuspenda até uma densidade de 1,0 x 107 células por 100 μL de solução de tampão de fluxo-1. Adicione o cocktail de selecção FITC (5 μL por 100 μL de suspensão celular). Misturar abundantemente por pipetagem e incubar no escuro durante 15 minutos a 20-25 °C.
- Adicionar 5 μL de nanopartículas magnéticas por 100 μL de suspensão celular, pipetar bem e incubar no escuro por 10 min a 20-25 °C.
- Transfira a suspensão celular para um tubo de citometria de fluxo de 5 mL e adicione tampão de fluxo-1 para atingir um volume total de 2,5 mL. Coloque o tubo de citometria de fluxo no ímã por 5 min.
- Em um movimento contínuo, inverta o ímã e decante a suspensão celular contendo células que não foram marcadas com o anticorpo FITC-CD31. Mantenha o ímã e o tubo na posição invertida por 2-3 s e, em seguida, remova o líquido restante. Aspirar quaisquer gotículas na borda do tubo antes de retornar o tubo à posição vertical.
- Pegue o tubo de citometria de fluxo do ímã e adicione 2,5 mL de tampão de fluxo-1 para lavar as células CD31+ restantes. Ressuspenda as células pipetando suavemente as células para cima e para baixo duas ou três vezes. Coloque o tubo de fluxo no ímã por 5 min.
- Repita as etapas 1.4.11-1.4.12 três vezes e, em seguida, a etapa 1.4.11 mais uma vez para um total de quatro lavagens.
- Remova o tubo de fluxo do ímã e adicione a quantidade indicada de um meio adequado (por exemplo, meio livre de soro endotelial humano [hECSR] para cultura de EC estendida ou meio de congelamento para congelamento) ao tubo para ressuspender as células CD31+ purificadas. Reserve duas alíquotas de 10 μL da suspensão, uma para contagem de células e a segunda para análise por citometria de fluxo para avaliar a pureza das células CD31+ em amostras pós-MACS (Figura 2). Se um citómetro de fluxo não estiver disponível imediatamente, conservar a alíquota a 4 °C até à análise.
- Se as próximas etapas (até a etapa 2) não puderem ser executadas imediatamente, congele as EPCs CD31+ neste ponto. Para expansão e passagem seletiva de EPCs, prossiga para a etapa 2.
NOTA: As placas de 12 poços revestidas com vitronectina de25 poços e o meio de manutenção hiPSC mais estável (mTeSR plus) podem ser usados no lugar das placas revestidas com matriz de membrana basal e do meio de manutenção hiPSC (mTeSR1). Para preparar placas de 12 poços revestidas com vitronectina, diluir a vitronectina com tampão de diluição até uma concentração final de 10 μg/mL e, em seguida, transferir 500 μL da solução diluída para cada poço das placas de 12 poços. Deixe as placas a 20-25 °C por pelo menos 1 h. A densidade de semeadura de hiPSCs singularizadas é comparável àquela usada para placas revestidas com matriz de membrana basal. A alteração do meio de cultura ou da composição da matriz pode afetar a proliferação e diferenciação espontânea das hiPSCs, que normalmente requerem 1-2 semanas para se adaptar às novas condições de cultura. Se o meio de manutenção hiPSC mais estável for usado para manutenção hiPSC, este meio pode ser usado para diferenciação EPC em vez do meio de manutenção hiPSC. Neste caso, o meio de manutenção hiPSC mais estável deve ser trocado no Dia -2 para remover o inibidor de ROCK, e a troca no Dia -1 pode ser ignorada.
2. Método de cultura de células endoteliais estendidas (EECM) para diferenciar células cerebrais microvasculares semelhantes a células endoteliais (BMEC-like) e células músculo-semelhantes lisas (SMLCs)
- Preparação de placas e reagentes revestidos com colágeno
- Preparar placas de 6 poços revestidas com colágeno dissolvendo 5 mg de colágeno cristalizado tipo IV em 5 mL de água estéril. Incubar durante a noite a 4 °C antes de aliquotar e armazenar a -20 °C. Diluir alíquotas de colágeno IV 1:100 em água estéril para produzir 10 μg/mL de soluções e adicionar 1 mL de 10 μg/mL de soluções de colágeno IV a cada poço das placas de 6 poços. Incubar as placas durante, pelo menos, 30 minutos a 37 °C. As placas podem ser armazenadas a 37 °C por até 1 semana.
- Preparar uma solução-mãe de fator de crescimento de fibroblastos humanos 2 (FGF2) dissolvendo 500 μg de FGF em 5 mL de PBS de Dulbecco, adicionar BSA a 7,5% até uma concentração final de 0,1% e alicitar a solução estoque em volumes de 20-200 μL. Estes podem ser armazenados a -20 °C por até 3 meses (Tabela 1). As soluções-estoque podem ser armazenadas a 4 °C por até 1 mês; Evite ciclos de congelamento-descongelamento. Preparar o meio hECSR adicionando 2 mL de suplemento B-27 e 20 μL de FGF2 em 98 mL de meio hECSR (Tabela 1). O meio hECSR pode ser armazenado a 2-8 °C por até 2 semanas.
- Preparar o meio de congelamento para as CPEs, células EECM-BMEC-like e SMLCs adicionando 15 mL de soro fetal bovino, 5 mL de DMSO e 25 μL de solução inibidora de ROCK a 30 mL de meio hECSR (Tabela 1). O meio de congelação pode ser armazenado a 2-8 °C por até 2 semanas.
- Semeando CPEs para cultura de células endoteliais estendidas
- Remova a solução de colágeno das placas de 6 poços. Em seguida, transferir 1,0-2,0 x 10 5 EPCs CD31+ purificadas em 2 mL de meio hECSR contendo5 μM de inibidor de ROCK (diluição de 1:2.000). Coloque a placa numa incubadora (37 °C, 5% CO2). Distribua uniformemente as células, deslizando suavemente as placas para frente e para trás, depois de um lado para o outro.
- No dia seguinte, remova o meio hECSR contendo inibidor de ROCK e adicione 2 mL de meio hECSR fresco sem inibidor de ROCK. Troque o meio hECSR a cada dois dias até atingir 100% de confluência.
NOTA: Se um horário de alimentação regular não puder ser mantido durante um fim de semana, o meio pode ser substituído na noite do último dia útil da semana e novamente no início da manhã após o fim de semana.
- Passagem seletiva para purificar células EECM-BMEC-like e SMLCs
- Remova o meio hECSR das placas de 6 poços que contêm uma mistura de CE e populações não-CE. Adicionar 1 mL de reagente de dissociação a cada poço.
- Monitorar cuidadosamente a morfologia celular ao microscópio. Quando as ECs (mas não as não-ECs) aparecerem brilhantes e redondas (normalmente dentro de 2-5 min), desconecte-as tocando na borda da placa. A maioria dos não-CE permanece presa à placa.
- Recolher os CE destacados utilizando uma micropipeta, tomando o cuidado de evitar a ressuspensão dos não-CE. Transferir as CEs para um tubo centrífugo de 15 mL ou 50 mL contendo 4 mL de DMEM/F12-10 por 1 mL de reagente de dissociação.
- Adicionar 2 mL de meio hECSR aos poços contendo os não-CE anexados restantes para estabelecer SMLCs. Coloque a placa na incubadora.
- Pipetar a suspensão EC no tubo da centrífuga para misturar completamente e reservar 10 μL da suspensão para contagem celular. Centrifugar as células restantes durante 5 minutos a 200 x g a 20-25 °C. Retire o sobrenadante do pellet e adicione 2 mL de meio hECSR por 1,0-2,0 x 105 CEs.
- Após a remoção da solução de colágeno IV de uma nova placa de 6 poços, adicionar 2 mL de suspensão de EC a cada poço, seguido de incubação a 37 °C com CO2 a 5%. Para distribuir uniformemente as células na placa, mova-a suavemente em um movimento para frente e para trás e de um lado para o outro na prateleira da incubadora.
- Substitua o meio hECSR a cada dois dias até que as CEs atinjam 100% de confluência.
- Repetir os passos 2.3.1-2.3.7 até obter uma monocamada CE pura. Se as etapas a seguir não puderem ser executadas, congele os ECs CD31+ (consulte a etapa 2.4.2). Para analisar as funções do EC, prossiga para a etapa 3.
NOTA: Em geral, duas ou três passagens seletivas são necessárias para obter culturas quase puras de CE que são adequadas para análises funcionais, e consideramos essas células como células EECM-BMEC-like. Após mais de cinco ou seis passagens, a proliferação celular tipicamente diminui, embora essa variável dependa da linha hiPSC. - Para cultivar SMLCs, substitua o meio hECSR a cada dois dias. Para coletar o meio condicionado SMLC (CM), passe o meio coletado através de um filtro de 0,22 μm a cada troca de meio. O CM pode ser usado para upregulation da expressão VCAM-1 de células EECM-BMEC-like. Agrupe o SMLC-CM até que os SMLCs atinjam 100% de confluência.
- EPC, EECM-BMEC-like cell, e SMLC criopreservação e descongelamento
- Para congelar as CPE, após a lavagem final do MACS (passo 1.4.13), ressuspenda as CPE em meio de congelação em vez de meio hECSR a uma densidade de 1,0-2,0 x 106 células/mL. Distribuir 1 mL da suspensão celular em criotubos. Coloque os criotubos em um dispositivo de congelamento de taxa controlada e transfira-os rapidamente para -80 °C. Para armazenamento a longo prazo, mova os tubos para um tanque de nitrogênio líquido 24 a 48 h após o congelamento.
- Para congelar células EECM-BMEC-like e SMLCs, após a remoção do meio dos poços, adicionar reagente de dissociação (1 mL/poço) e incubar a placa a 37 °C com 5% de CO2 até que as células se desprendam (5-7 min e 20-30 min para células EECM-BMEC-like e SMLCs, respectivamente). Coletar as células em um tubo centrífugo de 15 mL ou 50 mL contendo 4 mL de DMEM/F12-10 por 1 mL de reagente de dissociação.
- Pipetar bem para misturar e reservar 10 μL da suspensão celular para contagem celular. Pellet as células centrifugando a 200 x g por 5 min a 20-25 °C. Remova o sobrenadante e ressuspenda completamente as células em meio de congelamento até uma densidade de 1,0-2,0 x 106 células/mL. Distribuir 1 ml da suspensão celular em criotubos frescos.
- Coloque os criotubos num dispositivo de congelação a uma taxa controlada e transfira-os imediatamente para -80 °C. Para armazenamento a longo prazo, os tubos podem ser transferidos para um tanque de nitrogênio líquido 24 a 48 h após o congelamento.
- Para descongelar EPCs, células EECM-BMEC-like e SMLCs, enrole frascos de criotubos entre as mãos ou incube em banho-maria a 37 °C até que as células estejam quase completamente descongeladas. Adicionar 500 μL de DMEM/F12-10 e transferir suavemente a suspensão celular para um tubo de 15 mL contendo 4 mL de meio DMEM/F12-10. Lavar o criotubo uma vez adicionando 1 ml de DMEM/F12-10 e, em seguida, centrifugar as células a 200 x g durante 5 minutos a 20-25 °C.
- Aspirar o sobrenadante e ressuspender o pellet em 2 mL de meio hECSR contendo 5 μM de inibidor de ROCK (diluição de 1:2.000) a uma densidade de 1,0-2,0 x 10 5 células por 2 mL para CPEs, e 2,0-3,0 x 105 células por 2 mL para células EECM-BMEC-like e SMLCs. Distribuir a suspensão celular entre os orifícios das placas de 6 poços revestidas de colágeno após aspirar a solução de colágeno.
- Mover suavemente as placas para frente e para trás, depois de um lado para o outro, na prateleira de uma incubadora a 37 °C, 5 % CO2 para distribuir uniformemente as células nos poços.
- No dia seguinte, troque o meio por meio hECSR fresco sem inibidor de ROCK. Troque o meio hECSR a cada dois dias até que 100% de confluência seja alcançada. Em seguida, proceda à passagem seletiva para CPE (ver etapa 2.3) e análises funcionais para células EECM-BMEC-like (ver etapa 3). Antes de realizar a caracterização molecular e ensaios funcionais, as células EECM-BMEC-like devem ser 100% confluentes, o que normalmente é alcançado 2-3 dias após o descongelamento.
3. Validação de células EECM-BMEC-like e SMLCs
- Ensaio de permeabilidade para traçadores de pequenas moléculas
- Avaliar a integridade da barreira celular EECM-BMEC-like medindo a permeabilidade à fluoresceína sódica, conforme descrito por Nishihara et al.26. Semeando as células EECM-BMEC-like em inserções de filtro para desenvolver monocamadas completas e medir a permeabilidade da fluoresceína de sódio.
- Coloração por imunofluorescência para avaliar moléculas-chave.
- Para a coloração por imunofluorescência para monitorar a expressão de moléculas juncionais, moléculas de adesão ou proteínas do citoesqueleto de células EECM-BMEC-like em monocamadas ou de SMLCs, use lâminas de câmara, placas de 96 poços ou membranas com filtros de inserção. Avaliar a expressão celular EECM-BMEC-like de moléculas de adesão da superfície celular com ou sem estimulação de citocinas inflamatórias, como descrito por Nishihara et al.26.
- Citometria de fluxo para análise da expressão de moléculas de adesão da superfície celular em células EECM-BMEC-like
- Utilizar citometria de fluxo para avaliar a expressão semiquantitativa de moléculas de adesão da superfície celular envolvidas na migração de células imunes para o SNC, incluindo ICAM-1, ICAM-2, VCAM-1, P-selectina, E-selectina, CD99 e molécula de adesão de células endoteliais plaquetárias-1 (PECAM-1), conforme descrito por Nishihara et al.26. Cultivar células EECM-BMEC-like com meio condicionado por SMLC na presença e ausência de citocinas inflamatórias por 16-18 h.
- Ensaio de adesão imune celular em condições estáticas para avaliar a expressão de moléculas de adesão funcionais
- Utilizar o método descrito por Nishihara et al.26 para determinar se as moléculas de adesão à superfície celular das células EECM-BMEC-like são funcionais.
- Resumidamente, semeie as células EECM-BMEC-like em uma lâmina de câmara a 5,5 x 104/cm2 e cresça até a confluência. Cerca de 24 h depois, trocar o meio de cultura para meio condicionado por SMLC na presença ou ausência de citocinas pró-inflamatórias e incubar as células EECM-BMEC-like por mais 16 h.
- No dia do experimento, descongelar células imunes criopreservadas (por exemplo, células T ou células mononucleares do sangue periférico [PBMCs]) com tampão de lavagem de células T (Tabela 1) e marcar com corantes fluorescentes (por exemplo, corantes rastreadores de células) em meio de células T (Tabela 1). A otimização do meio de cultura para as células imunes deve ser adaptada ao tipo específico de células imunes em estudo.
- Em uma lâmina de câmara de 16 poços, adicione 2 x 104 células Th1 às células EECM-BMEC-like. Especificamente, ao trabalhar com células T efetoras, como as células Th1, observou-se que elas exibem maior ligação às células EECM-BMEC-like em comparação com as PBMCs (Nishihara. et al. [2022]). Consequentemente, o número de PBMCs a serem adicionados às células EECM-BMEC-like precisa ser maior em comparação com as células T efetoras puras.
- Incubar as células imunes com a monocamada de células EECM-BMEC-like por 30 min em meio de ensaio de migração (Tabela 1). Após 30 min, lavar suavemente a lâmina, duas vezes imergindo em um frasco contendo PBS de Dulbecco e, em seguida, fixar com solução de glutaraldeído a 2,5% a 4 °C por 2 h.
- Após a fixação, lave a lâmina duas vezes mergulhando em um frasco contendo PBS de Dulbecco e monte com uma lamínula. Posteriormente, adquirir imagens de microscopia de fluorescência do centro da monocamada nas lâminas para contagem de células imunes ligadas a monocamadas celulares EECM-BMEC-like.
Resultados
Ensaio de permeabilidade
A permeabilidade da fluoresceína sódica foi calculada medindo-se a intensidade da fluorescência do meio coletado da câmara inferior aos 15, 30, 45 e 60 min. Um total de 150 μL de meio é amostrado em cada ponto de tempo e o volume ausente de 150 μL é substituído por meio hECSR. a intensidade da fluorescência é lida usando um leitor de placa fluorescente (excitação de 485 nm/emissão de 530 nm) e os sinais, volumes de depuração e permeabilidades corretos são calculados usando uma fórmula previamente descrita18 (Tabela 2). Recomenda-se confirmar se a intensidade de fluorescência da fluoresceína sódica aumenta ao longo do tempo. Vários filtros - pelo menos triplicados - devem ser usados para um ensaio para garantir a reprodutibilidade. Para células saudáveis derivadas do controle EECM-BMEC-like, a permeabilidade à fluoresceína sódica (376 Da) deve ser inferior a 0,3 x 10-3 cm/min. Para confirmar a formação de uma monocamada celular confluente EECM-BMEC-like, a coloração de imunofluorescência para proteínas juncionais das células EECM-BMEC-like de cada filtro usado nos ensaios de permeabilidade deve ser realizada após este ensaio.
Coloração por imunofluorescência
A coloração por imunofluorescência de moléculas juncionais celulares EECM-BMEC-like, incluindo claudina-5, ocludina e VE-caderina1, foi usada para avaliar a morfologia celular e a presença de junções contínuas e maduras (Figura 4). As monocamadas de células EECM-BMEC-like nas membranas das pastilhas filtrantes foram fixadas com metanol frio (-20 °C) por 20 s, bloqueadas com tampão de bloqueio (Tabela 1) e, em seguida, incubadas com anticorpos primários e secundários. As células EECM-BMEC-like exibiram formas fusiformes e junções em zigue-zague, ambas características morfológicas características das BMECs27. A estimulação das células EECM-BMEC-like semeadas em lâminas de câmara com citocinas pró-inflamatórias, como fator de necrose tumoral-α (TNF-α) e interferon-γ (INF-γ) (0,1 ng/mL TNF-α + 2 UI/mL IFN-γ) diluídas em meio condicionado derivado de SMLC, aumentou a expressão de moléculas de adesão, como ICAM-1 e VCAM-128 (Figura 5). Imagens representativas de marcadores de células musculares lisas, incluindo actina de músculo α liso (AMS), calponina e proteína de músculo liso 22-Alfa (SM22a)29, são mostradas na Figura 6. Os SMLCs semeados na lâmina da câmara foram fixados com paraformaldeído a 4% por 10 min, bloqueados com tampão de bloqueio e, em seguida, incubados com anticorpos primários e secundários.
Análise por citometria de fluxo da expressão de moléculas de adesão à superfície celular por células EECM-BMEC-like
Resultados representativos para a expressão na superfície celular de moléculas de adesão endotelial em células EECM-BMEC semelhantes a EECM-BMEC são mostrados na Figura 7. A estimulação com citocinas pró-inflamatórias, como TNF-α e INF-γ, aumentou a expressão na superfície celular de várias moléculas de adesão, incluindo ICAM-1, VCAM-1 e P-selectina. O cultivo de células EECM-BMEC-like com meio condicionado por SMLC aumentou a expressão endotelial da superfície celular VCAM-1. O efeito da indução da expressão da superfície celular VCAM-1 pode variar entre lotes de meio condicionado por SMLC. Recomenda-se que vários lotes de meio condicionado colhidos de SMLCs, derivados da mesma fonte hiPSC, sejam armazenados ao diferenciar SMLCs, a fim de verificar qual lote induz a expressão apropriada de VCAM-1.
Ensaio de adesão de células imunes em condições estáticas
O número de células imunes aderidas correlacionou-se com o nível de expressão de moléculas de adesão funcionais na superfície de células EECM-BMEC-like. A estimulação com citocinas inflamatórias aumentou a expressão das moléculas de adesão endotelial e promoveu o aumento do número de células imunes aderidas às monocamadas celulares EECM-BMEC-like (Figura 8). O experimento atual demonstrou a funcionalidade de moléculas de adesão em células EECM-BMEC-like, tornando este modelo adequado para estudar interações imune-CE.

Figura 2: Purificação das CE CD31+ . Gráficos de pontos de dados representativos de citometria de fluxo de dispersão de CE e coloração CD31 marcada com FITC de populações celulares antes (etapa 1.4.7) e após (etapa 1.4.14) MACS. MACS melhora a pureza de EPCs CD31+ na população. Abreviações: SSC = dispersão lateral; FSC = dispersão para frente; FITC = isotiocianato de fluoresceína; MACS = classificação de células ativadas por magnética. Clique aqui para ver uma versão maior desta figura.
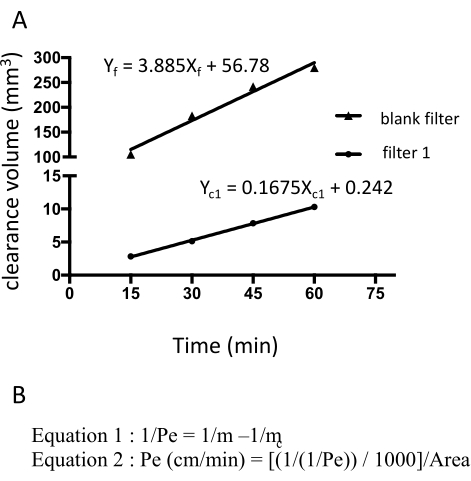
Figura 3: Permeabilidade da monocamada EECM-BMEC (10-3 cm/min) calculada a partir da intensidade bruta de fluorescência da fluoresceína sódica. A inclinação linear do volume de folga é calculada usando regressão linear para cada filtro (Figura 3A). A permeabilidade da fluoresceína sódica é calculada usando duas fórmulas (Figura 3B). (A) A inclinação linear do volume de folga versus o tempo foi calculada usando regressão linear para o filtro 1 (mc1) e o filtro em branco (mf). O m c1 e m f são coeficientes de Xc1 e Xf, respectivamente. (B) Fórmula para o cálculo da permeabilidade à fluoresceína (Pe) utilizando mc e mf (Fórmula 1). As unidades de Pe foram convertidas usando a área de superfície de um filtro (Fórmula 2). Clique aqui para ver uma versão maior desta figura.

Figura 4: Células EECM-BMEC-like exibem junções celulares maduras. Coloração por imunofluorescência para claudina-5, ocludina ou VE-caderina (vermelho) em células EECM-BMEC-like cultivadas em membranas de filtros de inserção. Os núcleos foram corados com 4′,6-diamidino-2-fenilindol (DAPI) (azul). A coloração foi realizada exatamente nas mesmas pastilhas de filtro utilizadas para os ensaios de permeabilidade. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
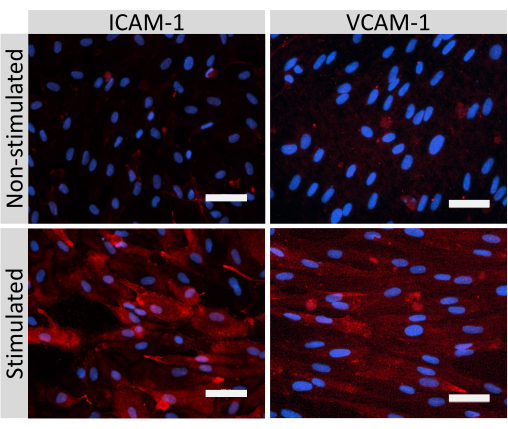
Figura 5: Expressão de moléculas de adesão endotelial por células EECM-BMEC-like. A coloração por imunofluorescência foi realizada em células EECM-BMEC-like cultivadas em membranas de inserções de filtro na presença de CM derivadas de SMLC. A imunomarcação para ICAM-1 ou VCAM-1 (vermelho) é mostrada para células não estimuladas e 1 ng/mL de TNF-α + 20 UI/mL de IFN- γ estimuladas por EECM-BMEC-like. Os núcleos foram corados com DAPI (azul). Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Caracterização dos SMLCs. A imunocitoquímica da actina de músculo liso α (AMS), calponina ou proteína 22-alfa de músculo liso (SM22a) (vermelho) para SMLCs cultivadas em lâminas de câmara é mostrada. Os núcleos foram corados com DAPI (azul). Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
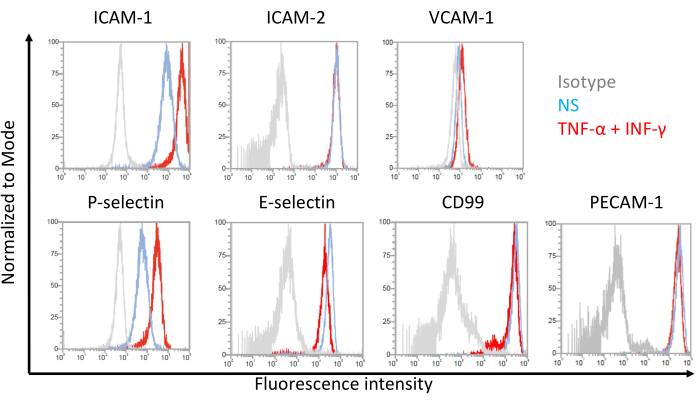
Figura 7: Expressão de moléculas de adesão na superfície celular endotelial em células EECM-BMEC-like. Resultados da análise por citometria de fluxo da expressão de moléculas de adesão de superfície de CE em células EECM-BMEC-like são mostrados. Células EECM-BMEC-like foram cultivadas usando meio condicionado derivado de SMLC. As linhas azul, vermelha e cinza das sobreposições do histograma mostram a condição não estimulada (NS), 1 ng/mL de TNF-α + 20 UI/mL de IFN-γ-estimulado e controle isotípico, respectivamente. A expressão na superfície celular de moléculas de adesão endotelial, incluindo molécula de adesão intercelular 1 (ICAM-1), ICAM-2, molécula de adesão celular vascular 1 (VCAM-1), P-selectina, E-selectina, CD99 e molécula de adesão de células endoteliais plaquetárias-1 (PECAM-1) foi avaliada. Clique aqui para ver uma versão maior desta figura.
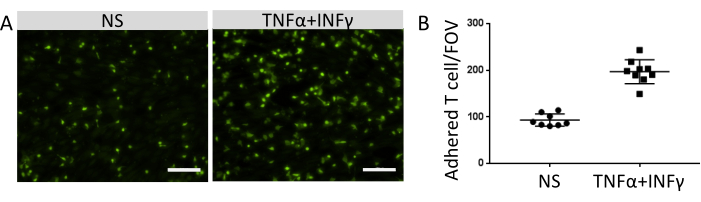
Figura 8: Adesão de células imunes em células EECM-BMEC-like. (A) Imagens de células imunes aderentes marcadas fluorescentemente em monocamadas celulares não estimuladas (NS) e 0,1 ng/mL de TNF-α + 2 UI/mL estimuladas por IFN-γ (TNF-α + IFN-γ) EECM-BMEC-like. As imagens correspondem aos centros dos poços. Barra de escala = 50 μm. (B) O número de células imunes marcadas fluorescentemente em monocamadas de NS e células de α TNF-γ + células EECM-BMEC-like estimuladas por IFN-. As células/campos de visão imunes aderentes (FOVs) foram contados automaticamente usando o software FIJI. Os pontos representam o número de células T anexadas. As barras mostram o valor médio e as barras de erro mostram o desvio padrão (DP) de oito tentativas. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Detalhes dos reagentes específicos para os ensaios. O nome e a quantidade exata de ingredientes para cada reagente específico são descritos. Clique aqui para baixar esta tabela.
Tabela 2: Exemplo de dados brutos do leitor de placas de fluorescência para cálculo de Pe. Números em negrito são a intensidade bruta de fluorescência da fluoresceína de sódio medida por um leitor de placas. Para analisar com precisão os dados, é necessário remover o sinal de fundo dos valores brutos e contabilizar qualquer perda de sinal resultante da amostragem da câmara inferior e, posteriormente, corrigir o sinal. Por exemplo, após subtrair o fundo, a amostra de 15 min exibe um sinal de 100 unidades de fluorescência relativa (RFU), e a amostra de 30 min exibe um sinal de 150 RFU. O sinal corrigido em 30 min é (150 RFU + os valores faltantes em 15 min [100 RFU x 150 μL/1.500 μL]), que é 150 RFU + 10 RFU = 160 RFU. O volume de folga = (1.500 x [S B,t])/(S T,60 min), onde 1.500 é o volume da câmara inferior (1.500 μL), S B,t é o sinal corrigido no tempo t e ST,60 min é o sinal da câmara superior a 60 min. Clique aqui para baixar esta Tabela.
Discussão
Pontos críticos e solução de problemas
Antes de iniciar a diferenciação das CPE, os pesquisadores devem garantir que nenhum evento de diferenciação celular espontânea tenha ocorrido nas culturas de hiPSC. A ausência de células espontaneamente diferenciadas e o uso de colônias puras de hiPSC são fundamentais para a obtenção de resultados reprodutíveis. A densidade de semeadura hiPSC no Dia -3 é importante para a obtenção de uma alta pureza de EPCs CD31+ após MACS. A densidade de semeadura para cada linha hiPSC e cada passagem pode exigir otimização. Dependendo da linha hiPSC e do número de passagem, a densidade de semeadura pode variar entre 75 x 10 3 a 400 x 10 3 hiPSCs por poço de uma placa de 12 poços (20-100 x 10 3/cm 2). O ponto de verificação de densidade mínima de hiPSCs é a densidade celular no Dia 2. As hiPSCs devem atingir 100% de confluência até o Dia 2, o mais tardar. Se as hiPSCs não forem confluentes até o Dia 2, a pureza das EPCs CD31+ após MACS geralmente será bastante baixa. Neste caso, a densidade de semeadura hiPSC pode ser aumentada. Se um grande número de células diferenciadoras se desprender da placa por volta do Dia 3 ao Dia 5, a densidade inicial de semeadura hiPSC pode ser diminuída. O CHIR99021 de 7-8 μM em nossa experiência é a concentração ideal para as linhagens de hiPSCs usadas aqui, mas a concentração pode precisar ser otimizada para outras linhas de hiPSC que podem responder de forma diferente ao tratamento com inibidor. A pureza das CPE CD31+ deve ser confirmada antes e depois da MACS. Antes de continuar o MACS, a mistura celular pré-selecionada deve ser de >10% de células CD31+. Porcentagens de células CD31+ de <6% tipicamente resultam em <80% de CPE após MACS. A otimização da densidade inicial de semeadura e/ou da concentração de CHIR99021 é necessária nesta situação.
Para o sucesso da passagem seletiva e geração de monocamadas de EC puras, a pureza pós-MACS das EPCs CD31+ é crítica. Se a pureza após o MACS for de <90%, recomenda-se uma ou duas lavagens adicionais (passos 1.4.11-1.4.12). O ideal é que a pureza pós-MACS seja de >95%. A densidade de semeadura de CPE em placas revestidas com colágeno deve ser otimizada de acordo com a linha hiPSC para atingir 100% de confluência dentro de 3-7 dias. Esperar até que as CEs sejam 100% confluentes geralmente levará a uma passagem seletiva bem-sucedida. No entanto, mesmo para ECs 100% confluentes, os SMLCs de algumas linhas hiPSC também se desprendem precocemente. Nesse caso, a passagem seletiva em confluência mais baixa (por exemplo, ≤80%) pode ser eficaz. Se alguns SMLCs se separarem mais cedo do que os ECs, os ECs muitas vezes não poderão ser resgatados da população mista EC-SMLC. Nesse caso, encurtar o tempo de ativação do reagente de dissociação em CE de passagem e passagem seletiva repetitiva pode ser útil. O uso de um reagente de dissociação comercial em vez de tripsina como reagente de dissociação é benéfico para a passagem seletiva, pois a tripsina não permite o desprendimento separado de CE e SMLCs. Nossos ensaios de permeabilidade usando traçadores de moléculas pequenas e testes de níveis de expressão de moléculas de junção apertada e adesão indicam que EPCs, células EECM-BMEC-like e SMLCs podem ser armazenadas em nitrogênio líquido por pelo menos 2 anos.
Significado e limitações do método
O método diferencia as CPEs CD31+ das hiPSCs através do uso de inibidores químicos da GSK-3 para ativar a sinalização Wnt/β-catenina . Após a seleção positiva de CPEs CD31+ pela MACS, as CPE são cultivadas em um meio endotelial definido que promove a diferenciação em populações endoteliais mistas e SMLC. A passagem seletiva dessas populações mistas com diferentes propriedades adesivas permite a separação das CEs das SMLCs. Após uma ou duas passagens, as células EECM-BMEC-like exibem propriedades de barreira e a expressão de moléculas de adesão endotelial que recapitulam as de BMECs humanas primárias. A co-cultura com SMLCs ou seus sobrenadantes induz a expressão de VCAM-1 induzida por citocinas.
In vivo, a BHE mantém a homeostase do SNC ao estabelecer baixa permeabilidade paracelular e transcelular das moléculas, através do transporte de nutrientes via transportadores específicos e do controle do tráfego de células imunes para o SNC. Para estudos da BHE, um modelo adequado que exiba as respectivas moléculas e funções de interesse é essencial. A produção de células EECM-BMEC-like usando reagentes definidos e amostras de pacientes ou indivíduos saudáveis fornece um modelo de BBB humano escalável. As vantagens de um modelo utilizando células EECM-BMEC-like sobre outros modelos BBB são: 1) um perfil morfológico e transcriptoma endotelial30 que se assemelha ao de BMECs humanas primárias; 2) presença de tight junctions maduras; 3) propriedades de barreira desejáveis; e 4) a expressão robusta de moléculas de adesão endotelial, incluindo ICAM-1, ICAM-2, VCAM-1, E- e P-selectina, CD99, molécula de adesão de células de melanoma (MCAM) e molécula de adesão de células leucocitárias ativadas (ALCAM)22. Assim, este modelo é particularmente útil para estudar interações entre células imunes e BMECs. Embora a permeabilidade de pequenas moléculas traçadoras seja maior para células EECM-BMEC-like do que aquela previamente relatada para células BMEC-like derivadas de iPSC14,15, as propriedades de barreira se comparam muito bem àquelas descritas para BMEC humanas primárias. Essa similaridade indica que células EECM-BMEC-like provavelmente são um bom modelo in vitro da BBB. A expressão de E-selectina em células EECM-BMEC-like em condições fisiológicas deve ser levada em consideração ao usar este modelo para estudar BBBs não inflamados que não expressam E-selectina constitutiva in vivo31. Em nosso estudo anterior, demonstramos que as células EECM-BMEC-like poderiam fenocopiar a BBB, como observado no cérebro de pacientes com EM em relação a junções apertadas rompidas. Isso resulta em maior permeabilidade de pequenas moléculas e maior expressão de moléculas de adesão funcional, mediando o aumento da adesão e transmigração de células imunes através das células BMEC-like32. Além disso, mostramos que a ativação da sinalização Wnt/β-catenina pode melhorar a ruptura das tight junctions e o aumento da expressão de VCAM-1 em células EECM-BMEC-like derivadas da MS32. Esses resultados indicam que o modelo é realmente útil para estudar o papel da BHE em doenças neuroimunológicas, como a SM.
Em conjunto, as células EECM-BMEC-like são uma ferramenta promissora para a compreensão aprofundada dos mecanismos fisiopatológicos no nível da BBB e como uma ferramenta para desenvolver novos alvos terapêuticos para a estabilização da BBB. No futuro, o modelo pode ser aplicado para estudar a disfunção BBB em um espectro mais amplo de doenças e pode abrir caminhos para novas abordagens terapêuticas.
Divulgações
BE recebeu uma concessão da Biogen para estudar a dosagem estendida de Natalizumab na migração de células T através da barreira hematoencefálica e uma concessão da CSL Behring para investigar os fundamentos moleculares da disfunção da barreira hematoencefálica em distúrbios neurológicos. HN e BE são inventores dos pedidos de patente provisórios dos EUA relacionados às células EECM-BMEC-like (63/084980 e 63/185815).
Agradecimentos
O HN foi apoiado pela Uehara Memorial Foundation, uma bolsa de intercâmbio de pesquisa de pós-doutorado ECTRIMS, JSPS no âmbito do Programa de Pesquisa Conjunta implementado em associação com o SNSF (JRPs) Grant No. JPJSJRP20221507 e KAKENHI Grant No. 22K15711, JST FOREST Program (Grant Number JPMJFR2269, Japão), YOKOYAMA Foundation for Clinical Pharmacology Grant No. YRY-2217, a FUNDAÇÃO ICHIRO KANEHARA, a Fundação de Pesquisa em Neurociência Narishige, a Fundação NOVARTIS (Japão) para a Promoção da Ciência e o FUNDO UNIVERSITÁRIO YAMAGUCHI. O BE foi apoiado pela Swiss MS Society e pela Swiss National Science Foundation (bolsas 310030_189080 e ZLJZ3_214086) e pelo Programa Estratégico de Ciência e Tecnologia Japonês-Suíço (SJSSTP) IZLJZ3_214086.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
Referências
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372(2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358(2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32(2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679(2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733(2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9(2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25(2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118(2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563(2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992(2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados