Method Article
Differenzierung von humanen induzierten pluripotenten Stammzellen zu mikrovaskulären Endothelzellzellen des Gehirns mit einem reifen Immunphänotyp
In diesem Artikel
Zusammenfassung
In dieser Arbeit beschreiben wir ein Protokoll, die erweiterte Endothelzellkulturmethode (EECM), die die Differenzierung von pluripotenten Stammzellen zu mikrovaskulären Endothelzellen (BMEC)-ähnlichen Zellen des Gehirns ermöglicht. Diese Zellen zeigen die Expression von Endothelzelladhäsionsmolekülen und sind somit ein humanes Blut-Hirn-Schrankenmodell, das geeignet ist, Immunzellinteraktionen in vitro zu untersuchen.
Zusammenfassung
Die Dysfunktion der Blut-Hirn-Schranke (BHS) ist ein pathologisches Kennzeichen vieler neurodegenerativer und neuroinflammatorischer Erkrankungen des zentralen Nervensystems (ZNS). Aufgrund des eingeschränkten Zugangs zu krankheitsbedingten BHS-Proben ist es immer noch nicht gut verstanden, ob eine Fehlfunktion der BHS ursächlich für die Krankheitsentstehung ist oder eher eine Folge des neuroinflammatorischen oder neurodegenerativen Prozesses. Humane induzierte pluripotente Stammzellen (hiPS-Zellen) bieten daher eine neuartige Möglichkeit, in vitro BHS-Modelle von gesunden Spendern und Patienten zu etablieren und damit krankheitsspezifische BHS-Charakteristika einzelner Patienten zu untersuchen. Es wurden mehrere Differenzierungsprotokolle etabliert, um mikrovaskuläre Endothelzellen (BMEC)-ähnliche Zellen des Gehirns aus hiPS-Zellen zu gewinnen. Die Berücksichtigung der spezifischen Forschungsfrage ist für die richtige Wahl des jeweiligen BMEC-Differenzierungsprotokolls zwingend erforderlich. In dieser Arbeit beschreiben wir die erweiterte Endothelzellkulturmethode (EECM), die darauf optimiert ist, hiPS-Zellen in BMEC-ähnliche Zellen mit einem reifen Immunphänotyp zu differenzieren, was die Untersuchung von Immunzell-BHS-Interaktionen ermöglicht. In diesem Protokoll werden hiPS-Zellen zunächst durch die Aktivierung des Wnt/β-Catenin-Signalwegs in endotheliale Vorläuferzellen (EPCs) differenziert. Die resultierende Kultur, die glattmuskelähnliche Zellen (SMLCs) enthält, wird dann sequenziell passaget, um die Reinheit der Endothelzellen (ECs) zu erhöhen und BHS-spezifische Eigenschaften zu induzieren. Die Co-Kultur von EECM-BMECs mit diesen SMLCs oder konditioniertem Medium aus SMLCs ermöglicht die reproduzierbare, konstitutive und zytokinregulierte Expression von EC-Adhäsionsmolekülen. Wichtig ist, dass EECM-BMEC-ähnliche Zellen Barriereeigenschaften entwickeln, die mit primären humanen BMECs vergleichbar sind, und aufgrund ihrer Expression aller EC-Adhäsionsmoleküle unterscheiden sich EECM-BMEC-ähnliche Zellen von anderen hiPSC-abgeleiteten in vitro BHS-Modellen. EECM-BMEC-ähnliche Zellen sind daher das Modell der Wahl, um die möglichen Auswirkungen von Krankheitsprozessen auf der Ebene der BHS zu untersuchen, die sich auf die Interaktion von Immunzellen auf personalisierte Weise auswirken.
Einleitung
Die neurovaskuläre Einheit (NVU) im zentralen Nervensystem (ZNS) besteht aus den hochspezialisierten mikrovaskulären Endothelzellen (ECs), in die Endothelmembran eingebetteten Perizyten sowie der parenchymalen Basalmembran und den Astrozytenendfüßen1. Innerhalb der NVU sind mikrovaskuläre Endothelzellen (BMECs) des Gehirns die Schlüsselkomponenten, die die Blut-Hirn-Schranke (BHS) bilden. BMECs bilden komplexe und kontinuierliche Tight Junctions und haben im Vergleich zu mikrovaskulären ECs in peripheren Organen eine extrem geringe pinozytotische Aktivität, die es der BHS ermöglichen, die freie parazelluläre Diffusion von wasserlöslichen Molekülen in das ZNS zu hemmen. Die Expression spezifischer Influxtransporter und Effluxpumpen durch BMECs sichert die Aufnahme und den Export von Nährstoffen bzw. schädlichen Molekülen aus dem ZNS2. Darüber hinaus kontrolliert die BHS den Eintritt von Immunzellen in das ZNS streng, indem sie geringe Mengen an endothelialen Adhäsionsmolekülen exprimiert, die für den Transport von Immunzellen in das ZNS entscheidendsind 3. Unter physiologischen Bedingungen sind die Expressionsniveaus von Adhäsionsmolekülen auf der Oberfläche von BMECs, wie z. B. interzelluläres Adhäsionsmolekül-1 (ICAM-1) und vaskuläres Zelladhäsionsmolekül-1 (VCAM-1), niedrig, aber diese Konzentrationen steigen bei einigen neurologischen Erkrankungenan 2. Ein morphologischer und funktioneller Zusammenbruch der BHS wird bei vielen neurologischen Erkrankungen berichtet, wie z. B. Schlaganfall4, Multiple Sklerose (MS)5 und mehreren neurodegenerativen Erkrankungen 6,7,8. Die detaillierte Untersuchung der zellulären und molekularen Eigenschaften von BMECs sowohl unter physiologischen als auch unter pathologischen Bedingungen ist ein Ansatz, um neue therapeutische Strategien zu identifizieren, die auf die BHS abzielen.
Bis vor kurzem wurden primäre oder immortalisierte BMECs von Menschen und Nagetieren verwendet, um die BHS zu untersuchen. Es ist jedoch unklar, ob Schlussfolgerungen, die auf Tiermodellen der BHS basieren, ohne weiteres auf die menschliche BHS übertragbar sind, da die Expression mehrerer wichtiger Moleküle, einschließlich Adhäsionsmolekülen und Trägerproteinen für gelöste Stoffe, zwischen Menschen und Nagetieren unterschiedlichist 9,10. Obwohl humane BMEC-Linien wie hCMEC/D3 angemessene Mengen an Adhäsionsmolekülenexprimieren 11, weisen diese immortalisierten BMECs im Allgemeinen keine komplexen Tight Junctions und robusten Barriereeigenschaften12 auf. Primäre humane BMECs sind nützlich, um Barrierefunktionenzu untersuchen 13, aber sie sind nicht für alle Forscher ohne weiteres verfügbar. Darüber hinaus kann es schwierig sein, primäre BMECs von Patienten zu erhalten, da sie durch eine Gehirnbiopsie oder eine Operation gewonnen werden müssen, die nur unter bestimmten klinischen Bedingungen durchgeführt wird.
Jüngste Fortschritte in der Stammzelltechnologie haben die Differenzierung verschiedener menschlicher Zelltypen ermöglicht, die aus Stammzellquellen wie humanen induzierten pluripotenten Stammzellen (hiPSCs) stammen. Die von hiPSC abgeleiteten Modelle ermöglichen es uns, pathophysiologische Modelle unter Verwendung von Patientenproben zu erstellen. Mehrere aus hiPS-Zellen stammende Zelltypen können kombiniert werden, um autologe Kokulturen oder Organoide zu etablieren, die physiologische Bedingungen besser nachahmen. Mehrere weit verbreitete Protokolle 14,15,16,17,18,19 können verwendet werden, um von hiPSC abgeleitete BMEC-ähnliche Zellen zu unterscheiden, die robuste Diffusionsbarriereeigenschaften mit der Expression von BHS-spezifischen Transportern und Effluxpumpen aufweisen und nützlich sind, um die parazelluläre Diffusion kleiner Moleküle, molekulare Transportmechanismen und die Wirkstoffabgabe an das Gehirn zu untersuchen 20,21. Frühere Studien haben jedoch gezeigt, dass weit verbreiteten BMEC-ähnlichen Zellen aus hiPSC die Expression wichtiger endothelialer Adhäsionsmoleküle fehlt, darunter VCAM-1, Selektine und ICAM-2, die für die Vermittlung von Interaktionen zwischen Immunzellen und der BHS22 verantwortlich sind. Darüber hinaus wurde berichtet, dass frühere hiPSC-abgeleitete BMECs gemischte endotheliale und epitheliale Merkmale auf transkriptioneller Ebene aufweisen23. Daher haben wir die erweiterte Endothelzellkulturmethode (EECM) entwickelt, ein neuartiges Protokoll, das die Differenzierung von hiPSCs in BMEC-ähnliche Zellen ermöglicht, die primären humanen BMECs in Bezug auf Morphologie, Barriereeigenschaften und Expression von endothelialen Adhäsionsmolekülen ähneln. Dieses Protokoll beschreibt detailliert die methodischen Verfahren zur Differenzierung von hiPS-Zellen zu BMEC-ähnlichen Zellen, die einen reifen Immunphänotyp aufweisen.
Protokoll
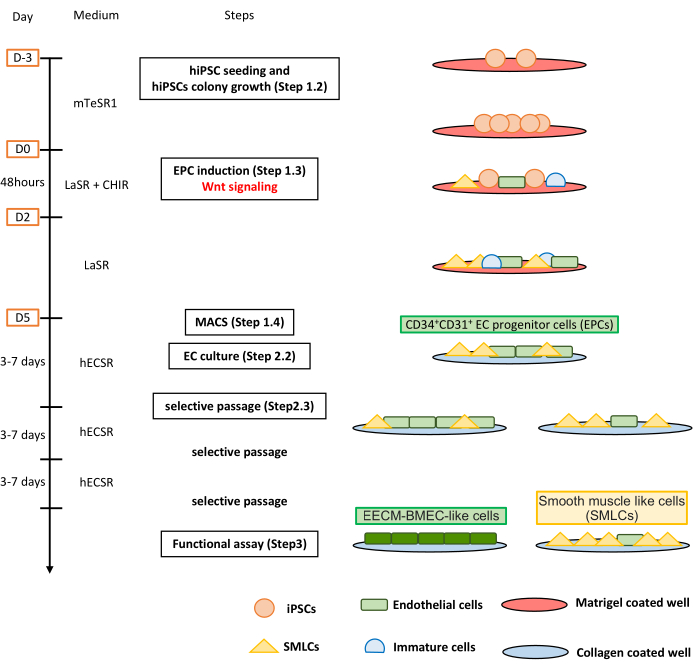
Abbildung 1: Überblick über das Protokoll. Das Manuskript stellt ein Schritt-für-Schritt-Protokoll zur Differenzierung von hiPS-Zellen in EECM-BMEC-ähnliche Zellen vor. Die richtigen Schemata stellen die Zellpopulationen bei jedem Schritt dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die hiPSC-Linie, HPS1006, wurde vom RIKEN BRC im Rahmen des National Bio-Resource Project der MEXT/AMED, Japan, zur Verfügung gestellt.
1. Induktion der hiPSC-Differenzierung in endotheliale Vorläuferzellen (EPCs)
- Mit extrazellulärer Matrix (ECM) beschichtete Platten und Reagenzien
- Bereiten Sie die mit der Basalmembranmatrix beschichteten 12-Well-Platten vor, indem Sie 2,5 mg Matrixgel in 50-ml-Zentrifugenröhrchen zur Lagerung bei -20 °C für bis zu 6 Monate aliquotieren. Geben Sie 30 ml kaltes Dermalcos modifiziertes Eagle's Medium/Nährstoff-Gemisch F-12 (DMEM/F12), das im Kühlschrank (4 °C) aufbewahrt wurde, in das Röhrchen. Mischen Sie vorsichtig durch Pipettieren, bis das Gel aufgetaut ist, und geben Sie dann 500 μl der Lösung in jede Vertiefung der 12-Well-Platte. Legen Sie die Platte für mindestens 1 h in einen Inkubator (37 °C, 5%CO 2).
HINWEIS: Das Basalmembranmatrix-Gel ist temperaturempfindlich und sollte gemäß den Anweisungen des Herstellers für die Aliquotierung und Plattenbeschichtung gehandhabt werden. Die Konzentration der Proteine der extrazellulären Matrix kann von Charge zu Charge variieren. Um die Genauigkeit zu gewährleisten, sollte die genaue Konzentration auf dem Qualitätszertifikatsblatt für die jeweilige Charge unter Verwendung der Chargennummer angegeben werden. Wenn die genaue Konzentration beispielsweise 10,0 mg/ml beträgt, verwenden Sie 250 μl Gel für insgesamt 2,5 mg. - Die Stammlösung des Rho-Kinase-Inhibitors (ROCK) wird hergestellt, indem der ROCK-Inhibitor in sterilem Wasser auf eine Konzentration von 10 mM aufgelöst wird (Tabelle 1). Aliquotieren Sie die Stammlösung in 100-200 μl Volumina und lagern Sie sie bei -20 °C, um Gefrier-Auftau-Zyklen zu vermeiden.
- Eine 100 mg/ml L-Stammlösung von L-Ascorbinsäure wird hergestellt, indem 5 g L-Ascorbinsäure in 50 ml sterilem Wasser aufgelöst und bei -20 °C gelagert werden (Tabelle 1). 6,25 ml Glutamin und 305 μl L-Ascorbinsäure-Stammlösung werden in 500 ml fortschrittliches DMEM/F12 gegeben, um ein LaSR-Medium24 herzustellen (Tabelle 1). Bei 2-8 °C bis zu 2 Wochen lagern.
- Herstellung der CHIR99021-Lösung durch Auflösen von CHIR99021 in unverdünntem Dimethylsulfoxid (DMSO) bis zu einer Endkonzentration von 10 mM (Tabelle 1). Aliquotieren Sie die Lösung in 100-200 μl Volumina, um Gefrier-Auftau-Zyklen zu vermeiden, und lagern Sie sie bis zu 1 Jahr bei -20 °C. Lagern Sie Arbeitsaliquote der Stammlösung bei 4 °C bis zu 1 Monat lang.
- Bereiten Sie DMEM/F12-10-Medium vor, indem Sie 50 ml hitzeinaktiviertes fötales Kälberserum zu 450 ml DMEM/F12 hinzufügen. Lagern Sie das Medium bei 2-8 °C bis zu 1 Monat (Tabelle 1).
- Bereiten Sie den Flusspuffer-1 vor, indem Sie 33,3 ml 7,5 % Rinderserumalbumin (BSA) zu 467 ml Dulbeccos phosphatgepufferter Kochsalzlösung (PBS) hinzufügen (Tabelle 1). Bei 2-8 °C bis zu 6 Monate lagern.
- Bereiten Sie die mit der Basalmembranmatrix beschichteten 12-Well-Platten vor, indem Sie 2,5 mg Matrixgel in 50-ml-Zentrifugenröhrchen zur Lagerung bei -20 °C für bis zu 6 Monate aliquotieren. Geben Sie 30 ml kaltes Dermalcos modifiziertes Eagle's Medium/Nährstoff-Gemisch F-12 (DMEM/F12), das im Kühlschrank (4 °C) aufbewahrt wurde, in das Röhrchen. Mischen Sie vorsichtig durch Pipettieren, bis das Gel aufgetaut ist, und geben Sie dann 500 μl der Lösung in jede Vertiefung der 12-Well-Platte. Legen Sie die Platte für mindestens 1 h in einen Inkubator (37 °C, 5%CO 2).
- Seeding singularisierter hiPSCs und Expansion zur EPC-Differenzierung (Tag -3 bis Tag -1)
- Beginnen Sie mit der Differenzierung, wenn die hiPSC-Kolonien in einer 6-Well-Platte keine spontane Differenzierung zeigen und die geeignete Dichte für die Passaging aufweisen, typischerweise etwa 80% Konfluenz (2,5-3,5 x 106 Zellen). Überwachen Sie spontan differenzierte Zellen sorgfältig unter dem Mikroskop, um sicherzustellen, dass mehrere Passagen erforderlich sind, um undifferenzierte Zellen zu eliminieren. Informationen zu Zellkulturmedium und extrazellulärer Matrix finden Sie im Hinweis unter Schritt 1.4.15.
- Das Medium wird angesaugt, 1 ml Dissoziationsreagenz in die Vertiefungen gegeben und 5-7 Minuten bei 37 °C inkubiert. Dissoziieren und singularisieren Sie die Zellen, indem Sie die Dissoziationsreagenzlösung zwei- oder dreimal vorsichtig über die Oberflächen der Vertiefungen pipettieren.
- Übertragen Sie die abgelösten Zellen in ein 15-ml-Röhrchen mit 4 ml hiPSC-Erhaltungsmedium und resuspendieren Sie die Zellen gründlich. Reservieren Sie ein Aliquot von 10 μl für die Zellzählung.
- Pelletieren Sie die Zellen durch Zentrifugieren für 5 min bei 200 x g bei 20-25 °C. Zählen Sie die Zellen und berechnen Sie das erforderliche Volumen, um eine geeignete Dichte von hiPSCs (75-400 x 103 pro Well) in einer mit Basalmembranmatrix beschichteten 12-Well-Platte zu erreichen (Schritt 1.1.1).
- Saugen Sie die Beschichtungslösung aus den Vertiefungen ab und geben Sie 1 ml hiPSC-Medium mit 10 μM ROCK-Inhibitor in jede Vertiefung (Verdünnung 1:1.000). Nach dem Zentrifugieren wird der Überstand abgesaugt und das Pellet in 1 ml hiPSC-Medium dissoziiert.
- Geben Sie das in Schritt 1.2.4 ermittelte erforderliche Volumen an hiPSC in jede Vertiefung der 12-Well-Platte. Zwei bis vier 12-Well-Platten können ausreichen, um einen hiPSC-Klon zu differenzieren. In Schritt 1.2.4 erfahren Sie, wie viele Platten für die Aussaat von Zellen erforderlich sind.
- Stellen Sie die Platte in einen Inkubator (37 °C, 5%CO 2). Verteilen Sie die Zellen gleichmäßig, indem Sie die Platte vorsichtig hin und her und dann von einer Seite zur anderen im Inkubator schieben.
- Tauschen Sie das Medium am folgenden Tag (d. h. Tag -2) gegen 2 ml hiPSC-Erhaltungsmedium ohne ROCK-Inhibitor aus. Tauschen Sie das Medium am nächsten Tag (Tag -1) gegen 2 ml frisches hiPSC-Erhaltungsmedium aus.
- Induktion von EPCs mit dem Glykogensynthase-Kinase-3 (GSK-3)-Inhibitor CHIR99021 (Tag 0 bis Tag 5)
- Ersetzen Sie an Tag 0 das hiPSC-Erhaltungsmedium in jeder Vertiefung durch 2 ml LaSR-Medium mit 8 μM CHIR99021.
- Saugen Sie an Tag 1 das Medium an und fügen Sie 2 ml frisches LaSR-Medium mit 8 μM CHIR99021 hinzu.
- Ersetzen Sie an den Tagen 2, 3 und 4 das Medium durch 2 ml frisches LaSR-Medium ohne CHIR99021.
- Magnetisch aktivierte Zellsortierung (MACS) zur Aufreinigung von CD31+ EPCs (Tag 5)
- An Tag 5 wird das Medium abgesaugt und dann 1 ml Dissoziationsreagenz in jede Vertiefung gegeben, bevor Sie 6-8 Minuten bei 37 °C inkubieren.
- Die Zellen werden mit einer Mikropipette dissoziiert und singularisiert und durch ein 40-μm-Zellsieb geleitet, um die Suspension in ein 50-ml-Röhrchen mit 10 ml DMEM/F12-10-Medium zu filtern. Filtern Sie die Zellsuspension, die von mehr als zwei 12-Well-Platten gesammelt wurde, in mindestens zwei 50-ml-Röhrchen.
- Stoppen Sie die Aufschlussreaktion durch Zugabe von DMEM/F12-10-Medium (bis zu 50 ml). Pipettieren Sie gründlich und reservieren Sie 10 μl für die Zählung der Zellen. Pelletieren Sie die Zellen durch Zentrifugieren für 5 min bei 200 x g bei 20-25 °C.
- Nach dem Entfernen des Überstandes werden 10 ml DMEM/F12-10-Medium hinzugefügt und die Zellsuspension in frische 15-ml-Röhrchen überführt. Pelletieren Sie die Zellen durch Zentrifugieren für 5 min bei 200 x g bei 20-25 °C.
- Saugen Sie den Überstand ab und resuspendieren Sie ihn in den Flusspuffer-1 mit einer Dichte von 1,0 x 107 Zellen pro 100 μl Puffer.
- Fügen Sie FcR-blockierendes Reagenz in einem Verhältnis von 1:100 hinzu und inkubieren Sie es 5 Minuten lang, bevor Sie den mit Fluoresceinisothiocyanat (FITC) markierten CD31-Antikörper in 1:200 Verdünnung hinzufügen. Die Suspension wird 30 min im Dunkeln bei 20-25 °C inkubiert.
- Fügen Sie 10 ml Durchflusspuffer-1 hinzu und reservieren Sie 10 μl der Suspension für die durchflusszytometrische Analyse, um den Anteil der CD31+ -Zellen zu bestimmen (Abbildung 2).
- Die Zellen werden durch Zentrifugieren bei 200 x g für 5 min bei 20-25 °C pelletiert. Entfernen Sie dann den Überstand und resuspendieren Sieihn auf eine Dichte von 1,0 x 10 7 Zellen pro 100 μl Flusspuffer-1-Lösung. Fügen Sie den FITC-Auswahlcocktail hinzu (5 μl pro 100 μl Zellsuspension). Durch Pipettieren gründlich mischen und 15 min bei 20-25 °C im Dunkeln inkubieren.
- Fügen Sie 5 μl magnetische Nanopartikel pro 100 μl Zellsuspension hinzu, pipettieren Sie sie gut und inkubieren Sie sie 10 Minuten lang im Dunkeln bei 20-25 °C.
- Übertragen Sie die Zellsuspension in ein 5-ml-Durchflusszytometrie-Röhrchen und fügen Sie Durchflusspuffer-1 hinzu, um ein Gesamtvolumen von 2,5 ml zu erreichen. Legen Sie das Durchflusszytometrieröhrchen für 5 Minuten in den Magneten.
- Drehen Sie den Magneten in einer kontinuierlichen Bewegung um und dekantieren Sie die Zellsuspension, die Zellen enthält, die nicht mit dem FITC-CD31-Antikörper markiert wurden. Halten Sie den Magneten und den Schlauch 2-3 s lang in umgekehrter Position und entfernen Sie dann die restliche Flüssigkeit. Saugen Sie alle Tröpfchen am Rand des Röhrchens ab, bevor Sie das Röhrchen wieder in eine aufrechte Position bringen.
- Nehmen Sie das Durchflusszytometrieröhrchen vom Magneten und fügen Sie 2,5 ml Durchflusspuffer-1 hinzu, um die verbleibenden CD31+ -Zellen zu waschen. Resuspendieren Sie die Zellen, indem Sie die Zellen zwei- oder dreimal vorsichtig auf und ab pipettieren. Setzen Sie den Durchflussschlauch für 5 Minuten in den Magneten ein.
- Wiederholen Sie die Schritte 1.4.11-1.4.12 dreimal und dann Schritt 1.4.11 noch einmal für insgesamt vier Wäschen.
- Entfernen Sie das Durchflussrohr vom Magneten und geben Sie die angegebene Menge eines geeigneten Mediums (z. B. humanes endotheliales serumfreies Medium [hECSR] für erweiterte EC-Kultur oder Gefriermedium zum Einfrieren) in das Röhrchen, um die gereinigten CD31+ -Zellen zu resuspendieren. Reservieren Sie zwei 10-μl-Aliquots der Suspension, eines für die Zellzählung und das zweite für die Durchführung einer durchflusszytometrischen Analyse, um die Reinheit von CD31+ -Zellen in Post-MACS-Proben zu beurteilen (Abbildung 2). Wenn ein Durchflusszytometer nicht sofort verfügbar ist, lagern Sie das Aliquot bis zur Analyse bei 4 °C.
- Wenn die nächsten Schritte (bis Schritt 2) nicht sofort ausgeführt werden können, frieren Sie die CD31+ EPCs an dieser Stelle ein. Für die Erweiterung und selektive Übergabe von EPCs fahren Sie mit Schritt 2 fort.
HINWEIS: Vitronectin25-beschichtete 12-Well-Platten und das stabilere hiPSC-Erhaltungsmedium (mTeSR plus) können anstelle von Basalmembranmatrix-beschichteten Platten und hiPSC-Erhaltungsmedium (mTeSR1) verwendet werden. Zur Herstellung von Vitronektin-beschichteten 12-Well-Platten wird Vitronektin mit Verdünnungspuffer auf eine Endkonzentration von 10 μg/ml verdünnt und dann 500 μl der verdünnten Lösung in jede Vertiefung der 12-Well-Platten übertragen. Lassen Sie die Platten mindestens 1 h bei 20-25 °C stehen. Die Seedingdichte von singularisierten hiPSCs ist vergleichbar mit der von Basalmembranmatrix-beschichteten Platten. Eine Änderung des Nährmediums oder der Matrixzusammensetzung kann sich auf die Proliferation und spontane Differenzierung von hiPS-Zellen auswirken, die in der Regel 1-2 Wochen benötigen, um sich an neue Kulturbedingungen anzupassen. Wenn das stabilere hiPSC-Erhaltungsmedium für die hiPSC-Instandhaltung verwendet wird, kann dieses Medium anstelle des hiPSC-Erhaltungsmediums für die EPC-Differenzierung verwendet werden. In diesem Fall sollte das stabilere hiPSC-Erhaltungsmedium an Tag -2 gewechselt werden, um den ROCK-Inhibitor zu entfernen, und der Austausch an Tag -1 kann übersprungen werden.
2. Erweiterte Endothelzellkulturmethode (EECM) zur Differenzierung von mikrovaskulären Endothelzell-ähnlichen Zellen (BMEC-ähnliche Zellen) und glattmuskelähnlichen Zellen (SMLCs)
- Herstellung von kollagenbeschichteten Platten und Reagenzien
- Bereiten Sie kollagenbeschichtete 6-Well-Platten vor, indem Sie 5 mg kristallisiertes Kollagen Typ IV in 5 ml sterilem Wasser auflösen. Über Nacht bei 4 °C inkubieren, dann aliquotieren und bei -20 °C lagern. Verdünnen Sie Kollagen-IV-Aliquoten im Verhältnis 1:100 in sterilem Wasser, um 10 μg/ml-Lösungen herzustellen, und geben Sie 1 ml 10 μg/ml-Kollagen-IV-Lösungen in jede Vertiefung der 6-Well-Platten. Die Platten mindestens 30 min bei 37 °C inkubieren. Die Platten können bei 37 °C bis zu 1 Woche gelagert werden.
- Bereiten Sie eine Stammlösung des humanen Fibroblasten-Wachstumsfaktors 2 (FGF2) vor, indem Sie 500 μg FGF in 5 ml Dulbeccos PBS auflösen, 7,5 % BSA bis zu einer Endkonzentration von 0,1 % hinzufügen und die Stammlösung in 20-200 μl-Volumina aliquotieren. Diese können bei -20 °C bis zu 3 Monate gelagert werden (Tabelle 1). Stammlösungen können bis zu 1 Monat bei 4 °C gelagert werden; Vermeiden Sie Frost-Auftau-Zyklen. Bereiten Sie hECSR-Medium vor, indem Sie 2 ml B-27-Supplement und 20 μl FGF2 in 98 ml hECSR-Medium geben (Tabelle 1). Das hECSR-Medium kann bis zu 2 Wochen bei 2-8 °C gelagert werden.
- Bereiten Sie Gefriermedium für die EPCs, EECM-BMEC-ähnlichen Zellen und SMLCs vor, indem Sie 15 ml fötales Kälberserum, 5 ml DMSO und 25 μl ROCK-Inhibitorlösung zu 30 ml hECSR-Medium hinzufügen (Tabelle 1). Das Gefriermedium kann bis zu 2 Wochen bei 2-8 °C gelagert werden.
- Seeding EPCs für erweiterte Endothelzellkultur
- Entfernen Sie die Kollagenlösung von den 6-Well-Platten. Anschließend werden 1,0-2,0 x 10 5 gereinigte CD31+ EPCs in 2 ml hECSR-Medium mit5 μM ROCK-Inhibitor (1:2.000 Verdünnung) übertragen. Stellen Sie die Platte in einen Inkubator (37 °C, 5%CO 2). Verteilen Sie die Zellen gleichmäßig, indem Sie die Platten vorsichtig hin und her und dann von einer Seite zur anderen schieben.
- Entfernen Sie am nächsten Tag das hECSR-Medium, das ROCK-Inhibitor enthält, und fügen Sie 2 ml frisches hECSR-Medium ohne ROCK-Inhibitor hinzu. Tauschen Sie das hECSR-Medium jeden zweiten Tag aus, bis eine 100%ige Konfluenz erreicht ist.
Anmerkungen: Wenn ein regelmäßiger Fütterungsplan über ein Wochenende nicht eingehalten werden kann, kann das Medium am Abend des letzten Arbeitstages der Woche und erneut am frühen Morgen nach dem Wochenende ausgetauscht werden.
- Selektive Passage zur Aufreinigung von EECM-BMEC-ähnlichen Zellen und SMLCs
- Entfernen Sie das hECSR-Medium von den 6-Well-Platten, die eine Mischung aus ECs- und Nicht-EC-Populationen enthalten. Geben Sie 1 ml Dissoziationsreagenz in jede Vertiefung.
- Beobachten Sie die Zellmorphologie sorgfältig unter dem Mikroskop. Wenn die ECs (aber nicht die Nicht-ECs) hell und rund erscheinen (normalerweise innerhalb von 2-5 Minuten), lösen Sie sie, indem Sie auf den Rand der Platte klopfen. Die meisten Nicht-ECs bleiben an der Platte haften.
- Sammeln Sie die abgelösten ECs mit einer Mikropipette und achten Sie darauf, dass die Nicht-ECs nicht resuspendiert werden. Übertragen Sie die ECs in ein 15-ml- oder 50-ml-Zentrifugenröhrchen, das 4 ml DMEM/F12-10 pro 1 ml Dissoziationsreagenz enthält.
- Geben Sie 2 ml hECSR-Medium in die Vertiefungen, die die verbleibenden angehängten Nicht-ECs enthalten, um SMLCs zu etablieren. Legen Sie die Platte in den Inkubator.
- Pipettieren Sie die EC-Suspension in das Zentrifugenröhrchen, um sie gründlich zu mischen, und reservieren Sie 10 μl der Suspension für die Zellzählung. Die restlichen Zellen werden für 5 min bei 200 x g bei 20-25 °C zentrifugiert. Entfernen Sie den Überstand aus dem Pellet und fügen Sie 2 ml hECSR-Medium pro 1,0-2,0 x 105 ECs hinzu.
- Nach der Entnahme der Kollagen-IV-Lösung aus einer neuen 6-Well-Platte werden 2 ml EC-Suspension in jede Vertiefung gegeben, gefolgt von einer Inkubation bei 37 °C mit 5 % CO2. Um die Zellen gleichmäßig in der Platte zu verteilen, bewegen Sie sie vorsichtig in einer Hin- und Herbewegung und von einer Seite zur anderen auf dem Inkubatorregal.
- Tauschen Sie das hECSR-Medium jeden zweiten Tag aus, bis die ECs eine 100%ige Konfluenz erreicht haben.
- Wiederholen Sie die Schritte 2.3.1-2.3.7, bis eine reine EC-Monoschicht erhalten ist. Wenn die folgenden Schritte nicht ausgeführt werden können, frieren Sie die CD31+ ECs ein (siehe Schritt 2.4.2). Um EC-Funktionen zu analysieren, fahren Sie mit Schritt 3 fort.
ANMERKUNG: Im Allgemeinen sind zwei oder drei selektive Passagen erforderlich, um nahezu reine Kulturen von ECs zu erhalten, die für funktionelle Analysen geeignet sind, und wir betrachten diese Zellen als EECM-BMEC-ähnliche Zellen. Nach mehr als fünf oder sechs Passagen verlangsamt sich die Zellproliferation in der Regel, obwohl diese Variable von der hiPSC-Linie abhängt. - Um SMLCs zu kultivieren, tauschen Sie das hECSR-Medium jeden zweiten Tag aus. Um SMLC-konditioniertes Medium (CM) zu sammeln, wird das gesammelte Medium bei jedem Mediumwechsel durch einen 0,22-μm-Filter geleitet. Das CM kann verwendet werden, um die VCAM-1-Expression von EECM-BMEC-ähnlichen Zellen hochzuregulieren. Fassen Sie die SMLC-CM zusammen, bis die SMLCs eine 100%ige Konfluenz erreichen.
- EPC-, EECM-BMEC-ähnliche Zell- und SMLC-Kryokonservierung und -auftauen
- Um EPCs einzufrieren, werden die EPCs nach der abschließenden MACS-Wäsche (Schritt 1.4.13) in Gefriermedium statt in hECSR-Medium mit einer Dichte von 1,0-2,0 x 106 Zellen/ml resuspendiert. Verteilen Sie 1 ml der Zellsuspension in Kryoröhrchen. Legen Sie die Kryoröhrchen in ein Gefriergerät mit kontrollierter Geschwindigkeit und übertragen Sie sie schnell auf -80 °C. Für die Langzeitlagerung stellen Sie die Röhrchen 24 bis 48 Stunden nach dem Einfrieren in einen Flüssigstickstofftank.
- Um EECM-BMEC-ähnliche Zellen und SMLCs einzufrieren, fügen Sie nach dem Entfernen des Mediums aus den Wells Dissoziationsreagenz (1 ml/Well) hinzu und inkubieren Sie die Platte bei 37 °C mit 5% CO2 , bis sich die Zellen ablösen (5-7 min bzw. 20-30 min für EECM-BMEC-ähnliche Zellen bzw. SMLCs). Sammeln Sie die Zellen in einem 15-ml- oder 50-ml-Zentrifugenröhrchen, das 4 ml DMEM/F12-10 pro 1 ml Dissoziationsreagenz enthält.
- Zum Mischen gründlich pipettieren und 10 μl der Zellsuspension für die Zellzählung aufbewahren. Die Zellen werden durch Zentrifugieren bei 200 x g für 5 min bei 20-25 °C pelletiert. Entfernen Sie den Überstand und resuspendieren Sie die Zellen gründlich in Gefriermedium auf eine Dichte von 1,0-2,0 x 106 Zellen/ml. Verteilen Sie 1 ml der Zellsuspension in frische Kryoröhrchen.
- Legen Sie die Kryoröhrchen in ein Gefriergerät mit kontrollierter Geschwindigkeit und übertragen Sie sie sofort auf -80 °C. Für die Langzeitlagerung können die Röhrchen 24 bis 48 h nach dem Einfrieren in einen Flüssigstickstofftank umgefüllt werden.
- Zum Auftauen von EPCs, EECM-BMEC-ähnlichen Zellen und SMLCs rollen Sie Fläschchen mit Kryoröhrchen zwischen den Händen oder inkubieren Sie sie in einem 37 °C warmen Wasserbad, bis die Zellen fast vollständig aufgetaut sind. Fügen Sie 500 μl DMEM/F12-10 hinzu und überführen Sie die Zellsuspension vorsichtig in ein 15-ml-Röhrchen mit 4 ml DMEM/F12-10-Medium. Waschen Sie das Kryoröhrchen einmal mit 1 ml DMEM/F12-10 und zentrifugieren Sie die Zellen dann bei 200 x g für 5 min bei 20-25 °C.
- Saugen Sie den Überstand an und resuspendieren Sie das Pellet in 2 ml hECSR-Medium, das 5 μM ROCK-Inhibitor (1:2.000 Verdünnung) enthält, auf eine Dichte von 1,0-2,0 x 105 Zellen pro 2 ml für EPCs und 2,0-3,0 x 10 5 Zellen pro 2 ml für EECM-BMEC-ähnlicheZellen und SMLCs. Verteilen Sie die Zellsuspension nach dem Absaugen der Kollagenlösung auf die Vertiefungen der kollagenbeschichteten 6-Well-Platten.
- Bewegen Sie die Platten vorsichtig hin und her und dann von einer Seite zur anderen, auf dem Regal eines Inkubators bei 37 °C, 5 % CO2 , um die Zellen gleichmäßig in den Vertiefungen zu verteilen.
- Tauschen Sie das Medium am nächsten Tag gegen ein frisches hECSR-Medium aus, dem der ROCK-Inhibitor fehlt. Tauschen Sie das hECSR-Medium jeden zweiten Tag aus, bis eine 100%ige Konfluenz erreicht ist. Fahren Sie dann mit der selektiven Passaging für EPCs (siehe Schritt 2.3) und der Funktionsanalyse für EECM-BMEC-ähnliche Zellen (siehe Schritt 3) fort. Vor der molekularen Charakterisierung und funktionellen Assays sollten EECM-BMEC-ähnliche Zellen zu 100% konfluent sein, was in der Regel 2-3 Tage nach dem Auftauen erreicht wird.
3. Validierung von EECM-BMEC-ähnlichen Zellen und SMLCs
- Permeabilitätsassay für niedermolekulare Tracer
- Beurteilen Sie die Integrität der EECM-BMEC-ähnlichen Zellbarriere durch Messung der Natriumfluorescein-Permeabilität, wie von Nishihara et al.26 beschrieben. Säen Sie die EECM-BMEC-ähnlichen Zellen auf Filtereinsätzen, um vollständige Monoschichten zu entwickeln und die Permeabilität von Natriumfluorescein zu messen.
- Immunfluoreszenzfärbung zur Beurteilung von Schlüsselmolekülen.
- Für die Immunfluoreszenzfärbung zur Überwachung der Expression von Junktionalmolekülen, Adhäsionsmolekülen oder Zytoskelettproteinen von EECM-BMEC-ähnlichen Zellen in Monoschichten oder von SMLCs werden Kammerobjektträger, 96-Well-Platten oder Membranen mit Einsatzfiltern verwendet. Untersuchung der EECM-BMEC-ähnlichen Zellexpression von Zelloberflächenadhäsionsmolekülen mit oder ohne inflammatorische Zytokinstimulation, wie von Nishihara et al.26 beschrieben.
- Durchflusszytometrie zur Analyse der Expression von Zelloberflächenadhäsionsmolekülen auf EECM-BMEC-ähnlichen Zellen
- Verwenden Sie die Durchflusszytometrie, um die semiquantitative Expression von Zelloberflächenadhäsionsmolekülen zu bewerten, die an der Migration von Immunzellen in das ZNS beteiligt sind, einschließlich ICAM-1, ICAM-2, VCAM-1, P-Selektin, E-Selektin, CD99 und Thrombozyten-Endothelzelladhäsionsmolekül-1 (PECAM-1), wie von Nishihara et al.26 beschrieben. Kultivieren Sie die EECM-BMEC-ähnlichen Zellen mit SMLC-konditioniertem Medium in An- und Abwesenheit von inflammatorischen Zytokinen für 16-18 h.
- Immunzelladhäsionsassay unter statischen Bedingungen zur Beurteilung der Expression funktioneller Adhäsionsmoleküle
- Verwenden Sie die von Nishihara et al.26 beschriebene Methode, um festzustellen, ob die Zelloberflächenadhäsionsmoleküle der EECM-BMEC-ähnlichen Zellen funktionsfähig sind.
- Säen Sie die EECM-BMEC-ähnlichen Zellen kurz auf einen Kammerschieber mit einer Größe von 5,5 x 104/cm2 und wachsen Sie bis zur Konfluenz heran. Etwa 24 Stunden später wird das Nährmedium in Anwesenheit oder Abwesenheit von proinflammatorischen Zytokinen auf SMLC-konditioniertes Medium umgestellt und die EECM-BMEC-ähnlichen Zellen für weitere 16 Stunden inkubiert.
- Am Tag des Experiments werden kryokonservierte Immunzellen (z. B. T-Zellen oder mononukleäre Zellen des peripheren Blutes [PBMCs]) mit T-Zell-Waschpuffer (Tabelle 1) aufgetaut und mit Fluoreszenzfarbstoffen (z. B. Zell-Tracker-Farbstoffe) in T-Zell-Medium markiert (Tabelle 1). Die Optimierung des Nährmediums für die Immunzellen sollte auf den spezifischen Typ der zu untersuchenden Immunzellen zugeschnitten sein.
- Fügen Sie in einem 16-Well-Kammerobjektträger 2 x 104 Th1-Zellen zu den EECM-BMEC-ähnlichen Zellen hinzu. Insbesondere bei der Arbeit mit Effektor-T-Zellen wie Th1-Zellen wurde beobachtet, dass diese im Vergleich zu PBMCs eine stärkere Bindung an EECM-BMEC-ähnliche Zellen aufweisen (Nishihara. et al. [2022]). Folglich muss die Anzahl der PBMCs, die zu den EECM-BMEC-ähnlichen Zellen hinzugefügt werden sollen, höher sein als bei reinen Effektor-T-Zellen.
- Die Immunzellen werden mit der Monoschicht aus EECM-BMEC-ähnlichen Zellen für 30 min in einem Migrationsassaymedium inkubiert (Tabelle 1). Waschen Sie den Objektträger nach 30 Minuten vorsichtig, zweimal durch Eintauchen in ein Glas mit Dulbeccos PBS und fixieren Sie ihn anschließend 2 Stunden lang mit 2,5%iger Glutaraldehydlösung bei 4 °C.
- Waschen Sie den Objektträger nach der Fixierung zweimal, indem Sie ihn in ein Glas mit Dulbeccos PBS tauchen und mit einem Deckglas montieren. Anschließend werden fluoreszenzmikroskopische Bilder des Zentrums der Monoschicht auf den Objektträgern aufgenommen, um Immunzellen zu zählen, die an EECM-BMEC-ähnliche Zellmonolagen gebunden sind.
Ergebnisse
Permeabilitäts-Assay
Die Permeabilität von Natriumfluorescein wurde berechnet, indem die Fluoreszenzintensität des aus der unteren Kammer gesammelten Mediums nach 15, 30, 45 und 60 min gemessen wurde. Zu jedem Zeitpunkt werden insgesamt 150 μl Medium beprobt und das fehlende Volumen von 150 μl durch hECSR-Medium ersetzt. Die Fluoreszenzintensität wird mit einem Fluoreszenzplatten-Reader (485 nm Anregung/530 nm Emission) abgelesen und die korrekten Signale, Abstandsvolumina und Permeabilitäten werden mit einer zuvor beschriebenen Formel18 berechnet (Tabelle 2). Es wird empfohlen zu überprüfen, ob die Fluoreszenzintensität von Natriumfluorescein mit der Zeit zunimmt. Mehrere Filter - mindestens dreifache - sollten für einen Assay verwendet werden, um die Reproduzierbarkeit zu gewährleisten. Für gesunde, von der Kontrolle abgeleitete EECM-BMEC-ähnliche Zellen sollte die Natriumfluorescein-Permeabilität (376 Da) unter 0,3 x 10-3 cm/min liegen. Um die Bildung einer konfluenten EECM-BMEC-ähnlichen Zellmonoschicht zu bestätigen, sollte im Anschluss an diesen Assay eine Immunfluoreszenzfärbung für Junktionalproteine der EECM-BMEC-ähnlichen Zellen jedes Filters durchgeführt werden, der in den Permeabilitätsassays verwendet wird.
Immunfluoreszenz-Färbung
Die Immunfluoreszenzfärbung von EECM-BMEC-ähnlichen Zellverbindungsmolekülen, einschließlich Claudin-5, Occludin und VE-Cadherin1, wurde verwendet, um die Zellmorphologie und das Vorhandensein kontinuierlicher und reifer Verbindungen zu beurteilen (Abbildung 4). Die Monoschichten von EECM-BMEC-ähnlichen Zellen auf den Membranen der Filtereinsätze wurden mit kaltem Methanol (-20 °C) für 20 s fixiert, mit Blockierpuffer blockiert (Tabelle 1) und anschließend mit primären und sekundären Antikörpern inkubiert. Die EECM-BMEC-ähnlichen Zellen wiesen spindelartige Formen und zickzackförmige Verbindungen auf, die beide charakteristische morphologische Merkmale von BMECssind 27. Die Stimulation der EECM-BMEC-ähnlichen Zellen, die auf Kammerobjektträgern mit proinflammatorischen Zytokinen wie Tumornekrosefaktor-α (TNF-α) und Interferon-γ (INF-γ) (0,1 ng/ml TNF-α + 2 IU/ml IFN-γ) in SMLC-abgeleitetem konditioniertem Medium ausgesät wurden, erhöhte die Expression von Adhäsionsmolekülen wie ICAM-1 und VCAM-128 (Abbildung 5). In Abbildung 6 sind repräsentative Bilder von Markern glatter Muskelzellen dargestellt, darunter α-Aktin der glatten Muskulatur (SMA), Calponin und glattes Muskelprotein 22-Alpha (SM22a)29. SMLCs, die auf dem Objektträger der Kammer ausgesät wurden, wurden 10 min lang mit 4%igem Paraformaldehyd fixiert, mit Blockierungspuffer blockiert und dann mit primären und sekundären Antikörpern inkubiert.
Durchflusszytometrische Analyse der Expression von Zelloberflächenadhäsionsmolekülen durch EECM-BMEC-ähnliche Zellen
Repräsentative Ergebnisse für die Zelloberflächenexpression von endothelialen Adhäsionsmolekülen auf EECM-BMEC-ähnlichen Zellen sind in Abbildung 7 dargestellt. Die Stimulation mit proinflammatorischen Zytokinen wie TNF-α und INF-γ erhöhte die Zelloberflächenexpression mehrerer Adhäsionsmoleküle, darunter ICAM-1, VCAM-1 und P-Selektin. Die Kultivierung von EECM-BMEC-ähnlichen Zellen mit SMLC-konditioniertem Medium verstärkte die endotheliale VCAM-1 Zelloberflächenexpression. Der Effekt der Induktion der VCAM-1-Zelloberflächenexpression kann zwischen den Chargen des SMLC-konditionierten Mediums variieren. Es wird empfohlen, bei der Unterscheidung von SMLCs mehrere Chargen konditionierten Mediums zu lagern, die aus SMLCs gewonnen wurden und aus derselben hiPSC-Quelle stammen, um zu überprüfen, welche Charge die entsprechende Expression von VCAM-1 induziert.
Immunzelladhäsionsassay unter statischen Bedingungen
Die Anzahl der angehefteten Immunzellen korrelierte mit dem Expressionsniveau der funktionellen Adhäsionsmoleküle auf der Oberfläche von EECM-BMEC-ähnlichen Zellen. Die Stimulation mit inflammatorischen Zytokinen erhöhte die Expression von endothelialen Adhäsionsmolekülen und förderte die erhöhte Anzahl von Immunzellen, die an EECM-BMEC-ähnlichen Zellmonoschichten adhäsierten (Abbildung 8). Das aktuelle Experiment demonstrierte die Funktionalität von Adhäsionsmolekülen auf EECM-BMEC-ähnlichen Zellen, wodurch sich dieses Modell für die Untersuchung von Immunzell-EC-Interaktionen eignet.

Abbildung 2: Aufreinigung von CD31+ ECs. Punktdiagramme repräsentativer Durchflusszytometriedaten aus Scatter-Gating von ECs und FITC-markierter CD31-Färbung von Zellpopulationen vor (Schritt 1.4.7) und nach (Schritt 1.4.14) MACS. MACS verbessert die Reinheit von CD31+ EPCs in der Population. Abkürzungen: SSC = Seitenstreuung; FSC = Vorwärtsstreuung; FITC = Fluorescein-Isothiocyanat; MACS = magnetisch aktivierte Zellsortierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
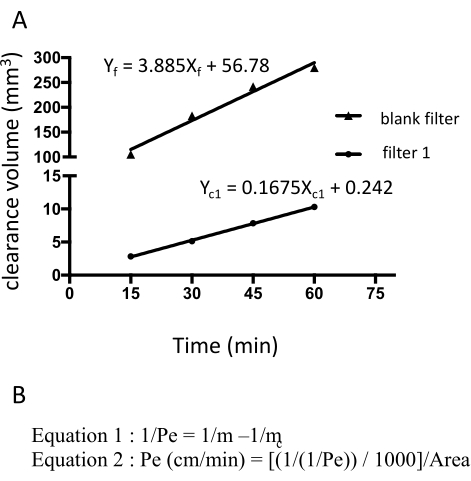
Abbildung 3: EECM-BMEC-Monolagenpermeabilität (10-3 cm/min) berechnet aus der rohen Fluoreszenzintensität von Natriumfluorescein. Die lineare Steigung des Spaltvolumens wird mit Hilfe der linearen Regression für jeden Filter berechnet (Abbildung 3A). Die Permeabilität von Natriumfluorescein wird anhand von zwei Formeln berechnet (Abbildung 3B). (A) Die lineare Steigung des Spaltvolumens über der Zeit wurde mittels linearer Regression für Filter 1 (mc1) und den Blindfilter (mf) berechnet. m c1 und m f sind Koeffizienten von Xc1 bzw. Xf. (B) Formel zur Berechnung der Fluoresceinpermeabilität (Pe) unter Verwendung von mc und mf (Formel 1). Pe-Einheiten wurden mit der Oberfläche eines Filters umgerechnet (Formel 2). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: EECM-BMEC-ähnliche Zellen weisen ausgereifte zelluläre Verbindungen auf. Immunfluoreszenzfärbung für Claudin-5, Occludin oder VE-Cadherin (rot) in EECM-BMEC-ähnlichen Zellen, die auf Membranen von Einsatzfiltern gezüchtet wurden. Die Zellkerne wurden mit 4′,6-Diamidino-2-phenylindol (DAPI) (blau) gefärbt. Die Färbung wurde mit genau den gleichen Filtereinsätzen durchgeführt, die für die Permeabilitätstests verwendet wurden. Maßstabsbalken = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
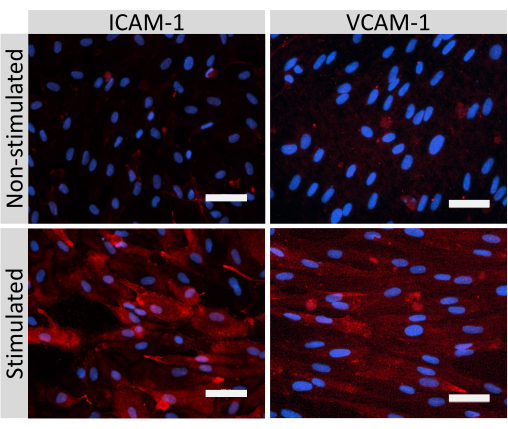
Abbildung 5: Expression von endothelialen Adhäsionsmolekülen durch EECM-BMEC-ähnliche Zellen. Die Immunfluoreszenzfärbung wurde an EECM-BMEC-ähnlichen Zellen durchgeführt, die auf Membranen von Filtereinsätzen in Gegenwart von SMLC-abgeleitetem CM gezüchtet wurden. Die Immunfärbung für ICAM-1 oder VCAM-1 (rot) ist für nicht stimulierte und 1 ng/mL TNF-α + 20 IU/mL IFN-γ stimulierte EECM-BMEC-ähnliche Zellen gezeigt. Die Zellkerne wurden mit DAPI (blau) gefärbt. Maßstabsbalken = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Charakterisierung von SMLCs. Die Immunzytochemie von α-Aktin der glatten Muskulatur (SMA), Calponin oder dem glatten Muskelprotein 22-Alpha (SM22a) (rot) für SMLCs, die auf Kammerobjektträgern gezüchtet wurden, wird gezeigt. Die Zellkerne wurden mit DAPI (blau) gefärbt. Maßstabsbalken = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
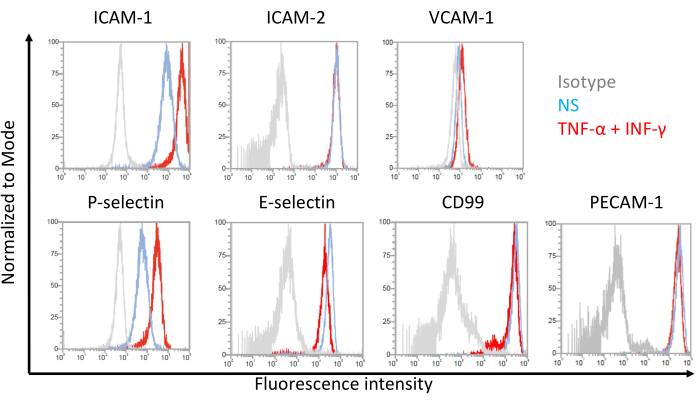
Abbildung 7: Expression von Adhäsionsmolekülen auf der Endothelzelloberfläche auf EECM-BMEC-ähnlichen Zellen. Die Ergebnisse der durchflusszytometrischen Analyse der Expression von EC-Oberflächenadhäsionsmolekülen auf EECM-BMEC-ähnlichen Zellen werden gezeigt. EECM-BMEC-ähnliche Zellen wurden mit SMLC-abgeleitetem konditioniertem Medium kultiviert. Blaue, rote und graue Linien der Histogramm-Überlagerungen zeigen die nicht stimulierte (NS) Bedingung, 1 ng/ml TNF-α + 20 IU/ml IFN-γ-stimulierte Bedingung bzw. die Isotypkontrolle. Die Zelloberflächenexpression von endothelialen Adhäsionsmolekülen, einschließlich interzellulärem Adhäsionsmolekül 1 (ICAM-1), ICAM-2, vaskulärem Zelladhäsionsmolekül 1 (VCAM-1), P-Selektin, E-Selektin, CD99 und Thrombozyten-Endothelzelladhäsionsmolekül-1 (PECAM-1) wurde untersucht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
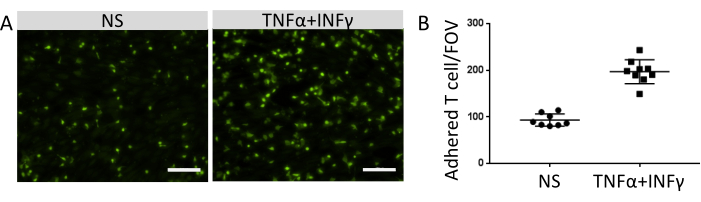
Abbildung 8: Adhäsion von Immunzellen an EECM-BMEC-ähnlichen Zellen. (A) Bilder von fluoreszenzmarkierten adhärenten Immunzellen auf nicht-stimulierten (NS) und 0,1 ng/mL TNF-α + 2 IU/mL IFN-γ-stimulierten (TNF-α + IFN-γ) EECM-BMEC-ähnlichen Zellmonolagen. Die Bilder entsprechen den Zentren der Brunnen. Maßstabsbalken = 50 μm. (B) Die Anzahl der fluoreszenzmarkierten Immunzellen auf Monoschichten von NS- und TNF-α + IFN-γ-stimulierten EECM-BMEC-ähnlichen Zellen. Adhärente Immunzellen/Sichtfelder (FOVs) wurden automatisch mit der FIDSCHI-Software gezählt. Punkte stellen die Anzahl der angehängten T-Zellen dar. Balken zeigen den Mittelwert und Fehlerbalken die Standardabweichung (SD) von acht Versuchen an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Angaben zu den spezifischen Reagenzien für die Assays. Der Name und die genaue Menge der Inhaltsstoffe für jedes spezifische Reagenz werden beschrieben. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Beispiel für Rohdaten des Fluoreszenzplatten-Readers für die Pe-Berechnung. Die fettgedruckten Zahlen sind die rohe Fluoreszenzintensität von Natriumfluorescein, gemessen mit einem Plattenlesegerät. Um die Daten genau analysieren zu können, ist es notwendig, das Hintergrundsignal aus den Rohwerten zu entfernen und alle Signalverluste zu berücksichtigen, die sich aus der Abtastung der unteren Kammer ergeben, und anschließend das Signal zu korrigieren. Nach Abzug des Hintergrunds zeigt die 15-minütige Abtastung beispielsweise ein Signal von 100 relativen Fluoreszenzeinheiten (RFU) und die 30-minütige Abtastung ein Signal von 150 RFU. Das korrigierte Signal nach 30 min ist (150 RFU + die fehlenden Werte nach 15 min [100 RFU x 150 μL/1.500 μL]), also 150 RFU + 10 RFU = 160 RFU. Das Abstandsvolumen = (1.500 x [S B,t])/(S T,60 min), wobei 1.500 das Volumen der unteren Kammer (1.500 μL), S B,t das korrigierte Signal zum Zeitpunkt t und ST,60 min das Signal der oberen Kammer bei60 min ist. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Kritische Punkte und Fehlerbehebung
Bevor mit der EPC-Differenzierung begonnen wird, sollten die Forscher sicherstellen, dass in den hiPSC-Kulturen keine spontanen Zelldifferenzierungsereignisse aufgetreten sind. Das Fehlen spontan differenzierter Zellen und die Verwendung reiner hiPSC-Kolonien ist entscheidend für reproduzierbare Ergebnisse. Die hiPSC-Seeding-Dichte an Tag -3 ist wichtig, um eine hohe Reinheit von CD31+ EPCs nach MACS zu erhalten. Die Seeding-Dichte für jede hiPSC-Linie und jede Passage muss möglicherweise optimiert werden. Abhängig von der hiPSC-Linie und der Passagenzahl kann die Aussaatdichte zwischen 75 x 10 3 und 400 x 10 3 hiPSCs pro Well einer 12-Well-Platte (20-100 x 103/cm2) liegen. Der minimale Dichte-Checkpoint von hiPS-Zellen ist die Zelldichte an Tag 2. Die hiPSCs sollten spätestens an Tag 2 eine 100%ige Konfluenz erreichen. Wenn die hiPSCs bis Tag 2 nicht konfluent sind, ist die Reinheit der CD31+ EPCs nach MACS in der Regel recht gering. In diesem Fall kann die hiPSC-Seedingdichte erhöht werden. Wenn sich zwischen Tag 3 und Tag 5 eine große Anzahl differenzierender Zellen von der Platte löst, kann die anfängliche hiPSC-Seeding-Dichte verringert werden. Die 7-8 μM CHIR99021 ist unserer Erfahrung nach die optimale Konzentration für die hier verwendeten hiPS-Leitungen, aber die Konzentration muss möglicherweise für andere hiPSC-Leitungen optimiert werden, die möglicherweise anders auf die Inhibitorbehandlung ansprechen. Die Reinheit von CD31+ EPCs sollte vor und nach MACS bestätigt werden. Bevor die MACS fortgesetzt wird, sollte die vorsortierte Zellmischung aus >10% CD31+-Zellen bestehen. CD31+-Zellanteile von <6 % führen in der Regel zu <80 % EPCs nach MACS. In dieser Situation ist eine Optimierung der anfänglichen Aussaatdichte und/oder der CHIR99021-Konzentration erforderlich.
Für eine erfolgreiche selektive Passage und die Erzeugung von reinen EC-Monolagen ist die Post-MACS-Reinheit von CD31+ EPCs von entscheidender Bedeutung. Wenn die Reinheit nach MACS <90 % beträgt, werden ein bis zwei zusätzliche Waschgänge empfohlen (Schritte 1.4.11-1.4.12). Idealerweise sollte die Reinheit nach MACS >95 % betragen. Die EPC-Seeding-Dichte auf kollagenbeschichteten Platten sollte entsprechend der hiPSC-Linie optimiert werden, um innerhalb von 3-7 Tagen eine 100%ige Konfluenz zu erreichen. Das Warten, bis die ECs zu 100 % konfluent sind, führt in der Regel zu einer erfolgreichen selektiven Passage. Aber selbst bei 100% konfluenten ECs lösen sich die SMLCs einiger hiPSC-Linien auch frühzeitig ab. In diesem Fall kann ein selektives Passaging bei geringerer Konfluenz (z. B. ≤80%) wirksam sein. Wenn sich einige SMLCs früher als ECs ablösen, können die ECs oft nicht aus der gemischten EC-SMLC-Population gerettet werden. In diesem Fall kann es hilfreich sein, die Aktivierungszeit für das Dissoziationsreagenz bei passierenden ECs und wiederholter selektiver Passaging zu verkürzen. Die Verwendung eines kommerziellen Dissoziationsreagenzes anstelle von Trypsin als Dissoziationsreagenz ist für die selektive Weitergabe von Vorteil, da Trypsin die getrennte Ablösung von ECs und SMLCs nicht zulässt. Unsere Permeabilitätstests mit niedermolekularen Tracern und die Prüfung der Expressionsniveaus von Tight Junction- und Adhäsionsmolekülen zeigen, dass EPCs, EECM-BMEC-ähnliche Zellen und SMLCs mindestens 2 Jahre in flüssigem Stickstoff gelagert werden können.
Bedeutung und Grenzen der Methode
Die Methode unterscheidet CD31+ EPCs von hiPSCs durch die Verwendung chemischer GSK-3-Inhibitoren zur Aktivierung des Wnt/β-Catenin-Signalwegs. Nach positiver Selektion von CD31+ EPCs durch MACS werden EPCs in einem definierten Endothelmedium kultiviert, das die Differenzierung in gemischte Endothel- und SMLC-Populationen fördert. Die selektive Weitergabe dieser gemischten Populationen mit unterschiedlichen Adhäsionseigenschaften ermöglicht die Trennung von ECs und SMLCs. Nach ein bis zwei Passagen zeigen EECM-BMEC-ähnliche Zellen Barriereeigenschaften und die Expression von endothelialen Adhäsionsmolekülen, die denen von primären humanen BMECs entsprechen. Die Co-Kultur mit SMLCs oder deren Überständen induziert die Zytokin-induzierte Expression von VCAM-1.
In vivo hält die BHS die ZNS-Homöostase aufrecht, indem sie eine niedrige parazelluläre und transzelluläre Permeabilität von Molekülen durch den Transport von Nährstoffen über spezifische Transporter und die Kontrolle des Transports von Immunzellen in das ZNS herstellt. Für die Untersuchung der BHS ist ein geeignetes Modell, das die jeweiligen Moleküle und Funktionen von Interesse abbildet, unerlässlich. Die Herstellung von EECM-BMEC-ähnlichen Zellen unter Verwendung definierter Reagenzien und Proben von Patienten oder gesunden Probanden liefert ein skalierbares humanes BHS-Modell. Die Vorteile eines Modells mit EECM-BMEC-ähnlichen Zellen gegenüber anderen BHS-Modellen sind: 1) ein Morphologie- und Endotheltranskriptomprofil30, das dem von primären humanen BMECs ähnelt; 2) das Vorhandensein von reifen Tight Junctions; 3) wünschenswerte Barriereeigenschaften; und 4) die robuste Expression von endothelialen Adhäsionsmolekülen, einschließlich ICAM-1, ICAM-2, VCAM-1, E- und P-Selektin, CD99, Melanomzelladhäsionsmolekül (MCAM) und aktiviertem Leukozytenzelladhäsionsmolekül (ALCAM)22. Daher ist dieses Modell besonders nützlich, um Interaktionen zwischen Immunzellen und BMECs zu untersuchen. Obwohl die Permeabilität von niedermolekularen Tracern für EECM-BMEC-ähnliche Zellen höher ist als diejenige, die zuvor für iPSC-abgeleitete BMEC-ähnliche Zellen beschrieben wurde14,15, sind die Barriereeigenschaften recht gut mit denen vergleichbar, die für primäre humane BMECs beschrieben wurden. Diese Ähnlichkeit deutet darauf hin, dass EECM-BMEC-ähnliche Zellen wahrscheinlich ein gutes in vitro Modell der BHS sind. Die E-Selektin-Expression auf EECM-BMEC-ähnlichen Zellen unter physiologischen Bedingungen muss berücksichtigt werden, wenn dieses Modell verwendet wird, um nicht-entzündete BHs zu untersuchen, denen die konstitutive E-Selektin-Expression in vivo fehlt 31. In unserer vorangegangenen Studie konnten wir zeigen, dass EECM-BMEC-ähnliche Zellen die BHS phänokopieren können, wie sie im Gehirn von MS-Patienten in Bezug auf gestörte Tight Junctions beobachtet wird. Dies führt zu einer höheren Permeabilität kleiner Moleküle und einer erhöhten Expression von funktionellen Adhäsionsmolekülen, was die erhöhte Adhäsion und Transmigration von Immunzellen durch die BMEC-ähnlichen Zellen vermittelt32. Darüber hinaus konnten wir zeigen, dass die Aktivierung des Wnt/β-Catenin-Signalwegs die Störung von Tight Junctions und eine erhöhte VCAM-1-Expression in MS-abgeleiteten EECM-BMEC-ähnlichen Zellen verbessern kann32. Diese Ergebnisse deuten darauf hin, dass das Modell tatsächlich nützlich ist, um die Rolle der BHS bei neuroimmunologischen Erkrankungen wie MS zu untersuchen.
Zusammenfassend sind EECM-BMEC-ähnliche Zellen ein vielversprechendes Werkzeug für ein tiefgreifendes Verständnis pathophysiologischer Mechanismen auf der Ebene der BHS und als Werkzeug zur Entwicklung neuer therapeutischer Ziele für die BHS-Stabilisierung. In Zukunft kann das Modell zur Untersuchung der BHS-Dysfunktion in einem breiteren Spektrum von Erkrankungen eingesetzt werden und könnte Wege für neue Therapieansätze eröffnen.
Offenlegungen
BE erhielt einen Zuschuss von Biogen zur Untersuchung der erweiterten Dosierung von Natalizumab bei der T-Zell-Migration über die Blut-Hirn-Schranke und einen Zuschuss von CSL Behring zur Untersuchung der molekularen Grundlagen der Blut-Hirn-Schranken-Dysfunktion bei neurologischen Erkrankungen. HN und BE sind Erfinder der vorläufigen US-Patentanmeldungen zu den EECM-BMEC-ähnlichen Zellen (63/084980 und 63/185815).
Danksagungen
HN wurde unterstützt von der Uehara Memorial Foundation, einem ECTRIMS Postdoctoral Research Exchange Fellowship, JSPS im Rahmen des Joint Research Program, das in Zusammenarbeit mit dem SNF (JRPs) Grant No. JPJSJRP20221507 und dem KAKENHI Grant No. 22K15711, JST FOREST Program (Grant-Nummer JPMJFR2269, Japan), dem YOKOYAMA Foundation for Clinical Pharmacology Grant No. YRY-2217, der ICHIRO KANEHARA FOUNDATION, der Narishige Neuroscience Research Foundation, die NOVARTIS Foundation (Japan) zur Förderung der Wissenschaft und der YAMAGUCHI UNIVERSITY FUND. BE wurde von der Schweizerischen MS-Gesellschaft und dem Schweizerischen Nationalfonds (Beiträge 310030_189080 und ZLJZ3_214086) sowie vom Strategic Japanese-Swiss Science and Technology Programme (SJSSTP) IZLJZ3_214086 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
Referenzen
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372 (2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358 (2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32 (2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679 (2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9 (2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25 (2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118 (2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992 (2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten