Method Article
Différenciation de cellules souches pluripotentes induites par l’homme en cellules endothéliales microvasculaires cérébrales de type phénotype avec un phénotype immunitaire mature
Dans cet article
Résumé
Ici, nous décrivons un protocole, la méthode de culture cellulaire endothéliale étendue (EECM), qui permet de différencier les cellules souches pluripotentes en cellules de type cellule endothéliale microvasculaire cérébrale (BMEC). Ces cellules présentent l’expression de molécules d’adhésion cellulaire endothéliale et constituent donc un modèle de barrière hémato-encéphalique humain adapté à l’étude des interactions entre cellules immunitaires in vitro.
Résumé
Le dysfonctionnement de la barrière hémato-encéphalique (BHE) est une caractéristique pathologique de nombreuses maladies neurodégénératives et neuroinflammatoires affectant le système nerveux central (SNC). En raison de l’accès limité aux échantillons de BHE liés à la maladie, on ne comprend toujours pas bien si le dysfonctionnement de la BHE est causal pour le développement de la maladie ou plutôt une conséquence du processus neuroinflammatoire ou neurodégénératif. Les cellules souches pluripotentes induites par l’homme (CSPhi) offrent donc une nouvelle occasion d’établir des modèles de BHE in vitro à partir de donneurs et de patients sains, et donc d’étudier les caractéristiques spécifiques de la maladie de la BHE chez des patients individuels. Plusieurs protocoles de différenciation ont été établis pour dériver des cellules de type cellules endothéliales microvasculaires cérébrales (BMEC) à partir de CSPhi. La prise en compte de la question de recherche spécifique est obligatoire pour le choix correct du protocole de différenciation BMEC respectif. Ici, nous décrivons la méthode de culture cellulaire endothéliale étendue (EECM), qui est optimisée pour différencier les CSPhi en cellules de type BMEC avec un phénotype immunitaire mature, permettant l’étude des interactions cellules immunitaires-BBB. Dans ce protocole, les hiPSC sont d’abord différenciées en cellules progénitrices endothéliales (CPE) en activant la signalisation Wnt/β-caténine. La culture résultante, qui contient des cellules musculaires lisses (SMLC), est ensuite passée séquentiellement pour augmenter la pureté des cellules endothéliales (CE) et induire des propriétés spécifiques de la BHE. La co-culture d’EECM-BMEC avec ces SMLC ou un milieu conditionné à partir de SMLC permet l’expression reproductible, constitutive et régulée par cytokines des molécules d’adhésion EC. Il est important de noter que les cellules de type EECM-BMEC établissent des propriétés de barrière comparables aux BMEC humaines primaires et, en raison de leur expression de toutes les molécules d’adhésion EC, les cellules de type EECM-BMEC sont différentes des autres modèles de BHE in vitro dérivés de l’hiPSC. Les cellules de type EECM-BMEC sont donc le modèle de choix pour étudier l’impact potentiel des processus pathologiques au niveau de la BHE, avec un impact sur l’interaction des cellules immunitaires de manière personnalisée.
Introduction
L’unité neurovasculaire (NVU) du système nerveux central (SNC) est constituée de cellules endothéliales microvasculaires (CE) hautement spécialisées, de péricytes intégrés dans la membrane basale endothéliale ainsi que de la membrane basale parenchymateuse et des pieds d’extrémitédes astrocytes 1. Dans la NVU, les cellules endothéliales microvasculaires cérébrales (BMEC) sont les composants clés qui forment la barrière hémato-encéphalique (BHE). Les BMEC forment des jonctions serrées complexes et continues et ont une activité pinocytotique extrêmement faible par rapport aux EC microvasculaires dans les organes périphériques, ce qui permet à la BHE d’inhiber la diffusion paracellulaire libre des molécules solubles dans l’eau dans le SNC. L’expression de transporteurs d’afflux spécifiques et de pompes à efflux par les BMEC assure l’absorption et l’exportation des nutriments et des molécules nocives, respectivement, à partir du SNC2. De plus, la BHE contrôle strictement l’entrée des cellules immunitaires dans le SNC en exprimant de faibles niveaux de molécules d’adhésion endothéliale cruciales pour le trafic des cellules immunitaires dans le SNC3. Dans des conditions physiologiques, les niveaux d’expression des molécules d’adhésion à la surface des BMEC, telles que la molécule d’adhésion intercellulaire-1 (ICAM-1) et la molécule d’adhésion cellulaire vasculaire-1 (VCAM-1), sont faibles, mais ces niveaux augmentent dans certains troubles neurologiques2. La dégradation morphologique et fonctionnelle de la BHE est signalée dans de nombreuses maladies neurologiques, telles que l’accident vasculaire cérébral4, la sclérose en plaques (SEP)5 et plusieurs maladies neurodégénératives 6,7,8. L’étude détaillée des caractéristiques cellulaires et moléculaires des BMEC dans des conditions physiologiques et pathologiques est une approche pour identifier de nouvelles stratégies thérapeutiques qui ciblent la BHE.
Jusqu’à récemment, les BMEC primaires ou immortalisés humains et rongeurs étaient utilisés pour étudier la BHE. Cependant, il n’est pas clair si les conclusions fondées sur des modèles animaux de la BHE sont facilement applicables à la BHE humaine, car l’expression de plusieurs molécules importantes, y compris les molécules d’adhésion et les protéines porteuses de soluté, diffère entre les humains et les rongeurs 9,10. Bien que les lignées BMEC humaines comme hCMEC/D3 expriment des niveaux appropriés de molécules d’adhésion11, ces BMEC immortalisées n’ont généralement pas de jonctions serrées complexes et de propriétés de barrière robustes12. Les BMEC humaines primaires sont utiles pour étudier les fonctions de barrière13, mais elles ne sont pas facilement accessibles à tous les chercheurs. De plus, les BMEC primaires des patients peuvent être difficiles à obtenir car elles doivent être prélevées par une biopsie cérébrale ou une intervention chirurgicale qui n’est effectuée que dans des conditions cliniques spécifiques.
Les progrès récents de la technologie des cellules souches ont permis la différenciation de divers types de cellules humaines, provenant de sources de cellules souches telles que les cellules souches pluripotentes induites par l’homme (CSPhi). Les modèles dérivés de hiPSC nous permettent d’établir des modèles physiopathologiques à l’aide d’échantillons dérivés de patients. Plusieurs types de cellules dérivées de l’hiPSC peuvent être combinés pour établir des co-cultures autologues ou des organoïdes qui imitent mieux les conditions physiologiques. Plusieurs protocoles largement utilisés 14,15,16,17,18,19 peuvent être utilisés pour différencier les cellules BMEC dérivées de hiPSC qui ont des propriétés de barrière de diffusion robustes avec l’expression de transporteurs spécifiques de la BHE et de pompes à efflux, et sont utiles pour étudier la diffusion paracellulaire de petites molécules, les mécanismes de transport moléculaire et l’administration de médicaments au cerveau 20,21. Cependant, des études antérieures ont montré que les cellules BMEC dérivées de l’hiPSC largement utilisées n’expriment pas les molécules clés d’adhésion endothéliale, y compris VCAM-1, les sélectines et ICAM-2, qui sont responsables de la médiation des interactions entre les cellules immunitaires et la BHE22. En outre, il a été signalé que les CEMO dérivés de l’hiPSC présentaient des caractéristiques endothéliales et épithéliales mixtes au niveau transcriptionnel23. Par conséquent, nous avons développé la méthode de culture cellulaire endothéliale étendue (EECM), un nouveau protocole qui permet la différenciation des CSPhi en cellules de type BMEC qui ressemblent à des BMEC humains primaires en ce qui concerne la morphologie, les caractéristiques de barrière et l’expression de la molécule d’adhésion endothéliale. Ce protocole décrit les procédures méthodologiques détaillées pour différencier les CSPhi des cellules de type BMEC présentant un phénotype immunitaire mature.
Protocole
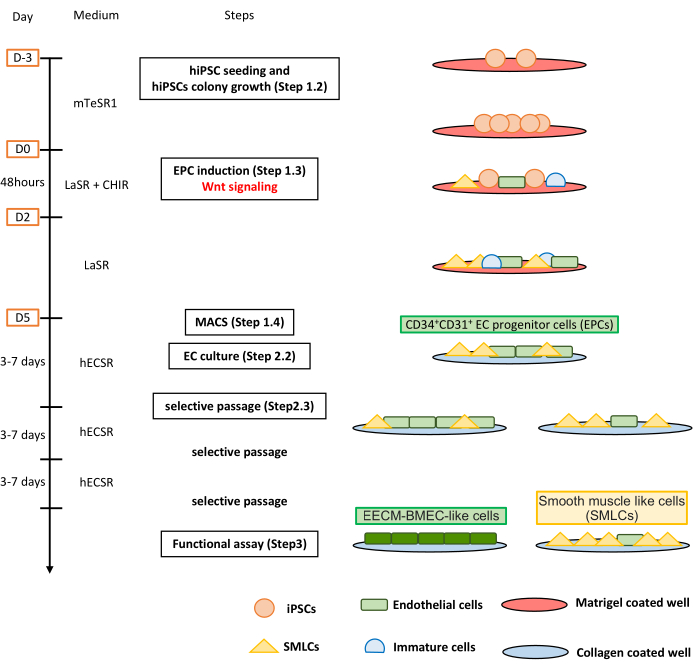
Figure 1 : Vue d’ensemble du protocole. Le manuscrit présente un protocole étape par étape pour différencier les CSPh en cellules de type EECM-BMEC. Les bons schémas représentent les populations cellulaires à chaque étape. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La ligne hiPSC, HPS1006, a été fournie par le BRC RIKEN dans le cadre du projet national de bioressources du MEXT/AMED, au Japon.
1. Induction de la différenciation des CSPhi dans les cellules progénitrices endothéliales (CPE)
- Plaques et réactifs revêtus de matrice extracellulaire (ECM)
- Préparer des plaques à 12 puits revêtues d’une matrice basale en aliquote 2,5 mg de gel matriciel dans des tubes centrifugés de 50 mL pour les stocker à -20 °C pendant une période allant jusqu’à 6 mois. Ajouter 30 ml de mélange médium/nutritif modifié F-12 (DMEM/F12) de Dulbecco à froid, qui a été conservé au réfrigérateur (4 °C), dans le tube. Mélanger doucement par pipetage jusqu’à ce que le gel ait décongelé, puis ajouter 500 μL de la solution dans chaque puits de la plaque de 12 puits. Placer la plaque dans un incubateur (37 °C, 5% CO2) pendant au moins 1 h.
REMARQUE : Le gel à matrice membranaire basale est sensible à la température et doit être manipulé conformément aux instructions du fabricant pour l’aliquote et le revêtement de la plaque. La concentration de protéines de la matrice extracellulaire peut varier d’un lot à l’autre. Pour garantir l’exactitude, la concentration exacte doit être indiquée sur la feuille de certificat de qualité pour le lot spécifique, en utilisant le numéro de lot. Par exemple, si la concentration exacte est de 10,0 mg/mL, utilisez 250 μL de gel pour un total de 2,5 mg. - Préparer la solution mère d’inhibiteur de la rho-kinase (ROCK) en dissolvant l’inhibiteur de ROCK dans de l’eau stérile jusqu’à une concentration de 10 mM (tableau 1). Aliquote la solution mère dans des volumes de 100 à 200 μL et la conserver à -20 °C pour éviter les cycles de gel-décongélation.
- Préparer une solution mère de 100 mg/mL d’acide L-ascorbique en dissolvant 5 g d’acide L-ascorbique dans 50 mL d’eau stérile et conserver à -20 °C (tableau 1). Ajouter 6,25 mL de glutamine et 305 μL de solution mère d’acide L-ascorbique dans 500 mL de DMEM/F12 avancé pour obtenir un milieu LaSR24 (tableau 1). Conserver entre 2 et 8 °C jusqu’à 2 semaines.
- Préparer la solution de CHIR99021 en dissolvant CHIR99021 dans du diméthylsulfoxyde (DMSO) non dilué jusqu’à une concentration finale de 10 mM (tableau 1). Aliquote la solution en volumes de 100 à 200 μL pour éviter les cycles de congélation-dégel et conserver à -20 °C jusqu’à 1 an. Conservez les aliquotes de travail de la solution mère à 4 °C jusqu’à 1 mois.
- Préparer le milieu DMEM/F12-10 en ajoutant 50 mL de sérum fœtal bovin inactivé par la chaleur à 450 mL de DMEM/F12. Conserver le milieu entre 2 et 8 °C jusqu’à 1 mois (tableau 1).
- Préparer le tampon de débit-1 en ajoutant 33,3 mL d’albumine sérique bovine (BSA) à 7,5 % à 467 mL de solution saline tamponnée au phosphate (PBS) de Dulbecco (tableau 1). Conserver entre 2 et 8 °C jusqu’à 6 mois.
- Préparer des plaques à 12 puits revêtues d’une matrice basale en aliquote 2,5 mg de gel matriciel dans des tubes centrifugés de 50 mL pour les stocker à -20 °C pendant une période allant jusqu’à 6 mois. Ajouter 30 ml de mélange médium/nutritif modifié F-12 (DMEM/F12) de Dulbecco à froid, qui a été conservé au réfrigérateur (4 °C), dans le tube. Mélanger doucement par pipetage jusqu’à ce que le gel ait décongelé, puis ajouter 500 μL de la solution dans chaque puits de la plaque de 12 puits. Placer la plaque dans un incubateur (37 °C, 5% CO2) pendant au moins 1 h.
- Ensemencement de hiPSC singularisés et expansion pour la différenciation EPC (Jour -3 à Jour -1)
- Commencer la différenciation lorsque les colonies de CSPhi dans une plaque à 6 puits ne montrent aucune différenciation spontanée et ont la densité appropriée pour le passage, généralement autour de 80% de confluence (2,5-3,5 x 106 cellules). Surveillez attentivement les cellules spontanément différenciées au microscope pour vous assurer que plusieurs passages sont nécessaires pour éliminer les cellules non différenciées. Reportez-vous à la note fournie ci-dessous à l’étape 1.4.15 pour obtenir des informations sur le milieu de culture cellulaire et la matrice extracellulaire.
- Aspirer le milieu et ajouter 1 mL de réactif de dissociation dans les puits et incuber pendant 5-7 min à 37 °C. Dissocier et singulariser les cellules en pipetant doucement la solution de réactif de dissociation sur les surfaces des puits deux ou trois fois.
- Transférer les cellules détachées dans un tube de 15 mL contenant 4 mL de milieu d’entretien hiPSC et remettre les cellules en suspension complètement. Réserver une partie aliquote de 10 μL pour le comptage cellulaire.
- Enduire les cellules par centrifugation pendant 5 min à 200 x g à 20-25 °C. Compter les cellules et calculer le volume requis pour obtenir une densité appropriée de CSPhi (75-400 x 103 par puits) dans une plaque à 12 puits revêtue d’une matrice membranaire basale (étape 1.1.1).
- Aspirer la solution de revêtement des puits et ajouter 1 mL de milieu hiPSC contenant 10 μM d’inhibiteur de ROCK dans chaque puits (dilution de 1:1 000). Après centrifugation, aspirer le surnageant et dissocier la pastille dans 1 mL de milieu hiPSC.
- Ajouter le volume requis de hiPSC, déterminé à l’étape 1.2.4, dans chaque puits de la plaque de 12 puits. Deux à quatre plaques de 12 puits peuvent suffire pour différencier un clone de hiPSC. Reportez-vous à l’étape 1.2.4 pour déterminer le nombre de plaques requises pour les cellules d’ensemencement.
- Placer la plaque dans un incubateur (37 °C, 5% CO2). Répartir uniformément les cellules en faisant glisser doucement la plaque d’avant en arrière, puis d’un côté à l’autre dans l’incubateur.
- Le lendemain (c.-à-d. jour -2), échangez le milieu avec 2 mL de milieu d’entretien hiPSC dépourvu d’inhibiteur de ROCK. Le lendemain (Jour -1), remplacez le milieu par 2 ml de milieu d’entretien HiPSC frais.
- Induction de CPE avec l’inhibiteur de la glycogène synthase kinase 3 (GSK-3) CHIR99021 (du jour 0 au jour 5)
- Le jour 0, remplacer le milieu d’entretien hiPSC dans chaque puits par 2 mL de milieu LaSR contenant 8 μM CHIR99021.
- Le jour 1, aspirer le milieu et ajouter 2 mL de milieu LaSR frais contenant 8 μM CHIR99021.
- Les jours 2, 3 et 4, remplacez le milieu par 2 ml de milieu LaSR frais sans CHIR99021.
- Tri des cellules activées magnétiques (MACS) pour purifier CD31+ CPE (Jour 5)
- Le jour 5, aspirer le milieu, puis ajouter 1 mL de réactif de dissociation à chaque puits, avant d’incuber pendant 6 à 8 minutes à 37 °C.
- Dissocier et singulariser les cellules à l’aide d’une micropipette et passer à travers une crépine cellulaire de 40 μm pour filtrer la suspension dans un tube de 50 mL contenant 10 mL de milieu DMEM/F12-10. Filtrer la suspension cellulaire recueillie à partir de plus de deux plaques de 12 puits dans au moins deux tubes de 50 mL.
- Arrêter la réaction de digestion en ajoutant DMEM/milieu F12-10 (jusqu’à 50 mL). Bien pipeter et réserver 10 μL pour les cellules de comptage. Enduire les cellules par centrifugation pendant 5 min à 200 x g à 20-25 °C.
- Après avoir retiré le surnageant, ajouter 10 mL de milieu DMEM/F12-10 et transférer la suspension cellulaire dans de nouveaux tubes de 15 mL. Enduire les cellules par centrifugation pendant 5 min à 200 x g à 20-25 °C.
- Aspirer le surnageant et le remettre en suspension dans le tampon d’écoulement 1 à une densité de 1,0 x 107 cellules par 100 μL de tampon.
- Ajouter le réactif bloquant FcR dans un rapport de 1:100 et incuber pendant 5 minutes avant d’ajouter l’anticorps CD31 marqué à l’isothiocyanate de fluorescéine (FITC) dilué 1:200. Incuber la suspension pendant 30 min dans l’obscurité à 20-25 °C.
- Ajouter 10 mL de tampon d’écoulement-1, en réservant 10 μL de la suspension pour l’analyse par cytométrie en flux afin de déterminer la fraction de cellules CD31+ (Figure 2).
- Enduire les cellules par centrifugation à 200 x g pendant 5 min à 20-25 °C. Ensuite, retirez le surnageant et remettez en suspension à une densité de 1,0 x 107 cellules par 100 μL de solution tampon-1 d’écoulement. Ajouter le cocktail de sélection FITC (5 μL par 100 μL de suspension cellulaire). Bien mélanger par pipetage et incuber dans l’obscurité pendant 15 min à 20-25 °C.
- Ajouter 5 μL de nanoparticules magnétiques par 100 μL de suspension cellulaire, bien pipeter et incuber dans l’obscurité pendant 10 minutes à 20-25 °C.
- Transférer la suspension cellulaire dans un tube de cytométrie en flux de 5 mL et ajouter le tampon de débit-1 pour obtenir un volume total de 2,5 mL. Placez le tube de cytométrie en flux dans l’aimant pendant 5 min.
- Dans un mouvement continu, inverser l’aimant et décanter la suspension cellulaire contenant des cellules qui n’ont pas été marquées avec l’anticorps FITC-CD31. Maintenez l’aimant et le tube en position inversée pendant 2-3 s, puis retirez le liquide restant. Aspirez les gouttelettes sur le bord du tube avant de remettre le tube en position verticale.
- Prenez le tube de cytométrie en flux de l’aimant et ajoutez 2,5 mL de tampon de flux-1 pour laver les cellules CD31+ restantes. Remettez les cellules en suspension en les pipetant doucement de haut en bas deux ou trois fois. Placez le tube d’écoulement dans l’aimant pendant 5 min.
- Répétez les étapes 1.4.11-1.4.12 trois fois, puis l’étape 1.4.11 une fois de plus pour un total de quatre lavages.
- Retirer le tube d’écoulement de l’aimant et ajouter la quantité indiquée d’un milieu approprié (p. ex., milieu sans sérum endothélial humain [hECSR] pour culture EC prolongée ou milieu de congélation pour la congélation) dans le tube pour remettre en suspension les cellules CD31+ purifiées. Réserver deux aliquotes de 10 μL de la suspension, l’une pour le comptage cellulaire et l’autre pour effectuer une analyse de cytométrie en flux afin d’évaluer la pureté des cellules CD31+ dans les échantillons post-MACS (Figure 2). Si un cytomètre en flux n’est pas disponible immédiatement, conserver la partie aliquote à 4 °C jusqu’à l’analyse.
- Si les étapes suivantes (à l’étape 2) ne peuvent pas être effectuées immédiatement, gelez les CPE CD31+ à ce stade. Pour l’expansion et le passage sélectif des EPC, passez à l’étape 2.
REMARQUE : Les plaques à 12 puits revêtues de Vitronectine25 et le milieu de maintenance hiPSC plus stable (mTeSR plus) peuvent être utilisés à la place des plaques revêtues de matrice à membrane basale et du milieu de maintenance hiPSC (mTeSR1). Pour préparer des plaques de 12 puits recouvertes de vitronectine, diluer la vitronectine avec un tampon de dilution jusqu’à une concentration finale de 10 μg/mL, puis transférer 500 μL de la solution diluée dans chaque puits des plaques de 12 puits. Laisser les plaques à 20-25 °C pendant au moins 1 h. La densité d’ensemencement des CSPhi singularisées est comparable à celle utilisée pour les plaques revêtues de matrice membranaire basale. La modification du milieu de culture ou de la composition de la matrice peut avoir un impact sur la prolifération et la différenciation spontanée des CSPh, qui nécessitent généralement 1 à 2 semaines pour s’adapter aux nouvelles conditions de culture. Si le support de maintenance hiPSC plus stable est utilisé pour la maintenance hiPSC, ce support peut être utilisé pour la différenciation EPC au lieu du support de maintenance hiPSC. Dans ce cas, le milieu d’entretien hiPSC plus stable doit être changé au jour -2 pour éliminer l’inhibiteur de ROCK, et l’échange au jour -1 peut être ignoré.
2. Méthode de culture de cellules endothéliales étendues (EECM) pour différencier les cellules de type cellule endothéliale microvasculaire cérébrale (cellules de type BMEC) et les cellules musculaires lisses (SMLC)
- Préparation de plaques et de réactifs enrobés de collagène
- Préparer des plaques à 6 puits recouvertes de collagène en dissolvant 5 mg de collagène cristallisé de type IV dans 5 mL d’eau stérile. Incuber pendant une nuit à 4 °C avant d’aliquoter et de conserver à -20 °C. Diluer les aliquotes de collagène IV 1:100 dans de l’eau stérile pour produire des solutions de 10 μg/mL et ajouter 1 mL de solutions IV de collagène 10 μg/mL à chaque puits des plaques à 6 puits. Incuber les plaques pendant au moins 30 min à 37 °C. Les plaques peuvent être conservées à 37 °C jusqu’à 1 semaine.
- Préparer une solution mère de facteur de croissance des fibroblastes humains 2 (FGF2) en dissolvant 500 μg de FGF dans 5 mL de PBS de Dulbecco, ajouter 7,5 % de BSA à une concentration finale de 0,1 % et aliquoter la solution mère en volumes de 20 à 200 μL. Ceux-ci peuvent être conservés à -20 °C jusqu’à 3 mois (tableau 1). Les solutions mères peuvent être conservées à 4 °C jusqu’à 1 mois; Évitez les cycles de gel-dégel. Préparer le milieu hECSR en ajoutant 2 mL de supplément de B-27 et 20 μL de FGF2 dans 98 mL de milieu hECSR (tableau 1). Le milieu hECSR peut être conservé entre 2 et 8 °C jusqu’à 2 semaines.
- Préparer le milieu de congélation pour les CPE, les cellules de type EECM-BMEC et les SMLC en ajoutant 15 mL de sérum bovin fœtal, 5 mL de DMSO et 25 μL de solution inhibitrice de ROCK à 30 mL de milieu hECSR (tableau 1). Le milieu de congélation peut être conservé entre 2 et 8 °C jusqu’à 2 semaines.
- Ensemencement de CPE pour une culture étendue de cellules endothéliales
- Retirer la solution de collagène des plaques à 6 puits. Ensuite, transférer 1,0-2,0 x 10 5 CPE CD31+ purifiés dans 2 mL de milieu hECSR contenant5 μM d’inhibiteur de ROCK (dilution 1:2 000). Placer la plaque dans un incubateur (37 °C, 5% CO2). Répartir uniformément les cellules en faisant glisser doucement les plaques d’avant en arrière, puis d’un côté à l’autre.
- Le lendemain, retirer le milieu hECSR contenant l’inhibiteur de ROCK et ajouter 2 mL de milieu hECSR frais sans inhibiteur de ROCK. Échangez le milieu hECSR tous les deux jours jusqu’à ce que la confluence soit atteinte à 100%.
REMARQUE : Si un horaire d’alimentation régulier ne peut être maintenu pendant une fin de semaine, le milieu peut être remplacé le soir du dernier jour ouvrable de la semaine et de nouveau tôt le matin après la fin de semaine.
- Passage sélectif pour purifier les cellules de type EECM-BMEC et les SMLC
- Retirer le milieu hECSR des plaques à 6 puits contenant un mélange de CEs et de populations non EC. Ajouter 1 mL de réactif de dissociation à chaque puits.
- Surveillez attentivement la morphologie cellulaire au microscope. Lorsque les EC (mais pas les non-CE) apparaissent brillants et ronds (généralement dans les 2-5 minutes), détachez-les en tapotant le bord de la plaque. La plupart des non-EC restent attachés à la plaque.
- Recueillir les EC détachés à l’aide d’une micropipette, en prenant soin d’éviter de remettre en suspension les CE. Transférer les CE dans un tube à centrifuger de 15 mL ou 50 mL contenant 4 mL de DMEM/F12-10 par 1 mL de réactif de dissociation.
- Ajouter 2 mL de milieu hECSR dans les puits contenant les autres non-EC rattachés pour établir des SMLC. Placez la plaque dans l’incubateur.
- Pipeter la suspension EC dans le tube à centrifuger pour bien mélanger et réserver 10 μL de la suspension pour le comptage des cellules. Centrifuger les cellules restantes pendant 5 min à 200 x g à 20-25 °C. Retirer le surnageant de la pastille et ajouter 2 mL de milieu hECSR par 1,0-2,0 x 105 CE.
- Lors du retrait de la solution IV de collagène d’une nouvelle plaque à 6 puits, ajouter 2 mL de suspension EC dans chaque puits, suivi d’une incubation à 37 °C avec 5% de CO2. Pour répartir uniformément les cellules dans la plaque, déplacez-la doucement d’avant en arrière et d’un côté à l’autre sur l’étagère de l’incubateur.
- Remplacez le milieu hECSR tous les deux jours jusqu’à ce que les EC atteignent 100% de confluence.
- Répéter les étapes 2.3.1-2.3.7 jusqu’à l’obtention d’une monocouche EC pure. Si les étapes suivantes ne peuvent être effectuées, congeler les EC CD31+ (voir l’étape 2.4.2). Pour analyser les fonctions EC, passez à l’étape 3.
NOTE: En général, deux ou trois passages sélectifs sont nécessaires pour obtenir des cultures presque pures de CE qui conviennent aux analyses fonctionnelles, et nous considérons ces cellules comme des cellules de type EECM-BMEC. Après plus de cinq ou six passages, la prolifération cellulaire ralentit généralement, bien que cette variable dépende de la ligne hiPSC. - Pour cultiver les SMLC, remplacez le milieu hECSR tous les deux jours. Pour recueillir le milieu conditionné SMLC (CM), passez le milieu collecté à travers un filtre de 0,22 μm à chaque changement de milieu. Le CM peut être utilisé pour réguler positivement l’expression VCAM-1 des cellules de type EECM-BMEC. Mettez en commun le SMLC-CM jusqu’à ce que les SMLC atteignent 100% de confluence.
- Cellule de type EPC, EECM-BMEC et cryoconservation et décongélation SMLC
- Pour congeler les CPE, après le lavage MACS final (étape 1.4.13), remettre les CPE en suspension dans un milieu de congélation plutôt que dans un milieu hECSR à une densité de 1,0-2,0 x 106 cellules/mL. Répartir 1 mL de la suspension cellulaire dans des cryotubes. Placez les cryotubes dans un dispositif de congélation à vitesse contrôlée et transférez-les rapidement à -80 °C. Pour un stockage à long terme, déplacer les tubes dans un réservoir d’azote liquide 24 à 48 h après la congélation.
- Pour congeler les cellules de type EECM-BMEC et les SMLC, après avoir retiré le milieu des puits, ajouter le réactif de dissociation (1 mL/puits) et incuber la plaque à 37 °C avec 5% de CO2 jusqu’à ce que les cellules se détachent (5-7 min et 20-30 min pour les cellules de type EECM-BMEC et les SMLC, respectivement). Recueillir les cellules dans un tube à centrifuger de 15 mL ou 50 mL contenant 4 mL de DMEM/F12-10 par 1 mL de réactif de dissociation.
- Bien mélanger à la pipette et réserver 10 μL de la suspension cellulaire pour le comptage des cellules. Enduire les cellules par centrifugation à 200 x g pendant 5 min à 20-25 °C. Retirer le surnageant et remettre soigneusement les cellules en suspension dans un milieu de congélation jusqu’à une densité de 1,0-2,0 x 106 cellules/mL. Répartir 1 mL de la suspension cellulaire dans des cryotubes frais.
- Placer les cryotubes dans un dispositif de congélation à vitesse contrôlée et les transférer immédiatement à -80 °C. Pour un stockage à long terme, les tubes peuvent être transférés dans un réservoir d’azote liquide 24 à 48 h après la congélation.
- Pour décongeler les CPE, les cellules de type EECM-BMEC et les SMLC, rouler des flacons de cryotubes entre les mains ou incuber dans un bain-marie à 37 °C jusqu’à ce que les cellules soient presque complètement décongelées. Ajouter 500 μL de DMEM/F12-10 et transférer doucement la suspension cellulaire dans un tube de 15 mL contenant 4 mL de milieu DMEM/F12-10. Laver le cryotube une fois en ajoutant 1 mL de DMEM/F12-10, puis centrifuger les cellules à 200 x g pendant 5 min à 20-25 °C.
- Aspirer le surnageant et remettre en suspension la pastille dans 2 mL de milieu hECSR contenant 5 μM d’inhibiteur de ROCK (dilution de 1:2 000) à une densité de 1,0-2,0 x 105 cellules par 2 mL pour les CPE, et de 2,0-3,0 x 105 cellules par 2 mL pour les cellules de type EECM-BMEC et les SMLC. Répartir la suspension cellulaire entre les puits des plaques à 6 puits recouvertes de collagène après avoir aspiré la solution de collagène.
- Déplacer doucement les plaques d’avant en arrière, puis d’un côté à l’autre, sur la tablette d’un incubateur à 37 °C, 5 % de CO2 pour répartir uniformément les cellules dans les puits.
- Le lendemain, échangez le milieu avec un milieu hECSR frais dépourvu d’inhibiteur de ROCK. Échangez le milieu hECSR tous les deux jours jusqu’à ce que la confluence soit atteinte à 100%. Ensuite, passez au passage sélectif pour les CPE (voir étape 2.3) et aux analyses fonctionnelles pour les cellules de type EECM-BMEC (voir étape 3). Avant d’effectuer la caractérisation moléculaire et les essais fonctionnels, les cellules de type EECM-BMEC doivent être confluentes à 100%, ce qui est généralement obtenu 2-3 jours après la décongélation.
3. Validation des cellules de type EECM-BMEC et des SMLC
- Essai de perméabilité pour traceurs à petites molécules
- Évaluer l’intégrité de la barrière cellulaire de type EECM-BMEC en mesurant la perméabilité à la fluorescéine sodique, telle que décrite par Nishihara et coll.26. Ensemencer les cellules de type EECM-BMEC sur des inserts filtrants pour développer des monocouches complètes et mesurer la perméabilité de la fluorescéine de sodium.
- Coloration par immunofluorescence pour évaluer les molécules clés.
- Pour la coloration par immunofluorescence afin de surveiller l’expression des molécules jonctionnelles, des molécules d’adhésion ou des protéines cytosquelettiques des cellules de type EECM-BMEC dans les monocouches ou des SMLC, utilisez des lames de chambre, des plaques à 96 puits ou des membranes avec filtres à insert. Évaluer l’expression cellulaire de type EECM-BMEC de molécules d’adhésion à la surface cellulaire avec ou sans stimulation de cytokines inflammatoires, telle que décrite par Nishihara et al.26.
- Cytométrie en flux pour analyser l’expression des molécules d’adhésion de surface cellulaire sur des cellules de type EECM-BMEC
- Utiliser la cytométrie en flux pour évaluer l’expression semi-quantitative des molécules d’adhésion à la surface cellulaire impliquées dans la migration des cellules immunitaires dans le SNC, y compris ICAM-1, ICAM-2, VCAM-1, P-séclectine, E-séclectine, CD99 et la molécule d’adhésion des cellules endothéliales plaquettaires-1 (PECAM-1), comme décrit par Nishihara et al.26. Culture des cellules de type EECM-BMEC avec un milieu conditionné par SMLC en présence et en l’absence de cytokines inflammatoires pendant 16-18 h.
- Essai d’adhésion des cellules immunitaires dans des conditions statiques pour évaluer l’expression des molécules d’adhésion fonctionnelle
- Utiliser la méthode décrite par Nishihara et coll.26 pour déterminer si les molécules d’adhésion à la surface cellulaire des cellules de type EECM-BMEC sont fonctionnelles.
- Brièvement, ensemencer les cellules de type EECM-BMEC sur une lame de chambre à 5,5 x 104/cm2 et croître jusqu’à confluence. Environ 24 h plus tard, changer le milieu de culture en milieu conditionné SMLC en présence ou en l’absence de cytokines pro-inflammatoires, et incuber les cellules de type EECM-BMEC pendant 16 heures supplémentaires.
- Le jour de l’expérience, décongeler les cellules immunitaires cryoconservées (p. ex. lymphocytes T ou cellules mononucléées du sang périphérique [PBMC]) à l’aide d’un tampon de lavage des lymphocytes T (tableau 1) et les marquer avec des colorants fluorescents (p. ex. colorants traqueurs cellulaires) dans un milieu de lymphocytes T (tableau 1). L’optimisation du milieu de culture pour les cellules immunitaires doit être adaptée au type spécifique de cellules immunitaires étudiées.
- Dans une lame de chambre de 16 puits, ajouter 2 x 104 cellules Th1 aux cellules de type EECM-BMEC. Plus précisément, lorsqu’on travaille avec des lymphocytes T effecteurs comme les lymphocytes Th1, on a observé qu’ils présentent une plus grande fixation aux cellules de type EECM-BMEC par rapport aux PBMC (Nishihara. et coll. [2022]). Par conséquent, le nombre de PBMC à ajouter aux cellules de type EECM-BMEC doit être plus élevé que celui des cellules T effectrices pures.
- Incuber les cellules immunitaires avec la monocouche de cellules de type EECM-BMEC pendant 30 minutes dans un milieu d’essai de migration (tableau 1). Après 30 min, laver la lame doucement, deux fois en l’immergeant dans un bocal contenant le PBS de Dulbecco, puis fixer avec une solution de glutaraldéhyde à 2,5% à 4 °C pendant 2 h.
- Après la fixation, lavez la lame deux fois en l’immergeant dans un bocal contenant le PBS de Dulbecco et montez avec un couvercle. Acquérir ensuite des images de microscopie à fluorescence du centre de la monocouche sur les lames pour compter les cellules immunitaires attachées aux monocouches cellulaires de type EECM-BMEC.
Résultats
Essai de perméabilité
La perméabilité de la fluorescéine de sodium a été calculée en mesurant l’intensité de fluorescence du milieu prélevé dans la chambre inférieure à 15, 30, 45 et 60 min. Un total de 150 μL de milieu est échantillonné à chaque point temporel et le volume manquant de 150 μL est remplacé par un milieu hECSR. l’intensité de fluorescence est lue à l’aide d’un lecteur de plaque fluorescente (excitation de 485 nm/émission de 530 nm) et les signaux, volumes de clairance et perméabilités corrects sont calculés à l’aide d’une formule18 décrite précédemment (tableau 2). Il est recommandé de confirmer si l’intensité de fluorescence de la fluorescéine de sodium augmente avec le temps. Plusieurs filtres, au moins trois exemplaires, devraient être utilisés pour un essai afin d’assurer la reproductibilité. Pour les cellules saines de type EECM-BMEC dérivées du contrôle, la perméabilité à la fluorescéine de sodium (376 Da) doit être inférieure à 0,3 x 10-3 cm/min. Pour confirmer la formation d’une monocouche cellulaire confluente de type EECM-BMEC, une coloration par immunofluorescence des protéines jonctionnelles des cellules de type EECM-BMEC de chaque filtre utilisé dans les essais de perméabilité doit être effectuée après cet essai.
Coloration par immunofluorescence
La coloration par immunofluorescence de molécules jonctionnelles cellulaires de type EECM-BMEC, y compris la claudine-5, l’occludine et la VE-cadhérine1, a été utilisée pour évaluer la morphologie cellulaire et la présence de jonctions continues et matures (Figure 4). Les monocouches de cellules de type EECM-BMEC sur les membranes des inserts filtrants ont été fixées avec du méthanol froid (-20 °C) pendant 20 s, bloquées avec un tampon bloquant (tableau 1), puis incubées avec des anticorps primaires et secondaires. Les cellules de type EECM-BMEC présentaient des formes fusiformes et des jonctions en forme de zigzag, deux caractéristiques morphologiques caractéristiques des BMEC27. La stimulation des cellules de type EECM-BMEC ensemencées sur des lames de chambre avec des cytokines pro-inflammatoires, telles que le facteur de nécrose tumorale α (TNF-α) et l’interféron-γ (INF-γ) (0,1 ng/mL de TNF-α + 2 UI/mL d’IFN-γ) diluées dans un milieu conditionné dérivé de SMLC, régulent à la hausse l’expression de molécules d’adhésion, telles que ICAM-1 et VCAM-128 (Figure 5). Des images représentatives des marqueurs des cellules musculaires lisses, y compris l’actine α-muscle lisse (SMA), la calponine et la protéine musculaire lisse 22-Alpha (SM22a)29, sont présentées à la figure 6. Les SMLC ensemencés sur la lame de chambre ont été fixés avec 4% de paraformaldéhyde pendant 10 min, bloqués avec un tampon de blocage, puis incubés avec des anticorps primaires et secondaires.
Analyse par cytométrie en flux de l’expression de molécules d’adhésion à la surface cellulaire par des cellules de type EECM-BMEC
Des résultats représentatifs pour l’expression de surface cellulaire des molécules d’adhésion endothéliale sur des cellules de type EECM-BMEC sont présentés à la figure 7. La stimulation avec des cytokines pro-inflammatoires, comme le TNF-α et l’INF-γ, a régulé à la hausse l’expression de surface cellulaire de plusieurs molécules d’adhésion, y compris ICAM-1, VCAM-1 et P-séclectine. La culture de cellules de type EECM-BMEC avec une expression de surface cellulaire endothéliale VCAM-1 conditionnée par SMLC a été améliorée. L’effet de l’induction de l’expression de surface cellulaire VCAM-1 peut varier d’un lot à l’autre de milieu conditionné SMLC. Il est recommandé de stocker plusieurs lots de milieu conditionné récoltés dans des SMLC, dérivés de la même source de CSPhi, lors de la différenciation des SMLC, afin de vérifier quel lot induit l’expression appropriée de VCAM-1.
Essai d’adhésion des cellules immunitaires dans des conditions statiques
Le nombre de cellules immunitaires attachées était corrélé au niveau d’expression des molécules d’adhésion fonctionnelle à la surface des cellules de type EECM-BMEC. La stimulation par cytokines inflammatoires a régulé à la hausse l’expression des molécules d’adhésion endothéliale et favorisé l’augmentation du nombre de cellules immunitaires qui ont adhéré aux monocouches cellulaires de type EECM-BMEC (Figure 8). L’expérience actuelle a démontré la fonctionnalité des molécules d’adhésion sur des cellules de type EECM-BMEC, ce qui rend ce modèle approprié pour étudier les interactions cellules immunitaires-EC.

Figure 2 : Purification des EC CD31+. Diagrammes à points de données représentatives de cytométrie en flux provenant de la dispersion des CE et de la coloration CD31 marquée FITC des populations cellulaires avant (étape 1.4.7) et après (étape 1.4.14) MACS. La MACS améliore la pureté des CPE CD31+ dans la population. Abréviations : SSC = dispersion latérale; FSC = diffusion vers l’avant; FITC = isothiocyanate de fluorescéine; MACS = tri des cellules activées magnétiquement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
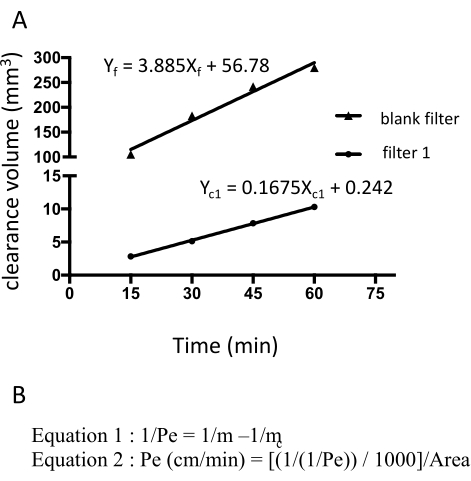
Figure 3: Perméabilité monocouche EECM-BMEC (10-3 cm/min) calculée à partir de l’intensité de fluorescence brute de la fluorescéine de sodium. La pente linéaire du volume de dégagement est calculée à l’aide d’une régression linéaire pour chaque filtre (figure 3A). La perméabilité de la fluorescéine de sodium est calculée à l’aide de deux formules (figure 3B). (A) La pente linéaire du volume de dégagement en fonction du temps a été calculée en utilisant la régression linéaire pour le filtre 1 (mc1) et le filtre blanc (mf). Les m c1 et m f sont des coefficients de Xc1 et X f, respectivement. (B) Formule de calcul de la perméabilité à la fluorescéine (Pe) en mc et mf (formule 1). Les unités PE ont été converties en utilisant la surface d’un filtre (Formule 2). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Les cellules de type EECM-BMEC présentent des jonctions cellulaires matures. Coloration par immunofluorescence de la claudine-5, de l’occludine ou de la VE-cadhérine (rouge) dans les cellules de type EECM-BMEC cultivées sur les membranes des filtres à insert. Les noyaux ont été colorés à l’aide de 4′,6-diamidino-2-phénylindole (DAPI) (bleu). La coloration a été effectuée sur les mêmes inserts de filtre utilisés pour les tests de perméabilité. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
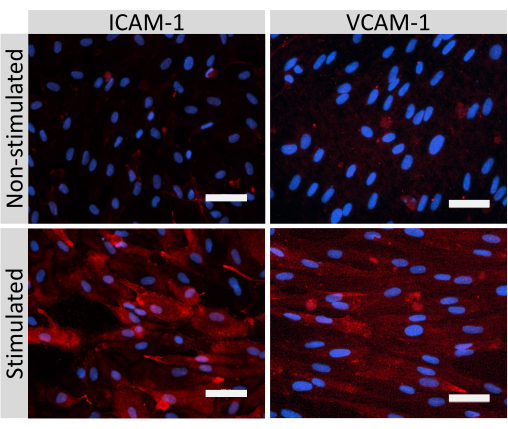
Figure 5 : Expression des molécules d’adhésion endothéliale par les cellules de type EECM-BMEC. La coloration par immunofluorescence a été réalisée sur des cellules de type EECM-BMEC cultivées sur des membranes d’inserts filtrants en présence de CM dérivée de SMLC. L’immunomarquage pour ICAM-1 ou VCAM-1 (rouge) est montré pour les cellules non stimulées et 1 ng/mL de type TNF-α + 20 UI/mL d’IFN- γ stimulées par EECM-BMEC. Les noyaux ont été colorés avec DAPI (bleu). Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Caractérisation des SMLC. L’immunocytochimie de l’actine α-muscle lisse (SMA), de la calponine ou de la protéine 22-Alpha du muscle lisse (SM22a) (rouge) pour les CLMS cultivés sur des lames de chambre est montrée. Les noyaux ont été colorés avec DAPI (bleu). Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
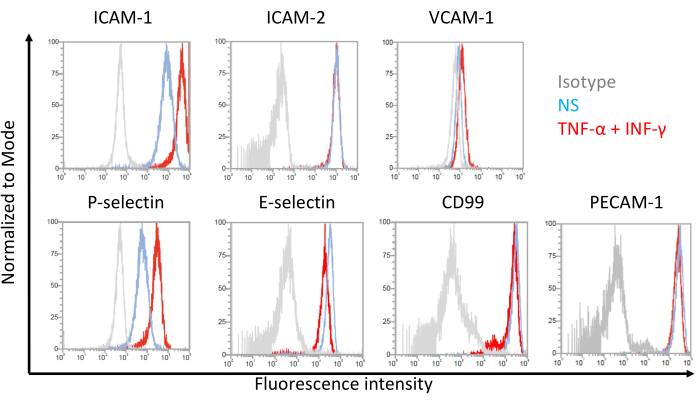
Figure 7 : Expression de surface des cellules endothéliales des molécules d’adhésion sur des cellules de type EECM-BMEC. Les résultats de l’analyse par cytométrie en flux de l’expression de la molécule d’adhésion de surface EC sur des cellules de type EECM-BMEC sont présentés. Des cellules de type EECM-BMEC ont été cultivées en utilisant un milieu conditionné dérivé de SMLC. Les lignes bleues, rouges et grises des superpositions d’histogrammes montrent la condition non stimulée (NS), la condition stimulée par 1 ng / mL TNF-α + 20 UI / mL stimulée par l’IFN-γ et le contrôle de l’isotype, respectivement. L’expression de surface cellulaire des molécules d’adhésion endothéliale, y compris la molécule d’adhésion intercellulaire 1 (ICAM-1), ICAM-2, la molécule d’adhésion cellulaire vasculaire 1 (VCAM-1), la P-séclectine, E-séclectine, CD99 et la molécule d’adhésion plaquettaire des cellules endothéliales 1 (PECAM-1) ont été évaluées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
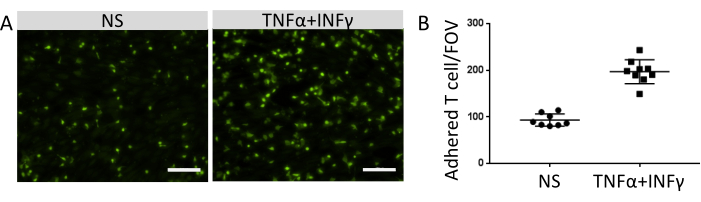
Figure 8 : Adhésion des cellules immunitaires sur les cellules de type EECM-BMEC. (A) Images de cellules immunitaires adhérentes marquées par fluorescence sur des monocouches de type IFN-γ stimulées (TNF-α α + IFN- 0,1 ng/mL + IFN-γ + IFN-). Les images correspondent aux centres des puits. Barre d’échelle = 50 μm. (B) Nombre de cellules immunitaires marquées par fluorescence sur des monocouches de cellules de type EECM-BMEC stimulées par la NS et le TNF-α + l’IFN-γ. Les cellules/champs de vision immunitaires adhérents (FOV) ont été automatiquement comptés à l’aide du logiciel FIJI. Les points représentent le nombre de cellules T attachées. Les barres montrent la valeur moyenne et les barres d’erreur montrent l’écart-type (ET) de huit essais. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Détails des réactifs spécifiques pour les essais. Le nom et la quantité exacte d’ingrédients pour chaque réactif spécifique sont décrits. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Exemple de données brutes du lecteur de plaque de fluorescence pour le calcul du Pe. Les nombres en caractères gras sont l’intensité de fluorescence brute de la fluorescéine de sodium mesurée par un lecteur de plaques. Afin d’analyser avec précision les données, il est nécessaire de supprimer le signal de fond des valeurs brutes et de tenir compte de toute perte de signal résultant de l’échantillonnage de la chambre inférieure, puis de corriger le signal. Par exemple, après soustraction de l’arrière-plan, l’échantillon de 15 min présente un signal de 100 unités de fluorescence relative (RFU), et l’échantillon de 30 min présente un signal de 150 RFU. Le signal corrigé à 30 min est (150 RFU + les valeurs manquantes à 15 min [100 RFU x 150 μL/1 500 μL]), soit 150 RFU + 10 RFU = 160 RFU. Le volume de jeu = (1 500 x [S B,t])/(S T,60 min), où 1 500 est le volume de la chambre inférieure (1 500 μL), S B,t est le signal corrigé au temps t, et ST,60 min est le signal de la chambre supérieure à 60 min. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Points critiques et dépannage
Avant de commencer la différenciation EPC, les chercheurs doivent s’assurer qu’aucun événement spontané de différenciation cellulaire ne s’est produit dans les cultures hiPSC. L’absence de cellules spontanément différenciées et l’utilisation de colonies d’hiPSC pures sont essentielles pour obtenir des résultats reproductibles. La densité d’ensemencement hiPSC au jour -3 est importante pour obtenir une grande pureté de CD31+ EPC après MACS. La densité d’ensemencement pour chaque ligne hiPSC et chaque passage peut nécessiter une optimisation. Selon la ligne hiPSC et le nombre de passage, la densité d’ensemencement peut varier entre 75 x 10 3 et 400 x 10 3 hiPSC par puits d’une plaque de 12 puits (20-100 x 103/cm2). Le point de contrôle de densité minimale des CSPhi est la densité cellulaire au jour 2. Les CSPhi devraient atteindre 100% de confluence au plus tard le jour 2. Si les CSPhi ne sont pas confluentes au jour 2, la pureté des CPE CD31+ après MACS sera généralement assez faible. Dans ce cas, la densité d’ensemencement hiPSC peut être augmentée. Si un grand nombre de cellules différenciantes se détachent de la plaque entre le jour 3 et le jour 5, la densité initiale d’ensemencement des CSPh peut être diminuée. D’après notre expérience, le CHIR99021 de 7-8 μM est la concentration optimale pour les lignées de CSPhi utilisées ici, mais la concentration peut devoir être optimisée pour d’autres lignées de CSPhi qui peuvent répondre différemment au traitement inhibiteur. La pureté des CPE CD31+ doit être confirmée avant et après la MACS. Avant de poursuivre la MACS, le mélange de cellules pré-triées doit être composé de >10% de cellules CD31+. Des pourcentages de cellules CD31+ de <6 % donnent généralement <80 % de CPE après MACS. Dans cette situation, l’optimisation de la densité initiale de semis et/ou de la concentration CHIR99021 est nécessaire.
Pour réussir le passage sélectif et la génération de monocouches EC pures, la pureté post-MACS des CPE CD31+ est essentielle. Si la pureté après MACS est de <90%, un ou deux lavages supplémentaires sont recommandés (étapes 1.4.11-1.4.12). Idéalement, la pureté post-MACS devrait être de >95%. La densité d’ensemencement EPC sur les plaques recouvertes de collagène doit être optimisée en fonction de la ligne hiPSC pour atteindre une confluence de 100% dans les 3-7 jours. Attendre que les CE soient 100% confluents conduira généralement à un passage sélectif réussi. Cependant, même pour les EC 100% confluents, les SMLC de certaines lignes hiPSC se détachent également tôt. Dans ce cas, le passage sélectif à une confluence plus faible (p. ex. ≤80 %) peut être efficace. Si certains SMLC se détachent plus tôt que les CE, les CE ne peuvent souvent pas être sauvés de la population mixte CE-SMLC. Dans ce cas, il peut être utile de raccourcir le temps d’activation du réactif de dissociation dans les CE passagères et les passations sélectives répétitives. L’utilisation d’un réactif de dissociation commercial plutôt que de trypsine comme réactif de dissociation est bénéfique pour le passage sélectif, car la trypsine ne permet pas le détachement séparé des CE et des SMLC. Nos tests de perméabilité utilisant des traceurs de petites molécules et les tests des niveaux d’expression des molécules à jonction serrée et à adhésion indiquent que les EPC, les cellules de type EECM-BMEC et les SMLC peuvent être stockés dans de l’azote liquide pendant au moins 2 ans.
Importance et limites de la méthode
La méthode différencie les CPE CD31+ des CSPhi grâce à l’utilisation d’inhibiteurs chimiques de GSK-3 pour activer la signalisation Wnt/β-caténine. Après sélection positive des CPE CD31+ par MACS, les CPE sont cultivés dans un milieu endothélial défini qui favorise la différenciation en populations endothéliales mixtes et SMLC. Le passage sélectif de ces populations mixtes aux propriétés adhésives différentes permet de séparer les CE des SMLC. Après un ou deux passages, les cellules de type EECM-BMEC présentent des propriétés de barrière et l’expression de molécules d’adhésion endothéliale qui récapitulent celles des BMEC humaines primaires. La co-culture avec des SMLC ou leurs surnageants induit l’expression induite par les cytokines de VCAM-1.
In vivo, la BHE maintient l’homéostasie du SNC en établissant une faible perméabilité paracellulaire et transcellulaire des molécules, grâce au transport des nutriments via des transporteurs spécifiques et au contrôle du trafic des cellules immunitaires dans le SNC. Pour les études de la BHE, un modèle approprié qui affiche les molécules et les fonctions d’intérêt respectives est essentiel. La production de cellules de type EECM-BMEC à l’aide de réactifs définis et d’échantillons provenant de patients ou de sujets sains fournit un modèle humain évolutif de BHE. Les avantages d’un modèle utilisant des cellules de type EECM-BMEC par rapport à d’autres modèles de BHE sont les suivants : 1) un profil morphologique et transcriptome endothélial30 qui ressemble à celui des BMEC humains primaires; 2) la présence de jonctions serrées matures; 3) propriétés de barrière souhaitables; et 4) l’expression robuste des molécules d’adhésion endothéliale, y compris ICAM-1, ICAM-2, VCAM-1, E- et P-séclectine, CD99, molécule d’adhésion cellulaire de mélanome (MCAM) et molécule d’adhésion cellulaire leucocytaire activée (ALCAM)22. Ainsi, ce modèle est particulièrement utile pour étudier les interactions entre les cellules immunitaires et les BMEC. Bien que la perméabilité des traceurs à petites molécules soit plus élevée pour les cellules de type CEEM-BMEC que celle précédemment rapportée pour les cellules de type BMEC dérivées des CSPi14,15, les propriétés de barrière se comparent assez bien à celles décrites pour les BMEC humaines primaires. Cette similitude indique que les cellules de type EECM-BMEC sont susceptibles d’être un bon modèle in vitro de la BHE. L’expression de la E-sélectine sur des cellules de type EECM-BMEC dans des conditions physiologiques doit être prise en compte lors de l’utilisation de ce modèle pour étudier des BHE non enflammées dépourvues d’expression constitutive d’E-sélectine in vivo31. Dans notre étude précédente, nous avons démontré que les cellules de type EECM-BMEC pouvaient phénocopier la BHE, comme observé dans le cerveau des patients atteints de SEP en ce qui concerne les jonctions serrées perturbées. Il en résulte une plus grande perméabilité des petites molécules et une expression accrue de la molécule d’adhésion fonctionnelle, médiant l’adhésion et la transmigration accrues des cellules immunitaires à travers les cellules de type BMEC32. De plus, nous avons montré que l’activation de la signalisation Wnt/β-caténine peut améliorer la perturbation des jonctions serrées et l’augmentation de l’expression de VCAM-1 dans les cellules de type EECM-BMECdérivées de MS 32. Ces résultats indiquent que le modèle est effectivement utile pour étudier le rôle de la BHE dans les maladies neuroimmunologiques, telles que la SEP.
Ensemble, les cellules de type EECM-BMEC sont un outil prometteur pour la compréhension approfondie des mécanismes physiopathologiques au niveau de la BHE et comme outil pour développer de nouvelles cibles thérapeutiques pour la stabilisation de la BHE. À l’avenir, le modèle pourra être appliqué pour étudier le dysfonctionnement de la BHE dans un plus large éventail de maladies et pourrait ouvrir la voie à de nouvelles approches thérapeutiques.
Déclarations de divulgation
BE a reçu une subvention de Biogen pour étudier l’extension de la posologie du natalizumab sur la migration des lymphocytes T à travers la barrière hémato-encéphalique et une subvention de CSL Behring pour étudier les fondements moléculaires du dysfonctionnement de la barrière hémato-encéphalique dans les troubles neurologiques. HN et BE sont les inventeurs des demandes de brevet américaines provisoires relatives aux cellules de type EECM-BMEC (63/084980 et 63/185815).
Remerciements
HN a été soutenu par la Fondation Uehara Memorial, une bourse d’échange de recherche postdoctorale ECTRIMS, JSPS dans le cadre du programme de recherche conjoint mis en œuvre en association avec SNSF (JRPs) Grant No. JPJSJRP20221507 et KAKENHI Grant No. 22K15711, JST FOREST Program (Grant Number JPMJFR2269, Japon), YOKOYAMA Foundation for Clinical Pharmacology Grant No. YRY-2217, la Fondation ICHIRO KANEHARA, la Narishige Neuroscience Research Foundation, la Fondation NOVARTIS (Japon) pour la promotion de la science, et le YAMAGUCHI UNIVERSITY FUND. BE a été soutenu par la Société suisse de la SEP et le Fonds national suisse de la recherche scientifique (subventions 310030_189080 et ZLJZ3_214086) et par le programme stratégique nippo-suisse pour la science et la technologie (SJSSTP) IZLJZ3_214086.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
Références
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372 (2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358 (2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32 (2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679 (2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9 (2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25 (2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118 (2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992 (2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon