Method Article
ヒト人工多能性幹細胞の成熟免疫表現型を有する脳微小血管内皮細胞様細胞への分化
要約
ここでは、多能性幹細胞を脳微小血管内皮細胞(BMEC)様細胞に分化させるプロトコルである拡張内皮細胞培養法(EECM)について述べる。これらの細胞は内皮細胞接着分子発現を示すため、in vitroで免疫細胞相互作用を研究するのに適したヒト血液脳関門モデルです。
要約
血液脳関門(BBB)機能障害は、中枢神経系(CNS)に影響を与える多くの神経変性疾患および神経炎症性疾患の病理学的特徴です。疾患関連のBBBサンプルへのアクセスが限られているため、BBBの機能不全が疾患の発症の原因なのか、それとも神経炎症性または神経変性プロセスの結果なのかはまだよくわかっていません。したがって、ヒト人工多能性幹細胞(hiPSC)は、健康なドナーと患者から in vitro BBBモデルを確立し、個々の患者からの疾患特異的BBB特性を研究する新しい機会を提供します。hiPS細胞から脳微小血管内皮細胞(BMEC)様細胞を誘導するためのいくつかの分化プロトコルが確立されています。特定の研究課題を考慮することは、それぞれのBMEC分化プロトコルを正しく選択するために必須です。ここでは、hiPS細胞を成熟免疫表現型を持つBMEC様細胞に分化させるために最適化され、免疫細胞とBBBの相互作用の研究を可能にする拡張内皮細胞培養法(EECM)について説明します。このプロトコルでは、hiPS細胞はまずWnt/β-カテニンシグナル伝達を活性化することにより内皮前駆細胞(EPC)に分化します。得られた培養物は平滑筋様細胞(SMLC)を含み、内皮細胞(EC)の純度を高め、BBB特異的特性を誘導するために順次継代されます。EECM-BMECとこれらのSMLCまたはSMLCからのコンディショニング培地との共培養により、EC接着分子の再現性、構成的、およびサイトカイン調節された発現が可能になります。重要なことに、EECM-BMEC様細胞は初代ヒトBMECに匹敵するバリア特性を確立し、すべてのEC接着分子の発現により、EECM-BMEC様細胞は他のhiPS細胞由来の in vitro BBBモデルとは異なります。したがって、EECM-BMEC様細胞は、BBBのレベルで疾患プロセスの潜在的な影響を調査するための選択モデルであり、免疫細胞の相互作用にパーソナライズされた方法で影響を与えます。
概要
中枢神経系(CNS)の神経血管ユニット(NVU)は、高度に特殊化された微小血管内皮細胞(EC)、内皮基底膜に埋め込まれた周皮細胞、実質基底膜、星状細胞末端で構成されています1。NVU内では、脳微小血管内皮細胞(BMEC)が血液脳関門(BBB)を形成する重要な構成要素です。BMECは複雑で連続的なタイトジャンクションを形成し、末梢臓器の微小血管ECと比較して非常に低いpinocytotic活性を有するため、BBBは水溶性分子のCNSへの自由な傍細胞拡散を阻害することができる。BMECによる特定の流入トランスポーターおよび排出ポンプの発現は、CNS2からの栄養素および有害分子のそれぞれ取り込みおよび輸出を確実にする。さらに、BBBは、CNS3への免疫細胞輸送に不可欠な低レベルの内皮接着分子を発現することにより、CNSへの免疫細胞の侵入を厳密に制御します。生理学的条件下では、細胞間接着分子-1(ICAM-1)や血管細胞接着分子-1(VCAM-1)などのBMECの表面上の接着分子の発現レベルは低いですが、これらのレベルは一部の神経障害で増加します2。BBBの形態学的および機能的破壊は、脳卒中4、多発性硬化症(MS)5、およびいくつかの神経変性疾患などの多くの神経疾患で報告されています6、7、8。生理学的および病理学的条件の両方におけるBMECの細胞的および分子的特性の詳細な調査は、BBBを標的とする新しい治療戦略を特定するためのアプローチです。
最近まで、一次または不死化されたヒトおよびげっ歯類のBMECがBBBの研究に使用されていました。しかしながら、BBBの動物モデルに基づく結論がヒトBBBに容易に適用できるかどうかは、接着分子および溶質キャリアタンパク質を含むいくつかの重要な分子の発現がヒトおよびげっ歯類の間で異なるため、不明である9,10。hCMEC/D3のようなヒトBMEC株は適切なレベルの接着分子を発現しますが11、これらの不死化BMECは一般に複雑なタイトジャンクションと堅牢なバリア特性を持っていません12。初代ヒトBMECはバリア機能の研究に有用ですが13、すべての研究者がすぐに利用できるわけではありません。さらに、患者からの一次BMECは、特定の臨床条件下でのみ行われる脳生検または手術によって収集する必要があるため、取得が困難な場合があります。
幹細胞技術の最近の進歩により、ヒト人工多能性幹細胞(hiPSC)などの幹細胞源から生じるさまざまなヒト細胞タイプの分化が可能になりました。hiPS細胞由来モデルにより、患者由来サンプルを用いた病態生理学的モデルの構築が可能です。いくつかのhiPS細胞由来の細胞タイプを組み合わせて、生理学的条件をよりよく模倣する自家共培養またはオルガノイドを確立することができます。いくつかの広く使用されているプロトコル14,15,16,17,18,19は、BBB特異的トランスポーターおよび排出ポンプの発現を有する堅牢な拡散障壁特性を有し、低分子の傍細胞拡散、分子輸送機構、および脳への薬物送達を研究するのに有用であるhiPSc由来BMEC様細胞を分化させるために使用され得る20,21。.しかし、以前の研究では、広く使用されているhiPS細胞由来のBMEC様細胞は、免疫細胞とBBB22との間の相互作用を媒介するVCAM-1、セレクチン、ICAM-2などの重要な内皮接着分子の発現を欠いていることが示されている。さらに、以前のhiPS細胞由来のBMECは、転写レベルで内皮および上皮の混合特性を示すことが報告されています23。そこで、形態、バリア特性、内皮接着分子発現に関して、ヒト初代BMECに似たBMEC様細胞にhiPS細胞を分化させる新しいプロトコルである拡張内皮細胞培養法(EECM)を開発しました。このプロトコルでは、hiPS細胞を成熟免疫表現型を示すBMEC様細胞に分化させるための詳細な方法論的手順について説明します。
プロトコル
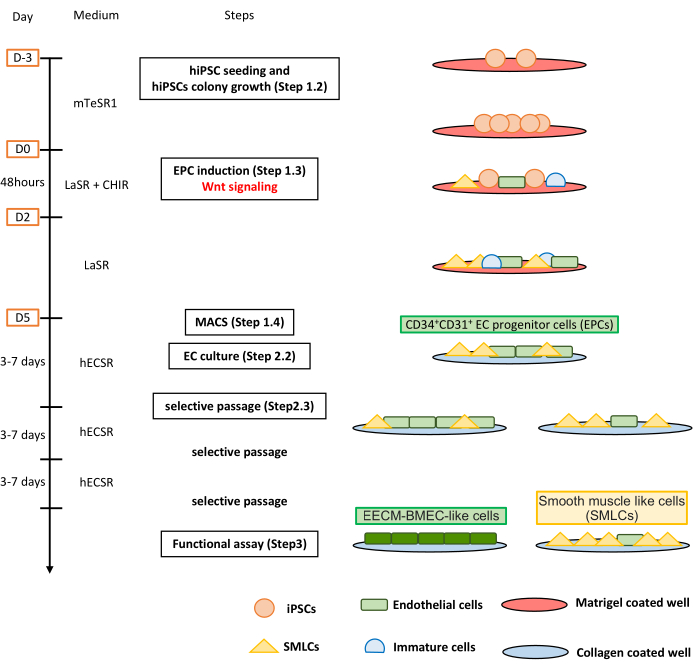
図1:プロトコルの概要。 この原稿は、hiPS細胞をEECM-BMEC様細胞に分化させるための段階的なプロトコルを提示しています。適切なスキームは、各ステップでの細胞集団を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
hiPScラインHPS1006は、文部科学省の国家バイオリソースプロジェクトを通じて理研BRCから提供されました。
1. 内皮前駆細胞(EPC)へのhiPS細胞分化誘導
- 細胞外マトリックス(ECM)コーティングプレートおよび試薬
- 基底膜マトリックスコーティング12ウェルプレートを調製し、2.5 mgのマトリックスゲルを50 mL遠沈管に分注し、-20°Cで最大6か月間保存します。冷蔵庫(4°C)に保管した冷たいダルベッコの改質イーグル培地/栄養混合物F-12(DMEM / F12)30mLをチューブに加えます。ゲルが溶けるまでピペッティングで穏やかに混合し、12ウェルプレートの各ウェルに500 μLの溶液を加えます。プレートをインキュベーター(37°C、5%CO2)に少なくとも1時間入れます。
注意: 基底膜マトリックスゲルは温度に敏感であり、分注とプレートコーティングに関する製造元の指示に従って取り扱う必要があります。細胞外マトリックスタンパク質の濃度はバッチ間で変化し得る。正確さを確実にするために、正確な濃度は、ロット番号を使用して、特定のバッチの品質証明書シートで参照する必要があります。たとえば、正確な濃度が10.0 mg / mLの場合、250 μLのゲルを使用して合計2.5 mgになります。 - ROCK阻害剤を滅菌水に10mMの濃度になるように溶解することにより、rhoキナーゼ(ROCK)阻害剤ストック溶液を調製する(表1)。ストック溶液を100〜200μLの容量で分注し、凍結融解サイクルを避けるために-20°Cで保存します。
- 5 gのL-アスコルビン酸を50 mLの滅菌水に溶解してL-アスコルビン酸の100 mg/mLストック溶液を作り、-20°Cで保存します(表1)。6.25 mLのグルタミンと305 μLのL-アスコルビン酸ストック溶液を500 mLの高度なDMEM / F12に加え、LaSR培地24 を作成します(表1)。2〜8°Cで最大2週間保管します。
- CHIR99021を希釈していないジメチルスルホキシド(DMSO)に終濃度10 mMまで溶解することにより、CHIR99021溶液を調製します(表1)。凍結融解サイクルを避けるために溶液を100〜200μLの容量に分注し、-20°Cで最大1年間保管します。ストック溶液の作業アリコートを4°Cで最大1か月間保存します。
- 450 mLのDMEM/F12に50 mLの熱不活化ウシ胎児血清を加えて、DMEM/F12-10培地を調製します。培地を2〜8°Cで最大1か月間保管します(表1)。
- 33.3 mLの7.5%ウシ血清アルブミン(BSA)を467 mLのダルベッコリン酸緩衝生理食塩水(PBS)に加えて、フローバッファー-1を調製します(表1)。2〜8°Cで最大6か月間保管します。
- 基底膜マトリックスコーティング12ウェルプレートを調製し、2.5 mgのマトリックスゲルを50 mL遠沈管に分注し、-20°Cで最大6か月間保存します。冷蔵庫(4°C)に保管した冷たいダルベッコの改質イーグル培地/栄養混合物F-12(DMEM / F12)30mLをチューブに加えます。ゲルが溶けるまでピペッティングで穏やかに混合し、12ウェルプレートの各ウェルに500 μLの溶液を加えます。プレートをインキュベーター(37°C、5%CO2)に少なくとも1時間入れます。
- 特異化ヒジPS細胞の播種とEPC分化のための拡大(-3日目から-1日目)
- 6ウェルプレート内のhiPSCコロニーが自発分化を示さず、継代に適した密度(通常は約80%のコンフルエンシー(2.5-3.5 x 106 細胞))である場合に分化を開始します。顕微鏡下で自然分化細胞を注意深く監視し、未分化細胞を排除するために複数の継代が必要かどうかを確認します。細胞培養培地および細胞外マトリックスに関する情報については、ステップ1.4.15以下の注を参照してください。
- 培地を吸引し、1 mLの解離試薬をウェルに加え、37°Cで5〜7分間インキュベートします。 解離試薬溶液をウェルの表面に2〜3回穏やかにピペッティングすることにより、細胞を解離および単数化します。
- 剥離した細胞を4 mLのhiPSC維持培地を含む15 mLチューブに移し、細胞を完全に再懸濁します。細胞計数用に10 μLのアリコートを予約します。
- 20〜25°Cで200 x g で5分間遠心分離することにより、細胞をペレット化します。 細胞をカウントし、基底膜マトリックスコーティングされた12ウェルプレートで適切な密度のhiPSC(ウェルあたり75-400 x 103 )を達成するために必要な体積を計算します(ステップ1.1.1)。
- ウェルからコーティング溶液を吸引し、10 μM ROCK阻害剤を含む1 mLのhiPS細胞培地を各ウェルに加えます(1:1,000希釈)。遠心分離後、上清を吸引し、1 mLのhiPS細胞培地でペレットを解離させます。
- ステップ1.2.4で決定した必要量のhiPSCを12ウェルプレートの各ウェルに追加します。2〜4枚の12ウェルプレートで、hiPSCクローンを鑑別するのに十分であり得る。ステップ1.2.4を参照して、細胞の播種に必要なプレートの数を決定します。
- プレートをインキュベーター(37°C、5%CO2)に入れる。プレートをゆっくりと前後にスライドさせてからインキュベーター内で左右にスライドさせて、細胞を均等に分配します。
- 翌日(すなわち、−2日目)に、ROCK阻害剤を欠く2mLのhiPSC維持培地と培地を交換する。翌日(-1日目)に、培地を2 mLの新鮮なhiPS細胞維持培地と交換します。
- グリコーゲンシンターゼキナーゼ3(GSK-3)阻害剤CHIR99021によるEPCの誘導(0日目から5日目)
- 0日目に、各ウェルのhiPSC維持培地を8 μM CHIR99021を含む2 mLのLaSR培地と交換します。
- 1日目に培地を吸引し、8 μM CHIR99021を含む新しいLaSR培地2 mLを加えます。
- 2日目、3日目、および4日目に、培地をCHIR99021を含まない2mLの新しいLaSR培地と交換します。
- CD31を精製するための磁気活性化細胞ソーティング(MACS)+ EPC (5日目)
- 5日目に、培地を吸引し、次に1 mLの解離試薬を各ウェルに加えた後、37°Cで6〜8分間インキュベートします。
- マイクロピペットで細胞を解離して単離し、40 μmのセルストレーナーを通過させて、10 mLのDMEM/F12-10培地を含む50 mLチューブに懸濁液をろ過します。2つ以上の12ウェルプレートから採取した細胞懸濁液を、少なくとも2つの50 mLチューブにろ過します。
- DMEM/F12-10培地(最大50 mL)を加えて消化反応を停止します。徹底的にピペットし、細胞をカウントするために10 μLを予約します。20〜25°Cで200 x g で5分間遠心分離することにより、細胞をペレット化します。
- 上清を除去した後、10 mLのDMEM/F12-10培地を加え、細胞懸濁液を新しい15 mLチューブに移します。20〜25°Cで200 x g で5分間遠心分離することにより、細胞をペレット化します。
- 上清を吸引し、バッファー100 μLあたり1.0 x 107 細胞の密度でフローバッファー-1に再懸濁します。
- FcRブロッキング試薬を1:100の比率で添加し、5分間インキュベートしてから、1:200に希釈したフルオレセインイソチオシアネート(FITC)標識CD31抗体を添加します。懸濁液を20〜25°Cの暗所で30分間インキュベートする。
- 10 mLのフローバッファー-1を追加し、フローサイトメトリー分析用に10 μLの懸濁液を予約して、CD31+ 細胞の画分を測定します(図2)。
- 200 x g で20-25°Cで5分間遠心分離することにより、細胞をペレット化します。 その後、上清を除去し、フローバッファー-1溶液100 μLあたり7 細胞1.0 x 10の密度に再懸濁します。FITCセレクションカクテル(細胞懸濁液100 μLあたり5 μL)を追加します。ピペッティングで十分に混合し、暗所で20〜25°Cで15分間インキュベートします。
- 細胞懸濁液100 μLあたり5 μLの磁性ナノ粒子を加え、よくピペットでピペットし、暗所で20〜25°Cで10分間インキュベートします。
- 細胞懸濁液を5 mLフローサイトメトリーチューブに移し、フローバッファー-1を加えて総容量2.5 mLにします。フローサイトメトリーチューブを磁石に5分間入れます。
- 連続運動で磁石を反転させ、FITC-CD31抗体で標識されていない細胞を含む細胞懸濁液をデカントします。磁石とチューブを逆位置に2〜3秒間維持してから、残りの液体を取り除きます。チューブを直立位置に戻す前に、チューブの端にある液滴を吸引します。
- マグネットからフローサイトメトリーチューブを取り出し、2.5 mLのフローバッファー-1を加えて残りのCD31+ 細胞を洗浄します。細胞を2〜3回穏やかに上下にピペッティングして、細胞を再懸濁します。フローチューブを磁石に5分間入れます。
- 手順1.4.11〜1.4.12を3回繰り返してから、手順1.4.11をもう一度繰り返して、合計4回の洗浄を行います。
- フローチューブを磁石から取り外し、指示量の適切な培地(例:拡張EC培養用のヒトリンパ管内皮無血清培地[hECSR]または凍結用の凍結培地)をチューブに加えて、精製CD31+ 細胞を再懸濁します。懸濁液の10 μLアリコートを2つ予約し、1つは細胞計数用、もう1つはフローサイトメトリー分析を実行して、MACS後のサンプル中のCD31+ 細胞の純度を評価します(図2)。フローサイトメーターがすぐに利用できない場合は、分析までアリコートを4°Cで保存してください。
- 次の手順(手順2まで)をすぐに実行できない場合は、この時点でCD31+ EPCをフリーズします。EPCの拡張と選択継代については、ステップ2に進みます。
注:基底膜マトリックスコーティングプレートおよびhiPSC維持培地(mTeSR1)の代わりに、ビトロネクチン25コーティング12ウェルプレートおよびより安定したhiPSC維持培地(mTeSRプラス)を使用できます。ビトロネクチンコーティング12ウェルプレートを調製するには、ビトロネクチンを希釈バッファーで最終濃度10 μg/mLに希釈し、500 μLの希釈溶液を12ウェルプレートの各ウェルに移します。プレートを20〜25°Cで少なくとも1時間放置します。特異化されたhiPS細胞の播種密度は、基底膜マトリックスコーティングプレートに使用されるものに匹敵します。培地またはマトリックス組成を変更すると、hiPS細胞の増殖および自発的分化に影響を与える可能性があり、通常、新しい培養条件に適応するのに1〜2週間かかります。より安定なhiPSC維持培地をhiPSC維持に用いる場合、この培地をhiPSC維持培地の代わりにEPC分化に用いることができる。この場合、ROCK阻害剤を除去するために、より安定したhiPSC維持培地を-2日目に交換する必要があり、-1日目の交換はスキップできます。
2. 脳微小血管内皮細胞様細胞(BMEC様細胞)と平滑筋様細胞(SMLC)を分化させるための拡張内皮細胞培養法(EECM)
- コラーゲンコーティングプレートおよび試薬の調製
- 結晶化コラーゲンIV型5 mgを滅菌水5 mLに溶解して、コラーゲンコーティング6ウェルプレートを調製します。4°Cで一晩インキュベートしてから、分注して-20°Cで保存します。 コラーゲンIVを滅菌水で1:100に希釈して10 μg/mL溶液を生成し、1 mLの10 μg/mLコラーゲンIV溶液を6ウェルプレートの各ウェルに追加します。プレートを37°Cで少なくとも30分間インキュベートします。 プレートは37°Cで最大1週間保存できます。
- 5 mLのFGFをダルベッコPBS5 mLに溶解してヒト線維芽細胞増殖因子2(FGF2)のストック溶液を調製し、最終濃度0.1%になるように7.5%BSAを添加し、ストック溶液を20〜200 μLの容量に分注します。これらは-20°Cで最大3ヶ月間保存できます(表1)。ストック溶液は4°Cで最大1ヶ月間保存できます。凍結融解サイクルを避けてください。98 mLのhECSR培地に2 mLのB-27サプリメントと20 μLのFGF2を加えて、hECSR培地を調製します(表1)。hECSR培地は、2〜8°Cで最大2週間保存できます。
- 30 mLのhECSR培地に15 mLのウシ胎児血清、5 mLのDMSO、および25 μLのROCK阻害剤溶液を加えて、EPC、EECM-BMEC様細胞、およびSMLC用の凍結培地を準備します(表1)。凍結培地は、2〜8°Cで最大2週間保存できます。
- 拡張内皮細胞培養のためのEPCの播種
- 6ウェルプレートからコラーゲン溶液を除去します。次に、5 μM ROCK阻害剤を含む2 mLのhECSR培地(1:2,000希釈)に1.0-2.0 x 105 精製CD31+ EPCを移します。プレートをインキュベーター(37°C、5%CO2)に入れる。プレートを前後にゆっくりとスライドさせてから左右にスライドさせて、セルを均等に分配します。
- 翌日、ROCK阻害剤を含むhECSR培地を除去し、ROCK阻害剤を含まない新鮮なhECSR培地2mLを加える。100%コンフルエントに達するまで、hECSR培地を1日おきに交換します。
注意: 週末に定期的な給餌スケジュールを維持できない場合は、週の最後の営業日の夕方と週末の後の早朝に培地を交換することができます。
- EECM-BMEC様細胞およびSMLCを精製するための選択的継代
- ECと非EC集団の混合物を含む6ウェルプレートからhECSR培地を除去します。各ウェルに1 mLの解離試薬を加えます。
- 顕微鏡下で細胞の形態を注意深く監視します。EC(非ECではない)が明るく丸く見える場合(通常は2〜5分以内)、プレートの端をタップしてECCを取り外します。ほとんどの非ECはプレートに取り付けられたままです。
- マイクロピペットを使用して切り離されたECを収集し、非ECを再懸濁しないように注意してください。ECを、解離試薬1 mLあたり4 mLのDMEM/F12-10を含む15 mLまたは50 mLの遠沈管に移します。
- 残りの結合した非ECを含むウェルに2 mLのhECSR培地を加えてSMLCを確立します。 プレートをインキュベーターに置きます。
- EC懸濁液を遠沈管にピペットで入れて完全に混合し、細胞計数用に10 μLの懸濁液を予約します。残りの細胞を20-25°Cで200 x g で5分間遠心分離します。 ペレットから上清を取り除き、1.0-2.0 x 105 ECあたり2 mLのhECSR培地を追加します。
- 新しい6ウェルプレートからコラーゲンIV溶液を取り出したら、2mLのEC懸濁液を各ウェルに加え、続いて5%CO2と共に37°Cでインキュベートした。プレート内の細胞を均等に分配するには、インキュベーターの棚の上で前後左右にゆっくりと動かします。
- ECが100%コンフルエンシーに達するまで、hECSR培地を1日おきに交換します。
- 純粋なEC単層が得られるまで、ステップ2.3.1〜2.3.7を繰り返します。次の手順を実行できない場合は、CD31+ ECをフリーズします(手順2.4.2を参照)。EC機能を分析するには、手順3に進みます。
注:一般に、機能解析に適したECのほぼ純粋な培養物を得るには、2〜3回の選択継代が必要であり、これらの細胞をEECM-BMEC様細胞と見なしています。5〜6回以上の継代の後、細胞増殖は通常遅くなりますが、この変数はhiPSC株に依存します。 - SMLCを培養するには、hECSR培地を1日おきに交換します。SMLC馴化培地(CM)を収集するには、培地を交換するたびに、収集した培地を0.22 μmフィルターに通します。CMは、EECM-BMEC様細胞のVCAM-1発現をアップレギュレートするために使用できます。SMLC が 100% コンフルエンシーに達するまで SMLC-CM をプールします。
- EPC、EECM-BMEC様細胞、SMLC凍結保存および解凍
- EPCを凍結するには、最後のMACS洗浄(ステップ1.4.13)に続いて、EPCをhECSR培地ではなく凍結培地に1.0〜2.0 x 106 細胞/ mLの密度で再懸濁します。1 mLの細胞懸濁液をクライオチューブに分配します。クライオチューブを制御された速度凍結装置に入れ、すばやく-80°Cに移します。 長期保存の場合は、凍結後24〜48時間でチューブを液体窒素タンクに移動します。
- EECM-BMEC様細胞およびSMLCを凍結するには、ウェルから培地を除去した後、解離試薬(1 mL /ウェル)を添加し、細胞が剥離するまでプレートを5%CO2 で37°Cでインキュベートします(EECM-BMEC様細胞およびSMLCの場合はそれぞれ5〜7分および20〜30分)。解離試薬1 mLあたり4 mLのDMEM/F12-10を含む15 mLまたは50 mLの遠沈管で細胞を収集します。
- ピペットで十分に混合し、細胞計数用に10 μLの細胞懸濁液を予備します。200 x g で20-25°Cで5分間遠心分離することにより、細胞をペレット化します。 上清を除去し、細胞を凍結培地に1.0-2.0 x 106 細胞/mLの密度まで完全に再懸濁します。1 mLの細胞懸濁液を新しいクライオチューブに分配します。
- クライオチューブを制御された速度凍結装置に入れ、すぐに-80°Cに移します。 長期保存のために、チューブは凍結後24〜48時間で液体窒素タンクに移すことができる。
- EPC、EECM-BMEC様細胞、およびSMLCを解凍する場合は、クライオチューブのバイアルを手の間で転がすか、細胞がほぼ完全に解凍されるまで37°Cの水浴中でインキュベートします。500 μLのDMEM/F12-10を加え、4 mLのDMEM/F12-10培地を含む15 mLチューブに細胞懸濁液を静かに移します。1 mLのDMEM/F12-10を加えてクライオチューブを1回洗浄し、細胞を200 x g で20-25°Cで5分間遠心分離します。
- 上清を吸引し、5 μM ROCK阻害剤(1:2,000希釈)を含む2 mLのhECSR培地にペレットを再懸濁して、EPCの場合は2 mLあたり1.0〜2.0 x 10 5細胞、EECM-BMEC様細胞およびSMLCの場合は2 mLあたり2.0〜3.0 x 105細胞の密度に再懸濁します。 コラーゲン溶液を吸引した後、コラーゲンコーティングされた6ウェルプレートのウェル間で細胞懸濁液を分配します。
- プレートを37°C、5%CO2 のインキュベーターの棚上でゆっくりと前後に動かし、次に左右に動かして、ウェル内の細胞を均等に分散させます。
- 翌日、ROCK阻害剤を欠く新鮮なhECSR培地と培地を交換する。100%コンフルエンシーが達成されるまで、hECSR培地を1日おきに交換します。次に、EPCの選択的継代(ステップ2.3を参照)およびEECM-BMEC様細胞の機能解析(ステップ3を参照)に進みます。分子特性評価および機能アッセイを行う前に、EECM-BMEC様細胞は100%コンフルエントである必要があり、これは通常、融解後2〜3日で達成される。
3. EECM-BMEC様細胞およびSMLCの検証
- 低分子トレーサーの透過性アッセイ
- EECM-BMEC様細胞バリアの完全性を評価するには、フルオレセインナトリウム透過性を測定することによって、西原ら26が記載したようにする。EECM-BMEC様細胞をフィルターインサートに播種して、完全な単層を発達させ、フルオレセインナトリウムの透過性を測定します。
- 重要な分子を評価するための免疫蛍光染色。
- 単層またはSMLCのEECM-BMEC様細胞の接合分子、接着分子、または細胞骨格タンパク質の発現をモニターするための免疫蛍光染色には、チャンバースライド、96ウェルプレート、またはインサートフィルター付きメンブレンを使用します。西原ら26に記載されているように、炎症性サイトカイン刺激の有無にかかわらず、細胞表面接着分子のEECM-BMEC様細胞発現を評価します。
- EECM-BMEC様細胞上の細胞表面接着分子の発現を解析するためのフローサイトメトリー
- フローサイトメトリーを使用して、ICAM-1、ICAM-2、VCAM-1、P-セレクチン、E-セレクチン、CD99、および血小板内皮細胞接着分子-1(PECAM-1)を含むCNSへの免疫細胞移動に関与する細胞表面接着分子の半定量的発現を評価します。EECM-BMEC様細胞をSMLC馴化培地を用いて炎症性サイトカインの存在下および非存在下で16〜18時間培養する。
- 機能的接着分子の発現を評価するための静的条件下での免疫細胞接着アッセイ
- 西原ら26 に記載の方法を用いて、EECM-BMEC様細胞の細胞表面接着分子が機能しているか否かを判定する。
- 簡単に説明すると、EECM-BMEC様細胞を5.5 x 104 / cm2 のチャンバースライドに播種し、コンフルエントになるまで増殖させます。約24時間後、炎症誘発性サイトカインの存在下または非存在下で培養培地をSMLC馴化培地に変更し、EECM-BMEC様細胞をさらに16時間インキュベートします。
- 実験当日、凍結保存された免疫細胞(T細胞または末梢血単核球[PBMC]など)をT細胞洗浄バッファー(表1)で解凍し、T細胞培地中の蛍光色素(細胞トラッカー色素など)で標識します(表1)。免疫細胞用の培地の最適化は、研究対象の特定の種類の免疫細胞に合わせて調整する必要があります。
- 16ウェルチャンバースライドで、EECM-BMEC様細胞に2 x 104 Th1細胞を追加します。具体的には、Th1細胞などのエフェクターT細胞を用いた場合、PBMCと比較してEECM-BMEC様細胞へのより大きな接着を示すことが観察されている(西原ら[2022])。したがって、EECM-BMEC様細胞に添加されるPBMCの数は、純粋なエフェクターT細胞と比較して多くする必要があります。
- 単層のEECM-BMEC様細胞を用いて免疫細胞を遊走アッセイ培地中で30分間インキュベートする(表1)。30分後、スライドを穏やかに洗浄し、ダルベッコのPBSが入っているジャーに浸して2回洗浄し、続いて2.5%グルタルアルデヒド溶液で4°Cで2時間固定します。
- 固定後、ダルベッコのPBSが入った瓶に浸してスライドを2回洗い、カバーガラスで取り付けます。続いて、EECM-BMEC様細胞単層に付着した免疫細胞を計数するためのスライド上の単層の中心の蛍光顕微鏡画像を取得する。
結果
透過性アッセイ
フルオレセインナトリウムの透過性は、15、30、45、および60分で下部チャンバーから採取した培地の蛍光強度を測定することによって計算した。各時点で合計150 μLの培地をサンプリングし、不足している容量の150 μLをhECSR培地に置き換えます。蛍光プレートリーダー(485 nm励起/530 nm発光)を使用して蛍光強度を読み取り、前述の式18 を使用して正しいシグナル、クリアランス体積、および透過性を計算します(表2)。フルオレセインナトリウムの蛍光強度が時間の経過とともに増加するかどうかを確認することをお勧めします。再現性を確保するために、1回のアッセイに複数のフィルター(少なくとも3倍)を使用する必要があります。健康な対照由来のEECM-BMEC様細胞の場合、フルオレセインナトリウム(376 Da)の透過性は0.3 x 10-3 cm / min未満である必要があります。コンフルエントなEECM-BMEC様細胞単層の形成を確認するには、透過性アッセイで使用される各フィルターのEECM-BMEC様細胞の接合タンパク質に対する免疫蛍光染色をこのアッセイに続いて実行する必要があります。
免疫蛍光染色
クローディン-5、オクルージン、VE-カドヘリン1などのEECM-BMEC様細胞接合分子の免疫蛍光染色を使用して、細胞形態と連続および成熟接合の存在を評価しました(図4)。フィルターインサートのメンブレン上のEECM-BMEC様細胞の単層を冷メタノール(-20°C)で20秒間固定し、ブロッキングバッファーでブロックし(表1)、一次抗体と二次抗体とともにインキュベートしました。EECM-BMEC様細胞は、BMECs27の特徴である紡錘体状形状およびジグザグ形状接合部を示した。SMLC由来のコンディショニング培地で希釈した腫瘍壊死因子α(TNF-α)およびインターフェロンγ(INF-γ)(0.1 ng/mL TNF-α + 2 IU/mL IFN-γ)などの炎症誘発性サイトカインでチャンバースライドに播種したEECM-BMEC様細胞を刺激すると、ICAM-1やVCAM-1などの接着分子の発現がアップレギュレートされました28 (図5)。α平滑筋アクチン(SMA)、カルポニン、平滑筋タンパク質22-アルファ(SM22a)29を含む平滑筋細胞マーカーの代表的な画像を 図6に示します。チャンバースライドに播種したSMLCを4%パラホルムアルデヒドで10分間固定し、ブロッキングバッファーでブロッキングした後、一次抗体と二次抗体でインキュベートしました。
EECM-BMEC様細胞による細胞表面接着分子発現のフローサイトメトリー解析
EECM-BMEC様細胞における内皮接着分子の細胞表面発現についての代表的な結果を 図7に示す。TNF-αやINF-γなどの炎症誘発性サイトカインによる刺激は、ICAM-1、VCAM-1、P-セレクチンなどのいくつかの接着分子の細胞表面発現をアップレギュレートしました。内皮VCAM-1細胞表面発現を増強したSMLC馴化培地を用いてEECM-BMEC様細胞を培養する。VCAM-1細胞表面発現の誘導の効果は、SMLC馴化培地のバッチ間で異なり得る。どのバッチがVCAM-1の適切な発現を誘導するかを検証するために、SMLCを区別する際には、同じhiPS細胞源に由来するSMLCから採取したコンディショニング培地の複数のバッチを保存することをお勧めします。
静置条件下での免疫細胞接着アッセイ
付着した免疫細胞の数は、EECM-BMEC様細胞の表面上の機能的接着分子の発現量と相関した。炎症性サイトカインによる刺激は、内皮接着分子の発現をアップレギュレートし、EECM-BMEC様細胞単層に接着する免疫細胞数の増加を促進しました(図8)。今回の実験では、EECM-BMEC様細胞上の接着分子の機能性が実証され、免疫細胞とECの相互作用の研究に適したモデルとなっています。

図2:CD31+ ECの精製。 MACSの前(ステップ1.4.7)および後(ステップ1.4.14)の細胞集団のECおよびFITC標識CD31染色の散乱ゲーティングからの代表的なフローサイトメトリーデータのドットプロット。MACSは、集団中のCD31+ EPCの純度を向上させます。略語: SSC = 側方散乱;FSC = 前方散乱;FITC=フルオレセインイソチオシアネート;MACS = 磁気活性化細胞ソーティング。 この図の拡大版を表示するには、ここをクリックしてください。
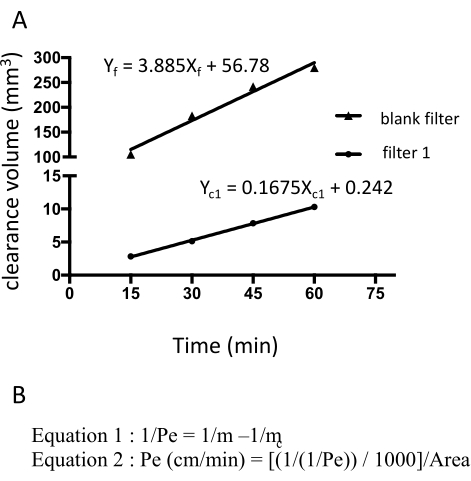
図3:フルオレセインナトリウムの生の蛍光強度から計算されたEECM-BMEC単層透過性(10-3 cm / min)。クリアランス体積の線形勾配は、各フィルタの線形回帰を使用して計算されます(図3A)。フルオレセインナトリウムの透過性は、2つの式を使用して計算されます(図3B)。(A)クリアランス体積対時間の線形勾配は、フィルタ1(mc1)とブランクフィルタ(mf)の線形回帰を用いて計算した。なお、mc1およびmfは、それぞれXc1およびXfの係数である。(b)mcおよびmfを用いたフルオレセイン透過性(Pe)の算出式(化学式1)。Pe単位は、フィルターの表面積を用いて換算した(式2)。この図の拡大版を表示するには、ここをクリックしてください。

図4:EECM-BMEC様細胞は成熟細胞接合部を示す。 インサートフィルターの膜上で増殖したEECM-BMEC様細胞におけるクローディン-5、オクルージン、またはVE-カドヘリン(赤色)の免疫蛍光染色。核は、4′,6-ジアミジノ-2-フェニルインドール(DAPI)(青色)を用いて染色した。染色は、透過性アッセイに使用したのとまったく同じフィルターインサートで実施しました。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
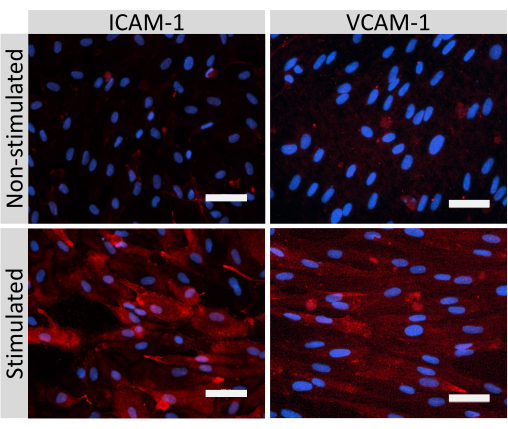
図5:EECM-BMEC様細胞による内皮接着分子の発現。 免疫蛍光染色は、SMLC由来のCMの存在下でフィルターインサートの膜上で増殖したEECM-BMEC様細胞に対して実施されました。 ICAM-1またはVCAM-1(赤)の免疫染色は、非刺激および1 ng/mL TNF-α + 20 IU/mL IFN-γ刺激EECM-BMEC様細胞について示されています。核はDAPI(青色)で染色した。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図6:SMLCの特性評価。 チャンバースライド上で増殖させたSMLCのα平滑筋アクチン(SMA)、カルポニン、または平滑筋タンパク質22-アルファ(SM22a)(赤)の免疫細胞化学を示します。核はDAPI(青色)で染色した。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
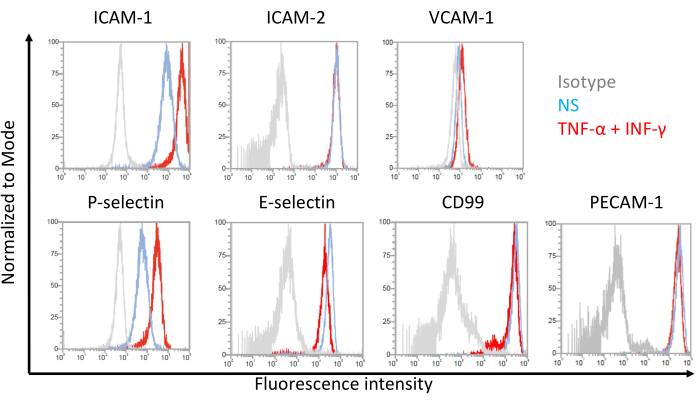
図7:EECM-BMEC様細胞における接着分子の内皮細胞表面発現。 EECM-BMEC様細胞におけるEC表面接着分子発現のフローサイトメトリー解析の結果を示す。EECM-BMEC様細胞は、SMLC由来の馴化培地を用いて培養した。ヒストグラムオーバーレイの青、赤、および灰色の線は、それぞれ非刺激(NS)条件、1 ng/mL TNF-α + 20 IU/mL IFN-γ刺激条件、およびアイソタイプコントロールを示しています。細胞間接着分子1(ICAM-1)、ICAM-2、血管細胞接着分子1(VCAM-1)、P-セレクチン、E-セレクチン、CD99、および血小板内皮細胞接着分子-1(PECAM-1)を含む内皮接着分子の細胞表面発現を評価した。 この図の拡大版を表示するには、ここをクリックしてください。
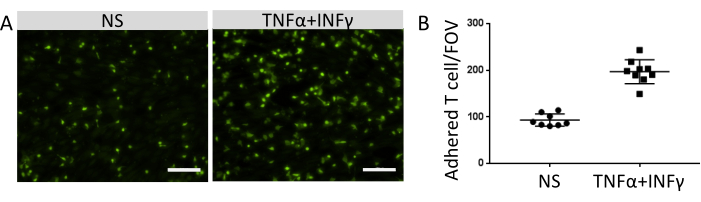
図8:EECM-BMEC様細胞への免疫細胞の接着 。 (A)非刺激(NS)および0.1 ng/mL TNF-α + 2 IU/mL IFN-γ刺激(TNF-α + IFN-γ)EECM-BMEC様細胞単層上に蛍光標識された接着免疫細胞の画像。画像は井戸の中心に対応しています。スケールバー = 50 μm。 (B)NSおよびTNF-α+IFN-γ刺激EECM-BMEC様細胞の単層上の蛍光標識免疫細胞の数。接着免疫細胞/視野(FOV)は、FIJIソフトウェアを使用して自動的にカウントされました。ドットは結合したT細胞の数を表す。バーは平均値を示し、エラーバーは8回の試行の標準偏差(SD)を示します。 この図の拡大版を表示するには、ここをクリックしてください。
表1:アッセイのための特定の試薬の詳細。 各特定の試薬の成分の名前と正確な量が説明されています。 この表をダウンロードするには、ここをクリックしてください。
表2:Pe計算用蛍光プレートリーダーの生データの例。太字の数字は、プレートリーダーで測定したフルオレセインナトリウムの生蛍光強度です。データを正確に解析するためには、生の値からバックグラウンド信号を除去し、ボトムチャンバのサンプリングに起因する信号損失を考慮し、その後信号を補正する必要があります。例えば、バックグラウンドを差し引くと、15分サンプルは100相対蛍光単位(RFU)のシグナルを示し、30分サンプルは150RFUのシグナルを示す。30分で補正された信号は(150 RFU + 15分での欠損値[100 RFU x 150 μL/1,500 μL])で、150 RFU + 10 RFU = 160 RFUです。クリアランス体積=(1,500 x [S B,t])/(S T,60分)、ここで、1,500はボトムチャンバの容積(1,500 μL)、S B,tは時刻tにおける補正信号、ST,60分は60分におけるトップチャンバの信号である。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
重要なポイントとトラブルシューティング
EPC分化を開始する前に、研究者はhiPSC培養で自発的な細胞分化イベントが発生していないことを確認する必要があります。自然分化した細胞がなく、純粋なhiPScコロニーを使用することは、再現性のある結果を得るために重要です。-3日目のhiPS細胞播種密度は、MACS後に高純度のCD31+ EPCを得るために重要です。各hiPSC株および各継代のシード密度は、最適化が必要な場合があります。hiPSC株と継代数に応じて、播種密度は、12ウェルプレート(20-100 x 10 3/cm2)のウェルあたり75 x 10 3〜400 x 10 3 hiPScの範囲です。hiPS細胞の最小密度チェックポイントは、2日目の細胞密度です。hiPS細胞は遅くとも2日目までに100%コンフルエントに達するはずです。2日目までにhiPS細胞がコンフルエントでない場合、MACS後のCD31+ EPCの純度は通常かなり低くなります。この場合、hiPScの播種密度を高めることができる。3日目から5日目頃に多数の分化細胞がプレートから剥離すると、初期のiPS細胞播種密度が低下する可能性があります。私たちの経験では、7〜8 μM CHIR99021は、ここで使用されるhiPS細胞株の最適濃度ですが、阻害剤治療に対して異なる反応を示す可能性のある他のhiPSC株に対して濃度を最適化する必要がある場合があります。CD31+ EPCの純度は、MACSの前後に確認する必要があります。MACSを継続する前に、事前にソートされた細胞混合物は>10%CD31 +細胞である必要があります。CD31+細胞の割合が<6%の場合、通常、MACS後に<80%のEPCが得られます。この状況では、初期播種密度および/またはCHIR99021濃度の最適化が必要です。
選択的継代と純粋なEC単分子膜の生成を成功させるには、CD31+ EPCのMACS後の純度が重要です。MACS後の純度が<90%の場合は、1回または2回の追加洗浄をお勧めします(ステップ1.4.11-1.4.12)。理想的には、MACS後の純度は>95%である必要があります。コラーゲンコーティングプレート上のEPC播種密度は、3〜7日以内に100%のコンフルエンシーを達成するために、hiPSCラインに従って最適化する必要があります。ECが100%コンフルエントになるまで待つと、通常、選択的通過が成功します。ただし、100%コンフルエントECであっても、一部のhiPSCラインのSMLCも早期に分離します。この場合、より低いコンフルエント(例えば、≤80%)での選択的継代が有効であり得る。一部のSMLCがECよりも早くデタッチすると、ECをEC-SMLC混合集団から救出できないことがよくあります。この場合、継代ECおよび反復選択継代における解離試薬の活性化時間を短縮することが有用であり得る。トリプシンはECとSMLCの別々の剥離を可能にしないため、解離試薬としてトリプシンではなく市販の解離試薬を使用することは、選択的継代に有益です。低分子トレーサーを用いた透過性アッセイ、タイトジャンクションおよび接着分子の発現レベルのテストは、EPC、EECM-BMEC様細胞、およびSMLCが液体窒素に少なくとも2年間保存できることを示しています。
この方法の意義と限界
この方法は、化学GSK-3阻害剤を使用してWnt/β-カテニンシグナル伝達を活性化することにより、CD31+ EPCをhiPS細胞と区別します。MACSによるCD31+ EPCのポジティブセレクションの後、EPCは、混合内皮およびSMLC集団への分化を促進する定義された内皮培地で培養されます。異なる接着特性を有するこれらの混合集団の選択的継代は、SMLCからのECの分離を可能にする。1回または2回の継代後、EECM-BMEC様細胞は、バリア特性および初代ヒトBMECのものを要約する内皮接着分子の発現を示す。SMLCまたはその上清との共培養は、VCAM-1のサイトカイン誘導性発現を誘導します。
生体内では、BBBは、特定のトランスポーターを介した栄養素の輸送とCNSへの免疫細胞輸送の制御を通じて、分子の低い傍細胞および経細胞透過性を確立することにより、CNS恒常性を維持します。BBBの研究には、それぞれの分子や目的とする機能を表示する適切なモデルが不可欠です。定義された試薬および患者または健常者からの試料を用いたEECM−BMEC様細胞の産生は、スケーラブルなヒトBBBモデルを提供する。EECM-BMEC様細胞を用いたモデルが他のBBBモデルよりも優れている点は、1)初代ヒトBMECの形態および内皮トランスクリプトームプロファイル30;2)成熟したタイトジャンクションの存在。3)望ましいバリア特性。4)ICAM-1、ICAM-2、VCAM-1、E-およびP-セレクチン、CD99、黒色腫細胞接着分子(MCAM)、および活性化白血球細胞接着分子(ALCAM)を含む内皮接着分子の堅牢な発現22。したがって、このモデルは、免疫細胞とBMECとの間の相互作用を研究するのに特に有用である。EECM-BMEC様細胞の低分子トレーサーの透過性は、iPS細胞由来のBMEC様細胞について以前に報告されたものよりも高いが14,15、バリア特性は初代ヒトBMECについて記載されたものと非常によく比較される。この類似性は、EECM−BMEC様細胞がBBBの良好なインビトロモデルである可能性が高いことを示している。生理学的条件下でのEECM-BMEC様細胞でのE-セレクチン発現は、このモデルを使用して、in vivoで構成的なE-セレクチン発現を欠く非炎症性BBBを研究する場合、考慮に入れる必要があります31。以前の研究では、EECM-BMEC様細胞が、破壊されたタイトジャンクションに関してMS患者の脳で観察されるように、BBBを表現コピーできることを示しました。これは、小分子のより高い透過性および機能的接着分子の発現の増加をもたらし、BMEC様細胞32を横切る免疫細胞の接着および遊走の増加を媒介する。さらに、Wnt/β-カテニンシグナル伝達の活性化が、MS由来のEECM-BMEC様細胞におけるタイトジャンクションの破壊およびVCAM-1発現の増加を改善できることを示した32。これらの結果は、このモデルがMSなどの神経免疫疾患におけるBBBの役割を研究するのに実際に有用であることを示しています。
まとめると、EECM-BMEC様細胞は、BBBレベルでの病態生理学的メカニズムを深く理解し、BBB安定化のための新しい治療標的を開発するためのツールとして有望なツールです。将来的には、このモデルは、より広範な疾患におけるBBB機能障害の研究に適用でき、新しい治療アプローチへの道を開く可能性があります。
開示事項
BEは、血液脳関門を越えるT細胞遊走に対するナタリズマブの長期投与を研究するためのバイオジェンからの助成金と、神経疾患における血液脳関門機能障害の分子基盤を研究するためのCSLベーリングからの助成金を受けました。HNおよびBEは、EECM-BMEC様細胞に関連する暫定的な米国特許出願の発明者である(63/084980および63/185815)。
謝辞
HNは、上原記念財団、ECTRIMS特別研究員、日本学術振興会の助成を受けて、日本学術振興会(JRPs)JPJSJRP20221507および科研費第22K15711号、JSTフォレストプログラム(課題番号JPMJFR2269、日本)、横山臨床薬理財団 YRY-2217、金原一郎財団、成重神経科学研究財団、 ノバルティス学術振興財団、山口大学基金BEは、スイスMS協会とスイス国立科学財団(助成金310030_189080およびZLJZ3_214086)および戦略的日スイス科学技術プログラム(SJSSTP)助成金IZLJZ3_214086によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
参考文献
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372(2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358(2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32(2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679(2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733(2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9(2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25(2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118(2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563(2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992(2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved