Method Article
인간 유도 만능 줄기 세포를 성숙한 면역 표현형을 가진 뇌 미세혈관 내피 세포 유사 세포로 분화
요약
여기에서는 만능 줄기 세포를 뇌 미세혈관 내피 세포(BMEC) 유사 세포로 분화할 수 있는 프로토콜인 확장된 내피 세포 배양 방법(EECM)에 대해 설명합니다. 이들 세포는 내피 세포 부착 분자 발현을 보여주므로 시험관 내에서 면역 세포 상호작용을 연구하기에 적합한 인간 혈액-뇌 장벽 모델입니다.
초록
혈액-뇌 장벽(BBB) 기능 장애는 중추신경계(CNS)에 영향을 미치는 많은 신경퇴행성 및 신경염증성 질환의 병리학적 특징입니다. 질병 관련 BBB 샘플에 대한 제한된 접근으로 인해 BBB 오작동이 질병 발병의 원인인지 아니면 신경염증 또는 신경퇴행성 과정의 결과인지는 아직 잘 알려져 있지 않습니다. 따라서 인간 유도 만능 줄기 세포(hiPSC)는 건강한 기증자와 환자로부터 시험관 내 BBB 모델을 확립하여 개별 환자의 질병 특이적 BBB 특성을 연구할 수 있는 새로운 기회를 제공합니다. hiPSC에서 뇌 미세혈관 내피 세포(BMEC) 유사 세포를 유도하기 위한 여러 분화 프로토콜이 확립되었습니다. 각 BMEC 차별화 프로토콜의 올바른 선택을 위해서는 특정 연구 질문에 대한 고려가 필수입니다. 여기에서는 hiPSC를 성숙한 면역 표현형을 가진 BMEC 유사 세포로 분화하도록 최적화되어 면역 세포-BBB 상호 작용을 연구할 수 있는 확장된 내피 세포 배양 방법(EECM)에 대해 설명합니다. 이 프로토콜에서 hiPSC는 먼저 Wnt/β-카테닌 신호 전달을 활성화하여 내피 전구 세포(EPC)로 분화됩니다. 그런 다음 평활근 유사 세포(SMLC)를 포함하는 결과 배양물을 순차적으로 계대배양하여 내피 세포(EC)의 순도를 높이고 BBB 특이적 특성을 유도합니다. EECM-BMEC와 이러한 SMLC 또는 SMLC의 컨디셔닝 배지의 공동 배양은 EC 접착 분자의 재현 가능하고 구성적이며 사이토카인 조절 발현을 허용합니다. 중요하게도, EECM-BMEC-유사 세포는 일차 인간 BMEC에 필적하는 장벽 특성을 확립하고, 모든 EC 부착 분자의 발현으로 인해, EECM-BMEC-유사 세포는 다른 hiPSC-유래 시험관 내 BBB 모델과 상이하다. 따라서 EECM-BMEC 유사 세포는 개인화된 방식으로 면역 세포 상호 작용에 영향을 미치는 BBB 수준에서 질병 과정의 잠재적 영향을 조사하기 위해 선택되는 모델입니다.
서문
중추 신경계(CNS)의 신경혈관 단위(NVU)는 고도로 전문화된 미세혈관 내피 세포(EC), 내피 기저막에 박힌 혈관주위세포, 실질 기저막 및 성상교세포말단발로 구성됩니다1. NVU 내에서 뇌 미세혈관 내피 세포(BMEC)는 혈액-뇌 장벽(BBB)을 형성하는 핵심 구성 요소입니다. BMEC는 복잡하고 연속적인 밀착 접합부를 형성하고 말초 기관의 미세혈관 EC에 비해 피노세포화 활성이 매우 낮아 BBB가 수용성 분자가 CNS로 자유 세포상 확산되는 것을 억제할 수 있습니다. BMEC에 의한 특정 유입 수송체 및 유출 펌프의 발현은 CNS2로부터 각각 영양소 및 유해 분자의 흡수 및 내보내기를 보장합니다. 또한, BBB는 CNS3로의 면역 세포 이동에 중요한 낮은 수준의 내피 접착 분자를 발현함으로써 CNS로의 면역 세포 진입을 엄격하게 제어합니다. 생리학적 조건에서 세포간 접착 분자-1(ICAM-1) 및 혈관 세포 접착 분자-1(VCAM-1)과 같은 BMEC 표면의 접착 분자의 발현 수준은 낮지만 일부 신경 장애에서는 이러한 수준이 증가합니다2. BBB의 형태학적 및 기능적 쇠약은 뇌졸중4, 다발성 경화증(multiple sclerosis, MS)5 및 여러 신경퇴행성 질환(neurodegenerative disease)과 같은 많은 신경계 질환에서 보고된다 6,7,8. 생리학적 및 병리학적 조건 모두에서 BMEC의 세포 및 분자 특성에 대한 자세한 조사는 BBB를 표적으로 하는 새로운 치료 전략을 식별하는 접근 방식입니다.
최근까지 일차 또는 불멸의 인간 및 설치류 BMEC가 BBB를 연구하는 데 사용되었습니다. 그러나 접착 분자와 용질 운반 단백질을 포함한 몇 가지 중요한 분자의 발현이 인간과 설치류 간에 다르기 때문에 BBB의 동물 모델에 기초한 결론이 인간 BBB에 쉽게 적용될 수 있는지 여부는 불분명합니다 9,10. hCMEC/D3와 같은 인간 BMEC 라인은 적절한 수준의 접착 분자를 발현하지만11, 이러한 불멸화된 BMEC는 일반적으로 복잡한 밀착 접합부와 견고한 장벽 특성을 갖지 않는다12. 일차 인간 BMEC는 장벽 기능(barrier function)13을 연구하는데 유용하지만, 모든 연구자들이 쉽게 이용할 수 있는 것은 아니다. 또한, 환자의 원발성 BMEC는 특정 임상 조건에서만 수행되는 뇌 생검 또는 수술을 통해 수집해야 하기 때문에 얻기 어려울 수 있습니다.
최근 줄기 세포 기술의 발전으로 인간 유도 만능 줄기 세포(hiPSC)와 같은 줄기 세포 공급원에서 발생하는 다양한 인간 세포 유형의 분화가 가능해졌습니다. hiPSC 유래 모델을 통해 환자 유래 샘플을 사용하여 병태생리학적 모델을 설정할 수 있습니다. 여러 hiPSC 유래 세포 유형을 결합하여 생리학적 조건을 더 잘 모방하는 자가 공동 배양 또는 오가노이드를 설정할 수 있습니다. 몇몇 널리 사용되는 프로토콜(14,15,16,17,18,19)은 BBB-특이적 수송체 및 유출 펌프의 발현과 함께 강력한 확산 장벽 특성을 갖는 hiPSC-유래 BMEC-유사 세포를 분화시키는데 사용될 수 있고, 소분자의 세포 주위 확산, 분자 수송 메커니즘, 및 뇌로의 약물 전달을 연구하는데 유용하다 20,21. 그러나 이전 연구에서는 널리 사용되는 hiPSC 유래 BMEC 유사 세포가 면역 세포와 BBB22 사이의 상호 작용을 매개하는 VCAM-1, 셀렉틴 및 ICAM-2를 포함한 주요 내피 접착 분자의 발현이 부족하다는 것을 보여주었습니다. 또한, 이전의 hiPSC 유래 BMEC는 전사 수준23에서 혼합된 내피 및 상피 특성을 나타내는 것으로 보고되었습니다. 따라서 우리는 형태, 장벽 특성 및 내피 접착 분자 발현과 관련하여 hiPSC를 일차 인간 BMEC와 유사한 BMEC 유사 세포로 분화할 수 있는 새로운 프로토콜인 확장된 내피 세포 배양 방법(EECM)을 개발했습니다. 이 프로토콜은 hiPSC를 성숙한 면역 표현형을 나타내는 BMEC 유사 세포로 분화하기 위한 자세한 방법론적 절차를 설명합니다.
프로토콜
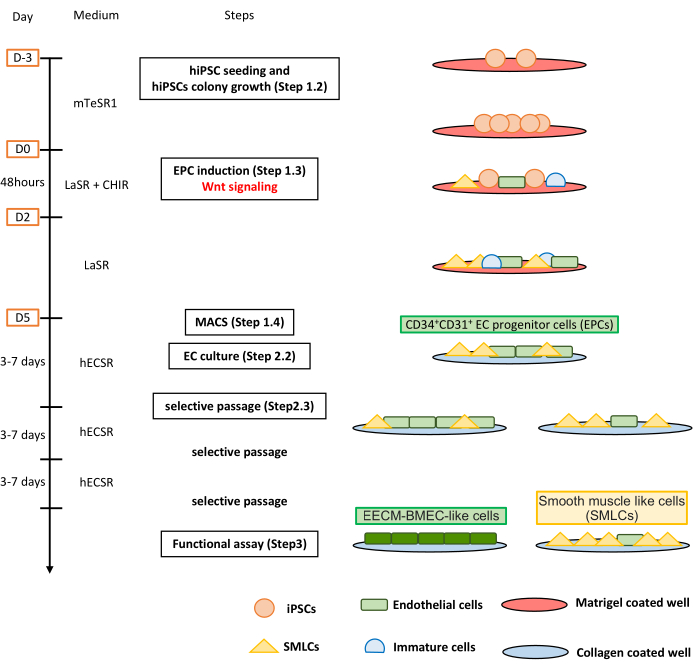
그림 1: 프로토콜 개요. 원고는 hiPSC를 EECM-BMEC 유사 세포로 분화하기 위한 단계별 프로토콜을 제시합니다. 올바른 계획은 각 단계에서 세포 집단을 묘사합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
hiPSC 라인인 HPS1006은 일본 문부과학성/AMED의 국가 생물 자원 프로젝트를 통해 RIKEN BRC에서 제공했습니다.
1. 내피 전구 세포(EPC)로의 hiPSC 분화 유도
- 세포외 기질(ECM) 코팅 플레이트 및 시약
- 최대 6개월 동안 -20°C에서 보관하기 위해 2.5mg의 매트릭스 겔을 50mL 원심분리기 튜브에 분취하여 기저막 매트릭스 코팅된 12웰 플레이트를 준비합니다. 냉장고(30°C)에 보관된 차가운 Dulbecco's modified Eagle's medium/nutrient mixture F-12(DMEM/F12)의 4mL를 튜브에 넣습니다. 겔이 해동될 때까지 피펫팅으로 부드럽게 혼합한 다음 500μL의 용액을 12웰 플레이트의 각 웰에 추가합니다. 플레이트를 인큐베이터(37°C, 5%CO2)에 최소 1시간 동안 놓습니다.
알림: 기저막 매트릭스 젤은 온도에 민감하므로 분취 및 플레이트 코팅에 대한 제조업체의 지침에 따라 취급해야 합니다. 세포외 기질 단백질의 농도는 배치마다 다를 수 있습니다. 정확성을 보장하려면 로트 번호를 사용하여 특정 배치에 대한 품질 인증서 시트에 정확한 농도를 참조해야 합니다. 예를 들어, 정확한 농도가 10.0mg/mL인 경우 총 2.5mg에 대해 250μL의 젤을 사용하십시오. - ROCK 억제제를 멸균수에 용해시켜 10 mM의 농도로 로키나아제(ROCK) 억제제 원액을 제조한다(표 1). 원액을 100-200 μL 부피로 분취하고 동결-해동 주기를 피하기 위해 -20°C에서 보관합니다.
- 멸균수 50mL에 L-아스코르빈산 5g을 용해시켜 L-아스코르빈산 원액 100mg/mL을 만들고 -20°C에서 보관한다(표 1). 글루타민 6.25mL와 L-아스코르브산 원액 305μL를 고급 DMEM/F12 500mL에 넣어 LaSR 배지24 를 만듭니다(표 1). 2-8 °C에서 최대 2주 동안 보관하십시오.
- CHIR99021을 희석되지 않은 디메틸 설폭사이드(DMSO)에 용해시켜 최종 농도 10mM로 CHIR99021 용액을 제조한다(표 1). 동결-해동 주기를 피하기 위해 용액을 100-200μL 부피로 분취하고 최대 1년 동안 -20°C에서 보관합니다. 원액의 작업 분취량을 4°C에서 최대 1개월 동안 보관하십시오.
- 12mL의 DMEM/F10에 50mL의 열 비활성화 소 태아 혈청을 추가하여 DMEM/F12-450 배지를 준비합니다. 배지를 2-8°C에서 최대 1개월 동안 보관합니다(표 1).
- 467mL의 Dulbecco's phosphate-buffered saline(PBS)에 33.3mL의 7.5% 소 혈청 알부민(BSA)을 첨가하여 유동 완충액-1을 준비합니다(표 1). 2-8 °C에서 최대 6개월 동안 보관하십시오.
- 최대 6개월 동안 -20°C에서 보관하기 위해 2.5mg의 매트릭스 겔을 50mL 원심분리기 튜브에 분취하여 기저막 매트릭스 코팅된 12웰 플레이트를 준비합니다. 냉장고(30°C)에 보관된 차가운 Dulbecco's modified Eagle's medium/nutrient mixture F-12(DMEM/F12)의 4mL를 튜브에 넣습니다. 겔이 해동될 때까지 피펫팅으로 부드럽게 혼합한 다음 500μL의 용액을 12웰 플레이트의 각 웰에 추가합니다. 플레이트를 인큐베이터(37°C, 5%CO2)에 최소 1시간 동안 놓습니다.
- 특이화된 hiPSC의 시드 및 EPC 분화를 위한 확장(-3일에서 -1일)
- 6웰 플레이트의 hiPSC 콜로니가 자발적인 분화를 나타내지 않고 계대배양에 적합한 밀도(일반적으로 약 80% 밀도)(2.5-3.5 x 106 개 세포)를 가질 때 분화를 시작합니다. 현미경으로 자연 분화된 세포를 주의 깊게 모니터링하여 미분화 세포를 제거하기 위해 여러 계대가 필요한지 여부를 확인합니다. 세포 배양 배지 및 세포외 기질에 대한 정보는 단계 1.4.15 아래에 제공된 참고 사항을 참조하십시오.
- 배지를 흡인하고 1mL의 해리 시약을 웰에 첨가하고 37°C에서 5-7분 동안 인큐베이션합니다. 해리 시약 용액을 웰 표면에 부드럽게 피펫팅하여 세포를 해리하고 특이하게 만듭니다.
- 분리된 세포를 4mL의 hiPSC 유지 배지가 들어 있는 15mL 튜브로 옮기고 세포를 완전히 재현탁합니다. 세포 계수를 위해 10μL 분취량을 예약합니다.
- 펠렛분리하여 세포를 20-25°C에서 200 x g 에서 5분 동안 원심분리하였다. 세포를 계수하고 기저막 매트릭스 코팅 12웰 플레이트에서 적절한 밀도의 hiPSC(웰당 75-400 x 103 )를 달성하는 데 필요한 부피를 계산합니다(단계 1.1.1).
- 웰에서 코팅 용액을 흡인하고 10μM ROCK 억제제가 포함된 hiPSC 배지 1mL를 각 웰에 추가합니다(1:1,000 희석). 원심분리 후, 상층액을 흡인하고 펠릿을 1mL의 hiPSC 배지에서 해리시킨다.
- 1.2.4 단계에서 결정된 필요한 부피의 hiPSC를 12웰 플레이트의 각 웰에 추가합니다. 2 내지 4개의 12-웰 플레이트는 hiPSC 클론을 분화시키기에 충분할 수 있다. 1.2.4 단계를 참조하여 세포 파종에 필요한 플레이트 수를 결정하십시오.
- 플레이트를 인큐베이터(37°C, 5%CO2)에 넣는다. 인큐베이터에서 플레이트를 앞뒤로 부드럽게 밀고 좌우로 밀어 세포를 고르게 분배합니다.
- 다음 날(즉, -2일)에 배지를 ROCK 억제제가 결여된 2mL의 hiPSC 유지 배지로 교환합니다. 다음날(Day -1)에 배지를 2mL의 신선한 hiPSC 유지 배지로 교환합니다.
- 글리코겐 합성효소 키나아제 3(GSK-3) 억제제 CHIR99021을 사용한 EPC 유도(0일에서 5일)
- 0일째에, 각 웰의 hiPSC 유지 배지를 8 μM CHIR99021을 함유하는 2 mL의 LaSR 배지로 교체한다.
- 1일째에 배지를 흡인하고 8μM CHIR99021을 함유하는 신선한 LaSR 배지 2mL를 추가합니다.
- 2일, 3일 및 4일에 배지를 CHIR99021이 없는 신선한 LaSR 배지 2mL로 교체합니다.
- CD31 정제를 위한 자기 활성화 세포 분류(MACS)+ EPC(5일차)
- 5일째에, 배지를 흡인한 다음, 37°C에서 6-8분 동안 인큐베이션하기 전에, 각 웰에 1 mL의 해리 시약을 첨가한다.
- 마이크로피펫으로 세포를 해리 및 특이화하고 40μm 세포 여과기를 통과하여 10mL의 DMEM/F12-10 배지가 들어 있는 50mL 튜브에 현탁액을 여과합니다. 2개 이상의 12-웰 플레이트로부터 수집된 세포 현탁액을 적어도 2개의 50 mL 튜브로 여과한다.
- DMEM/F12-10 배지(최대 50mL)를 추가하여 분해 반응을 중지합니다. 피펫을 완전히 피펫팅하고 세포 계수를 위해 10μL를 예약합니다. 펠렛분리하여 세포를 20-25°C에서 200 x g 에서 5분 동안 원심분리하였다.
- 상층액을 제거한 후 DMEM/F12-10 배지 10mL를 추가하고 세포 현탁액을 신선한 15mL 튜브에 옮깁니다. 펠렛분리하여 세포를 20-25°C에서 200 x g 에서 5분 동안 원심분리하였다.
- 상청액을 흡인하고 완충액 100μL당 1.0 x10 7 개 세포의 밀도로 유동 완충액-1에 재현탁합니다.
- FcR 차단 시약을 1:100의 비율로 첨가하고 5분 동안 배양한 후 1:200으로 희석된 플루오레세인 이소티오시아네이트(FITC) 표지 CD31 항체를 첨가합니다. 현탁액을 20-25°C의 암실에서 30분 동안 인큐베이션한다.
- CD31+ 세포의 분획을 측정하기 위해 유세포 분석을 위해 10μL의 현탁액을 예약하고 10mL의 유동 완충액-1을 추가합니다(그림 2).
- 20-25°C에서 5분 동안 200 x g 에서 원심분리하여 세포를 펠렛화한다. 이어서, 상층액을 제거하고, 완충액-1 용액 100 μL당1.0 x 10 7 세포의 밀도로 재현탁시킨다. FITC 선택 칵테일(세포 현탁액 100μL당 5μL)을 추가합니다. 피펫팅으로 완전히 혼합하고 20-25°C에서 15분 동안 암실에서 배양합니다.
- 세포 현탁액 100μL당 자성 나노입자 5μL를 넣고 잘 피펫팅하고 20-25°C에서 10분 동안 암실에서 배양합니다.
- 세포 현탁액을 5mL 유세포 분석 튜브로 옮기고 유동 완충액-1을 추가하여 총 부피가 2.5mL가 되도록 합니다. 유세포 분석 튜브를 자석에 5분 동안 넣습니다.
- 연속 동작으로 자석을 뒤집고 FITC-CD31 항체로 표지되지 않은 세포를 포함하는 세포 현탁액을 디캔팅합니다. 자석과 튜브를 거꾸로 된 위치에 2-3초 동안 유지한 다음 남은 액체를 제거합니다. 튜브를 똑바로 세우기 전에 튜브 가장자리의 물방울을 흡인하십시오.
- 자석에서 유세포 분석 튜브를 집어 들고 2.5mL의 유동 완충액-1을 추가하여 나머지 CD31+ 세포를 세척합니다. 세포를 두세 번 위아래로 부드럽게 피펫팅하여 세포를 재현탁합니다. 흐름 튜브를 자석에 5분 동안 넣습니다.
- 1.4.11-1.4.12단계를 세 번 반복한 다음 1.4.11단계를 한 번 더 반복하여 총 4번의 세척을 합니다.
- 자석에서 플로우 튜브를 제거하고 튜브에 적절한 배지(예: 확장된 EC 배양을 위한 인간 내피 무혈청 배지[hECSR] 또는 동결을 위한 동결 배지)의 표시된 양을 추가하여 정제된 CD31+ 세포를 재현탁합니다. 현탁액의 10μL 분취량 2개를 예약하는데, 하나는 세포 계수용이고 다른 하나는 MACS 후 샘플에서 CD31+ 세포의 순도를 평가하기 위해 유세포 분석을 수행합니다(그림 2). 유세포 분석기를 즉시 사용할 수 없는 경우 분석될 때까지 분취량을 4°C에서 보관하십시오.
- 다음 단계(2단계를 통해)를 즉시 수행할 수 없는 경우 이 시점에서 CD31+ EPC를 동결합니다. EPC의 확장 및 선택적 통과를 위해 2단계로 진행합니다.
참고: Vitronectin25 코팅 12웰 플레이트와 보다 안정적인 hiPSC 유지 배지(mTeSR plus)를 기저막 매트릭스 코팅 플레이트 및 hiPSC 유지 배지(mTeSR1) 대신 사용할 수 있습니다. 비트로넥틴으로 코팅된 12웰 플레이트를 준비하기 위해 비트로넥틴을 희석 완충액으로 최종 농도 10μg/mL로 희석한 다음 희석된 용액 500μL를 12웰 플레이트의 각 웰에 옮깁니다. 플레이트를 20-25°C에서 최소 1시간 동안 그대로 두십시오. 특이화된 hiPSC의 파종 밀도는 기저막 매트릭스 코팅 플레이트에 사용되는 밀도와 비슷합니다. 배양 배지 또는 매트릭스 조성을 변경하면 hiPSC의 증식 및 자발적 분화에 영향을 미칠 수 있으며, 이는 일반적으로 새로운 배양 조건에 적응하는 데 1-2주가 필요합니다. 보다 안정적인 hiPSC 유지 매체가 hiPSC 유지 매체에 사용되는 경우 이 매체는 hiPSC 유지 매체 대신 EPC 차별화에 사용할 수 있습니다. 이 경우 -2일에 보다 안정적인 hiPSC 유지 배지를 변경하여 ROCK 억제제를 제거해야 하며 -1일에 교환을 건너뛸 수 있습니다.
2. 뇌 미세혈관 내피세포 유사세포(BMEC 유사세포)와 평활근 유사세포(SMLC)를 분화하기 위한 확장된 내피세포배양법(EECM)
- 콜라겐 코팅 플레이트 및 시약의 제조
- 결정화된 콜라겐 IV형 5 mg 5 mL를 멸균수 5 mL에 용해시켜 콜라겐 코팅된 6-웰 플레이트를 준비한다. 4°C에서 하룻밤 동안 배양한 후 분취하여 -20°C에서 보관합니다. 콜라겐 IV 분취량을 멸균수에 1:100으로 희석하여 10μg/mL 용액을 생성하고 10μg/mL 콜라겐 IV 용액 1mL를 6웰 플레이트의 각 웰에 추가합니다. 플레이트를 37°C에서 최소 30분 동안 인큐베이션한다. 플레이트는 37°C에서 최대 1주일 동안 보관할 수 있습니다.
- 500μg의 FGF를 Dulbecco's PBS 5mL에 용해시켜 인간 섬유아세포 성장 인자 2(FGF2)의 원액을 준비하고, 7.5% BSA를 최종 농도 0.1%에 첨가하고, 원액을 20-200μL 부피로 분취합니다. -20°C에서 최대 3개월 동안 보관할 수 있습니다(표 1). 원액은 4°C에서 최대 1개월 동안 보관할 수 있습니다. 동결-해동 주기를 피하십시오. 2mL의 B-27 보충제와 20μL의 FGF2를 98mL의 hECSR 배지에 첨가하여 hECSR 배지를 준비합니다(표 1). hECSR 배지는 2-8°C에서 최대 2주 동안 보관할 수 있습니다.
- hECSR 배지 30mL에 소 태아 혈청 15mL, DMSO 5mL, ROCK 억제제 용액 25μL를 첨가하여 EPC, EECM-BMEC 유사 세포 및 SMLC용 동결 배지를 준비합니다(표 1). 동결 배지는 2-8°C에서 최대 2주 동안 보관할 수 있습니다.
- 확장된 내피 세포 배양을 위한 시딩 EPC
- 6-웰 플레이트에서 콜라겐 용액을 제거합니다. 그런 다음 5μM ROCK 억제제(1:2,000 희석)가 포함된 hECSR 배지 2mL에 1.0-2.0 x 10 5개의 정제된 CD31+ EPC를 옮깁니다. 플레이트를 인큐베이터(37°C, 5%CO2)에 넣는다. 플레이트를 앞뒤로 부드럽게 밀고 좌우로 밀어 세포를 고르게 분배합니다.
- 다음날, ROCK 억제제가 포함된 hECSR 배지를 제거하고 ROCK 억제제가 없는 신선한 hECSR 배지 2mL를 추가합니다. 100% 합류에 도달할 때까지 격일로 hECSR 배지를 교환합니다.
알림: 주말 동안 규칙적인 수유 일정을 유지할 수 없는 경우 배지는 주중 마지막 근무일 저녁에 교체하고 주말 이후 이른 아침에 다시 교체할 수 있습니다.
- EECM-BMEC 유사 세포 및 SMLC를 정제하기 위한 선택적 계대
- EC와 비-EC 집단의 혼합물을 함유하는 6-웰 플레이트로부터 hECSR 배지를 제거한다. 각 웰에 1mL의 해리 시약을 추가합니다.
- 현미경으로 세포 형태를 주의 깊게 모니터링합니다. EC(비 EC는 제외)가 밝고 둥글게 보이면 플레이트 가장자리를 두드려 분리합니다. 대부분의 비 EC는 플레이트에 부착된 상태로 유지됩니다.
- 마이크로피펫을 사용하여 분리된 EC를 수집하고, 비 EC가 다시 중단되지 않도록 주의합니다. EC를 해리 시약 1mL당 4mL의 DMEM/F50-4가 들어 있는 10mL 또는 10mL 원심분리기 튜브로 옮깁니다.
- 2mL의 hECSR 배지를 나머지 부착된 비EC를 포함하는 웰에 추가하여 SMLC를 설정합니다. 플레이트를 인큐베이터에 놓습니다.
- EC 현탁액을 원심분리기 튜브에 피펫팅하여 완전히 혼합하고 세포 계수를 위해 현탁액 10μL를 예약합니다. 나머지 세포를 20-25°C에서 200 x g 에서 5분 동안 원심분리한다. 펠릿에서 상청액을 제거하고 1.0-2.0 x 105 ECs 당 2 mL의 hECSR 배지를 첨가한다.
- 새로운 6-웰 플레이트로부터 콜라겐 IV 용액을 제거하면서, 2 mL의 EC 현탁액을 각 웰에 첨가하고, 이어서 5%CO2와 함께 37°C에서 인큐베이션하였다. 플레이트에 세포를 골고루 분배하려면 인큐베이터 선반에서 앞뒤로 좌우로 부드럽게 움직입니다.
- EC가 100% 밀도에 도달할 때까지 격일로 hECSR 배지를 교체합니다.
- 순수한 EC 단분자층이 얻어질 때까지 2.3.1-2.3.7단계를 반복합니다. 다음 단계를 수행할 수 없는 경우 CD31+ EC를 고정합니다(2.4.2단계 참조). EC 함수를 분석하려면 3단계로 이동합니다.
참고: 일반적으로 기능 분석에 적합한 거의 순수한 EC의 배양을 얻으려면 두세 개의 선택적 계대가 필요하며 이러한 세포를 EECM-BMEC 유사 세포로 간주합니다. 5 또는 6 회 이상의 계대 후, 세포 증식은 전형적으로 느려지지만,이 변수는 hiPSC 라인에 의존한다. - SMLC를 배양하려면 격일로 hECSR 배지를 교체하십시오. SMLC 컨디셔닝 배지(CM)를 수집하려면 각 배지 교체 시 수집된 배지를 0.22μm 필터를 통과시킵니다. CM은 EECM-BMEC-유사 세포의 VCAM-1 발현을 상향 조절하는 데 사용할 수 있습니다. SMLC가 100% 합류도에 도달할 때까지 SMLC-CM을 풀링합니다.
- EPC, EECM-BMEC 유사 세포, SMLC 냉동 보존 및 해동
- EPC를 동결하려면 최종 MACS 세척(단계 1.4.13) 후 hECSR 배지가 아닌 동결 배지에서 1.0-2.0 x 106 cells/mL의 밀도로 EPC를 다시 일시 중단합니다. 세포 현탁액 1mL를 cryotubes에 분배합니다. cryotube를 제어된 속도 동결 장치에 넣고 -80°C로 빠르게 옮깁니다. 장기간 보관하려면 튜브를 동결 후 24-48시간 액체 질소 탱크로 옮깁니다.
- EECM-BMEC-유사 세포 및 SMLC를 동결시키기 위해, 웰로부터 배지를 제거한 후, 해리 시약 (1 mL/웰)을 첨가하고, 세포가 분리될 때까지 5%CO2 와 함께 37°C에서 플레이트를 인큐베이션한다 (각각 EECM-BMEC-유사 세포 및 SMLC의 경우 5-7분 및 20-30분). 해리 시약 1mL당 4mL의 DMEM/F12-10이 들어 있는 15mL 또는 50mL 원심분리기 튜브에 세포를 수집합니다.
- 세포 계수를 위해 10 μL의 세포 현탁액을 완전히 혼합하고 비축하기 위해 피펫팅합니다. 20-25°C에서 5분 동안 200 x g 에서 원심분리하여 세포를 펠렛화한다. 상층액을 제거하고 동결 배지에서 세포를 1.0-2.0 x 106 cells/mL의 밀도로 완전히 재현탁합니다. 1mL의 세포 현탁액을 신선한 cryotubes에 분배합니다.
- cryotube를 제어된 속도 동결 장치에 넣고 즉시 -80°C로 옮깁니다. 장기 보관을 위해 튜브는 동결 후 24-48시간 액체 질소 탱크로 옮길 수 있습니다.
- EPC, EECM-BMEC 유사 세포 및 SMLC를 해동하기 위해 극저온 튜브 바이알을 손 사이에 굴리거나 세포가 거의 완전히 해동될 때까지 37°C 수조에서 배양합니다. 500μL의 DMEM/F12-10을 추가하고 세포 현탁액을 4mL의 DMEM/F12-10 배지가 들어 있는 15mL 튜브에 부드럽게 옮깁니다. DMEM/F12-10 1mL를 추가하여 cryotube를 한 번 세척한 다음 20-25°C에서 5분 동안 200 x g 에서 세포를 원심분리합니다.
- 상청액을 흡인하고 펠릿을 5μM ROCK 억제제(1:2,000 희석)를 함유하는 hECSR 배지 2mL에 EPC의 경우 2mL당 1.0-2.0 x 10 5 세포, EECM-BMEC 유사 세포 및 SMLC의 경우 2mL당 2.0-3.0 x 105 세포. 콜라겐 용액을 흡인 후 콜라겐 코팅된 6-웰 플레이트의 웰 사이에 세포 현탁액을 분배합니다.
- 플레이트를 앞뒤로 부드럽게 움직인 다음, 37°C, 5%CO2 에서 인큐베이터의 선반 상에서 웰 내에 세포를 고르게 분배한다.
- 다음날, 배지를 ROCK 억제제가 결여된 신선한 hECSR 배지로 교환한다. 100% 밀도에 도달할 때까지 hECSR 배지를 격일로 교환합니다. 그런 다음 EPC에 대한 선택적 계대평가(2.3단계 참조) 및 EECM-BMEC 유사 세포에 대한 기능 분석(3단계 참조)을 진행합니다. 분자 특성화 및 기능 분석을 수행하기 전에 EECM-BMEC 유사 세포는 100% 합류해야 하며, 이는 일반적으로 해동 후 2-3일 후에 달성됩니다.
3. EECM-BMEC 유사 세포 및 SMLC의 검증
- 저분자 추적자에 대한 투과성 분석
- Nishihara et al.26에 설명된 대로 불화나트륨 투과성을 측정하여 EECM-BMEC 유사 세포 장벽 무결성을 평가합니다. 필터 인서트에 EECM-BMEC 유사 세포를 시딩하여 완전한 단층을 개발하고 불화나트륨의 투과성을 측정합니다.
- 주요 분자를 평가하기 위한 면역형광 염색.
- 단층 또는 SMLC에서 EECM-BMEC 유사 세포의 접합 분자, 접착 분자 또는 세포골격 단백질의 발현을 모니터링하기 위한 면역형광 염색의 경우 챔버 슬라이드, 96웰 플레이트 또는 인서트 필터가 있는 멤브레인을 사용합니다. Nishihara et al.26에 의해 기술된 바와 같이, 염증성 사이토카인 자극을 포함하거나 포함하지 않는 세포 표면 접착 분자의 EECM-BMEC 유사 세포 발현을 평가한다.
- EECM-BMEC 유사 세포에서 세포 표면 부착 분자의 발현을 분석하기 위한 유세포 분석
- Nishihara et al.26에 기술된 바와 같이 ICAM-1, ICAM-2, VCAM-1, P-셀렉틴, E-셀렉틴, CD99 및 혈소판 내피 세포 접착 분자-1(PECAM-1)을 포함하여 CNS로의 면역 세포 이동에 관여하는 세포 표면 접착 분자의 반정량적 발현을 평가하기 위해 유세포 분석을 사용합니다. EECM-BMEC 유사 세포를 염증성 사이토카인의 존재 및 부재 하에 SMLC-conditioned 배지로 16-18시간 동안 배양합니다.
- 기능적 접착 분자의 발현을 평가하기 위한 정적 조건에서의 면역 세포 부착 분석
- Nishihara et al.26 에 의해 기술된 방법을 사용하여 EECM-BMEC 유사 세포의 세포 표면 접착 분자가 기능적인지 여부를 결정하십시오.
- 간단히 말해서, EECM-BMEC 유사 세포를 5.5 x 104/cm2 의 챔버 슬라이드에 시드하고 합류점으로 성장합니다. 약 24시간 후, 배양 배지를 전염증성 사이토카인의 존재 또는 부재 하에 SMLC-컨디셔닝 배지로 변경하고, 추가로 16시간 동안 EECM-BMEC-유사 세포를 배양한다.
- 실험 당일, T 세포 세척 완충액(표 1)으로 냉동 보존된 면역 세포(예: T 세포 또는 말초 혈액 단핵 세포[PBMC])를 해동하고 T 세포 배지(표 1)에서 형광 염료(예: 세포 추적기 염료)로 라벨링합니다. 면역 세포에 대한 배양 배지의 최적화는 연구 중인 면역 세포의 특정 유형에 맞게 조정되어야 합니다.
- 16웰 챔버 슬라이드에서 2 x 104 Th1 세포를 EECM-BMEC 유사 세포에 추가합니다. 구체적으로, Th1 세포와 같은 이펙터 T 세포로 작업할 때 PBMC에 비해 EECM-BMEC 유사 세포에 더 큰 부착을 나타내는 것이 관찰되었습니다(Nishihara. et al. [2022]). 결과적으로, EECM-BMEC-유사 세포에 첨가되는 PBMC의 수는 순수한 이펙터 T 세포에 비해 더 높을 필요가 있다.
- 면역 세포를 이동 분석 배지에서 30분 동안 EECM-BMEC 유사 세포의 단층과 함께 배양합니다(표 1). 30분 후, 슬라이드를 부드럽게 세척하고, 둘베코의 PBS가 들어 있는 병에 담그고, 이어서 4°C에서 2시간 동안 2.5% 글루타르알데히드 용액으로 고정시킨다.
- 고정 후 Dulbecco의 PBS가 들어있는 병에 담그고 커버 슬립으로 장착하여 슬라이드를 두 번 씻습니다. 이어서, EECM-BMEC 유사 세포 단층에 부착된 면역 세포를 계수하기 위해 슬라이드에서 단층 중심의 형광 현미경 이미지를 획득합니다.
결과
투과성 분석
소듐 플루오레세인의 투과성은 15분, 30분, 45분, 60분에 하부 챔버로부터 채취한 매질의 형광 강도를 측정함으로써 계산하였다. 각 시점에서 총 150 μL의 배지를 샘플링하고 150 μL의 누락된 부피를 hECSR 배지로 교체합니다. 형광 강도는 형광 플레이트 리더(485nm 여기/530nm 방출)를 사용하여 판독하고 올바른 신호, 간극 부피 및 투과율은 앞서 설명한 수식18 을 사용하여 계산됩니다(표 2). 시간이 지남에 따라 플루오레세인 나트륨의 형광 강도가 증가하는지 확인하는 것이 좋습니다. 재현성을 보장하기 위해 하나의 분석에 여러 필터(최소 3배)를 사용해야 합니다. 건강한 대조군 유래 EECM-BMEC 유사 세포의 경우 플루오레세인나트륨(376Da) 투과성은 0.3 x 10-3cm /min 미만이어야 합니다. 융합성 EECM-BMEC 유사 세포 단층의 형성을 확인하기 위해, 투과성 분석에 사용되는 각 필터의 EECM-BMEC 유사 세포의 접합 단백질에 대한 면역형광 염색을 이 분석에 따라 수행해야 합니다.
면역형광 염색
claudin-5, occludin, VE-cadherin1을 포함한 EECM-BMEC 유사 세포 접합 분자의 면역형광 염색을 사용하여 세포 형태와 연속적이고 성숙한 접합부의 존재를 평가했습니다(그림 4). 필터 삽입물의 멤브레인 상의 EECM-BMEC-유사 세포의 단층을 20초 동안 차가운 메탄올(-20°C)로 고정하고, 블로킹 완충액(표 1)으로 차단한 다음, 1차 및 2차 항체와 함께 배양하였다. EECM-BMEC 유사 세포는 방추형 및 지그재그 모양의 접합부를 나타내었으며, 이들 모두는 BMECs27의 특징적인 형태학적 특징이다. 종양 괴사 인자-α(TNF-α) 및 인터페론-γ(INF-γ)(0.1ng/mL TNF-α + 2IU/mL IFN-γ)과 같은 전염증성 사이토카인으로 챔버 슬라이드에 파종된 EECM-BMEC 유사 세포의 자극은 SMLC 유래 조건 배지에 희석되어 ICAM-1 및 VCAM-1과 같은 접착 분자의 발현을 상향 조절했습니다28 (그림 5). α-평활근 액틴(SMA), 칼포닌 및 평활근 단백질 22-알파(SM22a)29를 포함한 평활근 세포 마커의 대표적인 이미지가 그림 6에 나와 있습니다. 챔버 슬라이드에 시딩된 SMLC를 4% 파라포름알데히드로 10분 동안 고정하고 차단 완충액으로 차단한 다음 1차 및 2차 항체와 함께 배양했습니다.
EECM-BMEC 유사 세포에 의한 세포 표면 부착 분자 발현의 유세포 분석
EECM-BMEC 유사 세포에서 내피 부착 분자의 세포 표면 발현에 대한 대표적인 결과가 도 7에 나와 있다. TNF-α 및 INF-γ와 같은 전염증성 사이토카인을 사용한 자극은 ICAM-1, VCAM-1 및 P-셀렉틴을 포함한 여러 접착 분자의 세포 표면 발현을 상향 조절했습니다. SMLC 조건 배지로 EECM-BMEC 유사 세포를 배양하면 내피 VCAM-1 세포 표면 발현이 향상되었습니다. VCAM-1 세포 표면 발현 유도의 효과는 SMLC-조건화된 배지의 배치에 따라 달라질 수 있다. 어떤 배치가 VCAM-1의 적절한 발현을 유도하는지 확인하기 위해 SMLC를 구별할 때 동일한 hiPSC 소스에서 파생된 SMLC에서 수확된 컨디셔닝 배지의 여러 배치를 저장하는 것이 좋습니다.
정적 조건에서의 면역세포 부착 분석
부착된 면역 세포의 수는 EECM-BMEC 유사 세포의 표면에서 기능적 접착 분자의 발현 수준과 상관관계가 있습니다. 염증성 사이토카인을 사용한 자극은 내피 부착 분자의 발현을 상향 조절하고 EECM-BMEC 유사 세포 단층에 부착하는 면역 세포의 수를 증가시켰습니다(그림 8). 현재의 실험은 EECM-BMEC 유사 세포에 대한 접착 분자의 기능을 입증하여 이 모델을 면역 세포-EC 상호작용을 연구하는 데 적합하게 만들었습니다.

그림 2: CD31+ EC의 정제. MACS 전(단계 1.4.7) 및 후(단계 1.4.14)의 세포 집단의 EC의 산란 게이팅 및 FITC 표지된 CD31 염색으로부터의 대표적인 유세포 분석 데이터의 도트 플롯. MACS는 모집단에서 CD31+ EPC의 순도를 향상시킵니다. 약어: SSC = 측면 산란; FSC = 순방향 산란; FITC = 플루오레세인 이소티오시아네이트; MACS = 자기 활성화 세포 분류. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
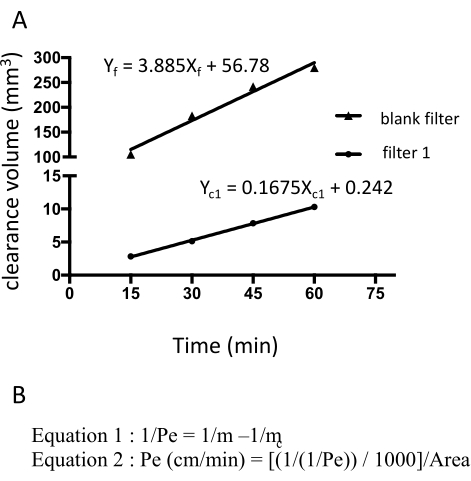
그림 3: 소듐 플루오레세인의 원시 형광 강도에서 계산된 EECM-BMEC 단층 투과성(10-3cm/min). 클리어런스 부피의 선형 기울기는 각 필터에 대한 선형 회귀를 사용하여 계산됩니다(그림 3A). 불화나트륨의 투과성은 두 가지 공식을 사용하여 계산됩니다(그림 3B). (A) 시간 대비 클리어런스 부피의 선형 기울기는 필터 1(mc1) 및 블랭크 필터(mf)에 대한 선형 회귀를 사용하여 계산되었습니다. mc1 및mf는 각각Xc1 및Xf의 계수이다. (B) mc 및 mf를 사용하여 플루오레세인 투과율(Pe)을 계산하는 공식(화학식 1). Pe 단위는 필터의 표면적을 이용하여 환산하였다(화학식 2). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: EECM-BMEC 유사 세포는 성숙한 세포 접합부를 나타냅니다. 삽입 필터의 막에서 성장한 EECM-BMEC 유사 세포에서 claudin-5, occludin 또는 VE-cadherin(빨간색)에 대한 면역형광 염색. 핵은 4′,6-디아미디노-2-페닐인돌(DAPI)(청색)을 사용하여 염색하였다. 투과성 분석에 사용된 것과 정확히 동일한 필터 삽입물 상에서 염색을 수행하였다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
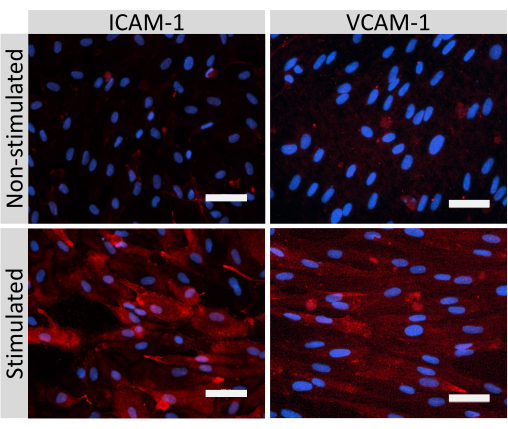
그림 5: EECM-BMEC 유사 세포에 의한 내피 접착 분자의 발현. 면역형광 염색은 SMLC 유래 CM의 존재 하에 필터 삽입물의 막에서 성장한 EECM-BMEC-유사 세포에 대해 수행하였다. ICAM-1 또는 VCAM-1(빨간색)에 대한 면역염색은 비자극 및 1 ng/mL TNF-α + 20 IU/mL IFN-γ 자극된 EECM-BMEC-유사 세포에 대해 나타내었다. 핵은 DAPI(청색)로 염색하였다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: SMLC의 특성화. 챔버 슬라이드에서 성장한 SMLC에 대한 α-평활근 액틴(SMA), 칼포닌 또는 평활근 단백질 22-알파(SM22a)(빨간색)의 면역세포화학이 표시됩니다. 핵은 DAPI(청색)로 염색하였다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
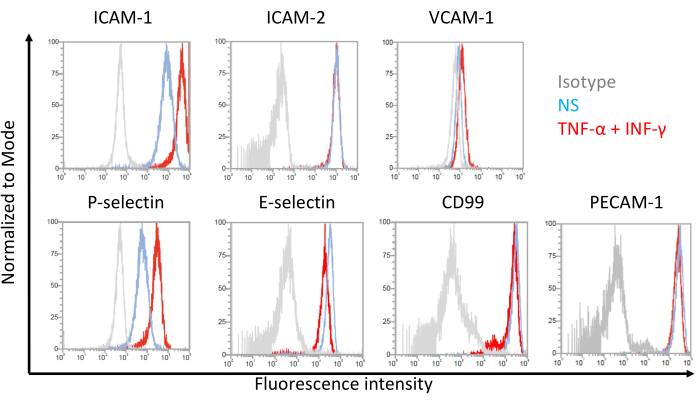
그림 7: EECM-BMEC 유사 세포에서 부착 분자의 내피 세포 표면 발현. EECM-BMEC-유사 세포에 대한 EC 표면 부착 분자 발현의 유세포 분석 결과가 나타나 있다. EECM-BMEC-유사 세포는 SMLC-유래 조건화 배지를 사용하여 배양하였다. 히스토그램 오버레이의 파란색, 빨간색 및 회색 선은 각각 비자극(NS) 조건, 1ng/mL TNF-α + 20IU/mL IFN-γ 자극 조건 및 이소타입 대조군을 보여줍니다. 세포간 접착 분자 1(ICAM-1), ICAM-2, 혈관 세포 접착 분자 1(VCAM-1), P-셀렉틴, E-셀렉틴, CD99 및 혈소판 내피 세포 접착 분자-1(PECAM-1)을 포함하는 내피 접착 분자의 세포 표면 발현을 평가하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
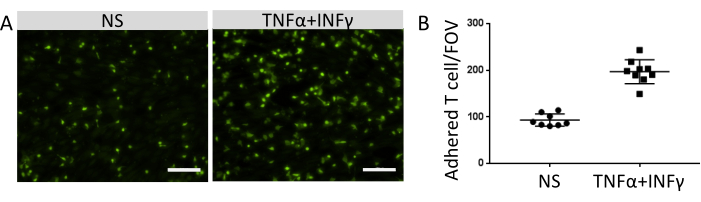
그림 8: EECM-BMEC 유사 세포에 대한 면역 세포의 부착. (A) 비자극(NS) 및 0.1ng/mL TNF-α + 2IU/mL IFN-γ 자극(TNF-α + IFN-γ) EECM-BMEC 유사 세포 단층에 형광 표지된 부착 면역 세포의 이미지. 이미지는 우물의 중심에 해당합니다. 스케일 바 = 50 μm. (B) NS 및 TNF-α + IFN-γ-자극 EECM-BMEC-유사 세포의 단층에서 형광 표지된 면역 세포의 수. 부착 면역 세포/시야(FOV)는 FIJI 소프트웨어를 사용하여 자동으로 계산되었습니다. 점은 부착된 T 세포의 수를 나타낸다. 막대는 평균값을 나타내고 오차 막대는 8개 시행의 표준 편차(SD)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 분석을 위한 특정 시약의 세부 사항. 각 특정 시약의 이름과 정확한 성분 양이 설명되어 있습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: Pe 계산을 위한 형광 플레이트 리더의 원시 데이터 예. 굵은 글씨체로 표시된 숫자는 플레이트 리더로 측정한 소듐 플루오레세인의 원시 형광 강도입니다. 데이터를 정확하게 분석하려면 원시 값에서 배경 신호를 제거하고 하단 챔버 샘플링으로 인한 신호 손실을 고려한 다음 신호를 수정해야 합니다. 예를 들어, 배경을 뺀 후 15분 샘플은 100 상대 형광 단위(RFU)의 신호를 나타내고 30분 샘플은 150 RFU의 신호를 나타냅니다. 30분에 보정된 신호는 (150 RFU + 15분에서의 결측값[100 RFU x 150 μL/1,500 μL])이며, 이는 150 RFU + 10 RFU = 160 RFU입니다. 클리어런스 부피 = (1,500 x [SB,t])/(ST,60분), 여기서 1,500은 하단 챔버의 부피(1,500μL), SB,t는 시간 t에서 보정된 신호,ST,60분은 60분에서 상단 챔버의 신호입니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
중요 사항 및 문제 해결
EPC 분화를 시작하기 전에 연구자들은 hiPSC 배양에서 자발적인 세포 분화 사건이 발생하지 않았는지 확인해야 합니다. 자발적으로 분화된 세포의 부재와 순수한 hiPSC 콜로니의 사용은 재현 가능한 결과를 얻는 데 중요합니다. -3일의 hiPSC 파종 밀도는 MACS 후 CD31+ EPC의 고순도를 얻는 데 중요합니다. 각 hiPSC 라인 및 각 통로에 대한 파종 밀도는 최적화가 필요할 수 있습니다. hiPSC 라인 및 계대 수에 따라 시딩 밀도는 12웰 플레이트(20-100 x 10 3/cm2)의 웰당 75 x 10 3 내지 400 x 103 hiPSC의 범위일 수 있다. hiPSC의 최소 밀도 체크포인트는 2일째의 세포 밀도입니다. hiPSC는 늦어도 2일차까지 100% 밀도에 도달해야 합니다. hiPSC가 2일까지 합류하지 않으면 MACS 후 CD31+ EPC의 순도는 일반적으로 매우 낮습니다. 이 경우, hiPSC 시딩 밀도를 증가시킬 수 있다. 3일차에서 5일차 사이에 많은 수의 분화 세포가 플레이트에서 분리되면 초기 hiPSC 파종 밀도가 감소할 수 있습니다. 우리의 경험에서 7-8μM CHIR99021은 여기에 사용된 hiPSC 라인에 대한 최적의 농도이지만 억제제 치료에 다르게 반응할 수 있는 다른 hiPSC 라인에 대해 농도를 최적화해야 할 수도 있습니다. CD31+ EPC의 순도는 MACS 전후에 확인해야 합니다. MACS를 계속하기 전에 미리 분류된 세포 혼합물은 >10% CD31+ 세포여야 합니다. <6%의 CD31+ 세포 비율은 일반적으로 MACS 후 <80% EPC를 초래합니다. 이 상황에서는 초기 파종 밀도 및/또는 CHIR99021 농도의 최적화가 필요합니다.
순수 EC 단층의 성공적인 선택적 계대배양 및 생성을 위해서는 CD31+ EPC의 MACS 이후 순도가 매우 중요합니다. MACS 후 순도가 <90%이면 한두 번의 추가 세척이 권장됩니다(단계 1.4.11-1.4.12). 이상적으로, MACS 이후 순도는 >95%여야 합니다. 콜라겐 코팅 플레이트의 EPC 파종 밀도는 3-7일 이내에 100% 밀도를 달성하기 위해 hiPSC 라인에 따라 최적화되어야 합니다. EC가 100% 합류할 때까지 기다리면 일반적으로 성공적인 선택적 통과로 이어집니다. 그러나 100% 합류 EC의 경우에도 일부 hiPSC 라인의 SMLC도 조기에 분리됩니다. 이 경우, 더 낮은 밀도(예를 들어, ≤80%)에서의 선택적 패시징이 효과적일 수 있다. 일부 SMLC가 EC보다 먼저 분리되면 EC는 혼합 EC-SMLC 모집단에서 구출될 수 없는 경우가 많습니다. 이 경우 계대 교환 EC에서 해리 시약의 활성화 시간을 단축하고 반복적인 선택적 계대 교환이 도움이 될 수 있습니다. 트립신이 EC와 SMLC의 분리를 허용하지 않기 때문에 해리 시약으로 트립신이 아닌 상업용 해리 시약을 사용하는 것이 선택적 계대 시약에 유리합니다. 소분자 추적자를 사용한 당사의 투과성 분석과 밀착 접합 및 접착 분자 발현 수준 테스트는 EPC, EECM-BMEC 유사 세포 및 SMLC를 최소 2년 동안 액체 질소에 보관할 수 있음을 나타냅니다.
방법의 중요성과 한계
이 방법은 Wnt/β-카테닌 신호 전달을 활성화하기 위해 화학적 GSK-3 억제제를 사용하여 CD31+ EPC를 hiPSC와 구별합니다. MACS에 의해 CD31+ EPC를 양성으로 선택한 후, EPC는 혼합 내피 및 SMLC 집단으로의 분화를 촉진하는 정의된 내피 배지에서 배양됩니다. 서로 다른 접착 특성을 가진 이러한 혼합 집단의 선택적 계대배양을 통해 SMLC에서 EC를 분리할 수 있습니다. 1회 또는 2회 계대 후, EECM-BMEC 유사 세포는 장벽 특성과 일차 인간 BMEC의 특성을 재현하는 내피 접착 분자의 발현을 나타냅니다. SMLC 또는 그의 상청액과의 공동 배양은 VCAM-1의 사이토카인 유도 발현을 유도합니다.
생체 내에서 BBB는 특정 수송체를 통한 영양소 수송 및 CNS로의 면역 세포 밀매 제어를 통해 분자의 낮은 세포 주위 및 세포 간 투과성을 확립함으로써 CNS 항상성을 유지합니다. BBB 연구의 경우, 관심있는 각 분자 및 기능을 표시하는 적합한 모델이 필수적입니다. 환자 또는 건강한 피험자로부터 정의된 시약 및 샘플을 사용하여 EECM-BMEC 유사 세포를 생산하면 확장 가능한 인간 BBB 모델이 제공됩니다. 다른 BBB 모델에 비해 EECM-BMEC-유사 세포를 사용하는 모델의 장점은 다음과 같다: 1) 일차 인간 BMEC의 형태 및 내피 전사체 프로파일(30); 2) 성숙한 밀착 접합부의 존재; 3) 바람직한 장벽 특성; 4) ICAM-1, ICAM-2, VCAM-1, E- 및 P-셀렉틴, CD99, 흑색종 세포 접착 분자(MCAM) 및 활성화된 백혈구 세포 접착 분자(ALCAM)22를 포함한 내피 접착 분자의 강력한 발현. 따라서 이 모델은 면역 세포와 BMEC 간의 상호 작용을 연구하는 데 특히 유용합니다. 소분자 추적자의 투과성은 iPSC 유래 BMEC 유사 세포에 대해 이전에 보고된 것보다 EECM-BMEC 유사 세포에서 더 높지만(14,15), 장벽 특성은 1차 인간 BMEC에 대해 설명된 것과 상당히 잘 비교됩니다. 이러한 유사성은 EECM-BMEC 유사 세포가 BBB의 양호한 시험관내 모델이 될 가능성이 높다는 것을 나타낸다. 생체 내에서 구성적 E-셀렉틴 발현이 결여된 비염증성 BBB를 연구하기 위해 이 모델을 사용할 때 생리학적 조건 하에서 EECM-BMEC 유사 세포에서의 E-셀렉틴 발현을 고려해야 한다 31. 이전 연구에서 우리는 EECM-BMEC 유사 세포가 단절된 밀착 접합부와 관련하여 MS 환자의 뇌에서 관찰된 바와 같이 BBB를 표현할 수 있음을 입증했습니다. 이는 소분자의 더 높은 투과성 및 기능적 접착 분자의 증가된 발현을 초래하여, BMEC-유사 세포32에 걸친 면역 세포의 증가된 접착 및 이동을 매개한다. 또한, 우리는 Wnt/β-카테닌 신호전달의 활성화가 MS 유래 EECM-BMEC 유사 세포에서 긴밀한 접합부의 파괴와 증가된 VCAM-1 발현을 개선할 수 있음을 보여주었습니다32. 이러한 결과는 모델이 MS와 같은 신경면역학적 질환에서 BBB의 역할을 연구하는 데 실제로 유용하다는 것을 나타냅니다.
종합하면, EECM-BMEC 유사 세포는 BBB 수준에서 병태생리학적 메커니즘에 대한 심층적인 이해와 BBB 안정화를 위한 새로운 치료 표적을 개발하는 도구를 위한 유망한 도구입니다. 앞으로 이 모델은 더 넓은 범위의 질병에서 BBB 기능 장애를 연구하는 데 적용될 수 있으며 새로운 치료 접근법을 위한 길을 열 수 있습니다.
공개
BE는 혈액-뇌 장벽을 가로지르는 T 세포 이동에 대한 나탈리주맙의 연장 투여를 연구하기 위해 Biogen으로부터 보조금을 받았고 신경 장애에서 혈액-뇌 장벽 기능 장애의 분자적 토대를 조사하기 위해 CSL Behring으로부터 보조금을 받았습니다. HN 및 BE는 EECM-BMEC-유사 셀과 관련된 임시 미국 특허 출원(63/084980 및 63/185815)의 발명자입니다.
감사의 말
HN은 우에하라 기념 재단, ECTRIMS 박사후 연구 교환 펠로우십, SNSF (JRPs) 보조금 번호 JPJSJRP20221507 및 KAKENHI 보조금 번호 22K15711, JST FOREST 프로그램 (보조금 번호 JPMJFR2269, 일본), 요코야마 임상 약리학 재단 보조금 번호 YRY-2217, 이치로 카네하라 재단, 나리시게 신경 과학 연구 재단, 과학 진흥을 위한 노바티스 재단(일본), 야마구치 대학 기금. BE는 스위스 MS 소사이어티와 스위스 국립 과학 재단(보조금 310030_189080 및 ZLJZ3_214086) 및 전략적 일본-스위스 과학 기술 프로그램(SJSSTP) 보조금 IZLJZ3_214086의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 mm Syringe filter | TPP | 99722 | |
| 15 mL Centrifuge tube | Falcon | 352196 | |
| 40 μm Falcon cell strainer | Falcon | 352340 | |
| 5 mL Round-bottom tube | SPL | 40005 | |
| 50 mL Centrifuge tube | Falcon | 352070 | |
| 96-Well plate, round bottom | SPL | 34096 | |
| Accutase | Sigma-Aldrich | A6964-500ml | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| All-in-One Fluorescence Microscope | Keyence | BZ-X810 | |
| B-27 Supplement (503), serum free | Thermo Fischer Scientific | 17504044 | |
| Bovine serum albumin (BSA), 7.5% in dPBS | Sigma-Aldrich | A8412 | |
| CellAdhere Dilution Buffer | STEMCELL Technologies | ST-07183 | |
| CellTracker Green CMFDA Dye | Invitrogen | C7025 | |
| Chamber slides | Thermo Fischer Scientific | 178599 | |
| CHIR99021 | Selleck Chemicals | S1263 | |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | |
| Corning tissue culture plates (12-well) | Corning | 3512 | |
| Corning tissue culture plates (6-well) | Corning | 3506 | |
| Cryo tube innercap 2.0 mL | Watson | 1396-201S | |
| Dimethylsulfoxide (DMSO), sterile | Sigma-Aldrich | D2650 | |
| DMEM (13), [+] 4.5 g/L D-glucose, [-] L-glutamine, [-] pyruvate | Thermo Fischer Scientific | 31053-028 | |
| Dulbecco’s (d) PBS (without calcium, magnesium) | Thermo Fisher | 14190250 | |
| Dulbecco’s modified Eagle’s medium/nutrient mixture F-12 (DMEM-F12) | Thermo Fischer Scientific | 11320074 | |
| EasySepFITC Positive Selection Kit II | STEMCELL Technologies | 18558 | |
| EasySepMagnet | Stemcell Technologies | 18000 | |
| Ethylenediaminetetraacetic Acid Solution0.02% in DPBS | Sigma | E8008-100ML | |
| Fetal Bovine Serum, qualified | Thermo Fischer Scientific | 10270106 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | |
| Ficoll-Paque PLUS | Sigma-Aldrich | GE17144002 | |
| FIJI software (Version 2.0.0) | Image J, USA | ||
| FlowJo version10 | BD | ||
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Glutaraldehyde solution | Sigma-Aldrich | G6257 | |
| HCL | Sigma-Aldrich | H1758 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Human Endothelial Serum Free Medium (hESFM) | Thermo Fischer Scientific | 11111-044 | |
| Human fibroblast growth factor 2 (FGF2) | Tocris | 233-FB-500 | |
| iPS human induced pluripotent stem cells | Riken RBC | HPS1006 | |
| Kanamycin Sulfate (100x) | Thermo Fischer Scientific | 15160-047 | |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | |
| L-Glutamine 200 mM (1003) | Thermo Fischer Scientific | 25030-024 | |
| Matrigel, growth factor reduced | Corning | 354230 | |
| MEM NEAA (1003) | Thermo Fischer Scientific | 11140-035 | |
| Methanol | Sigma-Aldrich | 32213 | |
| Mowiol | Sigma-Aldrich | 81381 | |
| mTeSR Plus-cGMP | STEMCELL Technologies | ST-100-0276 | |
| mTeSR1 complete kit (basal medium plus 53 supplement) | STEMCELL Technologies | 85850 | |
| NaCl | Sigma-Aldrich | 71376 | |
| Paraformaldehyde | Millipore | 104005 | |
| Pen Strep | Thermo Fischer Scientific | 15140-122 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF-100 | |
| Recombinant Human IL-2 | BD Biosciences | 554603 | |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI medium 1640 | Thermo Fischer Scientific | 21875-034 | |
| Scalpel | FEATHER | 2975-11 | |
| Skim milk | BD Biosciences | 232100 | |
| Sodium azide (NaN3) | Sigma-Aldrich | 71290 | |
| Sodium pyruvate | Thermo Fischer Scientific | 11360-039 | |
| Transwells, PC Membrane, 0.4 mm, 12 mm, TC-Treated | Corning | 3401 | |
| Tris base | Sigma-Aldrich | 93362 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vitronectin XF | STEMCELL Technologies | 078180 | |
| Water, sterile, cell culture | Sigma-Aldrich | W3500 |
참고문헌
- Castro Dias, M., Mapunda, J. A., Vladymyrov, M., Engelhardt, B. Structure and junctional complexes of endothelial, epithelial and glial brain barriers. International Journal of Molecular Sciences. 20 (21), 5372 (2019).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Marchetti, L., Engelhardt, B. Immune cell trafficking across the blood-brain barrier in the absence and presence of neuroinflammation. Vascular Biology. 2 (1), H1-H18 (2020).
- Yang, C., Hawkins, K. E., Dore, S., Candelario-Jalil, E. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke. American Journal of Physiology. Cell Physiology. 316 (2), C135-C153 (2019).
- Nishihara, H., Engelhardt, B. Brain barriers and multiple sclerosis: novel treatment approaches from a brain barriers perspective. Handbook of Experimental Pharmacology. 273, 295-329 (2020).
- Pan, Y., Nicolazzo, J. A. Altered blood-brain barrier and blood-spinal cord barrier dynamics in amyotrophic lateral sclerosis: Impact on medication efficacy and safety. British Journal of Pharmacology. 179 (11), 2577-2588 (2022).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology. 14 (3), 133-150 (2018).
- Desai, B. S., Monahan, A. J., Carvey, P. M., Hendey, B. Blood-brain barrier pathology in Alzheimer's and Parkinson's disease: implications for drug therapy. Cell Transplantation. 16 (3), 285-299 (2007).
- Song, H. W., et al. Transcriptomic comparison of human and mouse brain microvessels. Scientific Reports. 10 (1), 12358 (2020).
- Lecuyer, M. A., et al. Dual role of ALCAM in neuroinflammation and blood-brain barrier homeostasis. Proceedings of the National Academy of Sciences. 114 (4), E524-E533 (2017).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. The FASEB Journal. 19 (13), 1872-1874 (2005).
- DeStefano, J. G., Jamieson, J. J., Linville, R. M., Searson, P. C. Benchmarking in vitro tissue-engineered blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 32 (2018).
- Lyck, R., et al. ALCAM (CD166) is involved in extravasation of monocytes rather than T cells across the blood-brain barrier. Journal of Cerebral Blood Flow and Metabolism. 37 (8), 2894-2909 (2017).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), e1701679 (2017).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Hollmann, E. K., et al. Accelerated differentiation of human induced pluripotent stem cells to blood-brain barrier endothelial cells. Fluids and Barriers of the CNS. 14 (1), 9 (2017).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Praca, C., et al. Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells. Stem Cell Reports. 13 (4), 599-611 (2019).
- Al-Ahmad, A. J. Comparative study of expression and activity of glucose transporters between stem cell-derived brain microvascular endothelial cells and hCMEC/D3 cells. American Journal of Physiology. Cell Physiology. 313 (4), C421-C429 (2017).
- Canfield, S. G., et al. An isogenic neurovascular unit model comprised of human induced pluripotent stem cell-derived brain microvascular endothelial cells, pericytes, astrocytes, and neurons. Fluids and Barriers of the CNS. 16 (1), 25 (2019).
- Nishihara, H., et al. Advancing human induced pluripotent stem cell-derived blood-brain barrier models for studying immune cell interactions. The FASEB Journal. 34 (12), 16693-16715 (2020).
- Lu, T. M., et al. Pluripotent stem cell-derived epithelium misidentified as brain microvascular endothelium requires ETS factors to acquire vascular fate. Proceedings of the National Academy of Sciences. 118 (8), e2016950118 (2021).
- Lian, X., et al. Efficient differentiation of human pluripotent stem cells to endothelial progenitors via small-molecule activation of WNT signaling. Stem Cell Reports. 3 (5), 804-816 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nishihara, H., et al. Differentiation of human pluripotent stem cells to brain microvascular endothelial cell-like cells suitable to study immune cell interactions. STAR Protocols. 2 (2), 100563 (2021).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- Engelhardt, B., Capture Ransohoff, R. M. crawl, cross: the T cell code to breach the blood-brain barriers. Trends in Immunology. 33 (12), 579-589 (2012).
- Duband, J. L., Gimona, M., Scatena, M., Sartore, S., Small, J. V. Calponin and SM 22 as differentiation markers of smooth muscle: spatiotemporal distribution during avian embryonic development. Differentiation. 55 (1), 1-11 (1993).
- Gastfriend, B. D., et al. Wnt signaling mediates acquisition of blood-brain barrier properties in naïve endothelium derived from human pluripotent stem cells. eLife. 10, e70992 (2021).
- Eppihimer, M. J., Wolitzky, B., Anderson, D. C., Labow, M. A., Granger, D. N. Heterogeneity of expression of E- and P-selectins in vivo. Circulation Research. 79 (3), 560-569 (1996).
- Nishihara, H., et al. Intrinsic blood-brain barrier dysfunction contributes to multiple sclerosis pathogenesis. Brain. 145 (12), 4334-4348 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유