需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用 CRISPR/Cas9 系统生成着丝粒相关蛋白- E CENP-E-/- 敲除细胞系
摘要
本文报道了使用 CRISPR/Cas9 系统和三种基于表型的筛选策略构建着丝粒相关蛋白-E (CENP-E) 敲除细胞的过程。我们利用 CENP-E基因敲除细胞系建立了一种新的方法来验证CENP-E抑制剂的特异性和毒性,这对药物开发和生物学研究很有用。
摘要
CRISPR(成簇的规则间隔短回文重复序列)/Cas9 系统已成为在各种生物体中进行精确和高效基因编辑的有力工具。着丝粒相关蛋白-E (CENP-E) 是着丝粒-微管捕获、染色体比对和纺锤体组装检查点所需的正端定向驱动蛋白。尽管 CENP-E 蛋白的细胞功能已得到充分研究,但使用传统方案研究 CENP-E 蛋白的直接功能一直很困难,因为 CENP-E 消融通常会导致纺锤体组装检查点激活、细胞周期停滞和细胞死亡。在这项研究中,我们完全敲除了人类HeLa细胞中的 CENP-E 基因,并利用CRISPR/Cas9系统成功生成了 CENP-E-/- HeLa细胞。
建立了细胞集落筛选、染色体比对表型、CENP-E蛋白荧光强度等3种基于表型的优化筛选策略,有效提高了 CENP-E 敲除细胞的筛选效率和实验成功率。重要的是, CENP-E 缺失会导致染色体错位、BUB1 有丝分裂检查点丝氨酸/苏氨酸激酶 B (BubR1) 蛋白的异常位置和有丝分裂缺陷。此外,我们还利用 CENP-E 敲除HeLa细胞模型开发了CENP-E特异性抑制剂的鉴定方法。
在这项研究中,已经建立了一种验证 CENP-E 抑制剂特异性和毒性的有用方法。此外,本文还介绍了使用CRISPR/Cas9系统 进行CENP-E 基因编辑的方案,这可能是研究CENP-E在细胞分裂中机制的有力工具。此外, CENP-E基因敲除细胞系将有助于CENP-E抑制剂的发现和验证,对抗肿瘤药物开发、细胞生物学中细胞分裂机制的研究以及临床应用具有重要意义。
引言
工程基因组编辑介导各种细胞和生物体中基因的靶向修饰。在真核生物中,可以通过应用序列特异性核酸酶来引入位点特异性诱变,这些核酸酶刺激靶 DNA1 的同源重组。近年来,几种基因组编辑技术,包括锌指核酸酶 (ZFNs)2,3、转录激活因子样效应核酸酶 (TALENs)4,5 和归巢巨核酸酶 6,7,已被设计用于在特定位点切割基因组,但这些方法需要复杂的蛋白质工程和冗余的实验程序。研究表明,II 型原核生物簇状规则间隔短回文重复序列 (CRISPR)/Cas 系统是一种高效的基因编辑技术,可特异性介导多种细胞和物种中的 RNA 引导的位点特异性 DNA 切割 8,9,10,11。CRISPR/Cas9 基因敲除技术彻底改变了基础生物学、生物技术和医学领域12。
细菌和大多数古细菌已经进化出一种基于RNA的适应性免疫系统,该系统使用CRISPR和Cas蛋白来识别和破坏病毒和质粒13。化脓性链球菌Cas9 (SpCas9) 核酸内切酶含有 RuvC 样 Holliday 连接解析酶 (RuvC) 和 His-Asn-His (HNH) 结构域,可通过提供含有 CRISPR RNA (crRNA) 和反式激活 crRNA (tracrRNA) 的合成单向导 RNA (sgRNA) 有效介导序列特异性双链断裂 (DSB)14,15,16.DSB 可以通过插入缺失形成的非同源末端连接 (NHEJ) 或同源定向修复 (HDR) 通路进行修复,该通路在哺乳动物细胞中引入多种突变,包括插入、缺失或无疤痕的单核苷酸替换 1,8。容易出错的 NHEJ 和高保真 HDR 通路都可用于通过插入或缺失介导基因敲除,这可能导致移码突变和过早终止密码子10。
Kinesin-7 CENP-E 是细胞分裂过程中着丝粒-微管附着和染色体排列所必需的 17,18,19。CENP-E 的抗体显微注射20、21、siRNA 耗竭22、23、化学抑制24、25、26 和基因缺失27、28、29 导致染色体错位、纺锤体组装检查点和有丝分裂缺陷的激活,从而导致非整倍体和染色体不稳定19,30.在小鼠中,CENP-E缺失导致发育异常和胚胎致死率在发育的早期阶段27,29,31。CENP-E的基因缺失通常会导致染色体错位和细胞死亡26,27,29,这是研究CENP-E蛋白的功能和机制的障碍。
最近的一项研究使用生长素诱导的 CRISPR/Cas9 基因编辑方法32 建立了条件性 CENP-E 敲除细胞系,该方法可以在相对较短的时间内快速降解 CENP-E 蛋白33。然而,迄今为止,尚未建立稳定的CENP-E敲除细胞系,这是CENP-E生物学中尚未解决的技术挑战。考虑到遗传稳健性34、遗传补偿反应35、36、37和复杂的细胞内环境,由于CENP-E完全缺失的直接后果可能是复杂和不可预测的,因此建立CENP-E敲除细胞系对于研究染色体排列、纺锤体组装检查点和下游信号通路的机制非常重要。
CENP-E抑制剂的发现和应用对癌症治疗具有重要意义。迄今为止,已经发现并合成了七种类型的CENP-E抑制剂,包括GSK923295及其衍生物24,25、PF-2771 38,39、咪唑并[1,2-a]吡啶支架衍生物40,41、化合物A42,43、syntelin44,45、UA6278446和苯并[d]吡咯并[2,1-b]噻唑衍生物47.在这些抑制剂中,GSK923295是一种变构且有效的 CENP-E 抑制剂,它与 CENP-E 的运动结构域结合并抑制 CENP-E 微管刺激的 ATP 酶活性,Ki 为 3.2 ± 0.2 nM24,25。然而,与GSK923295对培养的癌细胞的抑制作用相比,GSK923295在临床癌症患者中的治疗效果并不理想48,49,这也引起了人们对GSK923295对CENP-E特异性的担忧。此外,其他CENP-E抑制剂对CENP-E蛋白的特异性和副作用是癌症研究的关键问题。
在这项研究中,我们使用 CRISPR/Cas9 系统完全敲除了 HeLa 细胞中的 CENP-E 基因。建立了细胞集落筛选、染色体比对表型、CENP-E蛋白荧光强度等3种基于表型的优化筛选策略,提高了CENP-E基因编辑的筛选效率和成功率。此外, CENP-E 敲除细胞系可用于测试CENP-E候选化合物的特异性。
研究方案
1. CRISPR/Cas9基因敲除载体的构建
- 选择人类 CENP-E 基因上的靶基因组DNA序列(GenBank登录号。NM_001286734.2) 并使用在线 CRISPR 设计工具 (http://crispor.tefor.net/) 设计 sgRNA。
- 输入单个基因组序列,选择"Homo sapiens-human-UCSC Dec 2013 (hg38 analysis set) + single nucleotide polymorphisms (SNPs): dbSNP148"的基因组,选择原间隔区相邻基序"20 bp-NGG-spCas9"。根据特异性评分50分、预测效率10分和最小脱靶率,选择sgRNA-1、5'-CGGCCGCACTCGCACGCAGA-3'和sgRNA-2 5'-TTCTTTAGAGACGCGGGCTC-3'两个引导序列。
- 订购并合成单链 DNA 寡核苷酸 (ssODN)。将ddH2O中的ssODN稀释至终浓度为100μM。为了磷酸化和退火sgRNA寡核苷酸,在聚合酶链反应(PCR)管中加入1μL正向寡核苷酸,1μL反向寡核苷酸,0.5μLT4多核苷酸激酶,1μLT4多核苷酸激酶缓冲液和6.5μL无RNase水,并在37°C孵育管30分钟,95°C孵育5分钟;然后,在5°C min-1下升温至25°C。
- 使用 Bbs
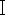 限制性内切酶消化 pX458 质粒。加入 1 μg pX458 质粒、2 μL 10x 缓冲液 G、1 μL Bbs
限制性内切酶消化 pX458 质粒。加入 1 μg pX458 质粒、2 μL 10x 缓冲液 G、1 μL Bbs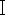 ,并在 1.5 mL 离心管中加入无 RNase ddH2O 至 20 μL。将管在37°C孵育2小时。然后,根据制造商的方案,使用柱DNA凝胶提取试剂盒纯化线性质粒。
,并在 1.5 mL 离心管中加入无 RNase ddH2O 至 20 μL。将管在37°C孵育2小时。然后,根据制造商的方案,使用柱DNA凝胶提取试剂盒纯化线性质粒。 - 将 sgRNA 寡核苷酸连接到 pX458 质粒中(pSpCas9(BB)-2A-绿色荧光蛋白 (GFP) 质粒,Addgene ID. 48138)。加入 1 μL 退火寡核苷酸、25 ng 线性质粒、1 μL 10x T4 DNA 连接缓冲液、0.5 μL T4 DNA 连接酶 (350 U/μL),并在 1.5 mL 离心管中用 ddH2O 配制多达 10 μL。将连接溶液在16°C孵育2小时。
- 将10μL构建的质粒与感受态DH5α细胞在冰上孵育30分钟,在42°C热休克45秒,并立即将它们放在冰上5分钟。加入 500 μL Luria-Bertani (LB) 培养基,并将细胞接种在含有氨苄青霉素 (100 μg/mL) 的 LB 平板上。将其在37°C孵育16小时并筛选抗性克隆。
- 用灭菌的移液器吸头选择 5-10 个单菌落,并将它们转移到含有氨苄青霉素 (100 μg/mL) 的 1 mL LB 培养基中。将培养物在37°C孵育,并以180rpm振荡12-16小时。
- 根据制造商的方案,使用质粒提取试剂盒分离质粒DNA。使用 U6-Fwd 引物 5'-GAGGGCCTTCCCATGATTCC-3' 通过 U6 启动子位点的 Sanger 测序验证每个菌落的质粒 DNA。
- 根据制造商的方案,使用无内切质粒DNA试剂盒提取和纯化质粒。
2. CENP-E 敲除HeLa细胞的转染、分离和筛选
- 在37°C和5%CO2的加湿培养箱中,在补充有10%胎牛血清和1%青霉素/链霉素的Dulbecco改良Eagle培养基(DMEM)中培养HeLa细胞。
- 使用0.25%胰蛋白酶/乙二胺四乙酸(EDTA)在37°C孵育HeLa细胞2-3分钟,通过轻轻移液解离细胞,然后以1:4的稀释比例将细胞接种在新板中用于细胞传代。
- 将细胞接种在 12 孔板中,并在转染前培养至 60-70% 汇合度。根据制造商的方案,使用参考试剂将pX458-sgRNA质粒转染到HeLa细胞中(参见 材料表)。
- 在试管 A 中轻轻混合 1 μg 经验证的 pX458-sgRNA 质粒和 50 μL 还原血清培养基。然后,在B管中轻轻混合2μL转染试剂和50μL还原血清培养基,在室温下分别孵育A和B管5分钟。
- 轻轻混合试管 A 和试管 B,并在室温下孵育 5 分钟。将混合物加入12孔板中,孵育细胞6小时,并用新鲜的DMEM培养基代替培养基。
- 在24小时或48小时后使用荧光显微镜检查HeLa细胞的转染效率。转染48小时后,在37°C下使用0.25%胰蛋白酶/ EDTA完全解离转染的HeLa细胞3-5分钟,使用Neubauer室或自动细胞计数器计数细胞数,并根据连续稀释方法10将细胞铺板到每个转染群体的三个单独的96孔板中。
- 将细胞放回湿培养箱中,然后再培养 1-2 周。每 3 天更换一次培养基。对于基于表型的 CENP-E 敲除筛选和验证,在 24 孔或 12 孔板中解离并扩增细胞 5-7 天。
- 使用配备10倍和20倍物镜的倒置显微镜筛选细胞集落直径较小的突变细胞。
注意: CENP-E 突变通常会导致细胞集落中分裂细胞数量的显着增加,这可能是筛选 CENP-E 突变细胞的关键指标之一。 - 根据制造商的方案,使用柱动物基因组DNA提取试剂盒收获用于DNA提取的细胞。按如下方式设置PCR反应:0.25μL Taq聚合酶,5μL 10x缓冲液(Mg2+ plus),4μL dNTP混合物,500ng DNA模板,1μL正向寡核苷酸,1μL反向寡核苷酸,并将ddH2O调节至50μL。 使用以下PCR程序设置进行基因扩增: 98°C,10秒;98 °C、10 s、55 °C、30 s、72 °C、60 s 共 33 个循环;72°C,10分钟,然后在4°C下保持。
注:用于克隆靶位点的特异性引物如下: CENP-E 靶标F1,5'-GAGGGTCCTGGCCATTTTCCTG-3'; CENP-E 靶标R1,5'-AGATCTCCGATCCTCCCCTGTC-3'; CENP-E 靶标F2,5'-TGGTAACTGCATTTTGGTGTTCTAC-3'; CENP-E 靶标R2,5'-CCTGTTGCAACGTGAGGGAAG-3'。 - 根据制造商的方案将靶DNA连接到pMD18-T载体中。将连接的质粒转染到感受态DH5α细胞中并培养用于选择克隆。
- 执行 Sanger 测序以确定 CENP-E 敲除的类型。根据制造商的方案,使用质粒提取试剂盒分离质粒DNA。使用 M13 正向和反向引物对每个菌落的质粒 DNA 进行 Sanger 测序。M13F引物,5'-TGTAAAACGACGGCCAGT-3';M13R引物,5'-CAGGAAACAGCTATGACC-3'。
- 将野生型和 CENP-E 突变HeLa细胞分别接种在24孔板中的12mm玻璃盖玻片上。除去完整的DMEM培养基,并在室温下将细胞固定在4%多聚甲醛/磷酸盐缓冲盐水(PBS)固定溶液中10分钟。
- 在室温下用4',6-二脒基-2-苯基吲哚(DAPI)溶液染色细胞核5分钟。使用配备 Plan Fluor 40x/数值孔径 (NA) 0.75 物镜的荧光显微镜,根据染色体比对的表型筛选和验证 CENP-E 突变细胞。
- 使用CENP-E蛋白的免疫荧光染色和分析(参见第3节)筛选和验证CENP-E敲除细胞。
3. 免疫荧光染色和高分辨率共聚焦显微镜
- 用4%多聚甲醛/ PBS固定溶液在室温下固定细胞10分钟,并在1x PBS中浸入2×5分钟。
注意:确保细胞处于健康状态,并轻轻收集和固定细胞,以避免中期细胞脱离。 - 在室温下用0.25%Triton X-100 / PBS透化细胞10分钟,并将其浸入1x PBS中2×5分钟。
- 在室温下用1%BSA / PBST(PBS中的0.1%吐温20)封闭细胞1小时。用1%BSA / PBST稀释一抗,并将样品在4°C孵育12小时。
- 弃去一抗溶液,用1x PBS冲洗细胞3×5分钟,并在室温下用稀释的二抗孵育细胞2小时。
- 弃去二抗,在1x PBS中冲洗细胞3×5分钟。
- 在室温下用DAPI染色细胞核5分钟。使用安装介质安装载玻片。用指甲油密封载玻片。
- 使用配备63x / NA 1.40物镜的扫描共聚焦显微镜观察和记录荧光图像。
4. 染色体制备和核型分析
- 在补充有 10% 胎牛血清和 1% 青霉素/链霉素的完全 DMEM 培养基中培养野生型和 CENP-E-/- HeLa 细胞 24 小时,然后将野生型和 CENP-E-/- HeLa 细胞与 300 nM 秋水仙碱孵育 5 小时。
- 将细胞与0.25%胰蛋白酶/ EDTA在37°C下孵育3分钟,并将细胞收集到1.5mL离心管中。
- 在室温下以1,000× g 离心细胞5分钟,弃去上清液,加入1.2mL0.075mol/L KCl溶液,并在37°C孵育20分钟。
- 在室温下以 1,000 × g 离心细胞 5 分钟,弃去上清液,加入 0.2 mL 固定溶液(甲醇:冰醋酸 = 3:1)用于预固定,并轻轻混合 1 分钟。
- 在室温下以1,000× g 离心细胞5分钟,收集沉淀,在室温下加入1.5mL固定溶液10分钟,然后在室温下以1,000× g 离心5分钟。
- 弃去上清液,加入 0.6 mL 固定溶液,并制备细胞悬浮液。在载冰上从35-40厘米的高度加入3-5滴细胞悬浮液。
注意:将细胞悬液释放到载玻片上的高度保持在35-40厘米;否则,染色体可能过于分散或彼此之间没有分离。 - 立即用酒精灯干燥载玻片,用10%Giemsa染色溶液染色样品7分钟,用流水冲洗载玻片2分钟,并使用配备Plan Fluor 40x / NA 0.75物镜的光学显微镜观察样品。
5. 细胞集落形成测定
- 在6孔板中以1,000-2,000个细胞/孔的细胞密度制备细胞悬液。轻轻摇晃板以均匀分布细胞。
- 将6孔板放入CO2 培养箱中,并在37°C下用5%CO2孵育2-3周。每 5 天更换一次培养基。使用配备10倍和20倍物镜的倒置显微镜记录图像。当菌落可见时收获细胞(克隆内有数百个细胞)。
- 为了研究GSK923295的影响,在6孔板中培养细胞24小时,并加入2mL终浓度为10、25、50、100和200nM的GSK923295。
注意:不要在克隆形成的早期阶段移动培养皿,以避免细胞脱落,这可能会形成新的克隆并影响转染细胞的筛选。 - 弃去培养基,并在室温下用1%PFA固定细胞10分钟。在室温下用0.1%结晶紫染色溶液染色菌落15分钟。用 1x PBS 冲洗样品三次。使用 ImageJ 软件记录细胞菌落的图像并量化每个菌落的直径。选择 直线 选择工具,单击 分析,选择 测量,然后记录长度。
- 用 1 mL 10% 乙酸溶液冲洗菌落 5 分钟。在 96 孔板中转移 200 μL 上清液溶液,并使用微孔板分光光度计在A 600 nm 处测量吸光度值。
6. 细胞活力测定
- 将细胞接种在24孔板中,并将细胞培养48小时至80-90%密度。
- 将细胞与100μL0.25%胰蛋白酶/ EDTA在37°C孵育3分钟。
- 用移液管枪将 400 μL PBS 与细胞混合。将 100 μL 细胞悬液转移到 96 孔板中。
- 在每个孔中加入 20 μL MTS 溶液,终浓度为 317 μg/mL,并根据制造商的方案轻轻混合。将样品在37°C下在CO2 培养箱中孵育1-3小时。
- 使用微孔板分光光度计记录A490nm 吸光度峰处每个孔的吸光度值。使用 A630 nm 的参考波长减去细胞碎片和非特异性吸光度(细胞活力 =A 490nm- A630 nm)贡献的背景。
结果
使用CRISPR/Cas9系统成功生成了CENP-E-/-HeLa细胞(图1)。该方法的时间表和关键实验步骤如图1所示。首先,我们设计合成了CENP-E特异性sgRNA,将sgRNA退火并连接到pX458质粒中,将质粒转染到HeLa细胞中,并培养48 h。将转染的细胞解离并使用连续稀释液接种在96孔板中(图1A)。使用三种基于表型的策略选择和筛选单...
讨论
驱动蛋白-7 CENP-E 是细胞分裂过程中染色体排列和纺锤体组装检查点的关键调节因子 17,19,20。CENP-E 的基因缺失通常会导致纺锤体组装检查点的激活、细胞周期停滞和细胞死亡 27,29,51,52。因此,构建稳定的CENP-E敲除细胞系是CENP...
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢福建医科大学细胞骨架实验室的所有成员进行了有益的讨论。我们感谢福建医科大学公共技术服务中心的Jun-Jin Lin、Zhi-Hong Huang、Ling Lin、Li-Li Pang、Lin-Ying 周、习 Lin和Min-Xia Wu的技术援助。我们感谢福建医科大学基础医学实验教学中心的郑思义、林颖和齐克的支持。本研究得到了以下资助:国家自然科学基金(批准号82001608和82101678)、中国福建省自然科学基金(批准号:2019J05071)、中国福建省科技创新联合基金(批准号:2021Y9160)和福建医科大学高层次人才科研启动资助项目(批准号XRCZX2017025)。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | |
| 1.5 mL centrifuge tube | Axygen | MCT-150-C | |
| 24-well plate | Corning | 3524 | |
| 4S Gelred, 10,000x in water | Sangon Biotech (Shanghai) | A616697 | |
| 50 mL centrifuge tube | Corning | 430828 | |
| 6 cm Petri dish | Corning | 430166 | |
| 95% ethanol | Sinopharm Chemical Reagent | 10009164 | |
| 96-well plate | Corning | 3599 | |
| Acetic acid | Sinopharm Chemical Reagent | 10000218 | Dissolve in H2O to prepare a 10% working solution. |
| Agarose | Sangon Biotech (Shanghai) | A620014 | |
| Alexa Fluor 488-labeled Goat Anti-Mouse IgG(H+L) | Beyotime | A0428 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:500 dilution. |
| Alexa Fluor 488-labeled Goat Anti-Rabbit IgG(H+L) | Beyotime | A0423 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:500 dilution. |
| Alexa Fluor 555-labeled Donkey Anti-Mouse IgG(H+L) | Beyotime | A0460 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:500 dilution. |
| Anhydrous ethanol | Sinopharm Chemical Reagent | 100092690 | |
| Anti-BubR1 rabbit monoclonal antibody | Abcam | ab254326 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:100 dilution |
| Anti-CENP-B mouse monoclonal antibody | Santa Cruz Biotechnology | sc-376392 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:50 dilution. |
| Anti-CENP-E rabbit monoclonal antibody | Abcam | ab133583 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:100 dilution. |
| Anti-fade mounting medium | Beyotime | P0131 | Slowing down the quenching of fluorescent signals. |
| Anti-α-tubulin mouse monoclonal antibody | Abcam | ab7291 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:100 dilution. |
| Biotek Epoch Microplate Spectrophotometer | Biotek Instruments | Biotek Epoch | |
| Bovine Serum Albumin (BSA) | Sinopharm Chemical Reagent | 69003435 | |
| BpiI (BbsI) | Thermo Fisher Scientific | ER1011 | |
| CellTiter 96 aqueous one solution cell proliferation assay | Promega | G3580 | |
| Centrifuge | Eppendorf | 5424BK745380 | |
| Colchicine | Sinopharm Chemical Reagent | 61001563 | |
| Confocal scanning microscope | Leica | Leica TCS SP8 | |
| Coverslip | CITOTEST | 80344-1220 | |
| DAPI | Beyotime | C1006 | |
| DH5α competent cells | Sangon Biotech (Shanghai) | B528413 | |
| DL2000 DNA marker | TaKaRa | 3427A | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | C11995500BT | |
Endo-free plasmid mini kit  | Omega | D6950 | |
| Ezup Column Animal Genomic DNA Purification Kit | Sangon Biotech (Shanghai) | B518251 | |
| Fetal bovine serum | Zhejiang Tianhang Biotechnology | 11011-8611 | |
| Gentian violet | Sinopharm Chemical Reagent | 71019944 | Dissolve in PBS to prepare 0.1% gentian violet/PBS. |
| Giemsa staining solution | Sinopharm Chemical Reagent | 71020260 | |
| GraphPad Prism version 8.0 software | GraphPad | www.graphpad.com | Statistical analysis. |
| GSK923295 | MedChemExpress | HY-10299 | |
| HeLa cell line | ATCC | CCL-2 | |
| Humidified incubator | Heal Force | HF90/HF240 | |
| Image J software | National Institutes of Health | https://imagej.nih.gov/ij/ | Image processing and analysis. |
| Inverted microscope | Nanjing Jiangnan Novel Optics | XD-202 | |
| LB agar powder | Sangon Biotech (Shanghai) | A507003 | |
| Lipo6000 transfection reagent | Beyotime | C0526 | |
| Nikon Ti-S2 microscope | Nikon | Ti-S2 | |
| Opti-MEM reduced serum medium | Gibco | 31985070 | |
| Paraformaldehyde | Sinopharm Chemical Reagent | 80096618 | Dissolve in PBS to prepare 4% paraformaldehyde/PBS. |
| Penicillin-streptomycin solution | HyClone | SV30010 | |
| SanPrep column DNA gel extraction kit | Sangon Biotech (Shanghai) | B518131 | |
| SanPrep column plasmid mini-preps kit | Sangon Biotech (Shanghai) | B518191 | |
| T4 DNA ligase | TaKaRa | 2011A | |
| T4 polynucleotide kinase | TaKaRa | 2021A | |
| TaKaRa Ex Taq | TaKaRa | RR001A | |
| Triton X-100 | Sinopharm Chemical Reagent | 30188928 | Dissolve in PBS to prepare 0.25% Triton X-100/PBS. |
| Tween 20 | Sinopharm Chemical Reagent | 30189328 | Dissolve in PBS to prepare 0.1% Tween 20/PBS. |
参考文献
- Jiang, W., Bikard, D., Cox, D., Zhang, F., Marraffini, L. A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nature Biotechnology. 31 (3), 233-239 (2013).
- Bibikova, M., Beumer, K., Trautman, J. K., Carroll, D. Enhancing gene targeting with designed zinc finger nucleases. Science. 300 (5620), 764 (2003).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nature Reviews Genetics. 11 (9), 636-646 (2010).
- Joung, J. K., Sander, J. D. TALENs: a widely applicable technology for targeted genome editing. Nature Reviews Molecular Cell Biology. 14 (1), 49-55 (2013).
- Wood, A. J., et al. Targeted genome editing across species using ZFNs and TALENs. Science. 333 (6040), 307 (2011).
- Stoddard, B. L. Homing endonuclease structure and function. Quarterly Reviews of Biophysics. 38 (1), 49-95 (2005).
- Pâques, F., Duchateau, P. Meganucleases and DNA double-strand break-induced recombination: perspectives for gene therapy. Current Gene Therapy. 7 (1), 49-66 (2007).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Shmakov, S., et al. Discovery and functional characterization of diverse class 2 CRISPR-Cas systems. Molecular Cell. 60 (3), 385-397 (2015).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Jia, N., Patel, D. J. Structure-based functional mechanisms and biotechnology applications of anti-CRISPR proteins. Nature Reviews Molecular Cell Biology. 22 (8), 563-579 (2021).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Gasiunas, G., Barrangou, R., Horvath, P., Siksnys, V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences of the United States of America. 109 (39), E2579-E2586 (2012).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Jackson, S. A., et al. CRISPR-Cas: Adapting to change. Science. 356 (6333), eaal5056 (2017).
- Wood, K. W., Sakowicz, R., Goldstein, L. S., Cleveland, D. W. CENP-E is a plus end-directed kinetochore motor required for metaphase chromosome alignment. Cell. 91 (3), 357-366 (1997).
- Craske, B., Welburn, J. P. I. Leaving no-one behind: how CENP-E facilitates chromosome alignment. Essays in Biochemistry. 64 (2), 313-324 (2020).
- Yu, K. W., Zhong, N., Xiao, Y., She, Z. Y. Mechanisms of kinesin-7 CENP-E in kinetochore-microtubule capture and chromosome alignment during cell division. Biology of the Cell. 111 (6), 143-160 (2019).
- Schaar, B. T., Chan, G. K., Maddox, P., Salmon, E. D., Yen, T. J. CENP-E function at kinetochores is essential for chromosome alignment. Journal of Cell Biology. 139 (6), 1373-1382 (1997).
- McEwen, B. F., et al. CENP-E is essential for reliable bioriented spindle attachment, but chromosome alignment can be achieved via redundant mechanisms in mammalian cells. Molecular Biology of the Cell. 12 (9), 2776-2789 (2001).
- Yao, X., Abrieu, A., Zheng, Y., Sullivan, K. F., Cleveland, D. W. CENP-E forms a link between attachment of spindle microtubules to kinetochores and the mitotic checkpoint. Nature Cell Biology. 2 (8), 484-491 (2000).
- Kim, Y., Heuser, J. E., Waterman, C. M., Cleveland, D. W. CENP-E combines a slow, processive motor and a flexible coiled coil to produce an essential motile kinetochore tether. Journal of Cell Biology. 181 (3), 411-419 (2008).
- Qian, X., et al. Discovery of the first potent and selective inhibitor of Centromere-Associated Protein E: GSK923295. ACS Medicinal Chemistry Letters. 1 (1), 30-34 (2010).
- Wood, K. W., et al. Antitumor activity of an allosteric inhibitor of centromere-associated protein-E. Proceedings of the National Academy of Sciences of the United States of America. 107 (13), 5839-5844 (2010).
- Pisa, R., Phua, D. Y. Z., Kapoor, T. M. Distinct mechanisms of resistance to a CENP-E inhibitor emerge in near-haploid and diploid cancer cells. Cell Chemical Biology. 27 (7), 850.e6-857.e6 (2020).
- Putkey, F. R., et al. Unstable kinetochore-microtubule capture and chromosomal instability following deletion of CENP-E. Developmental Cell. 3 (3), 351-365 (2002).
- Weaver, B. A., Silk, A. D., Montagna, C., Verdier-Pinard, P., Cleveland, D. W. Aneuploidy acts both oncogenically and as a tumor suppressor. Cancer Cell. 11 (1), 25-36 (2007).
- Silk, A. D., et al. Chromosome missegregation rate predicts whether aneuploidy will promote or suppress tumors. Proceedings of the National Academy of Sciences of the United States of America. 110 (44), E4134-E4141 (2013).
- Guo, Y., Kim, C., Ahmad, S., Zhang, J., Mao, Y. CENP-E-dependent BubR1 autophosphorylation enhances chromosome alignment and the mitotic checkpoint. Journal of Cell Biology. 198 (2), 205-217 (2012).
- Weaver, B. A., Cleveland, D. W. Aneuploidy: instigator and inhibitor of tumorigenesis. Cancer Research. 67 (21), 10103-10105 (2007).
- Nishimura, K., Fukagawa, T. An efficient method to generate conditional knockout cell lines for essential genes by combination of auxin-inducible degron tag and CRISPR/Cas9. Chromosome Research. 25 (3-4), 253-260 (2017).
- Owa, M., Dynlacht, B. A non-canonical function for Centromere-associated protein-E controls centrosome integrity and orientation of cell division. Communications Biology. 4 (1), 358 (2021).
- Barabási, A. L., Oltvai, Z. N. Network biology: understanding the cell's functional organization. Nature Reviews Genetics. 5 (2), 101-113 (2004).
- Rossi, A., et al. Genetic compensation induced by deleterious mutations but not gene knockdowns. Nature. 524 (7564), 230-233 (2015).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568 (7751), 259-263 (2019).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568 (7751), 193-197 (2019).
- Kung, P. P., et al. Chemogenetic evaluation of the mitotic kinesin CENP-E reveals a critical role in triple-negative breast cancer. Molecular Cancer Therapeutics. 13 (8), 2104-2115 (2014).
- Kim, J. H., et al. Development of a novel HAC-based "gain of signal" quantitative assay for measuring chromosome instability (CIN) in cancer cells. Oncotarget. 7 (12), 14841-14856 (2016).
- Hirayama, T., et al. Synthetic studies of centromere-associated protein-E (CENP-E) inhibitors: 1. Exploration of fused bicyclic core scaffolds using electrostatic potential map. Bioorganic & Medicinal Chemistry. 21 (17), 5488-5502 (2013).
- Hirayama, T., et al. Synthetic studies on Centromere-associated protein-E (CENP-E) inhibitors: 2. Application of electrostatic potential map (EPM) and structure-based modeling to Imidazo[1,2-a]pyridine derivatives as anti-tumor agents. Journal of Medicinal Chemistry. 58 (20), 8036-8053 (2015).
- Ohashi, A., et al. A novel time-dependent CENP-E inhibitor with potent antitumor activity. PLoS One. 10 (12), e0144675 (2015).
- Ohashi, A., et al. Aneuploidy generates proteotoxic stress and DNA damage concurrently with p53-mediated post-mitotic apoptosis in SAC-impaired cells. Nature Communications. 6, 7668 (2015).
- Ding, X., et al. Probing CENP-E function in chromosome dynamics using small molecule inhibitor syntelin. Cell Research. 20 (12), 1386-1389 (2010).
- Liu, X., et al. Phase separation drives decision making in cell division. Journal of Biological Chemistry. 295 (39), 13419-13431 (2020).
- Henderson, M. C., et al. UA62784, a novel inhibitor of centromere protein E kinesin-like protein. Molecular Cancer Therapeutics. 8 (1), 36-44 (2009).
- Yamane, M., et al. Identification of benzo[d]pyrrolo[2,1-b]thiazole derivatives as CENP-E inhibitors. Biochemical and biophysical research communications. 519 (3), 505-511 (2019).
- Lock, R. B., et al. Initial testing of the CENP-E inhibitor GSK923295A by the pediatric preclinical testing program. Pediatric Blood & Cancer. 58 (6), 916-923 (2012).
- Chung, V., et al. First-time-in-human study of GSK923295, a novel antimitotic inhibitor of centromere-associated protein E (CENP-E), in patients with refractory cancer. Cancer Chemotherapy and Pharmacology. 69 (3), 733-741 (2012).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature biotechnology. 31 (9), 827-832 (2013).
- Weaver, B. A., Cleveland, D. W. Decoding the links between mitosis, cancer, and chemotherapy: The mitotic checkpoint, adaptation, and cell death. Cancer Cell. 8 (1), 7-12 (2005).
- Manchado, E., Guillamot, M., Malumbres, M. Killing cells by targeting mitosis. Cell Death and Differentiation. 19 (3), 369-377 (2012).
- Dang, Y., et al. Optimizing sgRNA structure to improve CRISPR-Cas9 knockout efficiency. Genome Biology. 16, 280 (2015).
- Ratz, M., Testa, I., Hell, S. W., Jakobs, S. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592 (2015).
- Koch, B., et al. Generation and validation of homozygous fluorescent knock-in cells using CRISPR-Cas9 genome editing. Nature Protocols. 13 (6), 1465-1487 (2018).
- Yan, Q., et al. Multiplex CRISPR/Cas9-based genome engineering enhanced by Drosha-mediated sgRNA-shRNA structure. Scientific Reports. 6, 38970 (2016).
- Cheng, Y., et al. CRISPR/Cas9-mediated chicken TBK1 gene knockout and its essential role in STING-mediated IFN-β induction in chicken cells. Frontiers in Immunology. 9, 3010 (2019).
- Zhou, Y., et al. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Zeng, W., Guo, L., Xu, S., Chen, J., Zhou, J. High-throughput screening technology in industrial biotechnology. Trends in Biotechnology. 38 (8), 888-906 (2020).
- Tsai, S. Q., et al. GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nature Biotechnology. 33 (2), 187-197 (2015).
- Kim, D., et al. Genome-wide analysis reveals specificities of Cpf1 endonucleases in human cells. Nature Biotechnology. 34 (8), 863-868 (2016).
- Komor, A. C., Kim, Y. B., Packer, M. S., Zuris, J. A., Liu, D. R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature. 533 (7603), 420-424 (2016).
- Nishimasu, H., et al. Engineered CRISPR-Cas9 nuclease with expanded targeting space. Science. 361 (6408), 1259-1262 (2018).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Ablain, J., Durand, E. M., Yang, S., Zhou, Y., Zon, L. I. A CRISPR/Cas9 vector system for tissue-specific gene disruption in zebrafish. Developmental Cell. 32 (6), 756-764 (2015).
- Pickar-Oliver, A., Gersbach, C. A. The next generation of CRISPR-Cas technologies and applications. Nature Reviews Molecular Cell Biology. 20 (8), 490-507 (2019).
- Nalawansha, D. A., Gomes, I. D., Wambua, M. K., Pflum, M. K. H. HDAC inhibitor-induced mitotic arrest is mediated by Eg5/KIF11 acetylation. Cell Chemical Biology. 24 (4), 481.e5-492.e5 (2017).
- Kavalapure, R. S., et al. Design, synthesis, and molecular docking study of some 2-((7-chloroquinolin-4-yl) amino) benzohydrazide Schiff bases as potential Eg5 inhibitory agents. Bioorganic Chemistry. 116, 105381 (2021).
- Calligaris, D., Lafitte, D. Chemical inhibitors: the challenge of finding the right target. Chemistry & Biology. 18 (5), 555-557 (2011).
- Łomzik, M., et al. Metal-dependent cytotoxic and kinesin spindle protein inhibitory activity of Ru, Os, Rh, and Ir half-sandwich complexes of Ispinesib-derived ligands. Inorganic Chemistry. 59 (20), 14879-14890 (2020).
- Ferro, L. S., et al. Structural and functional insight into regulation of kinesin-1 by microtubule-associated protein MAP7. Science (New York, N.Y.). 375 (6578), 326-331 (2022).
- Atherton, J., et al. The mechanism of kinesin inhibition by kinesin-binding protein. eLife. 9, e61481 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。