JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
CRISPR/Cas9 시스템을 사용한 Centromere-Associated Protein-E CENP-E-/- Knockout 세포주 생성
요약
이 논문은 CRISPR/Cas9 시스템과 세 가지 표현형 기반 스크리닝 전략을 사용하여 중심체 관련 단백질-E(CENP-E) 녹아웃 세포의 구축을 보고합니다. 당사는 CENP-E 녹아웃 세포주를 활용하여 약물 개발 및 생물학 연구에 유용한 CENP-E 억제제의 특이성과 독성을 검증하기 위한 새로운 접근법을 확립했습니다.
초록
CRISPR(clustered regularly interspaced short palindromic repeats)/Cas9 시스템은 다양한 유기체에서 정밀하고 효율적인 유전자 편집을 위한 강력한 도구로 부상했습니다. Centromere-associated protein-E(CENP-E)는 키네토코어-미세소관 포획, 염색체 정렬 및 스핀들 어셈블리 체크포인트에 필요한 플러스 말단 지향 키네신입니다. CENP-E 단백질의 세포 기능은 잘 연구되어 왔지만, CENP-E 절제는 일반적으로 방추체 어셈블리 체크포인트 활성화, 세포 주기 정지 및 세포 사멸로 이어지기 때문에 기존 프로토콜을 사용하여 CENP-E 단백질의 직접적인 기능을 연구하는 것은 어려웠습니다. 이 연구에서는 인간 HeLa 세포에서 CENP-E 유전자를 완전히 녹아웃하고 CRISPR/Cas9 시스템을 사용하여 CENP-E-/- HeLa 세포를 성공적으로 생성했습니다.
세포 콜로니 스크리닝, 염색체 정렬 표현형, CENP-E 단백질의 형광 강도를 포함한 세 가지 최적화된 표현형 기반 스크리닝 전략이 수립되어 CENP-E 녹아웃 세포의 스크리닝 효율성과 실험 성공률을 효과적으로 개선했습니다. 중요하게도, CENP-E 결실은 염색체 부정합, BUB1 유사분열 체크포인트 세린/트레오닌 키나아제 B (BubR1) 단백질의 비정상적인 위치 및 유사분열 결손 귀착됩니다. 또한 CENP-E knockout HeLa 세포 모델을 활용하여 CENP-E 특이적 억제제에 대한 식별 방법을 개발했습니다.
이 연구에서는 CENP-E 억제제의 특이성과 독성을 검증하는 유용한 접근 방식이 확립되었습니다. 또한 이 논문은 세포 분열에서 CENP-E의 메커니즘을 조사하는 강력한 도구가 될 수 있는 CRISPR/Cas9 시스템을 사용한 CENP-E 유전자 편집 프로토콜을 제시합니다. 또한 CENP-E 녹아웃 세포주는 항종양 약물 개발, 세포 생물학의 세포 분열 메커니즘 연구 및 임상 적용에 중요한 영향을 미치는 CENP-E 억제제의 발견 및 검증에 기여할 것입니다.
서문
조작된 게놈 편집은 다양한 세포와 유기체에서 유전자의 표적 변형을 매개합니다. 진핵생물에서, 부위 특이적 돌연변이 유발은 표적 DNA의 상동 재조합을 자극하는 서열 특이적 뉴클레아제의 응용에 의해 도입될 수있다 1. 최근 몇 년 동안 징크 핑거 뉴클레아제(ZFN)2,3, 전사 활성제 유사 이펙터 뉴클레아제(TALEN)4,5 및 귀환 메가뉴클레아제(6,7)를 포함한 여러 게놈 편집 기술이 특정 부위에서 게놈을 절단하도록 설계되었지만 이러한 접근 방식에는 복잡한 단백질 엔지니어링과 중복 실험 절차가 필요합니다. 학문은 유형 II 원핵생물 군집된 규칙적으로 interspaced 짧은 회문 반복 (CRISPR)/Cas 체계가 특히 다양한 세포 및 종 8,9,10,11에 있는 RNA 인도한, 위치 특정한 DNA 절단을 중재하는 능률적인 유전자 편집 기술이다는 것을 보여주었습니다. CRISPR/Cas9 유전자 녹아웃 기술은 기초 생물학, 생명공학 및 의학 분야에 혁명을 일으켰습니다12.
박테리아와 대부분의 고세균은 바이러스와 플라스미드를 식별하고 파괴하기 위해 CRISPR 및 Cas 단백질을 사용하는 RNA 기반 적응 면역 시스템을 진화시켰다13. 연쇄상구균 화농균 Cas9(SpCas9) 엔도뉴클레아제는 CRISPR RNA(crRNA)를 포함하는 합성 단일 가이드 RNA(sgRNA)를 제공하고 trans-activating crRNA(tracrRNA)를 제공하여 염기서열 특이적 이중 가닥 절단(DSB)을 효율적으로 매개할 수 있는 RuvC 유사 Holliday 접합 리졸버제(RuvC) 및 His-Asn-His(HNH) 도메인을 포함합니다. DSB는 포유류 세포에서 삽입, 결실 또는 흉터가 없는 단일 뉴클레오티드 치환을 포함한 다중 돌연변이를 유발하는 indel-forming non-homologous end joining(NHEJ) 또는 homology-directed repair(HDR) 경로를 통해 복구될 수 있습니다 1,8. 오류가 발생하기 쉬운 NHEJ와 고충실도 HDR 경로 모두 삽입 또는 결실을 통해 유전자 knockout을 매개하는 데 사용할 수 있으며, 이는 프레임시프트 돌연변이 및 조기 정지 코돈을 유발할 수 있다10.
Kinesin-7 CENP-E는 세포 분열 중 키네토코어-미세소관 부착 및 염색체 정렬에 필요합니다 17,18,19. CENP-E의 항체 미세주입20,21, siRNA 고갈22,23, 화학적 억제 24,25,26 및 유전자 결실 27,28,29는 염색체 정렬 불량, 방추체 조립 체크포인트의 활성화 및 유사분열 결함을 유발하여 이수성 및 염색체 불안정성19,30을 초래합니다. 마우스에서 CENP-E 결실은 발달 초기 단계에서 비정상적인 발달 및 배아 치사율을 초래합니다 27,29,31. CENP-E의 유전적 결실은 일반적으로 염색체 정렬 불량과 세포 사멸을 초래하며, 이는 CENP-E 단백질의 기능과 메커니즘을 연구하는 데 장애가 됩니다 26,27,29.
최근 연구에서는 옥신 유도 CRISPR/Cas9 유전자 편집 방법(32)을 사용하여 조건부 CENP-E 녹아웃 세포주를 확립했으며, 이는 비교적 짧은 시간에 CENP-E 단백질을 빠르게 분해할 수 있습니다33. 그러나 현재까지 안정적인 CENP-E knockout 세포주는 확립되지 않았으며, 이는 CENP-E 생물학에서 해결되지 않은 기술적 과제입니다. 유전적 강건성(genetic robustness)34, 유전적 보상 반응(genetic compensation response)35,36,37 및 복잡한 세포 내 환경을 고려할 때, CENP-E의 완전한 결실의 직접적인 결과는 복잡하고 예측할 수 없기 때문에, 염색체 정렬, 방추체 어셈블리 체크포인트(spindle assembly checkpoint) 및 다운스트림 신호전달 경로(downstream signaling pathway)의 메커니즘을 조사하기 위해 CENP-E knockout 세포주를 확립하는 것이 중요하다.
CENP-E 억제제의 발견과 응용은 암 치료에 중요합니다. 현재까지 GSK923295 및 그 유도체24,25, PF-277138,39, 이미다조[1,2-a]피리딘 스캐폴드 유도체40,41, 화합물-A42,43, 신텔린44,45, UA6278446 및 벤조[d]피롤로[2,1-b]티아졸 유도체47을 포함하여 7가지 유형의 CENP-E 억제제가 발견되고 합성되었습니다. 이러한 억제제 중 GSK923295는 CENP-E의 운동 영역에 결합하고 3.2 ± 0.2 nM24,25의Ki 로 CENP-E 미세소관 자극 ATPase 활성을 억제하는 알로스테릭하고 효율적인 CENP-E 억제제입니다. 그러나 배양된 암세포에 대한 GSK923295의 억제 효과와 비교할 때, 임상적 암 환자에 대한 GSK923295의 치료 효과는 이상적이지 않으며48,49 이는 CENP-E에 대한 GSK923295의 특이성에 대한 우려를 불러일으켰다. 또한 CENP-E 단백질에 대한 다른 CENP-E 억제제의 특이성과 부작용은 암 연구의 핵심 문제입니다.
이 연구에서는 CRISPR/Cas9 시스템을 사용하여 HeLa 세포에서 CENP-E 유전자를 완전히 제거했습니다. CENP-E 유전자 편집의 스크리닝 효율성과 성공률을 개선하기 위해 세포 집락 스크리닝, 염색체 정렬 표현형, CENP-E 단백질의 형광 강도를 포함한 세 가지 최적화된 표현형 기반 스크리닝 전략이 수립되었습니다. 또한 CENP-E knockout 세포주를 사용하여 CENP-E에 대한 후보 화합물의 특이성을 테스트할 수 있습니다.
프로토콜
1. CRISPR/Cas9 유전자 knockout 벡터의 구성
- 인간 CENP-E 유전자의 표적 게놈 DNA 염기서열을 선택합니다(GenBank Accession No. NM_001286734.2) 온라인 CRISPR 설계 도구(http://crispor.tefor.net/)를 사용하여 sgRNA를 설계합니다.
- 단일 게놈 염기서열을 입력하고, "Homo sapiens-human-UCSC Dec 2013 (hg38 analysis set) + single nucleotide polymorphisms (SNPs): dbSNP148"의 게놈을 선택하고, protospacer 인접 모티프 "20 bp-NGG-spCas9"를 선택한다. 특이성 점수50, 예측 효율10 및 최소 off-target에 따라 sgRNA-1, 5'-CGGCCGCACTCGCACGCAGA-3' 및 sgRNA-2 5'-TTCTTTAGAGACGCGGGGCTC-3'을 포함한 두 개의 가이드 서열을 선택합니다.
- 단일 가닥 DNA 올리고뉴클레오티드(ssODN)를 주문하고 합성합니다. dH2O의 ssODN을 최종 농도 100μM로 희석합니다. sgRNA 올리고를 인산화 및 어닐링하기 위해 중합효소연쇄반응(PCR) 튜브에 전방 올리고 1μL, 역올리고 1μL, T4 폴리뉴클레오티드 키나아제 0.5μL, T4 폴리뉴클레오티드 키나아제 완충액 1μL, RNase가 없는 물 6.5μL를 첨가하고 튜브를 37°C에서 30분, 95°C에서 5분 동안 배양합니다. 그런 다음 5°C min-1에서 25°C로 낮춥니다.
- pX458 플라스미드를 Bbs
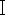 제한효소를 사용하여 절단합니다. pX458 플라스미드 1 μg, 10x buffer G 2 μL, Bbs
제한효소를 사용하여 절단합니다. pX458 플라스미드 1 μg, 10x buffer G 2 μL, Bbs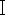 1 μL를 넣고 1.5 mL 원심분리 튜브에 RNase-free ddH2O - 20 μL를 추가합니다. 튜브를 37°C에서 2시간 동안 배양합니다. 그런 다음 제조업체의 프로토콜에 따라 컬럼 DNA 겔 추출 키트를 사용하여 선형 플라스미드를 정제합니다.
1 μL를 넣고 1.5 mL 원심분리 튜브에 RNase-free ddH2O - 20 μL를 추가합니다. 튜브를 37°C에서 2시간 동안 배양합니다. 그런 다음 제조업체의 프로토콜에 따라 컬럼 DNA 겔 추출 키트를 사용하여 선형 플라스미드를 정제합니다. - sgRNA oligo를 pX458 plasmid (pSpCas9(BB)-2A-green fluorescent protein (GFP) plasmid, Addgene ID. 48138)에 접합합니다. 어닐링된 올리고뉴클레오티드 1μL, 선형 플라스미드 25ng, 10x T4 DNA ligation buffer 1μL, T4 DNA 리가아제 0.5μL(350U/μL)를 추가하고 1.5mL 원심분리 튜브에 ddH2O로 최대 10μL를 만듭니다. 결찰 용액을 16°C에서 2시간 동안 배양합니다.
- 생성된 플라스미드 10 μL를 competent DH5α 세포와 함께 얼음 위에서 30분 동안 배양하고, 42°C에서 45초 동안 열충격한 후 즉시 얼음 위에 5분 동안 둡니다. 500μL의 Luria-Bertani(LB) 배지를 추가하고 암피실린(100μg/mL)이 포함된 LB 플레이트에 세포를 파종합니다. 37°C에서 16시간 동안 배양하고 내성 클론을 스크리닝합니다.
- 멸균된 피펫 팁이 있는 5-10개의 단일 콜로니를 선택하고 암피실린(100μg/mL)이 포함된 LB 배지의 1mL 배양액으로 옮깁니다. 배양액을 37°C에서 배양하고 180rpm에서 12-16시간 동안 흔듭니다.
- 제조업체의 프로토콜에 따라 plasmid extraction kit를 사용하여 plasmid DNA를 분리합니다. U6-Fwd primer 5'-GAGGGCCTATTTCCCATGATTCC-3'을 사용하여 U6 promoter site에서 Sanger 염기서열분석을 통해 각 콜로니의 플라스미드 DNA를 검증합니다.
- 제조업체의 프로토콜에 따라 endo-free plasmid DNA kit를 사용하여 plasmid를 추출하고 정제합니다.
2. CENP-E knockout HeLa 세포의 형질주입, 분리 및 스크리닝
- 5%CO2로 37°C의 가습 인큐베이터에서 10% 소 태아 혈청과 1% 페니실린/스트렙토마이신이 보충된 Dulbecco Modified Eagle's Medium(DMEM)에서 HeLa 세포를 배양합니다.
- 0.25% 트립신/에틸렌 디아민 테트라아세트산(EDTA)을 사용하여 37°C에서 2-3분 동안 HeLa 세포를 배양하고, 피펫팅으로 세포를 부드럽게 해리한 다음, 세포 통과를 위해 1:4의 희석 비율로 새 플레이트에 세포를 시드합니다.
- 12웰 플레이트에 세포를 시드하고 transfection 전에 60-70% 밀도로 배양합니다. pX458-sgRNA 플라스미드를 제조업체의 프로토콜에 따라 참조된 시약을 사용하여 HeLa 세포에 transfection합니다( 재료 표 참조).
- 검증된 pX458-sgRNA 플라스미드 1μg과 환원 혈청 배지 50μL를 튜브 A에 부드럽게 혼합합니다. 그런 다음 튜브 B에서 transfection 시약 2μL와 환원 혈청 배지 50μL를 부드럽게 혼합합니다. 튜브 A와 B를 실온에서 5분 동안 각각 배양합니다.
- 튜브 A와 튜브 B를 부드럽게 혼합하고 실온에서 5분 동안 배양합니다. 혼합물을 12웰 플레이트에 넣고 세포를 6시간 동안 배양한 다음 배지를 새 DMEM 배지로 교체합니다.
- 형광 현미경을 사용하여 24시간 또는 48시간 후에 형질 주입 효율을 검사합니다. 48시간 동안 transfection한 후, 37°C에서 3-5분 동안 0.25% 트립신/EDTA를 사용하여 transfection된 HeLa 세포를 완전히 해리하고, Neubauer 챔버 또는 자동 세포 카운터를 사용하여 세포 수를 계산하고, 연속 희석 방법10에 따라 각 transfection된 집단에 대해 세포를 3개의 개별 96웰 플레이트로 플레이트합니다.
- 세포를 가습 인큐베이터로 되돌린 다음 1-2주 더 배양합니다. 배양액은 3일에 한 번씩 교체합니다. CENP-E knockout의 표현형 기반 스크리닝 및 검증을 위해 5-7일 동안 24웰 또는 12웰 플레이트에서 세포를 해리 및 확장합니다.
- 10x 및 20x 대물 렌즈가 장착된 도립 현미경을 사용하여 더 작은 세포 콜로니 직경을 가진 돌연변이 세포를 스크리닝합니다.
참고: CENP-E 돌연변이는 일반적으로 세포 군집의 분열 세포 수를 크게 증가시키며, 이는 CENP-E 돌연변이 세포를 스크리닝하는 주요 지표 중 하나가 될 수 있습니다. - 제조업체의 프로토콜에 따라 컬럼 동물 게놈 DNA 추출 키트를 사용하여 DNA 추출을 위한 세포를 채취합니다. Taq 중합효소 0.25μL, 10x 완충액(Mg2+ 플러스) 5μL, dNTP 혼합물 4μL, DNA 템플릿 500ng, 전방 올리고 1μL, 역올리고 1μL를 사용하여 PCR 반응을 설정하고 ddH2O를 50μL로 조정합니다. 유전자 증폭을 위해 다음 PCR 프로그램 설정을 사용합니다. 98 °C, 10 초; 98 °C, 10 초, 55 °C, 30 초, 72 °C, 33 사이클 동안 60 초; 72°C, 10분 동안 유지한 다음 4°C에서 유지합니다.
참고: 표적 유전자좌의 클로닝을 위한 특정 프라이머는 다음과 같습니다: CENP-E 표적 F1, 5'-GAGGGTCCTGGCCATTTTCCTG-3'; CENP-E 표적 R1, 5'-AGATCTCCGATCCTCCCCTGTC-3'; CENP-E 표적 F2, 5'-TGGTAACTGCATTTTGGTGTTCTAC-3'; CENP-E 표적 R2, 5'-CCTGTTGCAACGTGAGGGAAG-3'. - 제조업체의 프로토콜에 따라 표적 DNA를 pMD18-T 벡터에 접합합니다. ligated plasmid를 유능한 DH5α 세포에 transfection하고 클론을 선택하기 위해 배양합니다.
- Sanger 염기서열분석을 수행하여 CENP-E 녹아웃 유형을 결정합니다. 제조업체의 프로토콜에 따라 plasmid extraction kit를 사용하여 plasmid DNA를 분리합니다. M13 forward 및 reverse primer를 사용하여 각 colony의 plasmid DNA에 대한 Sanger 염기서열분석을 수행합니다. M13F 프라이머, 5'-TGTAAAACGACGGCCAGT-3'; M13R 프라이머, 5'-CAGGAAACAGCTATGACC-3'.
- 야생형 및 CENP-E 돌연변이 HeLa 세포를 각각 24웰 플레이트의 12mm 유리 커버슬립에 파종합니다. 전체 DMEM 배지를 제거하고 실온에서 10분 동안 4% 파라포름알데히드/인산염 완충 식염수(PBS) 고정 용액에 세포를 고정합니다.
- 실온에서 5분 동안 4',6-diamidino-2-phenylindole(DAPI) 용액으로 핵을 염색합니다. Plan Fluor 40x/ Numerical Aperture (NA) 0.75 대물렌즈가 장착된 형광 현미경을 사용하여 염색체 정렬의 표현형을 기반으로 CENP-E 돌연변이 세포를 스크리닝하고 검증합니다.
- CENP-E 단백질의 면역형광 염색 및 분석(섹션 3 참조)을 사용하여 CENP-E knockout 세포를 스크리닝하고 검증합니다.
3. 면역형광 염색 및 고해상도 공초점 현미경 검사
- 실온에서 4% 파라포름알데히드/PBS 고정 용액으로 세포를 고정하고 1x PBS에서 2 x 5분 동안 담그십시오.
알림: 세포가 건강한 상태이고 중기 세포 분리를 방지하기 위해 세포를 수집하고 부드럽게 고정하는지 확인하십시오. - 실온에서 0.25% Triton X-100/PBS로 세포를 투과시키고 1x PBS에 2 x 5분 동안 담급니다.
- 실온에서 1시간 동안 1% BSA/PBST(PBS의 0.1% 트윈 20)로 셀을 차단합니다. 1차 항체를 1% BSA/PBST로 희석하고 샘플을 4°C에서 12시간 동안 배양합니다.
- 1차 항체 용액을 폐기하고, 1x PBS로 세포를 3 x 5분 동안 헹구고, 희석된 2차 항체로 실온에서 2시간 동안 세포를 배양합니다.
- 2차 항체를 폐기하고 1x PBS에서 3 x 5분 동안 세포를 헹굽니다.
- 실온에서 5분 동안 DAPI로 핵을 염색합니다. 장착 매체로 슬라이드를 장착합니다. 매니큐어로 슬라이드를 밀봉하십시오.
- 63x/NA 1.40 대물렌즈가 장착된 스캐닝 컨포칼 현미경을 사용하여 형광 이미지를 관찰하고 기록합니다.
4. 염색체 준비 및 핵형 분석
- 야생형 및 CENP-E-/- HeLa 세포를 10% 소 태아 혈청과 1% 페니실린/스트렙토마이신이 보충된 완전한 DMEM 배지에서 24시간 동안 배양한 다음 야생형 및 CENP-E-/- HeLa 세포를 300nM 콜히친으로 5시간 동안 배양합니다.
- 37°C에서 3분 동안 0.25% 트립신/EDTA로 세포를 배양하고 세포를 1.5mL 원심분리 튜브에 수집합니다.
- 실온에서 1,000× g 에서 5분 동안 세포를 원심분리하고, 상층액을 버리고, 0.075mol/L KCl 용액 1.2mL를 추가하고, 37°C에서 20분 동안 배양합니다.
- 1,000× g 에서 실온에서 5분간 세포를 원심분리한 후 상층액을 버리고 0.2mL의 고정액(메탄올: 빙초산=3:1)을 첨가하여 접두사로 사용하고 1분간 부드럽게 혼합한다.
- 실온에서 5분 동안 1,000× g 에서 세포를 원심분리하고, 펠릿을 수집하고, 실온에서 1.5mL의 고정액을 10분 동안 첨가한 다음, 실온에서 5분 동안 1,000× g 으로 원심분리합니다.
- 상층액을 버리고 0.6mL의 고정 용액을 첨가하고 세포 현탁액을 준비합니다. 얼음 슬라이드에 35-40cm 높이에서 셀 서스펜션 3-5방울을 추가합니다.
알림: 셀 서스펜션을 슬라이드에 분리하는 높이를 35-40cm로 유지하십시오. 그렇지 않으면 염색체가 너무 분산되어 있거나 서로 분리되지 않을 수 있습니다. - 즉시 알코올 램프로 슬라이드를 건조시키고, 10% Giemsa 염색액으로 7분 동안 염색하고, 흐르는 물로 2분 동안 슬라이드를 헹구고, Plan Fluor 40x/NA 0.75 대물렌즈가 장착된 광학 현미경을 사용하여 샘플을 관찰합니다.
5. 세포 콜로니 형성 분석
- 1,000-2,000 cells/well의 세포 밀도로 6-well 플레이트에서 세포 현탁액을 준비합니다. 플레이트를 부드럽게 흔들어 세포가 고르게 분포되도록 합니다.
- 6웰 플레이트를CO2 인큐베이터에 넣고 37°C에서 5%CO2로 2-3주 동안 배양합니다. 5일에 한 번씩 배양 배지를 교체합니다. 10x 및 20x 대물 렌즈가 장착된 도립 현미경을 사용하여 이미지를 기록합니다. 콜로니가 보이면 세포를 수확합니다(클론 내에 수백 개의 세포).
- GSK923295의 효과를 연구하기 위해 6웰 플레이트에서 세포를 24시간 동안 배양하고 최종 농도인 10, 25, 50, 100 및 200nM에서 2mL의 GSK923295를 추가합니다.
참고: 새로운 클론을 형성하고 transfection된 세포의 스크리닝에 영향을 미칠 수 있는 세포 흘림을 방지하기 위해 클론 형성의 초기 단계에서 배양 접시를 움직이지 마십시오. - 배양 배지를 버리고 실온에서 10분 동안 1% PFA로 세포를 고정합니다. 실온에서 0.1% 크리스탈 바이올렛 염색 용액으로 콜로니를 15분 동안 염색합니다. 샘플을 1x PBS로 세 번 헹굽니다. ImageJ 소프트웨어를 사용하여 세포 콜로니의 이미지를 기록하고 각 콜로니의 직경을 정량화합니다. 직선 선택 도구를 선택하고 분석을 클릭한 다음 측정을 선택하고 길이를 기록합니다.
- 콜로니를 10% 아세트산 용액 1mL로 5분 동안 헹굽니다. 200μL의 상층액 용액을 96웰 플레이트에 옮기고A 600nm에서 마이크로플레이트 분광광도계를 사용하여 흡광도 값을 측정합니다.
6. 세포 생존율 분석
- 24웰 플레이트에 세포를 파종하고 48시간에서 80-90% 밀도로 세포를 배양합니다.
- 37°C에서 3분 동안 100μL의 0.25% 트립신/EDTA로 세포를 배양합니다.
- 피펫 건으로 400μL의 PBS를 셀과 혼합합니다. 셀 현탁액 100μL를 96웰 플레이트로 옮깁니다.
- 최종 농도가 317μg/mL인 각 웰에 20μL의 MTS 용액을 추가하고 제조업체의 프로토콜에 따라 부드럽게 혼합합니다. 샘플을 37°C에서 CO2 인큐베이터에서 1-3시간 동안 배양합니다.
- 마이크로플레이트 분광 광도계를 사용하여A 490nm 의 흡광도 피크에서 각 웰의 흡광도 값을 기록합니다. A630nm 의 기준 파장을 사용하여 세포 파편 및 비특이적 흡광도(세포 생존도 = A490nm-A 630nm)에 의해 기여된 배경을 뺍니다.
결과
CENP-E-/- HeLa 세포는 CRISPR/Cas9 시스템을 사용하여 성공적으로 생성되었습니다(그림 1). 이 방법의 타임라인과 중요한 실험 단계는 그림 1에 나와 있습니다. 먼저, CENP-E 특이적 sgRNA를 설계 및 합성하고, sgRNA를 pX458 플라스미드에 어닐링 및 접합하고, 플라스미드를 HeLa 세포로 transfection하고, 48시간 동안 배양했습니다. 형질주입된 세포?...
토론
Kinesin-7 CENP-E는 세포 분열 17,19,20 중 염색체 정렬 및 방추체 조립 체크포인트의 핵심 조절자입니다. CENP-E의 유전적 결실은 일반적으로 방추체 조립 체크포인트, 세포주기 정지 및 세포 사멸의 활성화를 초래합니다 27,29,51,52. 따라서...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
유익한 토론을 해주신 Fujian Medical University의 세포골격 연구소의 모든 구성원에게 감사드립니다. 기술 지원을 제공해 주신 Fujian Medical University Public Technology Service Center의 Jun-Jin Lin, Zhi-Hong Huang, Ling Lin, Li-Li Pang, Lin-Ying Zhou, Xi Lin, Min-Xia Wu에게 감사드립니다. Fujian Medical University의 기초 의학 실험 교육 센터의 Si-Yi Zheng, Ying Lin, Qi Ke의 지원에 감사드립니다. 이 연구는 중국 국립자연과학재단(보조금 번호 82001608 및 82101678), 중국 푸젠성 자연과학재단(보조금 번호 2019J05071), 중국 푸젠성 과학기술혁신공동기금(보조금 번호 2021Y9160), 푸젠 의과대학 고급 인재 과학 연구 창업 자금 지원 프로젝트(보조금 번호 XRCZX2017025)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco | 25200056 | |
| 1.5 mL centrifuge tube | Axygen | MCT-150-C | |
| 24-well plate | Corning | 3524 | |
| 4S Gelred, 10,000x in water | Sangon Biotech (Shanghai) | A616697 | |
| 50 mL centrifuge tube | Corning | 430828 | |
| 6 cm Petri dish | Corning | 430166 | |
| 95% ethanol | Sinopharm Chemical Reagent | 10009164 | |
| 96-well plate | Corning | 3599 | |
| Acetic acid | Sinopharm Chemical Reagent | 10000218 | Dissolve in H2O to prepare a 10% working solution. |
| Agarose | Sangon Biotech (Shanghai) | A620014 | |
| Alexa Fluor 488-labeled Goat Anti-Mouse IgG(H+L) | Beyotime | A0428 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:500 dilution. |
| Alexa Fluor 488-labeled Goat Anti-Rabbit IgG(H+L) | Beyotime | A0423 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:500 dilution. |
| Alexa Fluor 555-labeled Donkey Anti-Mouse IgG(H+L) | Beyotime | A0460 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:500 dilution. |
| Anhydrous ethanol | Sinopharm Chemical Reagent | 100092690 | |
| Anti-BubR1 rabbit monoclonal antibody | Abcam | ab254326 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:100 dilution |
| Anti-CENP-B mouse monoclonal antibody | Santa Cruz Biotechnology | sc-376392 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:50 dilution. |
| Anti-CENP-E rabbit monoclonal antibody | Abcam | ab133583 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:100 dilution. |
| Anti-fade mounting medium | Beyotime | P0131 | Slowing down the quenching of fluorescent signals. |
| Anti-α-tubulin mouse monoclonal antibody | Abcam | ab7291 | For immunofluorescence. Dissolve in 1% BSA/PBST. 1:100 dilution. |
| Biotek Epoch Microplate Spectrophotometer | Biotek Instruments | Biotek Epoch | |
| Bovine Serum Albumin (BSA) | Sinopharm Chemical Reagent | 69003435 | |
| BpiI (BbsI) | Thermo Fisher Scientific | ER1011 | |
| CellTiter 96 aqueous one solution cell proliferation assay | Promega | G3580 | |
| Centrifuge | Eppendorf | 5424BK745380 | |
| Colchicine | Sinopharm Chemical Reagent | 61001563 | |
| Confocal scanning microscope | Leica | Leica TCS SP8 | |
| Coverslip | CITOTEST | 80344-1220 | |
| DAPI | Beyotime | C1006 | |
| DH5α competent cells | Sangon Biotech (Shanghai) | B528413 | |
| DL2000 DNA marker | TaKaRa | 3427A | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | C11995500BT | |
Endo-free plasmid mini kit  | Omega | D6950 | |
| Ezup Column Animal Genomic DNA Purification Kit | Sangon Biotech (Shanghai) | B518251 | |
| Fetal bovine serum | Zhejiang Tianhang Biotechnology | 11011-8611 | |
| Gentian violet | Sinopharm Chemical Reagent | 71019944 | Dissolve in PBS to prepare 0.1% gentian violet/PBS. |
| Giemsa staining solution | Sinopharm Chemical Reagent | 71020260 | |
| GraphPad Prism version 8.0 software | GraphPad | www.graphpad.com | Statistical analysis. |
| GSK923295 | MedChemExpress | HY-10299 | |
| HeLa cell line | ATCC | CCL-2 | |
| Humidified incubator | Heal Force | HF90/HF240 | |
| Image J software | National Institutes of Health | https://imagej.nih.gov/ij/ | Image processing and analysis. |
| Inverted microscope | Nanjing Jiangnan Novel Optics | XD-202 | |
| LB agar powder | Sangon Biotech (Shanghai) | A507003 | |
| Lipo6000 transfection reagent | Beyotime | C0526 | |
| Nikon Ti-S2 microscope | Nikon | Ti-S2 | |
| Opti-MEM reduced serum medium | Gibco | 31985070 | |
| Paraformaldehyde | Sinopharm Chemical Reagent | 80096618 | Dissolve in PBS to prepare 4% paraformaldehyde/PBS. |
| Penicillin-streptomycin solution | HyClone | SV30010 | |
| SanPrep column DNA gel extraction kit | Sangon Biotech (Shanghai) | B518131 | |
| SanPrep column plasmid mini-preps kit | Sangon Biotech (Shanghai) | B518191 | |
| T4 DNA ligase | TaKaRa | 2011A | |
| T4 polynucleotide kinase | TaKaRa | 2021A | |
| TaKaRa Ex Taq | TaKaRa | RR001A | |
| Triton X-100 | Sinopharm Chemical Reagent | 30188928 | Dissolve in PBS to prepare 0.25% Triton X-100/PBS. |
| Tween 20 | Sinopharm Chemical Reagent | 30189328 | Dissolve in PBS to prepare 0.1% Tween 20/PBS. |
참고문헌
- Jiang, W., Bikard, D., Cox, D., Zhang, F., Marraffini, L. A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nature Biotechnology. 31 (3), 233-239 (2013).
- Bibikova, M., Beumer, K., Trautman, J. K., Carroll, D. Enhancing gene targeting with designed zinc finger nucleases. Science. 300 (5620), 764 (2003).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nature Reviews Genetics. 11 (9), 636-646 (2010).
- Joung, J. K., Sander, J. D. TALENs: a widely applicable technology for targeted genome editing. Nature Reviews Molecular Cell Biology. 14 (1), 49-55 (2013).
- Wood, A. J., et al. Targeted genome editing across species using ZFNs and TALENs. Science. 333 (6040), 307 (2011).
- Stoddard, B. L. Homing endonuclease structure and function. Quarterly Reviews of Biophysics. 38 (1), 49-95 (2005).
- Pâques, F., Duchateau, P. Meganucleases and DNA double-strand break-induced recombination: perspectives for gene therapy. Current Gene Therapy. 7 (1), 49-66 (2007).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Shmakov, S., et al. Discovery and functional characterization of diverse class 2 CRISPR-Cas systems. Molecular Cell. 60 (3), 385-397 (2015).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Jia, N., Patel, D. J. Structure-based functional mechanisms and biotechnology applications of anti-CRISPR proteins. Nature Reviews Molecular Cell Biology. 22 (8), 563-579 (2021).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Gasiunas, G., Barrangou, R., Horvath, P., Siksnys, V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences of the United States of America. 109 (39), E2579-E2586 (2012).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Jackson, S. A., et al. CRISPR-Cas: Adapting to change. Science. 356 (6333), eaal5056 (2017).
- Wood, K. W., Sakowicz, R., Goldstein, L. S., Cleveland, D. W. CENP-E is a plus end-directed kinetochore motor required for metaphase chromosome alignment. Cell. 91 (3), 357-366 (1997).
- Craske, B., Welburn, J. P. I. Leaving no-one behind: how CENP-E facilitates chromosome alignment. Essays in Biochemistry. 64 (2), 313-324 (2020).
- Yu, K. W., Zhong, N., Xiao, Y., She, Z. Y. Mechanisms of kinesin-7 CENP-E in kinetochore-microtubule capture and chromosome alignment during cell division. Biology of the Cell. 111 (6), 143-160 (2019).
- Schaar, B. T., Chan, G. K., Maddox, P., Salmon, E. D., Yen, T. J. CENP-E function at kinetochores is essential for chromosome alignment. Journal of Cell Biology. 139 (6), 1373-1382 (1997).
- McEwen, B. F., et al. CENP-E is essential for reliable bioriented spindle attachment, but chromosome alignment can be achieved via redundant mechanisms in mammalian cells. Molecular Biology of the Cell. 12 (9), 2776-2789 (2001).
- Yao, X., Abrieu, A., Zheng, Y., Sullivan, K. F., Cleveland, D. W. CENP-E forms a link between attachment of spindle microtubules to kinetochores and the mitotic checkpoint. Nature Cell Biology. 2 (8), 484-491 (2000).
- Kim, Y., Heuser, J. E., Waterman, C. M., Cleveland, D. W. CENP-E combines a slow, processive motor and a flexible coiled coil to produce an essential motile kinetochore tether. Journal of Cell Biology. 181 (3), 411-419 (2008).
- Qian, X., et al. Discovery of the first potent and selective inhibitor of Centromere-Associated Protein E: GSK923295. ACS Medicinal Chemistry Letters. 1 (1), 30-34 (2010).
- Wood, K. W., et al. Antitumor activity of an allosteric inhibitor of centromere-associated protein-E. Proceedings of the National Academy of Sciences of the United States of America. 107 (13), 5839-5844 (2010).
- Pisa, R., Phua, D. Y. Z., Kapoor, T. M. Distinct mechanisms of resistance to a CENP-E inhibitor emerge in near-haploid and diploid cancer cells. Cell Chemical Biology. 27 (7), 850.e6-857.e6 (2020).
- Putkey, F. R., et al. Unstable kinetochore-microtubule capture and chromosomal instability following deletion of CENP-E. Developmental Cell. 3 (3), 351-365 (2002).
- Weaver, B. A., Silk, A. D., Montagna, C., Verdier-Pinard, P., Cleveland, D. W. Aneuploidy acts both oncogenically and as a tumor suppressor. Cancer Cell. 11 (1), 25-36 (2007).
- Silk, A. D., et al. Chromosome missegregation rate predicts whether aneuploidy will promote or suppress tumors. Proceedings of the National Academy of Sciences of the United States of America. 110 (44), E4134-E4141 (2013).
- Guo, Y., Kim, C., Ahmad, S., Zhang, J., Mao, Y. CENP-E-dependent BubR1 autophosphorylation enhances chromosome alignment and the mitotic checkpoint. Journal of Cell Biology. 198 (2), 205-217 (2012).
- Weaver, B. A., Cleveland, D. W. Aneuploidy: instigator and inhibitor of tumorigenesis. Cancer Research. 67 (21), 10103-10105 (2007).
- Nishimura, K., Fukagawa, T. An efficient method to generate conditional knockout cell lines for essential genes by combination of auxin-inducible degron tag and CRISPR/Cas9. Chromosome Research. 25 (3-4), 253-260 (2017).
- Owa, M., Dynlacht, B. A non-canonical function for Centromere-associated protein-E controls centrosome integrity and orientation of cell division. Communications Biology. 4 (1), 358 (2021).
- Barabási, A. L., Oltvai, Z. N. Network biology: understanding the cell's functional organization. Nature Reviews Genetics. 5 (2), 101-113 (2004).
- Rossi, A., et al. Genetic compensation induced by deleterious mutations but not gene knockdowns. Nature. 524 (7564), 230-233 (2015).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568 (7751), 259-263 (2019).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568 (7751), 193-197 (2019).
- Kung, P. P., et al. Chemogenetic evaluation of the mitotic kinesin CENP-E reveals a critical role in triple-negative breast cancer. Molecular Cancer Therapeutics. 13 (8), 2104-2115 (2014).
- Kim, J. H., et al. Development of a novel HAC-based "gain of signal" quantitative assay for measuring chromosome instability (CIN) in cancer cells. Oncotarget. 7 (12), 14841-14856 (2016).
- Hirayama, T., et al. Synthetic studies of centromere-associated protein-E (CENP-E) inhibitors: 1. Exploration of fused bicyclic core scaffolds using electrostatic potential map. Bioorganic & Medicinal Chemistry. 21 (17), 5488-5502 (2013).
- Hirayama, T., et al. Synthetic studies on Centromere-associated protein-E (CENP-E) inhibitors: 2. Application of electrostatic potential map (EPM) and structure-based modeling to Imidazo[1,2-a]pyridine derivatives as anti-tumor agents. Journal of Medicinal Chemistry. 58 (20), 8036-8053 (2015).
- Ohashi, A., et al. A novel time-dependent CENP-E inhibitor with potent antitumor activity. PLoS One. 10 (12), e0144675 (2015).
- Ohashi, A., et al. Aneuploidy generates proteotoxic stress and DNA damage concurrently with p53-mediated post-mitotic apoptosis in SAC-impaired cells. Nature Communications. 6, 7668 (2015).
- Ding, X., et al. Probing CENP-E function in chromosome dynamics using small molecule inhibitor syntelin. Cell Research. 20 (12), 1386-1389 (2010).
- Liu, X., et al. Phase separation drives decision making in cell division. Journal of Biological Chemistry. 295 (39), 13419-13431 (2020).
- Henderson, M. C., et al. UA62784, a novel inhibitor of centromere protein E kinesin-like protein. Molecular Cancer Therapeutics. 8 (1), 36-44 (2009).
- Yamane, M., et al. Identification of benzo[d]pyrrolo[2,1-b]thiazole derivatives as CENP-E inhibitors. Biochemical and biophysical research communications. 519 (3), 505-511 (2019).
- Lock, R. B., et al. Initial testing of the CENP-E inhibitor GSK923295A by the pediatric preclinical testing program. Pediatric Blood & Cancer. 58 (6), 916-923 (2012).
- Chung, V., et al. First-time-in-human study of GSK923295, a novel antimitotic inhibitor of centromere-associated protein E (CENP-E), in patients with refractory cancer. Cancer Chemotherapy and Pharmacology. 69 (3), 733-741 (2012).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature biotechnology. 31 (9), 827-832 (2013).
- Weaver, B. A., Cleveland, D. W. Decoding the links between mitosis, cancer, and chemotherapy: The mitotic checkpoint, adaptation, and cell death. Cancer Cell. 8 (1), 7-12 (2005).
- Manchado, E., Guillamot, M., Malumbres, M. Killing cells by targeting mitosis. Cell Death and Differentiation. 19 (3), 369-377 (2012).
- Dang, Y., et al. Optimizing sgRNA structure to improve CRISPR-Cas9 knockout efficiency. Genome Biology. 16, 280 (2015).
- Ratz, M., Testa, I., Hell, S. W., Jakobs, S. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Scientific Reports. 5, 9592 (2015).
- Koch, B., et al. Generation and validation of homozygous fluorescent knock-in cells using CRISPR-Cas9 genome editing. Nature Protocols. 13 (6), 1465-1487 (2018).
- Yan, Q., et al. Multiplex CRISPR/Cas9-based genome engineering enhanced by Drosha-mediated sgRNA-shRNA structure. Scientific Reports. 6, 38970 (2016).
- Cheng, Y., et al. CRISPR/Cas9-mediated chicken TBK1 gene knockout and its essential role in STING-mediated IFN-β induction in chicken cells. Frontiers in Immunology. 9, 3010 (2019).
- Zhou, Y., et al. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Zeng, W., Guo, L., Xu, S., Chen, J., Zhou, J. High-throughput screening technology in industrial biotechnology. Trends in Biotechnology. 38 (8), 888-906 (2020).
- Tsai, S. Q., et al. GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nature Biotechnology. 33 (2), 187-197 (2015).
- Kim, D., et al. Genome-wide analysis reveals specificities of Cpf1 endonucleases in human cells. Nature Biotechnology. 34 (8), 863-868 (2016).
- Komor, A. C., Kim, Y. B., Packer, M. S., Zuris, J. A., Liu, D. R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature. 533 (7603), 420-424 (2016).
- Nishimasu, H., et al. Engineered CRISPR-Cas9 nuclease with expanded targeting space. Science. 361 (6408), 1259-1262 (2018).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153 (4), 910-918 (2013).
- Ablain, J., Durand, E. M., Yang, S., Zhou, Y., Zon, L. I. A CRISPR/Cas9 vector system for tissue-specific gene disruption in zebrafish. Developmental Cell. 32 (6), 756-764 (2015).
- Pickar-Oliver, A., Gersbach, C. A. The next generation of CRISPR-Cas technologies and applications. Nature Reviews Molecular Cell Biology. 20 (8), 490-507 (2019).
- Nalawansha, D. A., Gomes, I. D., Wambua, M. K., Pflum, M. K. H. HDAC inhibitor-induced mitotic arrest is mediated by Eg5/KIF11 acetylation. Cell Chemical Biology. 24 (4), 481.e5-492.e5 (2017).
- Kavalapure, R. S., et al. Design, synthesis, and molecular docking study of some 2-((7-chloroquinolin-4-yl) amino) benzohydrazide Schiff bases as potential Eg5 inhibitory agents. Bioorganic Chemistry. 116, 105381 (2021).
- Calligaris, D., Lafitte, D. Chemical inhibitors: the challenge of finding the right target. Chemistry & Biology. 18 (5), 555-557 (2011).
- Łomzik, M., et al. Metal-dependent cytotoxic and kinesin spindle protein inhibitory activity of Ru, Os, Rh, and Ir half-sandwich complexes of Ispinesib-derived ligands. Inorganic Chemistry. 59 (20), 14879-14890 (2020).
- Ferro, L. S., et al. Structural and functional insight into regulation of kinesin-1 by microtubule-associated protein MAP7. Science (New York, N.Y.). 375 (6578), 326-331 (2022).
- Atherton, J., et al. The mechanism of kinesin inhibition by kinesin-binding protein. eLife. 9, e61481 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유